5 Глава Гипертоническая болезнь (эссенциальная гипертензия) и симптоматические гипертензии
 Скачать 2.67 Mb. Скачать 2.67 Mb.
|
|
2.4.4. Использование низкоинтенсивного лазерного излучения в терапии стенокардии В настоящее время общепринято, что оптимальная тактика лечения различных клинических форм стенокардии состоит в проведении фармакотерапии нитратами (короткого или прологированного действия, включая инфузии нитроглицерина), антиагрегантами, -адреноблокаторами или антагонистами кальция. При отсутствии явного положительного результата медикаментозного лечения рекомендуется коронарография для выбора дальнейшей тактики терапии (Гасилин В.С., Сидоренко Б.А., 1987, Сыркин А.Л.,1991, 1997, Meier B., Rutishauser W.,1985, Mabin T.A. et al.,1985, Ellis S. еt al., 1986). Операционная летальность в лучших клиниках мира, как было указано выше, составляет 1 - 4% и значительно возрастает, если утяжеляется контингент больных, направляемых на операцию – со сниженной сократительной функцией миокарда, нестабильной стенокардией, прединфарктным состоянием (Соловьев Г.М. и соавт., 1990, Kannel W.B. et al.,1986, Myler R.K. et al.,1990). Поэтому основная задача медикаментозной терапии состоит в предупреждении развития инфаркта миокарда, в переходе нестабильной стенокардии и предынфарктного состояния в стабильную стенокардию с последующим проведением оперативного лечения. В последние годы для лечения больных с различной патологией внутренних органов стали использовать лазерное излучение (Гамалея Н.Ф.,1972, Крюк А.С. и соавт., 1986, Корочкин И.М., 1983). В клинической практике, согласно данным литературы, для лечения различных клинических форм ИБС таких, как инфаркт миокарда, стенокардия, нарушения сердечного ритма, наиболее часто используется лазерное излучение длиной волны 632,8 нм, 540 - 570 нм и инфракрасное излучение в диапазоне длин волн 760 - 920 нм мощностью 0,5- 30 мВт (Корочкин И.М. и соавт., 1984, 1986, 1988, 1989, 1990, Агов Б.С. и соавт., 1985, Кипшидзе Н.Н. и соавт., 1986, 1988, Бобров В.А. и соавт.,1993). В настоящее время известны различные способы применения лазерного излучения, такие как накожный, надвенный, внутривенный, внутрисердечный, причем, по данным ряда авторов, наиболее эффективными при ИБС оказались внутривенное и внутрисердечное использование лазерного излучения (Корочкин И.М. и соавт., 1989, Кипшидзе Н.Н. и соавт.,1989, Сиренко Ю.Н., 1989). Положительный эффект, применяя внутривенное и внутрисердечное лазерное облучение крови у больных с различными клиническими формами стенокардии, получали в 93,4 - 98% случаев И.М. Корочкин и соавт. (1988,1989), в 75% - Ю.Н. Сиренко и соавторы (1989), 78% - С.С. Белоусов и соавт. (1990,1992), 56,4 - 94% - И.Э. Малиновская и соавторы (1990, 1993), 68% - В.В. Троцюк и соавт. (1991), 67% - В.К. Тащук и соавт. (1992), 42% - Ананченко В.Г. и соавт. (1993), учитывая в качестве критериев урежение и прекращение приступов стенокардии, снижение потребности в нитроглицерине. В работах Ю.П. Мажары и соавт. (1989,1990), А.И. Олесина и соавт. (1989,1992), А.П. Ионина, Э.Г. Волковой (1990), И.Э. Малиновской и соавт. (1990,1992, 1993), В.А. Бобров и соавт. (1992, 1993) отмечено антиаритмическое действие гелий-неонового и инфракрасного лазеров на наджелудочковые и желудочковые нарушения ритма. Длительность эффекта лазеротерапии у больных нестабильной стенокардией, по данным С.С. Белоусова и соавт. (1990,1991), составляет, в среднем, 6-7 недель, а по данным Ю.Н. Сиренко и соавт. (1993) - 12,1 1,5 месяцев. Согласно наблюдениям Г.В. Бабушкиной и соавт. (1992), частота обострений прогрессирующей стенокардии (кратность на год) при медикаментозной терапии составляет 4,55, а после курса лазеротерапии - 0,36. Некоторое расхождение результатов, полученных разными авторами при лечении больных нестабильной стенокардией, очевидно, можно объяснить тем, что в группы наблюдения включались больные с различной степенью тяжести и прогнозом заболевания, а также неоднородностью используемых доз лазеротерапии, что в значительной мере обуславливает ее эффективность. Механизм действия лазерного излучения в настоящее время недостаточно изучен. По мнению Т.Й. Кару (1986), первичным фотоакцептором лазерного излучения являются компоненты окислительно-восстановительной цепи клетки. Поглощение кванта первичными фотоакцепторами вызывает в клетке сигнальные изменения, приводящие к активации синтетических процессов, ускорению роста и деления клетки, причем, эффект зависит от длины волны используемого излучения, его мощности и интенсивности. Существует гипотеза, что эффект излучения гелий-неонового лазера реализуется через особую систему фоторегуляции, которая в естественных условиях опосредованно управляет действием солнечного света и биологическими эффектами лазерного излучения, связанными со случайным совпадением длины волны с областью поглощения хромофора фоторегуляторной системы (Гамалея Н.Ф.,1989). Общеизвестно участие активных форм кислорода /синглетный кислород/ в механизме сенсибилизированного повреждения биологических структур - так называемом фотодинамическом эффекте. Есть предположение о возможном участии активных форм кислородав механизме фотофизических процессов, определяющих биологическую и терапевтическую эффективность низкоинтенсивного лазерного излучения. Высказывается мнение, что определенную роль в механизме терапевтической эффективности лазерного излучения играют процессы, обусловленные генерацией синглетного кислорода в результате прямого возбуждения молекул кислорода (Мостовникова Г.Р. и соавт., 1990, Корочкин И.М., Бабенко Е.В., 1990, Удут В.В. и соавт., Бабий Л.Н. и соавт., 1994). Ряд авторов предполагает,что определенную роль в механизме действия низкоинтенсивного лазерного излучения играют светоиндуцируемые перестройки молекулярных и субмолекулярных биожидкокристаллических структур, в основном, молекул белков, в поле действия световой волны лазера. В отличие от фотобиологических эффектов, обусловленных реакциями синглетного или радикального кислорода с биомолекулами, эффекты светоиндуцированной перестройки структуры носят обратимый характер и зависят от длины волны лазерного излучения, мощности и времени облучения (Генкин В.М. и соавт., 1989, Корочкин И.М. и соавт., 1988, 1989, 1990, Мостовникова Г.Р. и соавт., 1990, Илларионов В.Е., 1990). Положительный эффект лазерного излучения у больных ИБС связывают со снижением агрегации тромбоцитов, эритроцитов, проницаемости клеточных мембран, расширением коронарных артерий, в том числе ускорением развития коллатерального кровообращения, снижением активности перекисного окисления липидов как в клетках, так и в плазме крови, увеличением активности антиоксидантной системы крови, улучшением реологических свойств крови, нормализацией состава фосфолипидов мембран кардиомиоцитов, активизацией кальций-магниевой- и натрий-калиевой-зависимой АТФаз (Корочкин И.М. и соавт., 1984, 1986, 1988, 1989, 1990, 1991, Кипшидзе Н.Н. и соавт., 1986, 1988, 1990, Олесин А.И. и соавт., 1990, 1991, 1994, Коновалов Е.П. и соавт., 1991, Бобров В.А. и соавт., 1993, Бабий Л.Н. и соавт.,1994, Катюхин Л.Н. и соавт., 1996). Физико-химические основы взаимодействия света и низкоинтенсивного лазерного излучения с биологическими тканями Механизм взаимодействия света и лазерного излучения с биологическим объектом сложен и до конца не изучен. Суммируя результаты исследования различных авторов (Корочкин И.М. и соавт., 988, 1989, 1990, 1991, Кипшидзе Н.Н. и соавт., 1988, 1990, Олесин А.И. и соавт., 1990, 1991, 1994, Коновалов Е.П. и соавт., 1991, Илларионов В.Е., 1992, Бобров В.А. и соавт., 1993, Бабий Л.Н. и соавт.,1994, Катюхин Л.Н. и соавт., 1996), механизм воздействия света и низкоинтенсивного лазерного излучения представляется следующим образом. Взаимодействие светового и лазерного излучения с биологической тканью происходит по следующей закономерности: на первом этапе наблюдается поглощение энергии излучения биообъектом, причем все процессы подчиняются физическим законам (Ясногородсткий В.Н., 1987), с последующим развитием внешнего и внутреннего фотоэффекта; на втором - изменение физико-химических процессов и на третьем - развитие биологических реакций организма. При воздействии светового и лазерного излучения на биообъект часть энергии электромагнитных волн отражается. Наибольший коэффициент отражения наблюдается при воздействии на кожные покровы и составляет при облучении в оптическом диапазоне от 43 до 55%. Существуют различные причины, влияющие на величину коэффициента отражения: он уменьшается на 10-15% при охлаждении участков кожи; у женщин на 5-7% ниже, чем у мужчин, а у лиц старше 60 лет - на 10% меньше в сравнении с молодыми пациентами (Улащик В.С., 1990). Увеличение угла падения приводит к значительному повышению коэффициента отражения (в несколько раз), причем на пигментированных участках он составляет до 10% (Улащик В.С., 1990). Наименьшее отражение наблюдается при внутрисосудистом облучении светом или лазерным излучением. Глубина проникновения лазерного электромагнитного излучения зависит от длины волны: максимальное проникновение видимого излучения отмечается в красном спектре (длина волны 620-650 нм) и составляет до 20-30 мм, наименьшее - от ультрафиолетового до оранжевого спектра (от 1-20 мкм до 2,5 мм). Пик проникающей способности наблюдается в ближнем инфракрасном диапазоне при длине волны 930-950 нм (до 70-100 мм), причем, проникновение резко снижается (до 0,1-1 мм) в дальнем инфракрасном диапазоне (Корчагин В.А., 1969, Полонский А.К. и соавт., 1984, Pratesi R., Saechi C., 1986, Yoon G. et al., 1987). Максимум пропускающей способности лазерного излучения находится в диапазоне 800-1200 нм (Полонский А.К. и соавт., 1984, Yamamoto T., et al., 1981). Поглощение тканей зависит от их биологических свойств: кожа поглощает лазерное излучение в диапазоне от 600 до 1400 нм 25-40% излучения, мышцы и кости - 30-80%, кровь и паренхиматозные органы до 100% (Байбеков И.М. и соавт., 1991, Bahr F., 1986). Внешний фотоэффект характеризуется поглощением молекулами и атомами тканей организма фотона светового или лазерного излучения, причем, электрон переходит в наиболее высокие энергетические уровни (синглетное или триплетное состояние) (Рубин А.Б., 1987). Внутренний фотоэффект обусловлен изменением электропроводимости и диэлектрической проницаемости тканей, появлением разности потенциалов между участками как облучаемого объекта, так и необлученных тканей (возникновение фотоэлектрической силы) (Тарасов Л.В., 1987). Развитие внутреннего фотоэффекта зависит от энергетической дозы и длины волны воздействующего излучения. r Терапевтическая доза лазерного излучения и методы ее определения В настоящее время нет единого мнения об использовании в клинической практике различных доз лазерного излучения. Многочисленные исследования посвящены оценке эффективности лазеротерапии, применяемой в самых разнообразных дозах, по данным клинико-инструментальных и лабораторных показателей, отражающих течение конкретного заболевания. p Обоснование использования лазерного излучения в кардиологии (экспериментальные данные). Нами была проведена попытка в эксперименте определить наиболее эффективные длины волн и терапевтические дозы лазерного излучения в кардиологии, в частности, на моделях различных по механизму нарушений сердечного ритма и сопоставить их с изменениями клинико-лабораторных и инструментальных показателей, обычно использующихся в клинической практике. В ранее проведенных нами экспериментальных исследованиях по изучению антиаритмической активности лазерного излучения в диапазоне длин волн от 0,44 мкм до 1,26 мкм было показано, что наибольшей противоаритмической активностью обладает излучение в диапазоне длин волн от 0,61 мкм до 0,67 мкм и от 0,83 мкм до 0,95 мкм (Олесин А.И., Лукин В.А.,1989, 1990, Maximov V.A. et al,1990, 1992). Поэтому представлялось целесообразным определить наибольшую противоаритмическую активность и эффективную дозу лазерного излучения в вышеуказанных диапазонах длин волн. Опыты проведены на 206 кроликах обоего пола массой 2,8 - 3,7 кг (в среднем 3,10,04 кг), 72 кошках обоего пола массой 2,3 - 3,6 кг (в среднем 3,00,05 кг) и 26 беспородных собаках обоего пола массой 3,6 - 8,0 кг (в среднем 5,20,3 кг). Экспериментальные аритмии моделировались на животных в зависимости от электрофизиологического механизма, участвующего в их возникновении. Задержанная постдеполяризация является основным механизмом развития хлоридбариевой, хлоридкальциевой, строфантиновой аритмий, ранняя постдеполяризация - аконитиновой аритмии, re-entry - для аритмий, вызванных аппликацией перекиси водорода на миокард или ишемией (реперфузией) сердечной мышцы в результате перевязки коронарных артерий. Хлоридбариевая аритмия моделировалась на кроликах по методу G.Papp, L.Szekeres (1966,1967), хлоридкальциевая аритмия - у кроликов по методу А.Н. Кудрина, Ж.К. Асланянц (1984) и строфантиновая аритмия - у кошек по методу Н.М. Машутиной и соавт. (1978). Аконитиновая аритмия моделировалась у кроликов и кошек путем аппликации 0,02% раствора аконитина на предсердия по методу И.А. Юрявичуса, Л.В. Розенштраух (1980), перекисные аритмии - путем аппликации 0,03% раствора перекиси водорода на предсердия (Олесин А.И. и соавт., 1991). Ишемические (реперфузионные) аритмии моделировались путем перевязки левой нисходящей коронарной артерии и параллельной ей вены у беспородных собак, находящихся под гексеналовым наркозом, с последующим восстановлением кровотока через 60 минут после перевязки. Через 10 ч после реперфузии проводилось патологоанатомическое исследование миокарда, которое заключалось в измерении площади инфаркта миокарда (в процентах от площади левого желудочка) по модифицированной методике A.I. Roberts et al. (1978) c последующим исследованием сердечной мышцы в зоне инфаркта и вокруг нее, а также в зоне, не подвергшейся ишемизации. Параллельно всем животным определялась агрегация тромбоцитов, коагулограмма и тромбоэластограмма, гидроперекиси липидов и активность антиоксидантной системы крови, осмотическая стойкость эритроцитов, капиляроскопия с помощью бульбарной микроскопии по общепринятым методикам. Источником лазерного излучения являлись импульсные излучатели типа ИЛПН-102 - ИЛПН-312 (длина волны лазерного излучения составила 0,61; 0,65; 0,67; 0,83; 0,85; 0,87; 0,91; 0,93; 0,95 мкм с углом расхождения лазерного луча 5о и мощностью 10-50 мВТ), гелий-неоновый лазер ЛГ-75, УЛФ-01, «УЗОР» (длина волны 0,63 мкм мощностью 2-25 мВТ и 0,89 мкм мощностью 2-20 мВТ соответственно). Лазерное облучение венозной крови длиной волны 0,61- 0,67 мкм проводилось с помощью кварцевого световода диаметром 200 мкм, вводимого в ушную вену кроликам и в бедренную - котам, собакам. Лазерное излучение в инфракрасном диапазоне длиной волны 0,83 - 0,95 мкм проводилось путем фиксации лазерных излучателей на грудную клетку (после удаления шерсти) в области сердца, благодаря способности излучения в этом диапазоне проникать на глубину до 20 см, не повреждая кожных покровов. У животных, находящихся под гексеналовым наркозом и на искусственной вентиляции легких, после вскрытия грудной клетки использовалось прямое облучение открытого сердца в вышеуказанных диапазонах длин волн. Доза лазерного излучения при облучении венозной крови оценивалась в Дж/кг, а при фиксации лазерных излучателей на грудную клетку и при облучении миокарда - в Дж/см2. Применение лазерного облучения венозной крови и прямого лазерного облучения миокарда обусловлено максимальным антиаритмическим эффектом в сравнении с воздействием лазерного излучения в видимом диапазоне на зоны Захарьина-Геда и при надвенном способе облучения (Олесин А.И., Лукин В.А., 1989, Синенко В.И., Олесин А.И.,1991). Результаты исследования показали, что наибольший антиаритмический эффект для лечения и предупреждения аритмий, обусловленных механизмом задержанной постдеполяризации, «re-entry» наблюдался при использовании лазерного облучения венозной крови длиной волны 0,63 мкм, при прекардиальном и прямом облучении миокарда лазерным излучением - 0.89, 0,93 мкм. Профилактическая активность лазерного излучения на аритмию, обусловленную механизмом ранней постдеполяризацией, отмечалась только при прямом воздействии на миокард лазерным излучением длиной волны 0,63, 0,89 и 0,93 мкм. Более детально было изучено воздействие лазерного излучения на размеры очага инфаркта миокарда и предупреждение реперфузионных аритмий. Эффективность лазерного облучения венозной крови длиной волны 0,63 мкм (3 серия) и воздействием на миокард лазерным излучением длиной волны 0,89 мкм (4 серия) и 0,93 мкм (5 серия) сравнивалась с новокаинамидом в наиболее эффективных дозах 30 мг/мг (2 серия). Контролем служили животные, которым за 5 дней до перевязки коронарных артерий на 60 мин проводились инъекции ионола в дозе 120 мг/кг (1 серия). Результаты исследования показали, что наилучший эффект наблюдался при использовании лазерного облучения венозной крови длиной волны 0,63 мкм и облучения миокарда длиной волны 0,93 мкм: на этих длинах волн, наряду с наименьшими размерами очага инфаркта миокарда, в период реперфузии аритмии не наблюдались. Для устранения реперфузионных аритмий доза лазерного облучения венозной крови длиной волны 0,63 мкм и прекардиальным лазерным облучением - 0,89 мкм, 0,93 мкм составила 0,2 - 0,4 Дж/кг (в среднем 0,30,1 Дж/кг) и 0,1-0,3 Дж/см2 (в среднем 0,20,1 Дж/см2) соответственно. Наиболее эффективная профилактическая суммарная доза при внутрисосудистом облучении крови длиной волны 0,63 мкм составила в среднем 3 Дж/кг, при прекардиальном воздействии через грудную клетку лазерного излучения длиной волны 0,89 и 0,93 мкм - до 25 Дж/см2, при прямом облучении миокарда - до 10 Дж/см2. Следует отметить, что при превышении вышеуказанных доз противоаритмический эффект лазерного излучения значительно снижался. Наиболее чувствительными показателями при воздействии на кровь лазерного излучения в различных диапазонах длин волн оказались гидроперекиси липидов и соответственно активность антиоксидантной системы, а в меньшей степени - агрегация тромбоцитов и осмотическая стойкость эритроцитов. r Методика проведения лазеротерапии и определение терапевтической дозы лазерного излучения. При оценке изменений биохимических параметров в процессе проведения лазерного облучения венозной крови в эксперименте было подтверждено, что наиболее чувствительными показателями при воздействии лазерного излучения оказались продукты перекисного окисления липидов, в то время как остальные биохимические показатели, включая агрегацию тромбоцитов, эритроцитов, изменялись в меньшей степени. Основываясь на изменении содержания в крови продуктов перекисного окисления липидов при использовании лазерного излучения в различных диапазонах длин волн, нами был разработан следующий метод определения однократной и суммарной терапевтической дозы при проведении лазеротерапии (Олесин А.И. и соавт., 1992). Способ определения терапевтической дозы и методика проведения лазеротерапии заключается в следующем. Методика проведения лазеротерапии. Лазерное облучение венозной крови проводится через кварцевый световод толщиной 200-400 мкм, введеный в кубитальную или подключичную вену. Стерилизация световода осуществляется 10% спиртовым раствором хлоргексидина (экспозиция не менее 10 минут - световод должен обрабатываться по стандартным правилам стерилизации эндокардиальных электродов, причем при использовании несменяемого световода перед последующим употреблением он отмывается от крови по стандартным методикам). Перед введением в вену световод находится в 96о спирте. Стерильным пинцетом, с соблюдением правил асептики, извлекается световод, измеряется мощность лазерного излучения на конце световода (фотоприемник индикатора должен быть обработан 96о спиртом). В момент измерения световод находится перпендикулярно к фотоприемнику, контакт не обязателен. Затем через пункционную иглу световод вводится в периферическую локтевую вену до появления в ней света. Можно совмещать инфузии лекарственных средств с проведением внутрисосудистого облучения крови при использовании достаточно толстой иглы или катетера. Концы световода должны быть тщательно обработаны. Полимерная оплетка на конце световода осторожно оплавляется в пламени так, чтобы не осталось утолщений и заусенцев. Оголенный участок стекловолокна не должен выступать из-под оболочки больше, чем на 0,5 мм. В случае необходимости торец обрабатывается бархатным надфелем или алмазным бруском. Световое пятно при проекции луча на экран должно быть равномерным, круглой формы с ровными контурами. Иглы заранее подбираются на соответствие их просвета с диаметром световода. Оборудование для проведения лазерного облучения венозной крови: комплект сменных (наиболее оптимально - одноразовых) моноволоконных световодов с внешним диаметром 200-400 мкм с соответствующими их диаметру иглам, обычно используемыми для пункции периферических вен; иглы для пункции периферических вен, причем должна быть обеспечена минимальная травматичность (наименьший диаметр иглы, соответствующий размеру световода), эксикаторы или аналогичные емкости для обработки и стерилизации световодов (2-3 шт.); стерильные пинцеты, стерильные простыни, полотенца или салфетки, подкладные клеенки; венозный жгут; 96о спирт, растворы хлоргексидина или родалона. Облучение миокарда лазерным излучением путем фиксации излучателей на грудной клетке. Лазерное излучение проводится в импульсном режиме и инфракрасном диапазоне путем фиксации лазерных излучателей в 3-5 межреберьях на расстоянии 1-2 см слева от грудины одновременно в 9 точках, расположенных квадратом и на расстоянии 1 - 2 см друг от друга, так, чтобы лазерные лучи фокусировались на глубине 10 -15 см. Глубину фокусирования определяли при эхокардиографическом исследовании в зависимости от расположения участков миокарда, на которые должно быть направлено лазерное излучение. Средняя мощность излучения должна составлять от 20 до 50 мВТ. Длительность воздействия на грудину при таком способе фиксации лазерных излучателей составляет, в среднем, 10-30 минут. При проведении лазерного облучения венозной крови в инфракрасном диапазоне излучатель фиксируют в области проекции подключичной вены, перпендикулярно ей. Следует помнить, что коэффициент поглощения лазерного излучения (в этих диапазонах длин волн) для кожи и мышц равен в среднем 0,7 и 0,4 при фиксации излучателей в области абсолютной тупости и в области проекции подключичной вены соответственно. Метод расчета терапевтической дозы лазерного излучения. Метод основан на определении чувствительности больного к лазерному воздействию при проведении лазерного облучения венозной крови в красном и инфракрасном диапазонах в пробной дозе 1,0 Дж, а при облучении миокарда путем фиксации лазерных излучателей длиной волны 0,89 мкм и (или) 0,93 мкм на грудной клетке в однократной дозе до 1,0 Дж/см2. До и после проведения лазерного облучения в пробной дозе определяют содержание в крови продуктов перекисного окисления липидов (гидроперекиси липидов) и (или) суммарную актиоксидантную активность (используя, например, метод хемилюминесценции). Расчет однократной терапевтической дозы лазерного излучения проводится по формуле: А Тодн. = ——— х Д, (1) Б - В где Тодн. - однократная терапевтическая доза лазерного излучения при проведении лазерного облучения венозной крови в Дж, а при фиксации излучателей на грудной клетке в Дж/см2; А - содержание продуктов перекисного окисления липидов или суммарной антиоксидантной активности крови у здоровых лиц, равные в среднем 1,24 ммоль/л и 0,78 имп/мин/мл103 соответственно; Б - содержание продуктов перекисного окисления липидов или суммарной антиоксидантной активности крови до проведения лазеротерапии; В - содержание продуктов перекисного окисления липидов или суммарной антиоксидантной активности крови после проведения лазеротерапии в дозе 1,0 Дж или 1,0 дж/см2; Д - доза лазерного излучения, равная для внутрисосудистого облучения венозной крови 1,0 Дж и при фиксации излучателей на грудной клетке 1,0 дж/см2. Расчет суммарной терапевтической дозы лазерного излучения проводится по формуле: А Тсум. = ——— х Тодн., (2) Б - С где Тсум. - суммарная терапевтическая доза лазерного излучения при проведении лазерного облучения венозной крови в Дж, а при фиксации излучателей на грудной клетке в Дж/см2; А - содержание продуктов перекисного окисления липидов или суммарная антиоксидантная активность крови у здоровых лиц, равные в среднем 1,24 ммоль/л и 0,78 имп/мин/мл103 соответственно; Б - содержание продуктов перекисного окисления липидов или суммарная антиоксидантная активность крови до проведения лазеротерапии; С - содержание продуктов перекисного окисления липидов или суммарной антиоксидантной активности крови до проведения второго сеанса лазеротерапии; Тодн. - однократная терапевтическая доза лазерного облучения венозной крови в Дж, а при фиксации излучателей на грудной клетке в Дж/см2. Для более точного определения однократной терапевтической дозы лазерного излучения определение биохимических показателей осуществляют в динамике при достижении дозы в 5-10 Дж до их нормализации, а суммарной - до проведения каждого сеанса лазеротерапии. Корреляция между расчетной и дозой лазерного излучения, определенной в динамике проведения лазеротерапии составила 0,93. При сопоставлении дозы лазерного излучения с изменениями клинико-биохимических, лабораторных и инструментальных показателей оказалось, что положительный клинический результат и положительная динамика исследуемых показателей наблюдались при достижении однократной терапевтической дозы лазерного излучения до 0,2 Дж/кг и суммарной - 1,0 Дж/кг. Поэтому ориентировочный подбор дозы лазерного излучения можно осуществить расчетным способом. Время экспозиции лазерного излучения в инфракрасном диапазоне определяется с учетом того, что больной должен получить энергетическую дозу до 0,2 Дж/кг, и рассчитывается по формуле: T = А D/B К, где T - время в сек.; А - разовая доза в Дж/кг; D - вес больного в кг; B - мощность лазерного излучения в Вт; К - коэффициент поглощения кожи, равный 0,7 при облучении в области абсолютной тупости или 0,4, если облучается область проекции подключичной вены, перпендикулярно ей. Аналогично этому способу используется определение дозы лазерного излучения путем облучения взвеси эритроцитов с оценкой гипоосмолярного гемолиза до и после ее облучения в дозе 1,0 Дж/ см2 с последующей оценкой степени гемолиза эритроцитов до проведения каждого сеанса лазеротерапии, причем курс считается законченным при достижении гипоосмолярного гемолиза эритроцитов соответствующих величин у здоровых лиц. Другие методы основаны на определении прекапиллярного давления, параметров вегетативной регуляции в динамике проведения лазеротерапии (Голуб Я.В. и соавт., 1992). Следует отметить, что, если терапевтическая (адекватная) доза лазерного излучения не достигнута, положительный результат использования лазеротерапии кратковременен или отсутствует, а при ее превышении (передозировке) - наблюдается отрицательный эффект, проявляющийся в виде головной боли, головокружения, слабости, тошноты, реже рвоты, которые проходят самостоятельно без дополнительной терапии. При передозировке лазерного излучения, например, у больных стенокардией, возможно снижение активности антиоксидантной системы, спазм коронарных артерий, гиперкоагуляция, в частности при использовании излучения длиной волны 0,63 мкм, ухудшение течения основного заболевания, проявляющееся в учащении и усилении ангинозных болей, увеличении частоты и тяжести течения клинических рецидивов пароксизмов аритмии, в том числе экстрасистолии. В этих случаях следует сделать 2-4 дневный перерыв с назначением витамина Е. Если доза лазерного излучения определяется расчетным способом, то для профилактики осложнений целесообразно использовать антиоксиданты, например, витамин Е, аевит или продукты, содержащие этот витамин (растительное или кукурузное масло). Для иллюстрации приводим изменение содержания в крови гидроперекисей липидов (в % отклонения от нормы) до и после проведения каждого сеанса лазерного облучения венозной крови длинойволны 0,63 мкм: при использовании терапевтической дозы и положительном эффекте (рис. 2.8.), при использовании субтерапевтической дозы и непродолжительном клиническом эффекте (рис. 2.9.), при передозировке и появлении осложнений (рис. 2.10.). Нами проводилась лазеротерапия у 79 больных стенокардией I-II функционального класса в качестве монотерапии: облучение надвенным способом и зон Захарьина-Геда (Агов Б.С. и соавт., 1985, Корочкин И.М. и соавт, 1988) и у 226 пациентов с III-IV классом стенокардии - дополнительно к проводимой антиангинальной терапии нитратами, антиагрегантами, антагонистами кальция или -адреноблокаторами. Вначале проводилось облучение зон Захарьина-Геда или надвенным способом, а при их неэффективности использовалось лазерное облучение венозной крови по вышеописанной методике. У 42(53,16%) из 79 больных стенокардией I-II функционального класса эффективность лазеротерапии сравнивалась с плацебо (больному показывали включенный лазерный аппарат, затем ему одевались специальные противолазерные очки, в которых лазерный свет не виден, а потом выключали лазер или шторкой закрывали выход лазерного луча из прибора). У 126(55,75%) больных с III-IV классом стенокардии наблюдалось развитие толерантности к нитратам: у этих пациентов доза нитропрепаратов (5-моно-, ди- и тринитраты) превышала 80-120 мг в сутки. Группу сравнения составили 65 больных со стенокардией III-IV функционального класса, которым была проведена операция аортокоронарного шунтирования. Критерием положительного эффекта явилось снижение частоты и интенсивности ангинозных болей, определяемых в баллах по методу Л.Т. Малая и соавт. (1984), уменьшение объема фармакологической антиангинальной терапии, в частности, применяемых нитропрепаратов, а также увеличение толерантности к нагрузке при применении чреспищеводной электрокардиостимуляции и велоэргометрии, проводимых по общепринятым методикам. 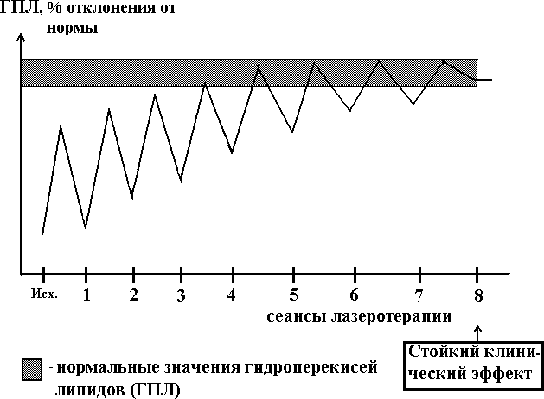 Рис. 2.8. Изменение содержания в крови гидроперекисей липидов до и после проведения сеансов лазерного облучения венозной крови длиной волны 0,63 мкм при использовании терапевтической дозы и положительном клиническом эффекте. ГПЛ – гидроперекиси липидов в % отклонения от нормы. После проведения каждого сеанса лазерного облучения венозной крови длиной волны 0,63 мкм ГПЛ приближаются к норме, а перед следующим сеансом – увеличиваются, но не доходят до исходных величин. При достижении терапевтической дозы лазеротерапии ГПЛ нормализуются, что коррелирует положительным клиническим эффектом (r = 0,92). 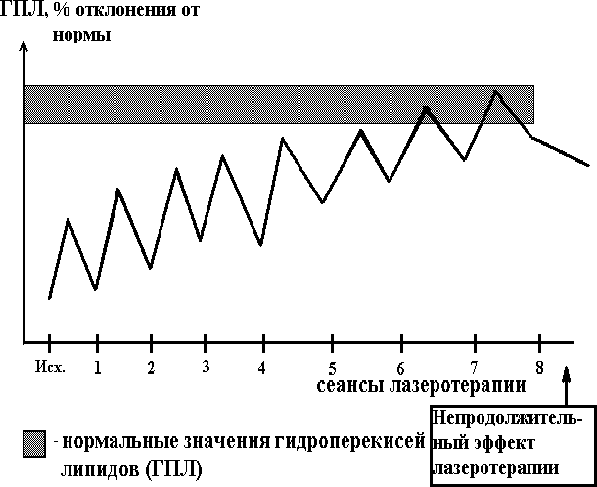 Рис. 2.9. Изменение содержания в крови гидроперекисей липидов до и после проведения сеансов лазерного облучения венозной крови длиной волны 0,63 мкм при использовании cубтерапевтической дозы и непродолжительном клиническом эффекте. ГПЛ – гидроперекиси липидов в % отклонения от нормы. После проведения каждого сеанса лазерного облучения венозной крови длиной волны 0,63 мкм ГПЛ приближаются к норме, а перед следующим сеансом – увеличиваются, но не доходят до исходных величин. При использовании субтерапевтической дозы лазеротерапии ГПЛ не нормализуются, а положительный клинический эффект непродолжительный. 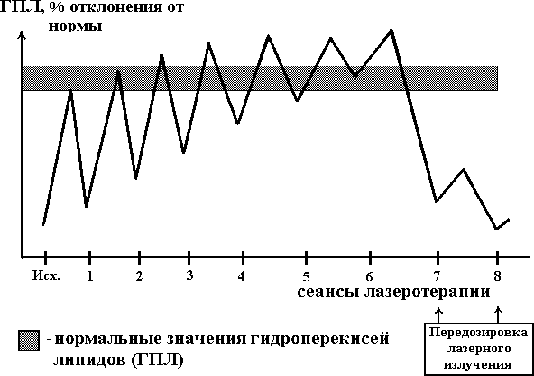 Рис. 2.10. Изменение содержания в крови гидроперекисей липидов до и после проведения сеансов лазерного облучения венозной крови длиной волны 0,63 мкм при передозировке терапевтической дозы лазеротерапии и появлении осложнений. ГПЛ – гидроперекиси липидов в % отклонения от нормы. После проведения каждого сеанса лазерного облучения венозной крови длиной волны 0,63 мкм ГПЛ приближаются к норме, а перед следующим сеансом – увеличиваются, но не доходят до исходных величин. При передозировке лазерного излучения ГПЛ вначале нормализуются (после 6 сеанса), а при последующих сеансах – снижаются ниже исходных величин, что коррелирует развитием осложнений (учащение и усиление ангинозных болей, увеличении частоты и тяжести течения клинических рецидивов пароксизмов аритмии, в том числе экстрасистолии) (r = 0,86). Продолжительность положительного клинического эффекта в течение в течение 6 месяцев и более после применения курса лазеротерапии расценивали как хороший результат лечения, от 1 до 6 месяцев - удовлетворительный и менее 1 месяца – неудовлетворительный. Результаты исследования показали, что облучение надвенным способом и зон Захарьина-Геда оказалось эффективным только у больных стабильной стенокардией I и II функционального класса, в то время как внутрисосудистое облучение венозной крови - III - IV функциональным класса. Следует отметить, что у 23(54,76%) из 42 больных стабильной стенокардией I и II функционального класса, которые получали плацебо, наблюдался положительный антиангинальный эффект. У 48(38,10%) из 126 больных с III-IV функциональным классом стенокардии и наличием толерантности к нитратам отмечалось уменьшение дозы применяемых нитропрепаратов в среднем в 3,5 раза. Хороший результат (от 6 до 11 месяцев) применения лазеротерапии наблюдался только у 23% больных стенокардией III - IV функционального класса, включая пациентов после аортокоронарного шунтирования, причем повторные сеансы (через несколько месяцев после первого курса) были значительно менее эффективны, чем первые (см. рис. 2.11.). Следует отметить, что положительный эффект лазеротерапии у больных после аортокоронарного шунтирования в большинстве случаев обусловлен улучшением проходимости шунтов (Олесин А.И. и соавт, 1995, Maximov V.A. et al., 1990, 1992). Продолжительность положительного эффекта лазеротерапии у больных стабильной стенокардией значительно уступает в сравнении с результатами оперативного лечения (аортокоронарного шунтирования и т.д.) (см. рис. 2.12.). 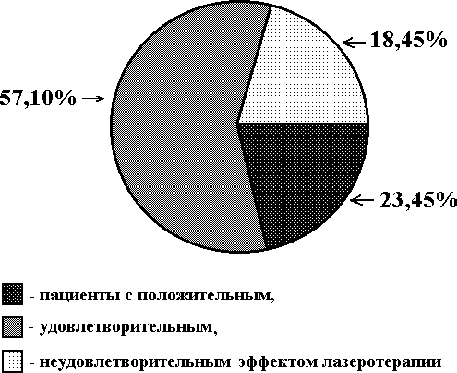 Рис. 2.11. Эффективность использования лазерного облучения венозной крови у больных стенокардией III-IV функционального класса. Лазеротерапия использовалась в терапевтических дозах. Рис. 2.12. Сопоставление продолжительности положительного клинического эффекта у больных стенокардией III-IV функционального класса при проведении лазеротерапии и аортокоронарного шунтирования. Лазеротерапия использовалась в терапевтических дозах.  Рис. 2.11. Эффективность использования лазерного облучения венозной крови у больных стенокардией III-IV функционального класса. Лазеротерапия использовалась в терапевтических дозах. Таким образом, одним из показаний применения лазеротерапии у больных стабильной стенокардией, согласно полученным нами результатам, является наличие толерантности к нитропрепаратам, предупреждение тромбоза шунтов после операции аорто-коронарного шунтирования. В остальных случаях у этих пациентов целесообразно использовать традиционные методы лечения, включая, наряду с антиангинальной терапией нитратами, антиагрегантами, бета-адреноблокаторами или антагонистами кальция, гипохолестренемическую терапию, диету, ограничение физических нагрузок, а при выявлении стеноза венечных артерий более 70% - проведение оперативного лечения. В доступной нам литературе мы не обнаружили оценки эффективности лазерного излучения у больных нестабильной стенокардией с повышенным риском развития инфаркта миокарда. Также не было информации о сравнительной оценке эффективности лазерного излучения в различных диапазонах длин волн и их сочетанного применения для предупреждения инфаркта миокарда у больных нестабильной стенокардией. Для оценки эффективности применения лазеротерапии для лечения различных клинических форм нестабильной стенокардии нами было обследовано 133 больных. Диагноз устанавливался на основании клинической картины заболевания, результатов электрокардиографического исследования в динамике, определения активности кардиоспецефических ферментов сыворотки крови. У всех обследуемых пациентов наблюдался высокий риск развития инфаркта миокарда, несмотря на проводимую адекватную антиангинальную терапию. К ним были отнесены следующие критерии: отсутствие уменьшения (в течение первых 1-2 дней со дня госпитализации) ангинозного синдрома, положительной динамики лабораторных (уменьшения содержания продуктов перекисного окисления липидов, мембранной проницаемости) и инструментальных показателей (данных электрокардиографического и эхокардиографического исследований) в сравнении с результатами при поступлении в стационар или данными обследования на догоспитальном этапе (Синенко В.И. и соавт., 1995). Следует отметить, что однократное обследование больных нестабильной стенокардией при поступлении в стационар не позволяет определить степень риска возможного развития инфаркта миокарда (Малая Л.Т., 1981, Ганелина Е.И., 1989, Чазов Е.И., 1992). Таблица 2.1. Частота развития инфаркта миокарда при проведении лазеротерапии у больных нестабильной стенокардией I, II, III и IV групп на госпитальном этапе заболевания 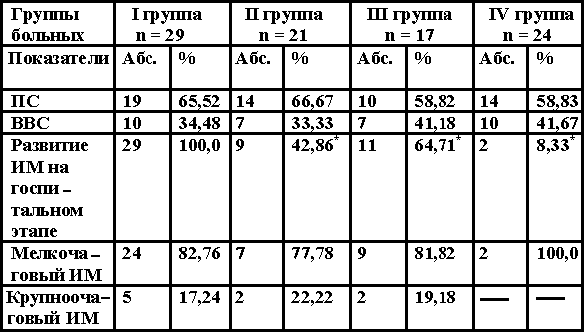 Примечание: * - достоверность различия показателей в сравнении с больными I группы (при р < 0,05); ПС - прогрессирующая стенокардия, ВВС - впервые возникшая стенокардия, ИМ – инфаркт миокарда. Эффективность проводимой терапии оценивалась в четырех группах. I группу составили 29 больных нестабильной стенокардией, которым проводилась только медикаментозная антиангинальная терапия. У всех больных этой группы на госпитальном этапе наблюдалось развитие инфарктамиокарда (группа сравнения). Во II группу вошли 21 больных нестабильной стенокардией, которым наряду с базисной антиангинальной терапией проводилось лазерное облучение венозной крови длиной волны 0,63 мкм, начиная со 1-2 суток со дня пребывания больных в стационаре. В III группу было включено 17 больных нестабильной стенокардией, которым наряду с базисным лечением проводилось облучение миокарда лазерным излучением длиной волны 0,89 мкм с 3 суток стационарного лечения. IV группу составили 24 больных нестабильной стенокардией, которым наряду с медикаментозной терапией, со 1-2 суток лечения в стационаре проводилось сочетанное применение лазерного облучения венозной крови длиной волны 0,63 мкм и миокарда лазерным излучением длиной волны 0,89 мкм. Методика его проведения и определение дозы лазерного излучения описаны выше. Частота развития инфаркта миокарда при проведении лазеротерапии у больных нестабильной стенокардией I, II, III и IV групп на госпитальном этапе заболевания представлена в таблице 2.1. Как видно из таблицы, наилучший эффект наблюдался у больных IV группы, причем достоверного различия в выявлении прогрессирующей и впервые возникшей стенокардии у больных этих групп выявлено не было. Таким образом, у больных нестабильной стенокардией при сохранении ангинозного синдрома в течение 1-2 суток от начала адекватной антиангинальной терапии показано применение лазерного облучения венозной крови длиной волны 0,63 мкм и облучение миокарда лазерным излучением длиной волны 0,89 мкм. Глава 3 |
