ихтиопаталогия. Дана характеристика рыб как переносчиков возбудителей болезней человека и животных. Для студентов вузов по специальности Водные биоресурсы и аквакультура
 Скачать 10.48 Mb. Скачать 10.48 Mb.
|
|
5.5. ОСПА КАРПА Оспа карпа — заразное заболевание вирусной природы. Этиология. Первые данные, позволяющие рассматривать оспу как вирусное заболевание, появились в 1950-х годах. В дальнейшем при помощи электронной микроскопии в оспенных образованиях на коже карпов обнаружены внутриклеточные элементарные тельца округлой формы. Вирус быть отнесен к группе герпес-вирусов. Его вирионы округлой формы диаметром до 110 нм локализуются в ядре эпителиальных клеток. Нуклеид содержит ДНК и окружен капсидом, заключенным во вторую мембрану (рис. 11). 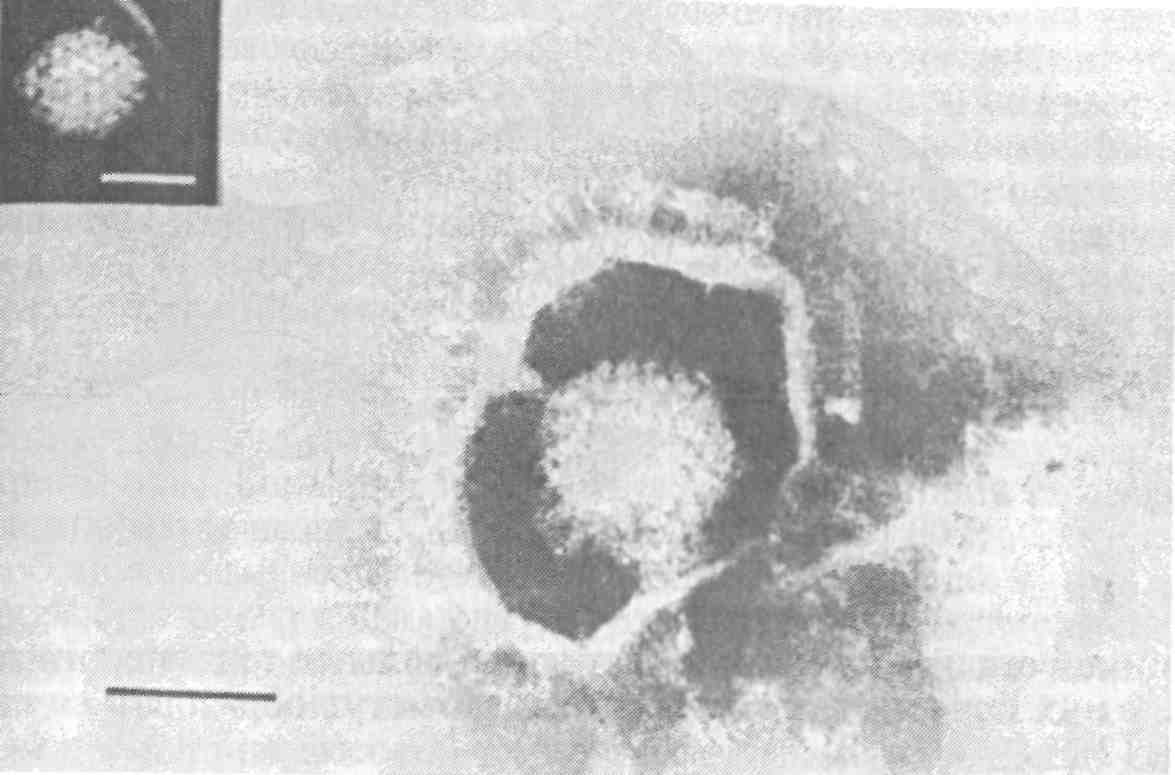 Рис. 11. Возбудитель оспы карпа К вирусу чувствительны клеточные линии FHM, МСТ и ЕРС. Эпизоотология. Заболевание характеризуется длительностью инкубационного периода, который растягивается иногда на год. В результате клинические признаки болезни, как правило, проявляются у двухлетков и крайне редко наблюдаются у сеголетков, хотя источником заражения молоди, несомненно, служат производители. По мнению ряда авторов, на заболеваемость оказывает влияние наследственная подверженность отдельных стад карпа к оспе; однако эти предположения не подкреплены экспериментальными Данными. По мнению большинства авторов, условия выращивания рыб влияют на течение болезни. Это в первую очередь искусственное Кормление кормами, бедными витаминами, и недостаток кальция в воде. Высокие плотности посадки, приводящие к замедленному Росту рыб, способствуют массовому заболеванию оспой. Клинические признаки и патогенез. Оспа характеризуется появлением на поверхности тела и плавниках плоских эпителиальных опухолей — эпителиом. Разрастание охватывает только поверхностную часть кожи. При тяжелой форме заболевания опухоли сливаются вместе в почти сплошной слой, но это наблюдается очень Редко. В начале болезни опухоли мягкие, в дальнейшем становятся плотнее и напоминают парафиновые пятна. Если больных рыб на ранней стадии болезни поместить на сильное течение, эпители-омы у них исчезают, но в дальнейшем могут образоваться снова (рис. 12). 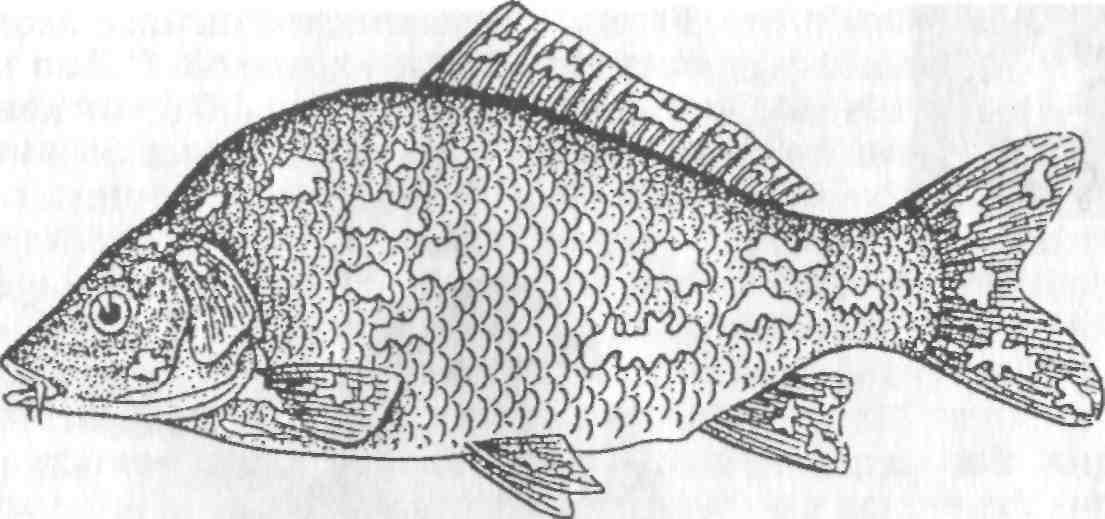 Рис. 12. Карп, пораженный оспой Оспа не вызывает гибели, но приводит к отставанию в росте, иногда достигающему 50 %. У больных рыб наблюдается размягчение костей, а в дальнейшем различные деформации скелета. Кроме того, оспенные наросты портят товарный вид рыбы. Поэтому оспа крайне нежелательна в прудовых хозяйствах. Меры борьбы. Для предупреждения заболевания пруды нужно поддерживать в хорошем санитарном состоянии, не допускать чрезмерно плотных посадок. При недостатке кальция в почве и воде необходимо систематическое известкование прудов, а также добавление к кормам мела (до 10 %). Очень хорошие результаты дает тщательная выбраковка всех заболевших рыб при зарыблении нагульных прудов. Особенно внимательно осуществляют выбраковку больных особей среди маточного стада как при весенней инвентаризации, так и осенью при посадке на зимовку. 5.6. ГЕРПЕСВИРУСНОЕ ЗАБОЛЕВАНИЕ КАНАЛЬНОГО СОМА Герпесвирусное заболевание канального сома (ГВКС, Channel catfish virus disease, CCVD). Болезнь очень опасна для молоди американского пятнистого, или канального, сома (Ictalurus punctatus). Этиология. Возбудителем является вирус, отнесенный к группе герпесвирусов. Размножается только на культурах клеток из гонад различных икталурусов при оптимальной температуре 25 "С (рис. 13). С первого пассажа дает характерное ЦПД—образование синцитиальных многоядерных, а также округлых клеток. При воспроизведении заболевания в биопробе патогенным материалом от культур любого пассажа получают 100 %-ную гибель сомиков. Ви-рионы отнесены к ДНК-содержащим герпесвирусам, имеют форму икосаэдра, их диаметр 175—200 нм. Сборка вирусных нуклеокапсидов происходит в ядре, а созревание вирионов — на ядерной мембране при выходе в цитоплазму клетки. Капсид состоит из 162 капсомеров. Вирус сохраняет вирулентность при 25 °С не более 2 сут, но при замораживании (при температуре -20 °С) — до 6 мес. Выделяют его только из мальков сома с внешними симптомами болезни. Эпизоотология. Заболевание отмечают в США при разведении сома в прудах. На Украине оно было зарегистрировано при выращивании сома в тепловодном бассейновом хозяйстве. Массовая смертность происходит на 5—7-й день после появления первых симптомов болезни. Болезни подвержены мальки и сеголетки канального сома массой до 10 г. Рыбы большей массы, включая производителей, невосприимчивы. Вспышки заболевания отмечают с июня по сентябрь при температуре выше 23 °С, смертность достигает 60 %. Факторами, способствующими возникновению заболевания, являются травмати-зация рыб, дефицит кислорода и другие стрессоры. Экспериментально рыбу заражают через воду, путем внутрибрюшинных инъекций, через рот и нанесением патогенного материала на жабры. Инкубационный период при высокой температуре воды (свыше 23 °С) длится около 3 дней, при ее понижении — удлиняется. Клиническая картина и патогенез. Заболевшие мальки слабеют, лишь изредка совершая спиральные движения, часто почти вертикально держатся у поверхности воды, затем опускаются на дно и гибнут. Болезнь сопровождается образованием геморрагии на брюшке и плавниках, водянкой брюшной полости тела, пучеглазием и побелением жабр. При вскрытии отмечены кровоизлияния в мышцы, почку, печень, стенки кишечника. Селезенка розоватого цвета, заметно увеличена. В полости тела и в желудке иногда обнаруживается жидкость беловатого цвета. 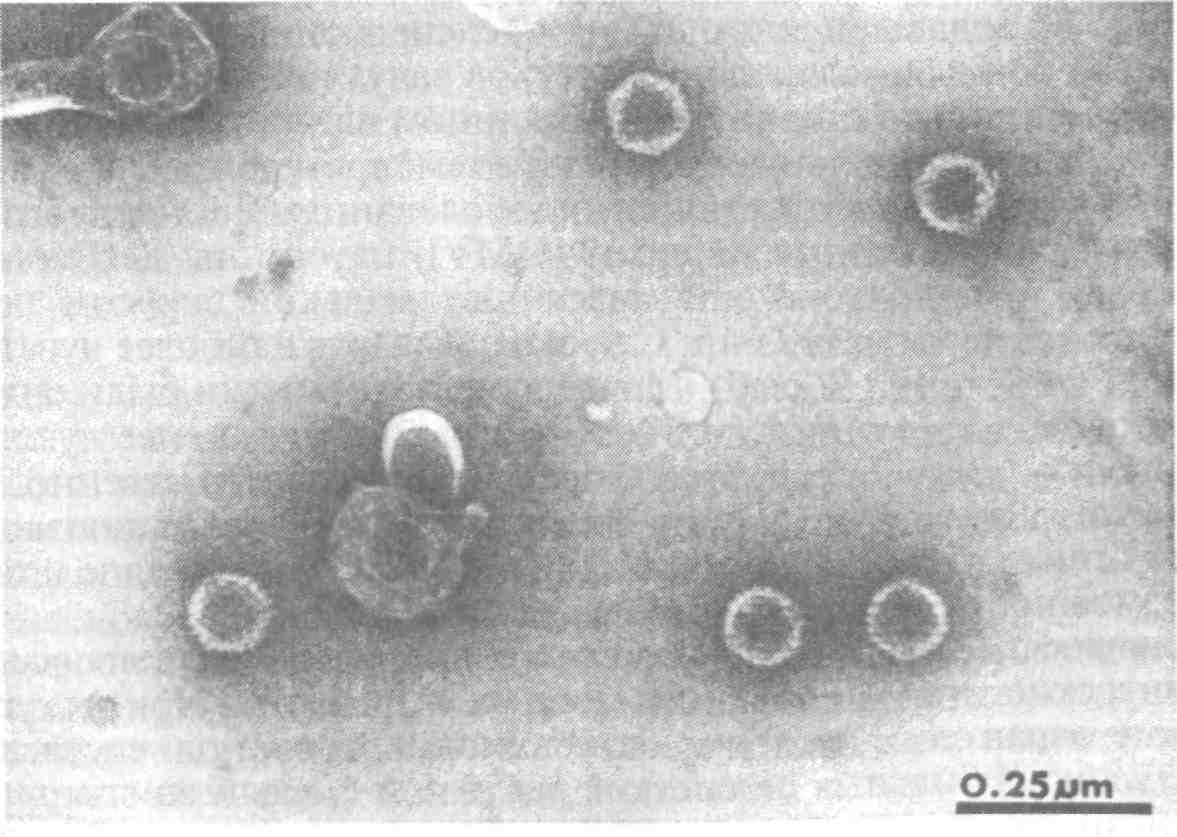 Рис. 13. Возбудитель герпесвирусного заболевания канального сома Меры борьбы. Неблагополучное хозяйство закрывают на карантин, а очаг купируют. Всю заболевшую рыбу уничтожают, водоем, пруд или бассейн спускают и подвергают дезинфекции негашеной или хлорной известью. 5.7. ГЕРПЕСВИРУСНЫЕ ИНФЕКЦИИ ЛОСОСЕВЫХ Возбудители. Герпесвирусы выделены от лососевых рыб в Северной Америке (HPV и SHV) и Японии (NeVTA, OMV, CSTV и YTV). Выделенные вирусы подразделяют на две группы: североамериканские изоляты (менее патогенные и не обладающие онко-генными свойствами) и японские изоляты (напротив, обладающие большей патогенностью и способностью вызывать папилломы у выживших после заражения рыб). Помимо этого, вирусы двух данных групп различаются между собой в антигенном отношении и по строению генома. Вирионы всех изолятов имеют примерно одинаковую морфологию и размер 150—250 нм. К вирусам чувствительны постоянные линии клеток лососевых RTG-2, RTF-1, KF-1, CHSE-214 и др. Цитопатогенное действие в культуре клеток характеризуется образованием симпластов, в ядрах инфицированных клеток обнаруживают включения. Эпизоотология. HPV был выделен в одном из рыбопитомников США в начале 1970-х годов от производителей радужной форели в связи с наблюдавшейся среди них посленерестовой гибелью. Вирус патогенен для мальков и сеголетков радужной форели в возрасте до 4 мес только при внутрибрюшинном введении, вызывая заболевание и значительную гибель при температуре воды 6—10 °С. Годовики нерки были устойчивы к заболеванию. Японские штаммы вируса, выделенные от симы (OMV), патогенны для молоди лососевых. После заражения месячных мальков вирусом через воду при температуре 10—15 °С нерка оказалась наиболее чувствительной (гибель 100 % рыб). Менее чувствительными были сима и кета (гибель соответственно 87 и 83 % рыб) и еще менее чувствительными — кижуч и радужная форель (гибель соответственно 39 и 29 % рыб). Вирус выделяли из овариальной жидкости производителей и гонад неполовозрелой молоди, в связи с чем предполагается возможность вертикальной передачи инфекции. Клинические признаки и патогенез. У производителей лососевых клинические признаки заболевания не выражены. При искусственном заражении молоди инкубационный период составляет 14—33 дня. У больных сеголетков радужной форели из анального отверстия выделяются тонкие слизистые шнуры. Затем развиваются экзофтальм, увеличение брюшка. Рыба становится вялой, не принимает корм, опускается и лежит на дне. У части рыб отмечают потемнение кожных покровов, анемию жабр, иногда — кровоизлияния в глазное яблоко. Содержание незрелых эритроцитов в периферической крови возрастает до 10—13 %, гематокрит падает до 12 %. В брюшной полости присутствует большое количество асцит -ной жидкости, внутренние органы бледные, печень пятнистая, пищеварительный тракт свободен от пищевых масс. Аналогичные изменения происходят у молоди лососевых после заражения ее вирусом симы. В опытах на симе, кижуче и кете опухоли появились более чем у 60 % выживших рыб через 130—250 дней после заражения вирусом OMV. Они находились на голове, но в одном случае опухоль была обнаружена в почках. Гистологически поверхностные опухоли не отличались от папиллом, регистрируемых у больных рыб в естественных водоемах. Вирусные частицы не были обнаружены в тканях опухолей при электронно-микроскопическом исследовании, но при первичном культивировании опухолевых клеток вирус был реизолирован. Меры борьбы. Для профилактики герпесвирусных инфекций лососевых рекомендуется обрабатывать оплодотворенную икру иодофорами, а в неблагополучных по заболеванию зонах подвергать подаваемую в бассейны воду ультрафиолетовому облучению. 5.8. ВИРУСНЫЕ БОЛЕЗНИ ОСЕТРОВЫХ За рубежом у осетровых рыб выявлено 10 различных вирусов. Четыре из них — аденовирус (WSAV), иридовирус — (WSIV) и два герпесвируса (WSHV-1 и WSHV-2) у белого осетра (в США) и один иридовирус (RSIV) - у русского осетра (в Бельгии) вызывают тяжело протекающие заболевания у молоди. Возбудители. Вирусы, выделенные от белого осетра в США, являются ДНК-геномными. Наиболее опасными и широко распространенными агентами из четырех считаются иридовирус (WSIV) и герпесвирус-2 (WSHV-2). Герпесвирусы легко выделяются на культурах клеточных линий WSS-2, WSSK-1, WSGO. Иридовирус выделяется на культуре клеток с трудом, аденовирус выделить на клеточных культурах не удается. Иридовирус (RSIV) от русского осетра обнаружен при электронной микроскопии в виде скопления частиц диаметром 283 нм. Они несколько крупнее, чем вирионы WSIV. Эпизоотология. Заболевания развиваются весной, в начале лета и осенью при температуре воды 9—20 °С и осложняются миксо-бактериозом и протозойными инвазиями. Стресс является фактором, провоцирующим вспышки эпизоотии, которые сопровождаются гибелью 80—95 % выращиваемой молоди белого осетра в США. Рыбы старшего возраста не болеют, но являются вирусоносителями. Дикие производители считаются главным источником возбудителей инфекций. Вирусы передаются через воду и возможен вертикальный путь передачи вирусов от производителей потомству. Заболевание молоди русского осетра, вызванное иридовирусом RSIV, вспыхнуло в одном из хозяйств Бельгии после завоза молоди и икры. Гибель четырехмесячной молоди достигала 50 %. Клинические признаки и патогенез. У больных рыб отмечают анорексию, истощение, угнетение, бледность жабр. Для иридо-вирусного поражения характерно увеличение брюшка и покраснение жучек. Вирус поражает эпидермис жабр и ротоглотки. Гер-песвирус локализуется в эпидермисе различных участков тела, в мышечной стенке, в жабрах. У заболевших рыб наблюдают гиперемию и изъязвления на вентральной части рострума, в области рта и ануса, очаговые скопления слизи на голове и грудных плавниках. При поражении аденовирусом у молоди отмечают истощение, бледность печени, отсутствие корма в кишечнике. Молодь русского осетра, пораженная RS1V, не реагирует на раздражители, отказывается от корма, приобретает бледную окраску тела, плавает в вертикальном положении, теряет равновесие и погибает. В жабрах больных рыб обнаруживают мелкие кровоизлияния. Диагноз. Его ставят на основании клинических и эпизоотических данных и подкрепляют результатами вирусологических исследований. Гистологические исследования позволяют выявить наличие большого числа гипертрофированных базофильных клеток в эпидермисе ротоглотки. Меры борьбы. Они сводятся к созданию оптимальных условий выращивания для рыбы первого года жизни. При отсутствии стрессовых воздействий даже инфицированная молодь белого осетра, но без клинических признаков заболевания выпускается в природные водоемы Северо-Запада США. 5.9. ЛИМФОЦИСТИС Лимфоцистис (Lymphocystis disease, LD) — вирусная болезнь морских и пресноводных костистых рыб, характеризующаяся гипертрофией соединительнотканных клеток кожи и иногда других тканей. Возбудитель. Возбудитель лимфоцистиса имеет икосаэдри-ческую форму частиц (вирионов). Их диаметр в зависимости от вида рыб колеблется от 200 до 300 нм. Это крупный ДНК-геномный вирус, относящийся к семейству иридовирусов (рис. 14). Вирус репродуцируется в цитоплазме клеток. Его вирионы имеют внешнюю липидосодержащую оболочку. Снаружи на оболочке имеются отростки, в состав которых входят мукополиса-хариды. К вирусу чувствительны постоянные клеточные линии рыб BF-W, BF-2, МСТ и другие, в которых он размножается при температуре 15—25 °С. Вызываемый вирусом цитопатический эффект развивается медленно (до 30 дней) и проявляется в виде увеличения диаметра инфицированных клеток до 50—70 мкм. Вирус лимфоцистиса чувствителен к эфиру и глицерину, кислоте (рН 3,0), но устойчив к замораживанию-оттаиванию и обработке ультразвуком в течение 30—90 с. Быстро инактивируется при 25 °С, но хорошо сохраняется при 4 °С и глубоком замораживании (до минус 70 0С). 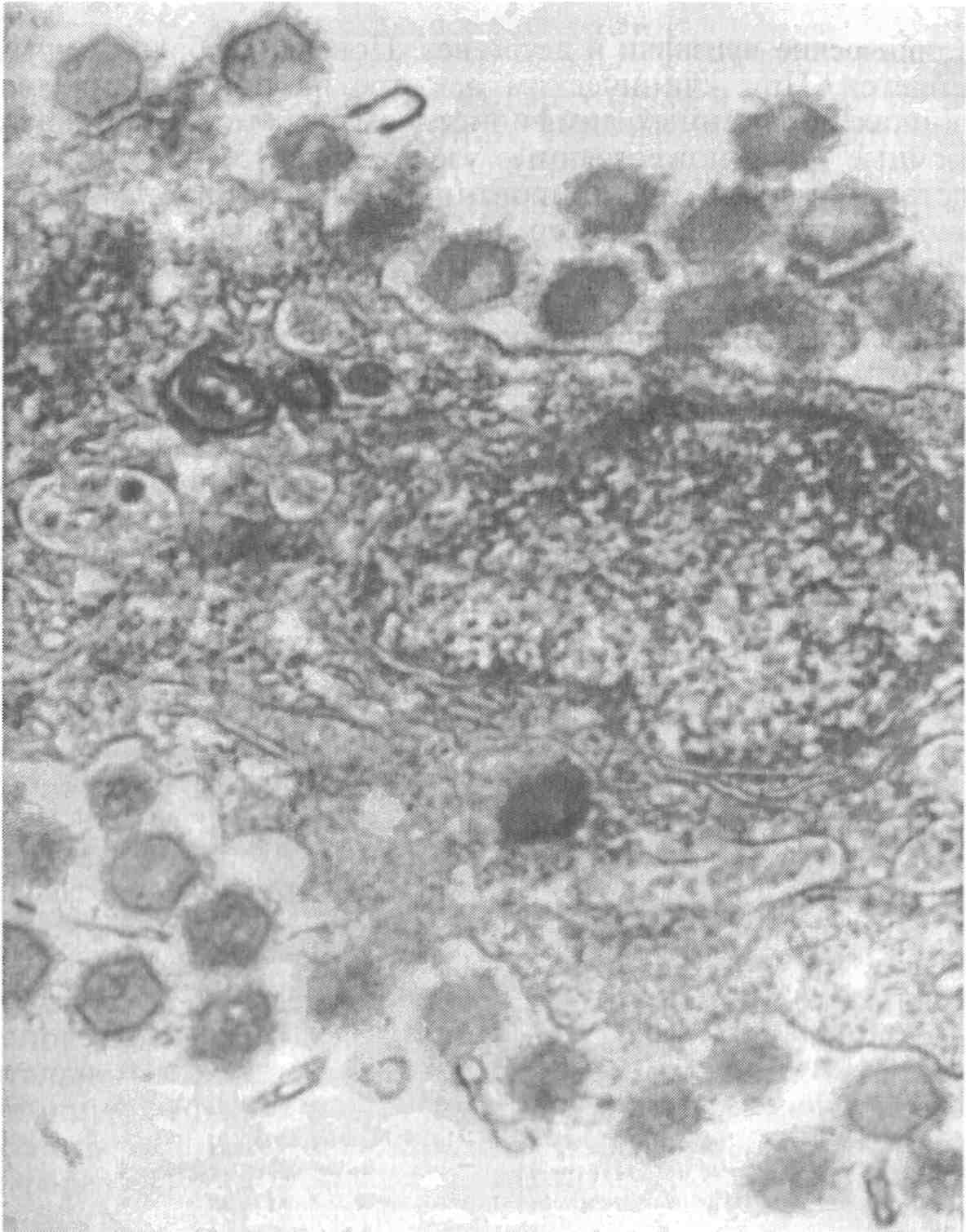 Рис. 14. Возбудитель лимфоцистиса Эпизоотология. Болезнь распространена очень широко и отмечена более чем у 150 видов рыб, из которых представители отрядов окунеобразных и камбалообразных составляют соответственно 75 и 10 %. Она наблюдается в Балтийском, Баренцевом, Чукотском, Беринговом, Японском и Эгейском морях. Заболеваемость лимфоцистисом обычно низкая, но иногда может быть значительной. Так, при исследовании обыкновенного робало (Centropomus undecimalis) размером 12—60 см из оз. Мара-канбо (Венесуэла) заболевание отмечали у 36 % выловленных рыб. В Осло-фьорде он был зарегистрирован летом у 1—10 % особей европейской камбалы (Platichthys flesus), а зимой — у 57 % этих рыб. Клинические признаки и патогенез. Поведение больных рыб не изменяется. При клиническом осмотре на поверхности тела и плавниках пораженных лимфоцистисом рыб можно обнаружить одиночные или множественные узелки (рис. 15). Каждый узелок представляет собой инфицированную вирусом клетку соединительной ткани кожи, диаметр которой увеличился в десятки раз (до 2 мм). Они проступают через покрывающий их эпителий, хорошо видны невооруженным глазом и часто образуют гроздепо-добные скопления, напоминающие ягоды малины. Вокруг них может отмечаться слабая воспалительная реакция. При сильном поражении такие клетки могут покрывать более половины поверхности тела больной рыбы. Иногда их находят также в глазах и внутренних органах. Под световым микроскопом видно, что клетки имеют овальную форму, у них увеличены ядро и ядрышко, по периферии цитоплазмы располагаются включения. Снаружи каждая клетка окружена толстой гиалиновой оболочкой. 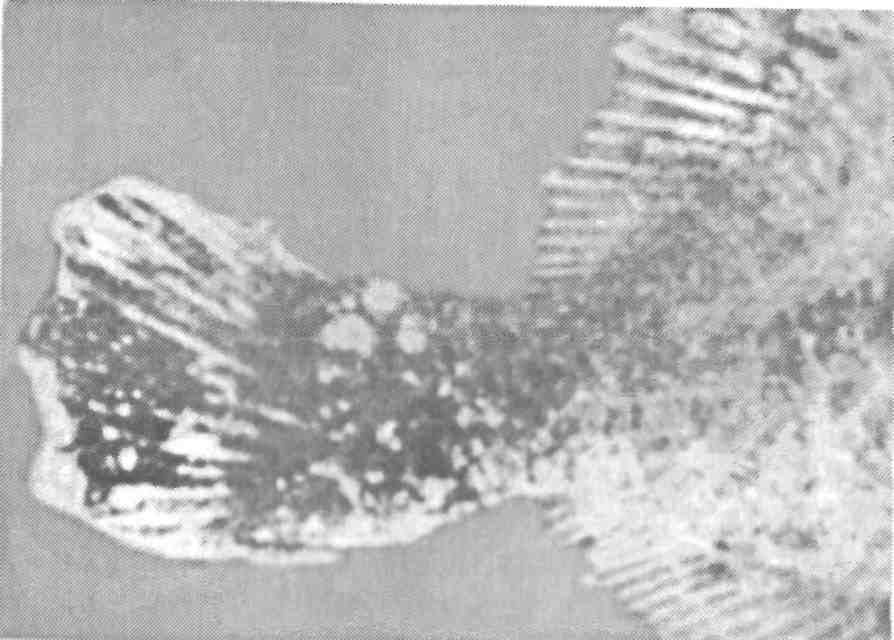 Рис. 15. Камбала, пораженная лимфоцистисом Гибели рыб от лимфоцистиса, как правило, не наблюдают. Гипертрофированные клетки разрушаются, и рыба выздоравливает, но может заболеть вновь. Диагноз. Его ставят на основании клинических, эпизоотологи-ческих данных, электронно-микроскопических и вирусологических исследований. Меры борьбы. Специальных мер борьбы с болезнью нет. 5.10. ВИРУСНЫЙ НЕКРОЗ ЭРИТРОЦИТОВ Вирусный некроз эритроцитов (ВНЭ, Viral erythrocytic necrosis, VEN) — это мягко протекающее заболевание. Возбудитель. Болезнь вызывают несколько иридовирусов, различающихся размерами вирионов у разных хозяев и по этому признаку условно разделенных на три группы: 310—360 нм — у атлантической трески, около 145 нм — у атлантической сельди и 189—205 нм — у тихоокеанских лососей и тихоокеанской сельди. При электронной микроскопии срезов пораженных эритроцитов вирионы обнаруживаются в цитоплазме и имеют вид правильных шести- и пятиугольников, внутри которых заключен электронно-плотный нуклеоид. Выделить вирус ВНЭ от больных рыб не удается. Эпизоотология. Болезнь распространена очень широко и отмечена у нескольких десятков видов рыб, представляющих около 20 семейств морских и анадромных рыб в районах тихоокеанского и атлантического побережий Северной Америки, Гренландии, Великобритании, Португалии и Норвегии, в Средиземном море и в прибрежных водах северной части Японии. Вероятно, на российском Северо-Западе и Дальнем Востоке возбудители ВНЭ также имеются. Из лососевых рыб заболевание наблюдали у океанических и идущих на нерест кеты и горбуши, а также у атлантического лосося при выращивании в морской воде. ВНЭ-включения в эритроцитах обнаружены у производителей кеты, чавычи, кижуча и стального-лового лосося в рыбопитомниках штата Орегон (США). Болезнь обнаружена у черной кефали (Mugil cephalus) в Португалии. Более того, включения были выявлены также в эритроцитах личинок кеты и молоди кижуча, полученных из икры инфицированных производителей. Это показывает, что заражение рыб может происходить на ранних стадиях развития, протекающих в пресной воде, и вероятно — вертикальным путем. При экспериментальном заражении в пресной воде к заболеванию были восприимчивы мальки кеты, горбуши, нерки, чавычи, кижуча, атлантического лосося, а также американской палии, кумжи и радужной форели. В Магаданской области ВНЭ-подобные включения в мазках Крови отмечали у производителей кеты и кижуча, идущих на нерест. Во время передержки производителей на рыбозаводе число рыб-вирусоносителей и доля пораженных эритроцитов резко возрастали. Заболевание наблюдается в разные сезоны года при температуре воды 5 —19 "С, но наиболее тяжело протекает летом. Резервуар инфекции находится в Мировом океане и, помимо естественно больных лососевых, формировать его могут и другие виды рыб, в частности тихоокеанская сельдь. Инкубационный период колеблется от нескольких дней до нескольких недель. Заболеваемость может достигать 100 %. Клинические признаки и патогенез. Главным признаком заболевания является анемия жабр и внутренних органов, иногда наблюдается увеличение селезенки. При экспериментальном заражении отмечали также экзофтальм, петехии на поверхности тела, а в желчном пузыре скопление темно-зеленой желчи. При микроскопии мазков крови в цитоплазме эритроцитов обнаруживаются от одного до (реже) трех на клетку округлых включений размером 0,5—5 мкм (рис. 16). Доля пораженных эритроцитов колеблется от менее 1 до 100 %. Для ВНЭ характерно также повреждение ядер инфицированных эритроцитов — от маргинации хроматина до кариорексиса. При экспериментальном заражении у молоди кеты отмечали резкое снижение содержания зрелых эритроцитов (до полного исчезновения) и увеличение содержания бластных форм клеток, наблюдали моноцитоз, сильно выраженную лейко- и лимфопению. Вирусные включения присутствовали также в эритробластах, макрофагах, гранулоцитах и лимфоцитах. Снижалась или полностью утрачивалась свертываемость крови. 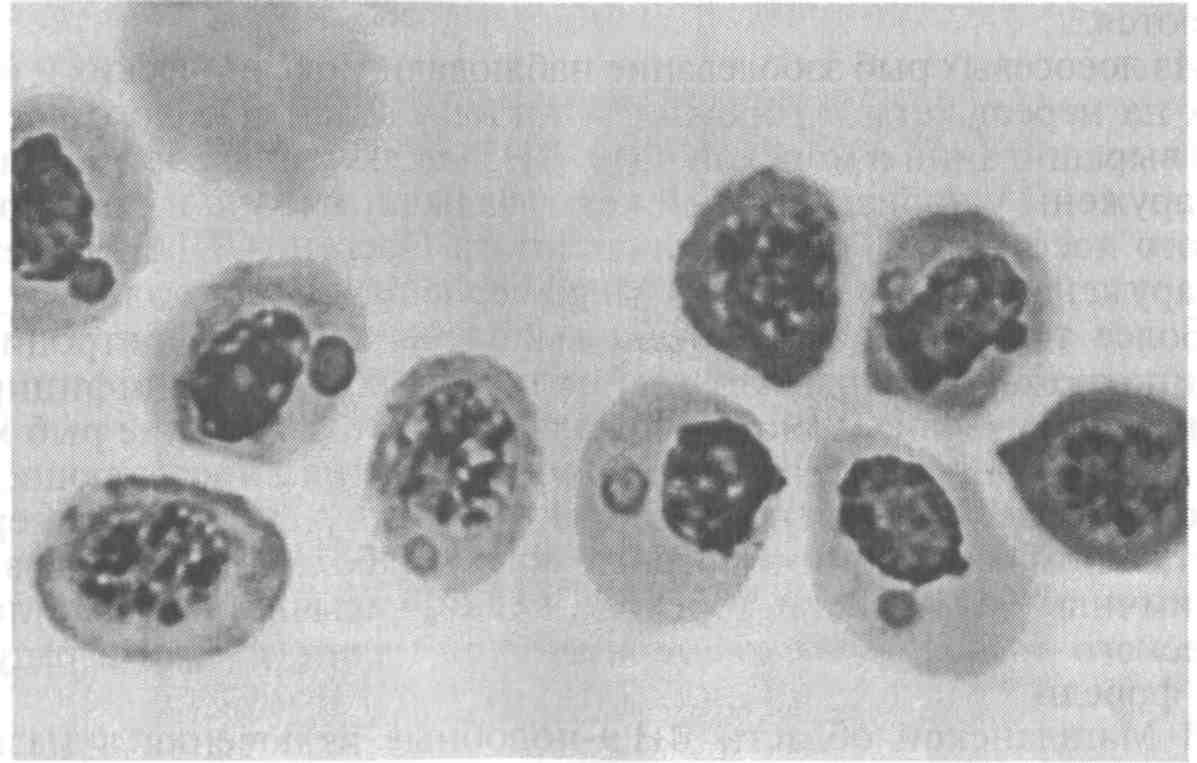 Рис. 16. Эритроциты кеты, пораженные ВЭН Сам ВНЭ не приводит к ощутимой гибели, однако больная рыба отстает в росте, у нее снижаются адаптационные способности и резистентность организма, в результате чего она обычно погибает от различных стрессовых воздействий (например, дефицита кислорода) или развития вторичных инфекций. Пораженные ВНЭ-включениями производители кеты и кижуча были более ослабленными, чем незараженные, и погибали при передержке от вторичных инфекций. Диагноз. Его ставят на основании клинических, гематологических, патологоанатомических, эпизоотологических данных и результатов электронномикроскопических исследований. Применение краски Гимза окрашивает включения, при ВНЭ — как ацидофильные (эозинофильные). Отдифференцировать два заболевания ВНЭ от возбудителя синдрома эритроцитарных телец включений (СЭТВ) можно и путем окраски мазков акридиновым оранжевым: ДНК-содержащие включения ВНЭ флуоресцируют зеленым светом, РНК-содержащие СЭТВ-включения — красным. Меры борьбы. Они не разработаны. Рекомендуется проводить комплекс рыбоводно-мелиоративных и ветеринарно-санитарных профилактических мероприятий. 5.11. СИНДРОМ ЭРИТРОЦИТАРНЫХ ТЕЛЕЦ-ВКЛЮЧЕНИЙ Синдром эритроцитарных телец-включений (СЭТВ, Erythrocytic inclusion body syndrome, EIBS) — это мягко протекающее заболевание лососевых рыб. Возбудитель. Возбудителем заболевания является оболочечный РНК-геномный вирус сферической формы, отнесенный с семейству тогавирусов. Липидосодержащая оболочка вируса плотно облегает его икосаэдрическии капсид, внутри которого заключен электронно-плотный нуклеотид диаметром 35—40 нм. Общий диаметр вирионов 70—80 нм. При электронномикроскопическом исследовании пораженных эритроцитов обнаруживаются отдельные вирионы, случайным образом разбросанные в цитоплазме клетки или собранные и заключенные в ограниченные мембраной везикулы в количестве до нескольких десятков. При неполном заполнении везикул в них наряду с вирионами можно различить лежащие параллельными слоями ламеллярные образования. Попытка выделить вирус из почки и селезенки больных годовиков кижуча на клетках линий CHSE-214, СНН-1, CSE-119, RTH-149, SSE-5, FHM, ЕРС и ВВ оказалась безуспешной. Эпизоотология. Обнаруженная впервые в 1982 г. у культивируемых годовиков чавычи в штате Вашингтон болезнь позднее была зарегистрирована в соседних штатах Тихоокеанского Северо-Запада США — Орегон и Айдахо, в канадской провинции Британская Колумбия, в Японии, Норвегии, Ирландии и в Чили. Инфекция, вероятно имеется в бассейнах Баренцева и Белого морей. В России СЭТВ-подобные включения выявлены в мазках крови молоди кеты (на рыбоводных заводах Магаданской области), чавычи и нерки (Камчатка). Заболевание наблюдается как у годовиков, так и у взрослых рыб как в пресной, так и в морской воде. В естественных условиях болеют чавыча, кижуч, атлантический лосось. При экспериментальном заражении путем инъекции заболели также радужная форель и лосось Кларка (О. clarki). Болезнь проявляется в холодное время года (осень—зима—весна) при температуре воды 6—12 °С. При более низкой температуре она протекает в хронической форме, когда включения встречаются редко. При температуре выше 15 °С заболевание прекращается. Инкубационный период после внутрибрюшинного введения фильтрата тканей больных рыб составляет при 6 °С 17 дней. Инфекция передается через воду, по-видимому, с экскрементами рыб и другими выделениями. Клинические признаки и патогенез. У больных рыб бледные жабры, другие внешние поражения отсутствуют, а если наблюдаются, то имеют иное происхождение. Печень бледная, с характерным желтоватым оттенком. При микроскопии мазков крови обнаруживаются округлые внутриэритроцитарные включения диаметром 0,8—3 мкм (рис. 17). Доля пораженных эритроцитов обычно невысока: до 1—5 %, реже 10—20 % и более. Встречаемость рыб с включениями (заболеваемость) колеблется в широких пределах и может достигать 100 %. Пик встречаемости инфицированных эритроцитов сменяется их лизисом и появлением теней, что сопровождается развитием анемии. Гематокрит падает до 1—15 %. В это время наблюдается гибель больных рыб от вторичных инфекций. Переболевшая рыба приобретает иммунитет, и инъекция ее сыворотки крови защищает здоровую рыбу от заболевания. Диагноз. Его ставят на основании клинических, гематологических, патолого-анатомических, эпизоотологических данных и результатов электронно-микроскопических исследований. При использовании красителя Гимза включения на мазках крови окрашиваются базофильно и имеют светло-голубой цвет. Более надежные результаты достигаются при применении хлорида пинацианола, окрашивающего включения в светло-фиолетовый цвет. 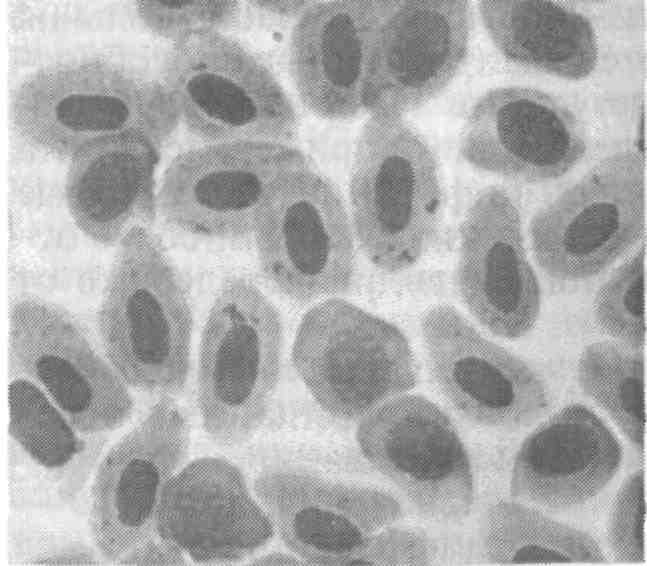 Рис. 17. Тельца-включения в эритроцитах атлантического лосося Меры борьбы. Они не разработаны. Рекомендуется выполнять комплекс рыбоводно-мелиоративных и ветеринарно-санитарных профилактических мероприятий. Добавление в рацион кижуча витамина С (1г/кг) снижало заболеваемость рыб. 5.12. БОЛЕЗНЬ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ АТЛАНТИЧЕСКОГО ЛОСОСЯ Болезнь поджелудочной железы атлантического лосося (БПЖ, Salmon pancreas disease, SPD) — острое, тяжело протекающее заболевание постсмолтов атлантического лосося. Возбудитель. Возбудитель заболевания — оболочечный РНК-геномный вирус сферической формы диаметром около 65 нм. Выделен из почки больных рыб на клетках линии CHSE-214 методом сокультивирования. Отнесен к семейству тогавирусов. Эпизоотология. Заболеванию подвержены постсмолты атлантического лосося вскоре после перевода молоди на выращивание в морскую воду. Оно отмечается в разные сезоны с пиком в летнее время при температуре воды 10—23 "С. Болезнь провоцируют стресс-факторы. Гибель рыб обычно незначительна и большинство их выздоравливает через 1—3 мес, однако многие заметно отстают в росте. В результате наложения вторичных заболеваний иногда может погибнуть до 50 % рыб. У переболевших рыб развивается устойчивый иммунитет. Заболевание было впервые обнаружено на фермах Шотландии в 1976 г. и с тех пор зарегистрировано также в Ирландии, Норвегии, Франции, Испании и на западном побережье США. В Шотландии и Норвегии болезнь распространена особенно широко и является одной из главных проблем при товарном выращивании лосося. Представляет реальную угрозу лососевым хозяйствам Кольского полуострова. Клинические признаки и патогенез. Первым признаком заболевания является внезапный массовый отказ от корма. Рыба скапливается у поверхности воды в углах садка, теряет способность сохранять нормальное положение тела. Из ануса больных рыб выделяются длинные псевдофекальные выделения с беловатым оттенком. Выздоровление может начаться уже через 2 нед, но часть рыб не выздоравливает даже спустя несколько месяцев, заметно истощаясь и отставая в росте. У них происходит почти полное разрушение поджелудочной железы. При гистологическом исследовании главные изменения отмечают в поджелудочной железе, где развивается быстрый генерализованный некроз ацинарных клеток, приводящий к полной утрате экзокриновой части железы и слущиванию дегенерирующих клеток в просвет пилоруса. В других органах изменения незначительны. Отмечают дегенеративные изменения в сердечной и скелетных мышцах. Диагноз. Его ставят на основании клинических, эпизоотологи-ческих, патологоанатомических данных и результатов вирусологических исследований. Отличие болезни поджелудочной железы от вирусного некроза поджелудочной железы (БПЖ от ИНПЖ) у атлантического лосося возможно на гистологическом уровне. Меры борьбы. Они не разработаны. Необходимо избегать стрес-сирования молоди при переводе на морскую воду. Следует выполнять весь комплекс оздоровительных мероприятий. 5.13. ИНФЕКЦИОННАЯ АНЕМИЯ АТЛАНТИЧЕСКОГО ЛОСОСЯ Инфекционная анемия атлантического лосося (ИААЛ, Infectious salmon anemia, ISA) — острое, тяжело протекающее заболевание постсмолтов лосося, сопровождающееся сильно выраженной анемией и высокой смертностью рыб. Возбудитель. Возбудитель заболевания — оболочечный РНК-геномный вирус диаметром 45—130 нм — предварительно отнесен к семейству ортомиксовирусов. Недавно вирус удалось выделить от больных рыб на новой постоянной линии клеток SHK-1, полученной из ткани головной почки атлантического лосося. Другие испытанные линии клеток лососевых ( AS, RTG-2 и CHSE-214) к вирусу нечувствительны. Эпизоотология. Впервые обнаруженная в одном из хозяйств юго-западной части Норвегии болезнь распространилась более чем на 100 рыбоводных фермах. Она считается одной из наиболее опасных для атлантического лосося и наносит значительный ущерб его товарному производству. Обычно заболевание у постсмолтов развивается спустя некоторое время после перевода их на морскую воду. Гибель составляет 50 %, но иногда достигает 100 %. Полагают, что проходная кумжа S. trutta L. и радужная форель формируют резервуар инфекции в море. При экспериментальном заражении эти рыбы не заболевали, но значительное время (кумжа более 7 мес) являлись виру-соносителями и передавали заболевание подсаженному на контакт атлантическому лососю. Переносчиками вируса являются копепо-ды Caligus elongatus и Lepeophtheirus salmonis, паразитирующие на поверхности тела лососей. В естественных условиях воротами инфекции являются жабры, далее вирус проникает во внутренние органы рыб, поражая, главным образом, клетки эндотелия кровеносных сосудов, клетки ге-мопоэтической ткани почек и лимфоциты. Он обнаруживается в крови, слизи и содержимом кишечника. Заболевание часто провоцируется стресс-факторами. Клинические признаки и патогенез. Заболевание характеризуется следующими признаками: потемнением кожных покровов и точечными кровоизлияниями на них, сильной анемией жабр и внутренних органов экзофтальмией, наличием асцита, увеличением и кровенаполненностью печени и селезенки, кровенаполненностью слизистой кишечника, петехиями на висцеральной жировой ткани. При гистологическом исследовании обнаруживают характерный для ИААЛ очаговый геморрагический некроз печени. В селезенке наблюдаются отложения гемосидерина. Отмечают лейко- и эритропению (гематокрит падает ниже 10), увеличение числа незрелых и дегенерирующих эритроцитов, снижение содержания сывороточного белка. Устойчивость к ИААЛ лосося из разных природных популяций сильно варьирует, однако существует мнение, что селекция на устойчивость не решит проблемы, а лишь замаскирует ее, поскольку едва ли позволит освободиться от вирусоносительства. Диагноз. Его ставят на основании клинических, патологоанато-мических и эпизоотологических данных и результатов вирусологических исследований. Меры борьбы. При обнаружении заболевания на хозяйство накладывают карантин и рыбу в нем уничтожают. На морских лососевых фермах Норвегии для борьбы с паразитирующими на лососе копеподами практикуется подсадка к нему местного губана (Labridae), поскольку последний использует их в пищу. Это, очевидно, можно рассматривать и как биологический способ профилактики заболевания. 5.14. ДЕРМАТОФИБРОСАРКОМА СУДАКА Опухолевое заболевание европейского (Stizostedion luciperca) и морского (S. marini) судаков. Оно распространено в пресных и морских водоемах стран СНГ. Клинически напоминает опухоли, встречающиеся у американского светлоперого судака (S. vitreum) и названные фибросаркомой. Этиология. Вирусологическими методами на первичных культурах из гонад судака изолированы цитопатогенные агенты, рост которых на перевиваемых клеточных линиях ЕРС и FHM менее активен. В биопробе на судаке получены положительные результаты. Специальными исследованиями доказано, что выделенные агенты являются потенциально опасными для теплокровных животных и человека. Они способны образовывать множественные новообразования в желудочно-кишечном тракте и печени у лабораторных животных. У больного светлоперого судака из опухолевых клеток выявлен ретровирус диаметром 135 нм, который назван вирусом дермальной саркомы стизостедиона (Walleye dermal sarcoma, WDS). Эпизоотология. Болезнь распространена в водоемах европейской части России (оз. Белое, Волго-Каспийский и Азовский бассейны) и Казахстана. Она поражает в основном судака, берша и маринку. В Каспии отмечено заболевание морского судака. Поражение фибросаркомой светлоперого судака встречается в США и Канаде.  Рис. 18. Судак, пораженный дерматофибросаркомой Опухоли образуются в основном у судаков трех-четырехлетнбго возраста. Усиление заболеваемости наблюдают к осени. Клиническая картина и патогенез. Новообразования располагаются на различных участках тела, жаберных крышках и хвостовом стебле и в редких случаях на голове, губах и грудных плавниках; они имеют овальную или овально-удлиненную форму (от 6,8x2 до 7x9 см), выступают над поверхностью кожи и имеют беловато-серую или светло-серую окраску (рис. 18). Поверхность их гладкая или сморщенная, консистенция плотная. На разрезах видна четкая граница между тканями опухоли и подлежащей мускулатурой. Со временем первичная опухоль распадается с образованием глубинных язв. Паренхима опухоли представлена в основном веретеновидными или овальными клетками и незначительным количеством тонких коллагеновых волокон. Опухолевые клетки обладают инфиль-трующим и деструктивным ростом. Выявлено метастазирование во внутренние органы. Наиболее часто метастазы формируются в пищеварительной системе и жабрах. Гибели судака при этой болезни не отмечено, но опухоли резко снижают товарное качество пораженной рыбы. Упитанность больных рыб ниже, чем здоровых. Диагноз. Его ставят на основании клинических признаков болезни. Меры борьбы. Специфичных мер борьбы не разработано. В водоемах, в которых судак поражен дерматофибросаркомой, вводят ограничения с запрещением вывоза из них судака любых возрастов, как и его икры, для акклиматизационных целей. В неблагополучных водоемах организуют усиленный вылов судаков старших возрастов — основных носителей болезни. В связи с потенциальной опасностью для человека и теплокровных животных на приемных пунктах сильно пораженного судака выбраковывают. При незначительных поражениях его очищают от новообразований и используют только в промышленную переработку (копчение, приготовление консервов). Отходы и выбракованную рыбу уничтожают, а сточные воды обеззараживают. 5.15. СТОМАТОПАПИЛЛОМА УГРЕЙ Болезнь также известна под названием «цветная капуста», так как на голове угря возникает крупная дольчатая опухоль, напоминающая кочан цветной капусты. Этиология. Вирусная природа стоматопапилломы изучена не полностью. При электронно-микроскопическом исследовании участков кожного эпителия от больных угрей обнаружены продолговатые тельца-включения, состоящие изпучка игольчатых образований, и много мелких частиц многогранной формы размером около 30нм в поперечнике. В клеточных культурах обнаружены более крупные многогранники — 55 нм в поперечнике. В проекции они имеют пяти- или шестиугольную форму, различимы капсид и нуклеоид. По-видимому, вирионы паразитируют в ядре клеток. Природа мелких частиц не установлена. У европейских угрей, пораженных стоматопапилломой, выделено девять изолятов вирусов, для чего использовали культуры клеток RTG-2 и ЕРС. В опытах по воспроизведению болезни путем введения внешне здоровым угрям крови от больных рыб лишь в одном случае получен положительный результат. Эпизоотология. Заболевание встречается у угрей, реже у лососевых, трески, уклейки, камбалообразных. Оно выявлено у карасей, лещей, усачей, золотой рыбки, обнаружено в Северном и Балтийском морях. Заболеваемость в Балтийском море колеблется от 0,1 до 2 %, в Северном море достигает 12 %. Больных угрей находят не только в морских и солоноватых водах, но и в пресных. Стомато-папиллома отмечена при выращивании угря в аквакультуре, где она поражает до 20 % рыб. Болезнь заносится в пресные воды с мигрирующими угрями. Возникновению болезни способствуют травматизация челюстей во время поиска пищи и укусы, которые наносят угри друг Другу в условиях больших плотностей посадок. Допускается также наличие какого-то переносчика. Болезнь поражает угрей всех возрастов. Клиническая картина и патогенез. Опухоли располагаются на голове, вокруг ротовой полости, у основания грудных плавников и Изредка на коже туловища и хвостового отдела (рис. 19). Самые Крупные (диаметром 10—35 см), полусферические, развиваются Преимущественно по кромке рта и у обонятельных ямок. Цвет от серовато-красного до темно-красного, мягкой консистенции. Микроскопически опухоль представляет собой разрастание кожи, формирующее бородавчатые наросты. Они могут быть единичными образованиями в виде пальцеобразных отростков (наиболее часто встречающаяся форма) или довольно крупными неоплазмами, состоящими из нескольких отростков. Атипическое разрастание эпидермиса с последующим врастанием в него соединительной ткани. 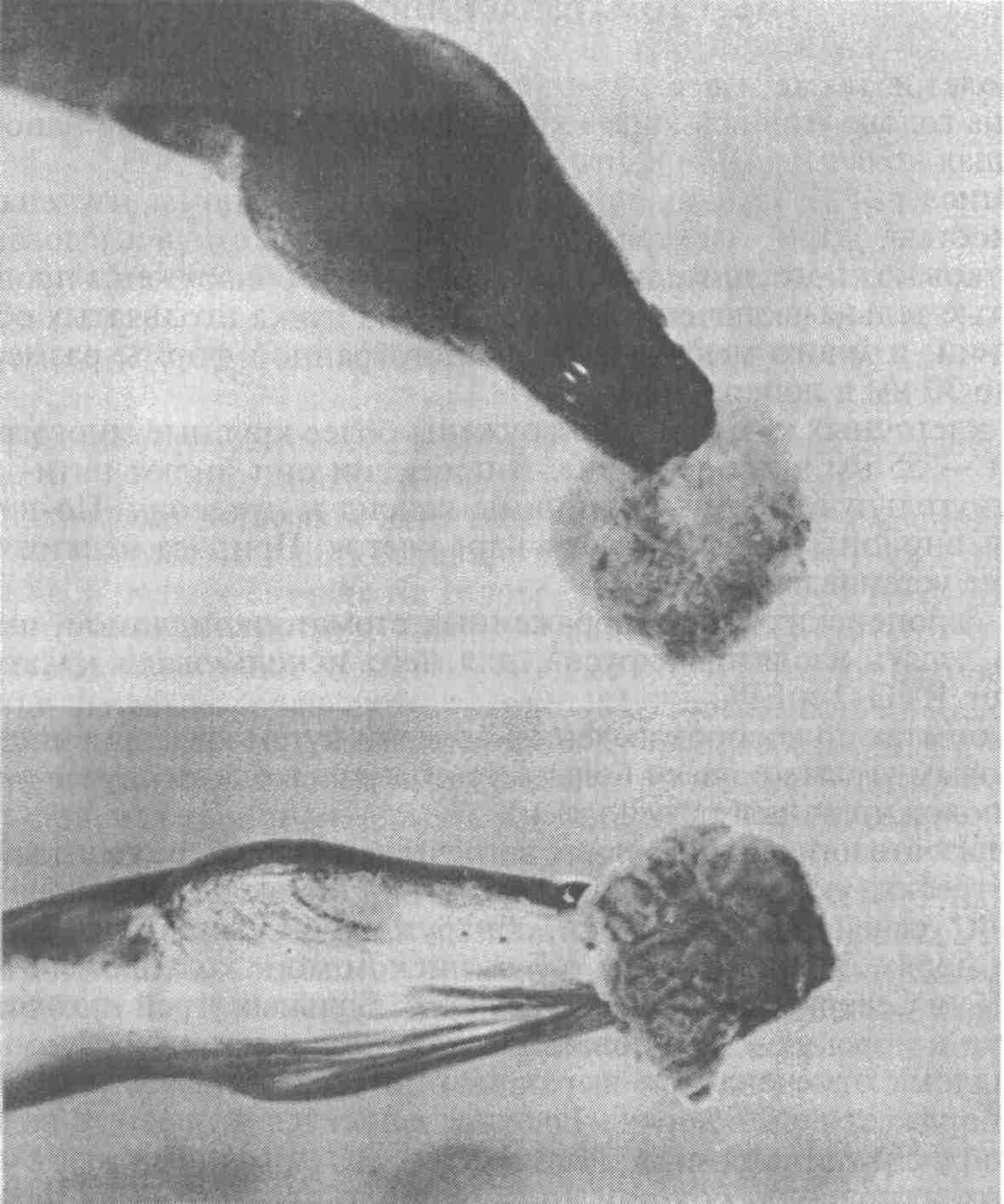 Рис. 19. Угорь, пораженный стоматопапилломой Разросшаяся на челюсти рыбы опухоль мешает захвату пищи; пораженные угри заметно отстают в росте, иногда вдвое против нормы. У сильно пораженных рыб резко уменьшается содержание жира: с 5 % (норма) до 0,9 %. Диагноз. Его ставят на основании клинических признаков заболевания. Вирусологические исследования не дают однозначных результатов. Меры борьбы. Специфических мер борьбы не разработано. В промысловых районах угри с опухолями или их головы должны уничтожаться и ни в коем случае не выбрасываться назад в воду. При прудовом выращивании угрей их необходимо периодически сортировать, отделяя медленно растущих и выбраковывая экземпляры с опухолями. 5.16. ЭПИДЕРМАЛЬНАЯ ПАПИЛЛОМА СОМА В дельте Волги констатируют различные новообразования у рыб. Среди них стала обращать на себя внимание кожная неоплазма сома (Siluras glanis), характеризующаяся появлением на поверхности тела небольших кожных наростов, вроде бородавок, отнесенных к типу эпидермальных папиллом. Этиология. Болезнь является инфекционной, что подтверждено ее воспроизведением в искусственных условиях при совместном содержании больных и здоровых сомов, а также при внутрибрюшин-ном введении здоровым рыбам нативного патологического материала. Подтверждением наличия вирусного агента явилось обнаружение цитопатогенного действия фильтратов патологического материала в трех и последующих пассажах клеточных культур. Эпизоотология. Болезнь в дельте Волги и в северной части Каспия поражает до 4 % сомов. Клиническая картина и патогенез. Папилломы располагаются преимущественно на брюшной поверхности тела и плавниках (рис. 20). На 1 -й стадии заболевания соединительная ткань в виде сосочков вдается в эпидермис, а иногда достигает самых поверхностных слоев эпителия. Морфологически 2-я стадия характеризуется появлением ангиоэпителиальных узелков. Растущие клетки, усиленно размножаясь, вытесняют нормальные эпителиальные клетки на поверхность, сам узелок сильно инфильтруется лимфоцитами. Ангиоэпителиальные узелки бедны стромой, иногда в центре узелка она представлена в незначительном количестве.  Рис. 20. Сом, пораженный папилломой Морфологические изменения 3-й стадии характеризуются уплотнением опухолевых клеток в узелки, которые превращаются в сосочки. На периферии сосочки плотно прилегают друг к другу, в них имеется много кровеносных сосудов и отмечается инфильтрация лимфоцитами. От здоровых участков кожи патологический процесс отграничен прослойками соединительной ткани, на которой располагается базальный слой нормального эпителия. При вскрытии отмечены слипчивое воспаление органов брюшной полости, гиперемия или анемия печени, увеличение селезенки. При гистологическом исследовании установлено, что структура почек, селезенки и печени не изменяется, но в почках и селезенке увеличивается число плазматических клеток. Диагноз. Его ставят на основании клинических данных и результатов вирусологических исследований. Меры борьбы. Рекомендуют усиленный вылов сомов, пораженных папилломой. Рыб с сильно выраженной папилломой запрещается выбрасывать назад в водоем. Вывоз сома из водоема, где обнаружена папиллома, в другие водоемы с целью акклиматизации или зарыбления воспрещается. 5.17. ПАПИЛЛОМАТОЗ АТЛАНТИЧЕСКОГО ЛОСОСЯ Папилломатоз (Atlantic salmon Papillomatosis ASP) — опухолевое заболевание атлантического лосося преимущественно на стадии смолтификации, для которого характерно появление множественных выпуклых эпидермальных новообразований (папиллом) на поверхности тела рыб. Возбудитель. Предположения о вирусной этиологии папилло-матоза существуют давно, однако выделить вирус на культуре клеток не удается. Электронно-микроскопические исследования давали либо отрицательные, либо разноречивые* результаты. С помощью электронной микроскопии в тканях папиллом был обнаружен герпесвирус (рис.21). Наблюдали разные стадии морфогенеза вируса в ядре и цитоплазме клеток и большие скопления вирионов в межклеточном пространстве. Вирус имеет кап-сид диаметром ПО нм, заключенный во внешнюю оболочку. Пространство между ними заполняет электронноплотный тегумент. Общий диаметр вирионов 200—250 нм. Попытки изолировать вирус из ткани папиллом на клетках линий ASE, RTG-2, CHSE-214 и СНН-1 не увенчались успехом. Этиологическая роль выявленного вируса не установлена. Эпизоотология. Болезнь всречается в Финляндии, Швеции, Норвегии, Великобритании, на северо-западе России, отмечена в Северной Америке. Заболевание у нас в стране появляется обычно в конце июля, достигая пика к сентябрю. В природных популяциях заболеваемость лосося невысока — около 1 %. При искусственном разведении описаны случаи с охва том до 90 % и гибелью 50 % рыб. Заболеванию подвержен атлантический лосось (семга). Описаны случаи папилломатоза у трехлетков радужной форели в садках в море. У других лососевых болезнь не обнаруживали. 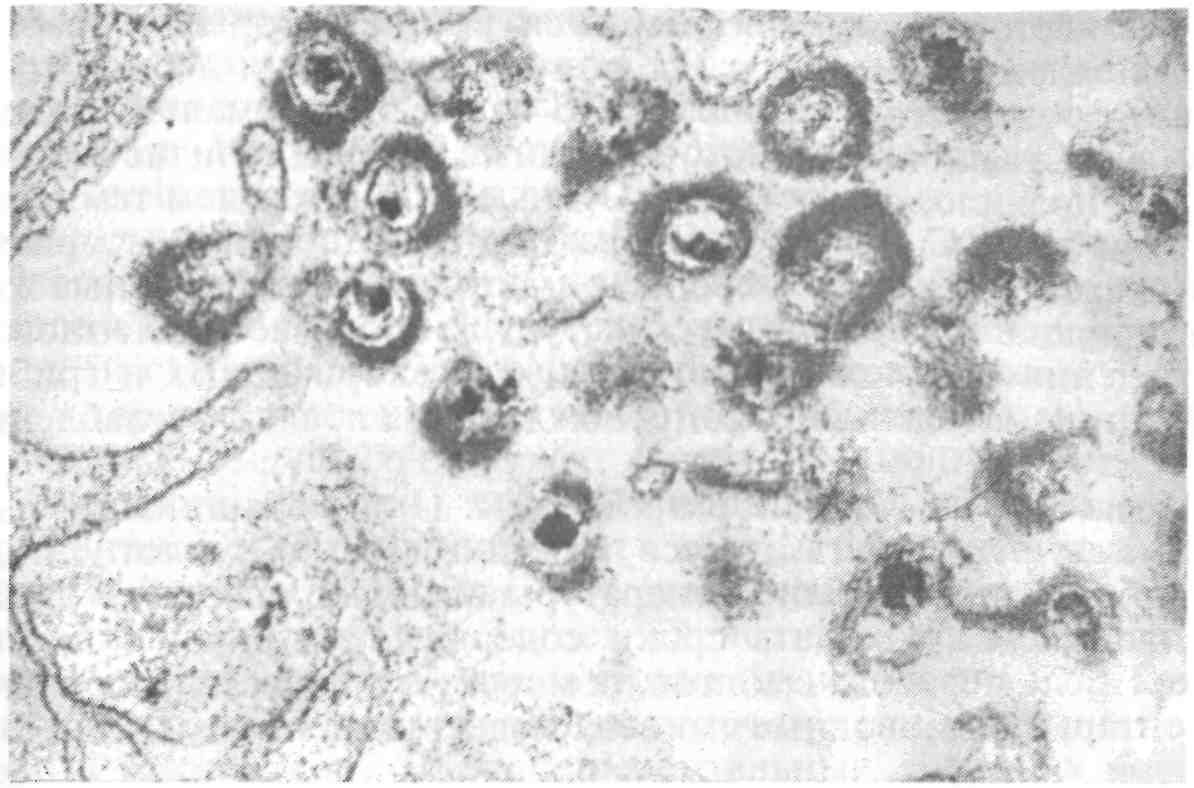 Рис. 21. Герпесвирус в тканях папиллом атлантического лосося Наиболее сильно лосось поражается в период смолтификации (сеголетки-трехлетки). Продолжительное удержание смолтов в пресной воде при подращивании на рыбозаводах ведет к росту заболеваемости. Часто жертвами папилломатоза оказываются карликовые самцы. По-видимому, гормональные перестройки в организме, сопутствующие процессам смолтификации и полового созревания, снижают резистентность рыбы, делая ее уязвимой к заболеванию. Взрослые особи болеют редко, но во время осеннего нерестового хода лосося встречали пораженных производителей. Учитывая способность герпесвирусов к длительной персистенции в организме хозяина и вертикальной передаче, можно предположить, что Источником инфекции являются больные половозрелые особи. Клинические признаки и патогенез. Папилломы представляют собой образования полусферической формы высотой 3—4 мм и диаметром обычно до 10 мм. Поверхность их неровная, с беловато-сероватым или голубовато-сероватым оттенком, иногда гиперемирована или испещрена петехиями. Они могут находиться на любых участках тела, но чаще локализуются на дорсальной части хвостового стебля, на хвостовом и других плавниках и у их оснований. Гистологически новообразования имеют вид типичных папиллом. Это многократно утолщенные (за счет разрастания эпителиальных клеток) участки эпидермиса, внутрь которых прорастают тяжи подлежащей рыхлой соединительной ткани дермы, содержащие кровеносные капилляры. В толще эпидермальных клеток папиллом различимы многочисленные митозы, слизистые клетки, как правило, отсутствуют. Осенью с понижением температуры воды до 6 °С и ниже наблюдаются разрушение и отторжение папиллом. На их месте нередко остаются кратероподобные язвы, обнажающие скелетную мускулатуру, и в случае медленного их заживления и наложения вторичных бактериальных и грибных инфекций заболевание сопровождается гибелью ослабленных рыб. Меры борьбы. Они не разработаны. При выращивании рыбы рекомендуют избегать стресса, связанного с переуплотненными посадками, перепадами температуры воды, нарушений в режиме кормления и сокращать сроки содержания молоди в пресной воде. После перевода смолтов на морскую воду весь рыбоводный инвентарь и рыбоводные емкости подвергают тщательной дезинфекции. 5.18. ЯЗВЕННЫЙ НЕКРОЗ КОЖИ ЛОСОСЕВЫХ Язвенный некроз кожи лососевых (ЯНКЛ, Ulcerative dermal necrosis, UDN) — это тяжело протекающее заболевание половозрелых лососей, развивающееся обычно во время осеннего нерестового хода и характеризующееся появлением на теле рыб специфических язв и высокой смертностью. Возбудитель. Этиология болезни остается невыясненной, но большинство исследователей считают ее вирусной. Болезнь контагиозна и передается через воду. Ее неоднократно воспроизводили путем инъекции рыбам безбактериального фильтрата (0,2 мкм) тканей пораженных участков кожи. При электронно-микроскопических исследованиях в цитоплазме клеток пораженных участков кожи было обнаружено большое количество электронно-плотных вирусоподобных частиц. Частицы имели сферическую или икосаэдрическую форму и диаметр 30—33 нм. Они образовывали скопления из нескольких десятков частиц, окруженных мембраной, или были свободно рассеяны в цитоплазме. В образцах ткани здоровых рыб частицы не встречались. Обнаруженный агент был отнесен к пикорнавирусам. Вместе с тем исследователи были достаточно осторожны в своих выводах относительно обнаружения вируса, признав, что подобную форму могут иметь также (3-частицы гликогена. Роль найденных частиц в заболевании осталась неизвестной. Интересно, что в последние пять лет у разных видов рыб, имевших признаки поражения центральной нервной системы, обнаружен целый ряд похожих агентов, которые после специальных исследований были отнесены к семейству но-давирусов. Эпизоотология. Впервые описанная в Великобритании в конце прошлого и начале нынешнего века болезнь с новой силой вспыхнула в Ирландии в 1964 г., а вскоре была зарегистрирована в Великобритании, Шотландии, Франции, Бельгии, Испании, Португалии, Швейцарии, ФРГ, Австрии, Болгарии, Швеции, Норвегии, Финляндии. Вероятно, имеется и в России. Заболеванию подвержены половозрелые особи проходного и жилого атлантического лосося, проходной и жилой кумжи и в меньшей степени радужной форели. Схожее заболевание встречали у хариуса и пеляди. В естественных водоемах оно наблюдается осенью у идущего на нерест лосося обычно при температуре 10 °С и ниже. Уже заходящий из моря лосось имеет типичные поражения. Болезнь продолжается далее и в пресной воде. В хозяйствах, имеющих собственное стадо производителей, заболевание длится несколько месяцев в холодное время года. По-видимому, преднерестовая гормональная перестройка в организме рыб и снижение температуры являются провоцирующими заболевание факторами. В экспериментальных условиях болезнь развивается и при 15 "С. При заражении контактным путем инкубационный период составлял 3 сут. С понижением температуры он удлинялся. Клинические признаки и патогенез. Больные рыбы отделяются от стаи и собираются в местах со спокойным течением. У некоторых особей наблюдаются симптомы повышенной возбудимости и нарушение координации движений (стремительное плавание у самой поверхности и выпрыгивание из воды, вращательные движения). Язвенные поражения развиваются на разных участках тела, но чаще на не покрытых чешуей местах — голове, жаберных крышках, жировом плавнике. Первый визуальный признак — появление тонких темного цвета колец или полуколец диаметром несколько миллиметров. Вскоре вслед за этим внутри колец начинается рост паразитических грибов в виде беловато-сероватых образований тоже кольцевой формы. Затем внутри колец появляются хорошо различимые в воде небольшие сероватые участки диаметром 1—3 мм, которые постепенно увеличиваются в размерах до нескольких сантиметров. Они шероховатые на ощупь, что является следствием прекращения функционирования здесь слизистых клеток и происходящего разрушения эпидермиса. На этой стадии небольшие язвы могут заживать. В тяжелых случаях повреждается базальная мембрана и язва проникает глубже, захватывая дерму и мускулатуру, что сопровождается появлением геморрагии и обильным ростом сапролегниевых грибов. Вслед за развитием обширных и множественных язв наступает гибель. Заболеваемость рыб достигает 20—40 % и более, в таких же пределах колеблется гибель. Описаны случаи гибели до 100 % заводских производителей. Меры борьбы. Они направлены на нераспространение инфекции и соблюдение профилактических ветеринарно-санитарных мероприятий. Обработка рыбы фунгицидными препаратами на стадии небольших язв дает положительный эффект. КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАНИЯ 1. Перечислить основные вирусные болезни карпа. 2. Назвать основные особо опасные инфекции лососевых. 3. Каковы вирусные болезни осетровых? 4. Перечислить основные папилломы, встречающиеся у рыб. 5. При каких вирусных заболеваниях на рыбоводные хозяйства накладывают карантин? |
