ихтиопаталогия. Дана характеристика рыб как переносчиков возбудителей болезней человека и животных. Для студентов вузов по специальности Водные биоресурсы и аквакультура
 Скачать 10.48 Mb. Скачать 10.48 Mb.
|
|
6.2.2. ЭДВАРДСИЕЛЛЕЗ Эдвардсиеллез наносит значительный ущерб при выращивании угря и канального сома. Этиология. Возбудителем являются представители сем. Entero-bacteriaceae — Edwardsiella tarda, E. ictaluri — мелкие прямые палочки размером 1x2—3 мкм (рис. 27). Подвижные за счет перит-рихиальных жгутиков клетки Е. ictaluri подвижны при 25 "С, при 37 °С — нет. Оптимальная температура для роста Е. tarda 37 °С, для Е. ictaluri предпочтительна более низкая. Е. tarda ферментирует глюкозу и некоторые другие углеводы с образованием кислоты и часто газа. Е. ictaluri практически инертна. Каталазоположительны и, как все энтеробактерии, оскидазоотрицательны, спор и капсул не образуют. Эпизоотология. К эдвардсиеллезу чувствительны угорь, канальный сом, золотая рыбка, большеротый окунь, американский со-Мик-кошка, ручьевая форель, некоторые виды аквариумных рыб. Е. tarda была также обнаружена у различных других животных, включая тюленей, морских львов, черепах, аллигаторов, змей. Упоминается в качестве патогена при некоторых заболеваниях человека, крупного рогатого скота и птиц. Заболевание провоцируется повышением температуры воды до 30 "С и выше и высоким содержанием органических веществ в Воде. Е. ictaluri вызывает кишечную септицемию у канальных со-Мов, сопровождающуюся гибелью до 50 % популяции, в связи с чем эдвардсиеллез канального сома Международное эпизоотическое бюро относит к опасным инфекциям рыб. Клинические признаки и патогенез. У пораженной рыбы отмечают опухоли, сопровождающиеся мелкими геморрагиями и перфорациями в области печени и почек, в селезенке и почках, выделены колонии бактерий в виде серовато-белых пятен. На голове, особенно на жаберных крышках, и на поверхности тела наблюдают кровоточащие язвы. В настоящее время различают две формы эдвардсиеллеза: нефротическую и гепатическую. При нефротической форме отмечают некротические поражения в гемопоэтической ткани почек, в дальнейшем развивающиеся в обширные язвы. В язвенных поражениях бактерии размножаются и вызывают расплавление окружающих тканей. Хорошо заметны метастатические поражения в различных органах. 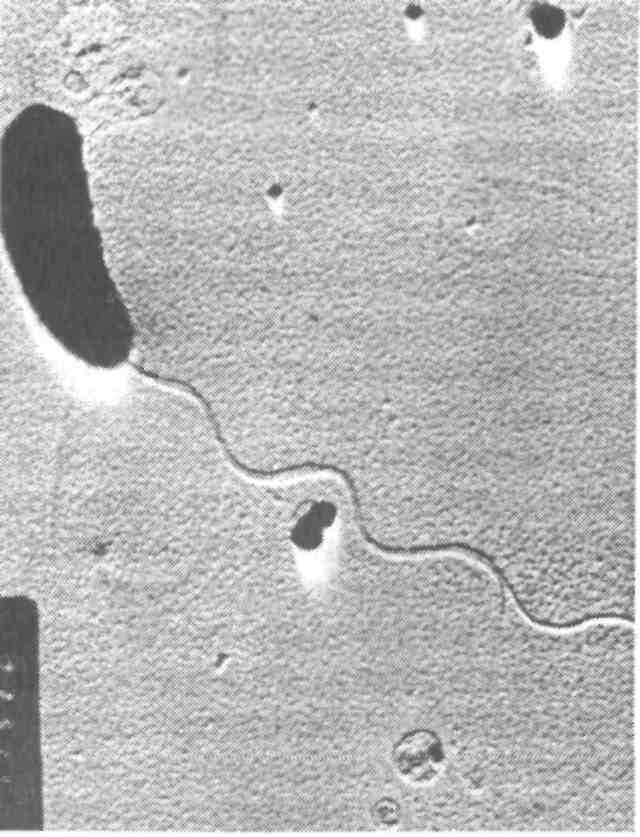 Рис. 27. Edwardsiella tarda — возбудитель эдвардсиеллеза При гепатической форме эдвардсиеллеза обширные поражения с расплавлением тканей в начальных стадиях появляются в печени. При прогрессировании болезни в печени формируются обширные язвенные абсцессы, гнойный перитонит и распространение воспаления на другие органы. Кроме культивируемых угрей эпизоотия эдвардсиеллеза была зарегистрирована среди популяции кефали в Японии. Пораженная рыба отличалась нарушением координации движения, держалась у поверхности воды. На теле наблюдались многочисленные обширные абсцессы с резким зловонным запахом, геморрагическими краями. У пораженной рыбы Е. tarda в большом количестве выделялась из почек. Е. ictaluri ассоциируется с двумя заболеваниями — септическим энтеритом канального сома (ESC) и «дырка в голове» (дырявая голова). Острая, или кишечная, форма, сопровождающаяся высокой летальностью, протекает или с незначительными клиническими признаками, или без таковых. Бактерии можно изолировать из почек. При хронической, или нейрогенной, форме, приводящей к заболеванию, известной как «дырявая голова», микроорганизм, находящиися в воде, попадает в обонятельную ямку и мигрирует к мозгу по каналу обонятельного нерва. Классические поражения головы являются результатом разрушения хрящей экстрацеллю-лярным энзимом хондриотиназой. Болезнь также может протекать в молниеносной форме, без проявления вышеуказанных признаков. Диагноз основывается на выделении и идентификации этиологического агента. Первичное вьщеление лучше делать из почек на триптиказасоевом агаре (TSA) или агаре «Д», инкубируемом при 20—25 °С в течение 2—4 сут. Через 48 ч инкубирования на агаре вырастают небольшие, круглые, прозрачные, слабовыпуклые оксид азоотрицательные колонии. Меры борьбы. Профилактика болезни основана на предупреждении прониковения ее в благополучные хозяйства, строгом соблюдении рыбоводно-санитарных требований. Особое внимание уделяют условиям содержания рыбы, качеству корма, заменяют пастообразный корм, содержащий фарш или селезенку крупного рогатого скота или рыбы, на качественный гранулированный комбикорм. Терапию проводят после определения чувствительности выделенных штаммов к антибактериальным лечебным препаратам. В зарубежной практике рекомендован террамицин (окситетра-циклин) с кормом в количестве 50 мг/кг массы рыбы в день, в течение 4—7 дней. Гибель рыбы в прудах резко снижается, однако полное выздоровление и заживление поражений является длительным процессом. 6.2.3. ПРОТЕОЗ До сравнительно недавнего времени заболевания рыб, вызываемые такими представителями сем. Enterobacteriaceae, как Proteus, уделялось мало внимания, хотя они проявляют себя все более активно, являясь причиной гибели рыб как в аквакультуре, так и в естественных водоемах. Этиология. Возбудителем протеоза являются грамотрицательные прямые палочки 0,4—0,8x1—3 мкм, подвижные за счет перит-рихиальных жгутиков. На плотных средах у большинства штаммов отмечается феномен роения, благодаря чему они растут в виде однородной пленки на поверхности среды или обширных колоний с образованием концентрических зон. В качестве возбудителя болезней рыб известны Proteus rettgeri, Pr. vulgaris и Pr. mirabilis. Возбудители протеоза хорошо растут на обычных средах. На МПА образуют роящиеся вуалевидные колонии серого цвета с резким гнилостным запахом. Эпизоотология. Заболеванию подвергаются многие виды рыб в рыбоводных хозяйствах различного типа (прудовых, садковых и с замкнутым водоснабжением). Источником инфекции являются больные и переболевшие рыбы, а также пастообразные корма с добавлением селезенки крупного рогатого скота. Возбудителя болезни обнаруживают в воде, иле, гниющих органических остатках (растительного или животного происхождения, испражнениях птиц). Заражение рыб происходит через пищеварительный тракт, поврежденную кожу и жабры. Заболевание чаще проявляется в весенний период при температуре воды от 8—10 °С до 15 °С. К осени эпизоотия затихает и болезнь принимает хроническое течение. Возбудитель переносится рыбой во время миграций и перевозок, а также водоплавающими и рыбоядными птицами. Инкубационный период длится от нескольких часов до 8 сут и зависит от температуры воды и резистентности рыбы. Развитию заболевания способствуют антисанитарное состояние водоема, травматические повреждения кожного покрова и жаберного аппарата рыб, неблагоприятные условия зимовки и высокие плотности посадки. Одним из основных факторов, определяющих патогенность протея, является его протеолитическая активность, под воздействием которой развиваются миопатическая дегенерация и септические процессы у рыб. Клинические признаки и патогенез. Протеоз у рыб протекает остро и хронически. Острое течение болезни сопровождается массовой гибелью рыб, чаще наблюдается весной при температуре воды от 10 до 15 °С, в другие сезоны года могут погибать единичные особи. Больная рыба малоподвижна, слабо реагирует на внешние раздражители. При развитии патологического процесса она опускается на дно и погибает. У карповых рыб болезнь проявляется в виде геморрагического воспаления отдельных участков тела или всего кожного покрова. У больных рыб отмечают кровоизлияния различной формы и величины на брюшной стороне тела, локальное ерошение чешуи. Плавники воспалены, часто принимают кроваво-красную окраску, крате -рообразно выпячен анус. У погибающей рыбы на пораженных участках тела начинается некроз, сопровождающийся размягчением тканей, глубинными изъязвлениями и миопатической дегенерацией. Жаберные лепестки могут также некротизироваться. При вскрытии брюшной полости ощущают резкий гнилостный запах. Отмечают отек паренхиматозных органов с петехиальными кровоизлияниями. Почки и селезенка увеличены, цвет значительно темнее обычного в связи с застоем крови. Печень пятнистая, гиперемирована, нередко бледно-желтая, сероватой и зеленоватой окраски с очагами некроза в ее отдельных долях. Желчный пузырь перенаполнен, на плавательном пузыре выражена инъекция кровеносных сосудов. При хроническом течении протеоза отмечают очаги геморрагического воспаления отдельных участков тела, чаще брюшной полости, с мелкими изъязвлениями. Характерны небольшие локальные очаги ерошения чешуи, а также рубцующиеся язвы. Патологоанатомические изменения выражены слабо: незначительные петехиальные кровоизлияния паренхиматозных органов, анемия печени в ее отдельных долях, небольшая отечность почек и селезенки. У сеголетков канального сома при протеозе наблюдают обширные очаги поверхностного дерматоза, геморрагии и глубокие, окруженные некротизированной кожно-мышечной тканью язвы. При патологоанатомическом вскрытии отмечают отек и кровенаполнение внутренних органов, тимпанию и отсутствие пищи в кишечнике. Диагноз. Его ставят на основании клинических признаков болезни, патологоанатомических изменений, эпизоотологических данных и результатов микробиологических исследований. Патматериал для бактериологического исследования берут из мест поражения и внутренних органов. Этиологическую роль выделенных штаммов оценивают в биопробе. Меры борьбы. Они не разработаны. Профилактика заболевания заключается в строгом выполнении рыбоводно-мелиоративных и ветеринарно-санитарных требований, особенно следует не допускать загрязнения водоема хозяйственно-бытовыми и коммунальными стоками и своевременно удалять погибшую и больную рыбу. Имеется некоторый положительный опыт применения лечебных препаратов: фуразолидона и карповита или биовита-120, ни-фулина. Назначение лечебного средства проводят после проверки чувствительности вьщеленного возбудителя к антибактериальным препаратам. 6.2.4. БАКТЕРИАЛЬНАЯ ГЕМОРРАГИЧЕСКАЯ СЕПТИЦЕМИЯ Бактериальная геморрагическая септицемия (БГС) — полиэтиологическое заболевание рыб. Этиология. Заболевание вызывается подвижными аэромонадами, псевдомонадами, энтеробактериями, флавобактериями. Эти группы грамотрицательных бактерий при определенных, неблагоприятных для хозяина условиях окружающей среды выделяются в ассоциациях и могут стать причиной серьезных септических инфекций. Особенно повышенной агрессивностью обладают комплексы подвижных аэромонад различных видов с энтеробактериями, флавобактериями; псевдомонад с энтеробактериями; различных представителей сем. Enterobacteriaceae в сочетании с протеем. Эпизоотология. БГС может поражать все виды рыб при условиях неблагоприятного воздействия на организм рыбы (высокое содержание органических веществ в воде, несоответствующая температура воды, плотные посадки, некачественные корма, хенд-линг, травматизация и др.). Клиника и патогенез. Природа патогенеза, вызываемая возбудителями БГС, сходна. Процесс начинается под влиянием эндотоксинов, являющихся комплексом протеинов, липидов, полисахаридов, присутствующих в стенке бактериальной клетки и освобождающихся при аутолизе после ее гибели. Эндотоксины обусловливают одни и те же основные симптомы болезни независимо от вида бактерий. Клинические проявления и патогенез больше зависят от вида, возраста и чувствительности рыбы и условий окружающей среды, чем от вида патогена. Поэтому проявления заболевания БГС сходны с заболеваниями, вызываемыми аэромонадами, псевдомонадами и другими грамнегативными бактериями. Диагноз. Он базируется на идентификации возбудителей, определении их чувствительности к антибактериальным препаратам и установлении их этиологической роли. Учитывая, что в ряде случаев симптомокомплекс заболевания обусловлен не одним, а группой возбудителей (ассоциацией), биопробу ставят со смешанной культурой доминирующих микроорганизмов. Меры борьбы. Профилактика заболевания включает строгое соблюдение рыбоводно-мелиоративных мероприятий, направленных на уменьшение негативного влияния абиотических и биотических факторов и стресса, снижающих неспецифическую резистентность рыбы. Хорошо себя зарекомендовали пробиотики в качестве лечебно-профилактических средств. Значительное затруднение при БГС вызывает подбор лечебных препаратов, которые следует выбирать с учетом чувствительности к ним основных представителей ассоциации, чтобы не спровоцировать новую вспышку заболевания. Подавление лечебными препаратами только одних видов микроорганизмов нарушает динамическое равновесие в микробиоценозе рыбы и улучшает условия для размножения других видов, способных вызвать рецидив заболевания. 6.3. БОЛЕЗНИ, ВЫЗЫВАЕМЫЕ МИКСОБАКТЕРИЯМИ Миксобактериозы — широко распространенные заболевания бактериальной этиологии пресноводных и некоторых видов морских рыб, отличающиеся большим разнообразием клинических проявлений и разной тяжестью течения болезни. В нашей стране они зарегистрированы практически во всех бассейновых и садковых хозяйствах, выращивающих лососевых и осетровых рыб (см. цв. вкл. табл. IX). Возбудители. Возбудителями миксобактериозов являются грам-отрицательные палочковидные скользящие бактерии группы 15, подгруппы 1, родов Cytophaga, Flexibacter и др. В настоящее время нет единого мнения о принадлежности миксобактерий к тому или иному роду. Разночтения имеются и в названии болезней, вызываемых ими. Это обусловлено неясным систематическим положением родов бывшего сем. Cytophagaceae. Согласно официальным документам, утвержденным Департаментом ветеринарии, миксобактерии вызывают три самостоятельных заболевания: флексибактериоз (колумнарис-болезнь, столбиковая болезнь, «серое седло»), возбудитель Flexibacter columnaris; бактериальная жаберная болезнь (БЖБ), возбудитель F. bran-chiophila; стебельковая, или холодноводная, болезнь, возбудитель Cytophaga psychrophila. Некоторые авторы выделяют еще солоно-ватоводную болезнь с возбудителем, отнесенным к роду Sporo-cytophaga, однако его значение в патологии рыб и таксономическое положение точно не определены. Эпизоотология. Эпизоотии, вызываемые миксобактериями, чаще наблюдаются летом при высоких температурах и дефиците воды. Появление и распространение болезни обусловлено загрязнением водоемов и влиянием антропогенных факторов, провоцирующих возникновение болезни, нарушением условий выращивания рыбы (травмы, стрессы, неполноценное кормление, пониженный водообмен, переуплотненные посадки, высокое содержание органических веществ и др.). Диагноз. Предварительный диагноз на миксобактериоз устанавливают на основании клинических признаков, эпизоотологичес-ких данных и микроскопического исследования нативных и окрашенных мазков с пораженных участков. Окончательный диагноз ставят после проведения бактериологического исследования и выделения возбудителя на цитофага-агаре или триптоно-дрож-жевом агаре, на которых они вырастают в виде колоний с желтым центром и белым ободком (Fl. columnaris), желтовато-зеленых (С. psychrophila), желтых с нечетким, расплывчатым краем (возбудители БЖБ). Меры борьбы. В отличие от клинических признаков и патогенеза, которые в некоторых случаях носят специфический характер, меры борьбы с миксобактериозами имеют много общего. Для профилактики миксобактериозов необходимо строго соблюдать технологию выращивания рыбы, регулярно проводить рыбоводно-мелиоративные и ветеринарно-санитарные мероприятия, не подвергать рыбу воздействию стресс-факторов. С целью лечения (и профилактики) применяют лекарственные средства в виде ванн: хлорамин Б (10 мг/л, экспозиция 1 ч), Фуразолидон (75 мг/м3, экспозиция 20 мин), окситетрациклин (10—50 мг/г, экспозиция 20 мин), марганцовокислый (перман-ганат) калий (кроме молоди осетровых, 2—4 г/м3 , экспозиция 20 мин), пероксид водорода (100 мг/л, экспозиция 10 мин). В корм рыбам вводят антибиотики: окситетрациклин, оксали-новую кислоту, левомицетин, после определения чувствительности к ним выделенных штаммов бактерий. 6.3.1. ФЛЕКСИБАКТЕРИОЗ Флексибактериоз (столбиковая болезнь, колумнарис-болезнь, «серое седло») вызывается миксобактерией Flexibacter columnaris. Это сапрофитная бактерия, обитающая как в почве, так и в воде, обычно поселяющаяся на разлагающемся органическом материале. Столбиковая болезнь (Columnaris disease) регистрируется чаще других и поражает многие виды культивируемых рыб. Возникновению болезни способствуют высокая температура воды (выше 15 °С), причем наибольший отход рыбы отмечается при 20 °С и выше. При температуре воды ниже 10 °С гибель рыбы прекращается. Бактерия F. columnaris легко различимая под микроскопом, нитевидная, длинная. Прикрепившись к поверхности жабр, она совершает волнообразные движения. К болезни могут привести любые манипуляции с рыбой. Травмированная кожа служит входными воротами инфекции. Флексибактериоз вызывают как высоко-, так и низковирулентные штаммы. Высоковирулентные штаммы обычно поражают жабры. Продолжительность инкубационного периода до 24 ч. Заболевание протекает быстро, часто бессимптомно, сопровождается массовой гибелью рыб (острая форма). Низковирулентные штаммы поражают кожу. Рыбы погибают в меньших количествах (хроническая форма). В зависимости от температуры воды инкубационный период длится от 48 ч до нескольких недель. Заболевшие рыбы плохо берут корм или полностью от него отказываются. У них отмечается усиленное слизеотделение на поверхности тела и жабр. Сначала наступает разрушение межлучевой ткани плавников, затем на поверхности головы и тела появляются мелкие, покрытые серым налетом некротические участки, обычно с покрасневшими краями. В результате повреждения эпидермиса возбудитель попадает в соединительную ткань, а затем проникает в мышцы, где разрушает ткань и капилляры. Поражения в виде очаговых гиперемий и мелких эрозий могут начинаться не только на теле рыбы, но и на ткани жабр. Нередко наблюдают обширные некрозы жабр, начинающиеся с дистальных концов жаберных лепестков, которые приводят к разрушению мягкой ткани жабр и хрящей жаберных лепестков. Возбудитель оказывает патогенное действие на ткани жабр, которые частично теряют экскреторную функцию и в результате гибель рыбы вызывается асфиксией. Патогенность миксобактерий объясняют выделением ими мощных протеолитических ферментов, которые вызывают некроз и лизис ткани. У лососевых и других холодноводных рыб болезнь иногда протекает без внешних симптомов, при этом бактерии обычно выделяются из почек. У сеголетков атлантического, балтийского лосося и форели отмечают «седловидную» болезнь, или «серое седло», возбудителем которой также является F. columnaris. Бактерии проникают в кожу через спинной плавник и распространяются по соединительной ткани. В верхних слоях кожи и отдельных чешуйках возникают струпы, в результате чего на боках тела ниже спинного плавника образуются симметричные полосы обесцвечивания. Бактерии проникают в мышечные волокна через сарколемму и разрушают их. Заболевание обычно возникает в июне—июле при температуре воды выше 18 "С. Массовые вспышки заболевания отмечены при 20—23 °С. Опасная для сеголетков и годовиков лососевых болезнь характеризуется появлением на поверхности тела серых пятен, которые в области спинного плавника сливаются и образуют как бы серый поясок. 6.3.2. БАКТЕРИАЛЬНАЯ ХОЛОДНОВОДНАЯ БОЛЕЗНЬ Бактериальная холодноводная болезнь (болезнь хвостового стебля) наблюдается преимущественно у лососевых при искусственном выращивании. Возбудитель — Cytophaga psychrophila, выделен из лососевых (кижуча, балтийского лосося, форели), сомовых и некоторых аквариумных рыб при температуре воды 4-10 "С. При холодноводной болезни у личинок, еще не ставших на плав, происходит коагуляция желтка, эрозия кожных покровов и желточного мешка. Гибель личинок может достигать 50 %. У мальков отмечают потемнение окраски тела, появление характерных поражений в виде белых пятен. У сеголетков отмечают эрозию спинного и хвостового плавников, гиперемию в области анального отверстия, некроз спинного плавника, хвостового стебля с оголением скелета, нижней челюсти. У годовиков выявляют разрушение кожи с оголением мышц на голове, челюстях, на разных участках тела, анемию и геморрагии жабр. Больные рыбы отказываются от корма. Отход мальков, сеголетков и годовиков достигает 10-20 %. У форели первым поражается жировой плавник, который постепенно к основанию обесцвечивается. Хвостовой стебель рыбы приобретает грязно-белый цвет. Иногда разрушение хвостового стебля развивается до такой степени, что обнажаются мышцы и позвоночник. У балтийского лосося поражения кожи могут начаться на спине. У кижуча часто поражаются голова, рот и почки. Повышение температуры воды до 15—16 °С ведет к прекращению заболевания. Возбудитель болезни Cytophaga psychrophila содержит желтый пигмент и протеолитические ферменты и выделяет эндотоксин. 6.3.3. БАКТЕРИАЛЬНАЯ ЖАБЕРНАЯ БОЛЕЗНЬ Заболевание встречается у лососевых, а также карповых при выращивании в тепловодных хозяйствах. Возбудитель — Flexi-bacter branchiophila, присутствует в воде, грунтах на ложе прудов. Заболевание с такой же клиникой вызывают несколько видов миксобактерий рода Cytophaga. Это удлиненные, тонкие грамот-рицательные палочки, которые совершают колебательные движения и на пластинчатых средах формируют желтые колонии с расплывающимися краями. Плодовых тел и микроцист не образуют. Бактериальная жаберная болезнь регистрируется как при низкой, так и при высокой температуре воды. Инкубационный период от 3—6 дней до нескольких недель. Заболевание протекает остро и хронически. Особенно страдает молодь карпа и осетровых при выращивании в индустриальных тепловодных хозяйствах. При острой форме за короткое время происходит массовое накопление возбудителя, нарушающее дыхание. Инкубационный период различен: от 24 ч до нескольких недель и зависит от вирулентности возбудителя и восприимчивости рыб. При острой форме признаки болезни не успевают развиться, наблюдается массовый отход без видимой патологии. При возникновении хронической формы болезни рыбы держатся у поверхности воды, становятся вялыми, находятся в вертикальном положении, слабо реагируют на внешние раздражители. У них наблюдают ослизнение и потемнение покровов, частичный или полный отказ от корма. Отмечают увеличение числа дыхательных движений, появляются характерные «кашлевые» движения. Жаберные крышки открыты, из под них видны бледно-розовые или сильно гиперемированные жаберные лепестки. При прогрессировании заболевания происходит слипание жаберных лепестков, развивается некроз. На некротизированных участках появляются возбудители сапролегниоза. 6.3.4. СОЛОНОВАТОВОДНЫЙ МИКСОБАКТЕРИОЗ Заболевание наблюдают у молоди лососевых при выращивании в морской воде. Во всех случаях выделяются морские миксобактерий, относящиеся к роду Sporocytophaga, однако их значение в патологии рыб и таксономическое положение точно не определены. При солоноватоводном миксобактериозе у больных чавычи и горбуши отмечают некротические участки на поверхности тела, сходные с поражениями при столбчатой болезни. У годовиков радужной форели формируется некроз верхней челюсти и полости рта, рыба не питается. Гибель достигает 10 %. У кижуча наблюдали симптомы, сходные с холодноводной болезнью, и одновременно — искривления позвоночника (сколиоз и лордоз). 6.4. БОЛЕЗНИ, ВЫЗЫВАЕМЫЕ ГРАМПОЛОЖИТЕЛЬНЫМИ БАКТЕРИЯМИ Из заболеваний, вызываемых грамположительными бактериями, наиболее распространены бактериальная почечная болезнь, стрептококкоз лососевых и микобактериозы. 6.4.1. БАКТЕРИАЛЬНАЯ ПОЧЕЧНАЯ БОЛЕЗНЬ Бактериальная почечная болезнь (БПБ) относится к наиболее серьезным инфекциям и является одной из самых распространенных в мире болезней культивируемых лососевых. Первое сообщение об этой болезни появилось в 1933 г. Типичные поражения наблюдали в селезенке и других внутренних органах атлантического лосося из рек Дия и Спей в Шотландии. Два года спустя сходное заболевание было обнаружено у ручьевой форели в Массачусетском хозяйстве (США). Этиология. Возбудителем БПБ является Renibacterium salmo-ninarum. Она представляет собой грамположительную неспоровую неподвижную палочку, которая медленно растет на обогащенных питательных средах (рис. 28). При температуре 16 °С через 28 дней на плотных средах вырастают мелкие, круглые, выпуклые, матово-белые колонии с ровными краями диаметром около 1 мм. При последующих пересевах такие колонии начинают формироваться в течение недели. Эпизоотология. Бактериальная почечная болезнь отмечается у рыб как в пресной, так и в морской воде. Она установлена у атлантического лосося, американской палии, кумжи, радужной форели, чавычи, кижуча и нерки. Возбудитель БПБ выделен от озерного гольца-кристивомера (Salvelinus namaycush), горбуши, симы и лосося Кларка. На рыбозаводах заболеваемость может составлять 10—25 % независимо от вида и возраста рыбы. 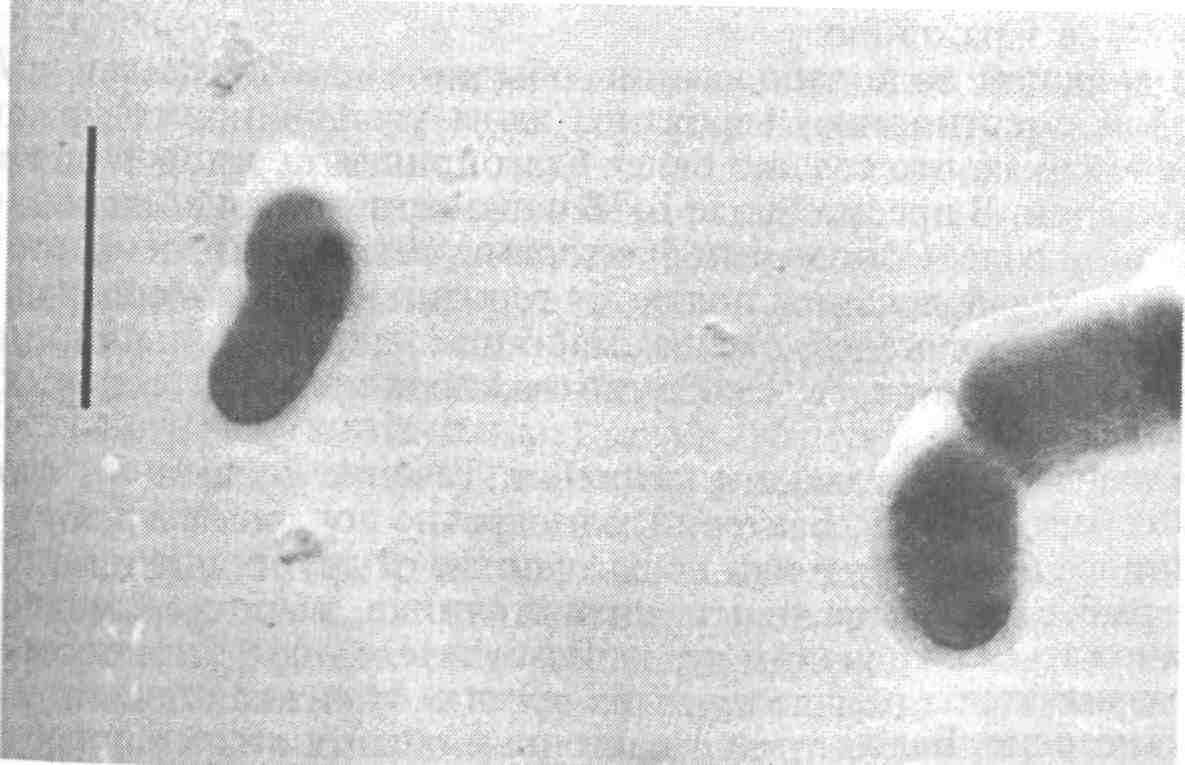 Рис. 28. Renibacterium salmoninarum — возбудитель бактериальной почечной болезни Возбудитель передается как горизонтально через пищеварительный тракт, так и вертикально, локализуясь на наружной и внутренней сторонах оболочек икринок и внутри икры, где они локализуются в желтке латентно инфицированной самки. Наибольшее число случаев почечной болезни возникает в марте—мае. Вероятно, первичное - инфицирование происходит за несколько месяцев ранее и вспыхивает, когда температура воды поднимается. У форели и лосося увеличение потерь среди молоди наступает с весенним повышением температур. Инкубационный период варьирует в зависимости от температуры воды. При температуре выше 15 "С первые потери начинают появляться через 30—35 дней после заражения. При температуре 11—13 "С инкубационный период удлиняется от 60 до 90 дней. Возбудитель БПБ никогда не инфицирует рыб других видов, кроме лососевых. При этом лососи более чувствительны, чем форель. Болезнь чаще всего проявляется у весенней чавычи, кижуча и нерки с тех пор, как эти виды стали выращивать на рыбозаводах до годовалого возраста. Наиболее восприимчивы к заболеванию ручьевая форель и кумжа, наименее — радужная форель. Заболевание редко поражает рыбу моложе шестимесячного возраста. Взрослые рыбы—носители возбудителя — являются основным источником инфекции. Скармливание молоди фарша из инфицированных и погибших рыб без термической обработки приводит к ее заражению. В морской воде заболевание обычно сопровождается повышенной смертностью, вероятно, из-за увеличения содержания соли в почках, что создает более благоприятные условия для роста бактерий. В пресной воде БПБ чаще встречается в мягкой, чем в жесткой воде. Основными факторами, имеющими значение для патогенеза заболевания, являются генотип и уровень содержания в крови ионов железа, меди, марганца, цинка, кальция, иода, фтора и витамина А. Особенно важным является содержание иода и фтора. Клинические признаки и патогенез. Течение болезни — хроническая бактериемия. Бактерии, однократно попавшие в рыбу с инфицированной пищей или подхваченные от других инфицированных рыб в хозяйстве или в водоисточнике, начинают медленно размножаться в кровяном русле. Возбудитель инфекции постепенно развивается в почках и других органах, таких как печень, селезенка, сердце. Белый гной и клеточные обломки накапливаются в волдырях и язвах, которые развиваются в этих органах до тех пор, пока поражения становятся легко заметными. Очаги поражения, развивающиеся в заднем отделе почки, обычно легче обнаружить, они могут достигать сантиметра и более в диаметре и проникать в мускулатуру, приводя к образованию пузырей под кожей. Когда заболевание переходит в стадию выраженных клинических признаков, терапевтическая обработка уже малоэффективна. Больные рыбы вялые, с пучеглазием, кровоизлияниями у оснований плавников, вздутиями и подкожными рубцами на боковой поверхности тела. При разрезе вздутий обнаруживают гнойное содержимое. При вскрытии рыб наблюдают водянку, бледный цвет печени, воспаление брюшины, наличие беловатых узелков в почках. Крупные узелки сливаются, при этом почки заметно набухают, особенно в заднем отделе, а иногда почка сморщена или «жгутоподобна». Отмечают также резкое снижение гематокрита и количества белков сыворотки крови. Эти симптомы не всегда развиваются у каждой больной рыбы. Часто единственным признаком заболевания являются серовато-белые узелки в почках. Диагноз. Для диагностики БПБ предложено несколько методов. Наиболее простой метод включает в себя выявление коротких грамположительных палочек в мазках-отпечатках и гистологических препаратах пораженных органов рыб. В заглазничной ткани бактерии могут быть обнаружены задолго до генерализации инфекции. Недостаток этого метода заключается в том, что при бессимптомном течении инфекции или носительстве бактерии не выявляются, так как в тканях они находятся в незначительном количестве. В препаратах, приготовленных из органов погибающей или мертвой рыбы, обнаруживают огромное количество бактерий, расположенных попарно и соединенных в мелкие V-образные конфигурации. При диагностике бактериальной почечной болезни следует быть особенно внимательным. В мазках из печени, почек и селезенки рыб часто в большом количестве присутствуют окрашенные гранулы меланина, причем таких же размеров, как и возбудители почечной болезни. Разделение их в мазках, окрашенных по Граму, требует определенных навыков. В мазках, окрашенных метиленовым синим, бактерии почечной болезни окрашиваются в голубой цвет, тогда как гранулы меланина остаются темно-коричневыми. В неокрашенных (контрольных) мазках гранулы пигмента имеют тот же темно-коричневый цвет, тогда как бактерии остаются почти невидимыми. Бактериологический метод с последующей идентификацией наиболее достоверен, однако возбудитель очень требователен к условиям культивирования и медленно растет. За рубежом для диагностики БПБ используют быстрые и точные серологические методы: реакцию агглютинации, прямой и Непрямой методы флюоресцирующих антител. Серологические Реакции более чувствительны. Меры борьбы. Международным эпизоотическим бюро заболевание отнесено к группе опасных инфекций. В нашей стране инструктивная документация по организации мер борьбы не разработана. Эффективность предупреждения бактериальной почечной болезни зависит от знания источника и способа инфицирования. Так как не исключена передача возбудителя с икрой, она должна быть получена от здоровых производителей. Запрещают кормление лососей сырым фаршем. Водоисточник и водоснабжающую систему освобождают от сорной рыбы. Перевозка инфицированной или подвергавшейся контакту с инфекцией рыбы или икры из хозяйства в хозяйство запрещена. Проводят индивидуальное тестирование маточного стада, выбраковывая инфицированных производителей. За рубежом из лечебных препаратов зарекомендовали себя сульфамеразин (доза 200 мг/кг массы рыбы, добавляют в корм в течение 10—15 дней) и сульфаметазин — его используют по такой же схеме, причем он может быть более эффективным, чем сульфамеразин. Однако более результативен эритромицин тиоционат (доза 0,1 г/кг массы рыбы, добавляют в корм в течение 21 дня). 6.4.2. МИКОБАКТЕРИОЗ Микобактериоз — системное инфекционное заболевание многих пресноводных, морских и аквариумных рыб. Раньше большинство микобактериальных инфекций относили к туберкулезу рыб. Впервые микобактериоз у рыб был описан в 1897 г. во Франции. В прудах заболели карпы, контаминированные слюной и выделениями людей, больных туберкулезом. У карпов развивались небольшие серые очаги поражения между брюшной стенкой и гонадами, которые при гистологическом исследовании оказались бугорками, содержащими кислотоустойчивые бактерии, патогенные для лягушек и ящериц, не патогенные для голубей и морских свинок. В 1913 г. спонтанная микобактериальная инфекция была описана у трески. С тех пор микобактериоз неоднократно наблюдался у многих видов морских, анадромных, аквариумных и пресноводных рыб. Этиология. Микобактерии рыб — грамположительные, кислотоустойчивые, неподвижные палочки обычно длиной 1—4 мкм, шириной 0,3—0,7 мкм. От рыб выделено 6 видов: Micobacterium piscium, M. marinum, M. platypoecilus, M. anabanti, M. fortuitum Cruz, M. balnei. Систематика этой группы бактерий постоянно уточняется. В 9-м издании Берджи оставлены М. marinum и М. fortuitum; остальные рассматриваются как синонимы. Эпизоотология. Микобактериоз поражает более 150 видов рыб из 34 семейств. Большинство восприимчивых видов встречается в семействах Cyprinidae, Characinidae, Poccilidae, Cichlidae, Salmonidae. Заболевание широко распространено в декоративном рыбоводстве. Особенно страдают рыбы в крупных морских аквариумах. Естественный путь инфицирования происходит при заглатывании возбудителя с водой, а в случае разведения лососей при кормлении свежем фаршем из контаминированной рыбы. У живородящих рыб возможна передача возбудителя трансовариальным путем. Распространена болезнь повсеместно. Изучение микобактериоза представляет интерес и с эпидемиологической точки зрения, так как доказано, что М. marinum может вызывать инфекцию у теплокровных животных и человека. На коже людей на месте внедрения возбудителя появляются локальные эритемодерматозные папулы. Входными воротами служат различные ссадины, царапины. Спорадические случаи заболевания называют «гранулемой рыбоводных танков», источником которых являются контаминированные аквариумы и рыбы, содержащиеся в них. Особую опасность заболевание представляет для рыбоводов, владельцев декоративных аквариумов и потребителей тропических рыб. Клиническая картина и патогенез. Симптомы, вызываемые ми-кобактериальной инфекцией, зависят от вида пораженной рыбы. У аквариумных рыб отмечают отказ от корма, истощение, грану-лематозные поражения на голове, поверхности тела и жабрах, по-бледнение окраски, дефекты и потерю чешуи, разрушение плавников, экзофтальмию, деформацию челюстей и позвоночника. Рыба может становиться вялой, забивается в угол аквариума или плавает, двигаясь резкими толчками. У чувствительных анадромных рыб клинические признаки обычно отсутствуют, но у отдельных особей могут быть один или несколько симптомов: задержка роста, более светлое по сравнению с нормальным окрашивание, непроявление вторичных половых признаков. Патологоанатомическая картина у всех пораженных видов рыб Достаточно сходная. Отдельные серо-белые миллиардные (просо-видные) образования — гранулемы могут присутствовать в печени, почках, редко в селезенке, при этом последняя может увеличиться в размерах в 2—3 раза. У инфицированной рыбы кислотоустойчивые бактерии могут быть обнаружены в мазках-отпечатках из жабр, сердца, мышц, пилорических отростков, кожных поражений, глаз, мозга, гонад и мезентериальных узлов. У лососей печеночная ткань может быть почти полностью замещена кислотоустойчивыми бактериями, в результате чего развиваются асцит и Желтуха органов брюшной полости. Наиболее общим проявлением болезни у лососей и аквариумных рыбок является слипание внутренностей. На гистологических срезах пораженная ткань имеет расплавления, сходные с теми, что видны в гранулемах ихтиофонуса. Гистологические исследования узелков показали, что они являются гранулемами с кислотоустойчивыми бактериями, окруженными моноцитами. Наблюдают два типа гранулематозных узелков. Первый — медленно развивающиеся поражения, состоящие из эпителиальных пленок, со стенкой из фибробластов; второй — быстро развивающиеся поражения, содержащие многочисленные гистиоциты, заполненные кислотоустойчивыми бактериями. Диагноз. Его ставят на основании клинических признаков, данных патологоанатомического вскрытия рыб и результатов бактериологического обследования. В мазках из почек, селезенки и других пораженных органов при окраске по Цилю—Нильсену обнаруживают кислотоустойчивые бактерии. Меры борьбы. Они направлены на профилактику микобактери-озов и в основном на предупреждение проникновения заболевания в благополучные хозяйства и аквариальные. На лососевых рыбозаводах соблюдают биотехнику выращивания рыбы. Не допускают кормление ее сырым фаршем из больной или инфицированной микобактериями рыбы. За рубежом в качестве лечебного средства используют канамицин. Препарат задают рыбе с кормом 3—4 раза в день в количестве 10—20 мг/кг массы рыбы в течение 7 дней. Для декоративного рыбоводства наиболее важно поддержание строгой санитарии в неблагополучных аквариумах. Нельзя допускать переуплотненных посадок: на каждую рыбу рекомендуется не менее 5 л воды. Каждая новая рыба должна быть обследована визуально в отношении признаков болезни и подвергнута карантину в течение 2—4 нед, прежде чем будет помещена в общий аквариум с другими рыбами. 6.4.3. СТРЕПТОКОККОЗ Стрептококкоз — это заболевание пресноводных и морских рыб. Этиология. Возбудителем заболевания является Streptococcus sp., таксономическое положение которого пока точно не определено. В ряде случаев этиологический агент был идентифицирован как S. milleri, S. difficile, S. shioli. Стрептококкоз на Европейском Севере России вызывают специфические штаммы Streptococcus sp., близкие по биохимическим свойствам к S. faecalis и S. faecium, но не идентичные им. Это грамположительные кокки, неподвижные, некислотоустойчивые, диаметром 0,62—0,65 мкм в диаметре (рис. 29), в мазке располагающиеся попарно или в виде коротких цепочек. На пластинчатых средах, содержащих соли желчных кислот, растет в виде небольших беловатых колоний. У возбудителя стрептококкоза установлено наличие как экзо- так и эндотоксинов, под воздействием которых развивается патологический процесс в почечной ткани рыб. Эпизоотология. Стрептококкоз поражает заводскую молодь атлантического лосося и радужную форель в морских и пресноводных хозяйствах. На рыбозаводах смертность сеголетков лососевых рыб от заболевания достигает 30 %. С возрастом она уменьшается до 1 %, но почти всегда наблюдается снижение темпа роста инфицированных рыб. На морских фермах у форели отмечается снижение не менее 20 % товарной массы. Стрептококковая инфекция выявлена также у молоди и производителей атлантического лосося в реках, а также у окуня, гольяна и девятииглой колюшки в озерах Кольского полуострова. Отмечены случаи заболевания трески в прибрежных районах Баренцева моря. Заболевание описано у многих видов рыб в Японии, США, ЮАР, Австралии, Испании. Гибель рыб в естественных популяциях от заболевания наблюдали в устьях рек побережья Флориды в стадах менхедена, лобана, горбыля и морских сомов. У культивируемых рыб, особенно при использовании интенсивной биотехники выращивания, заболевание протекает более тяжело. Вспышки стрептококкоза у желтохвоста связывают с кормлением морской рыбой. При исследовании свежей и мороженой рыбы, которую использовали в качестве корма, стрептококки выделяли от сардины, анчоуса, песчанки и других кормовых рыб. Даже в мороженой рыбе стрептококки оставались жизнеспособными в течение 6 мес. Случаи стрептококкоза зарегистрированы также у аю, лосося-амаго (Oncorhynchus rhodurus), камбалы (Paralichthys olivaceus), тиляпии, радужной форели. В Италии стрептококкоз является серьезной проблемой для форелевых ферм. В Японии эта болезнь регистрируется почти во всех районах страны и наносит значительный ущерб при промышленном выращивании желтохвоста. 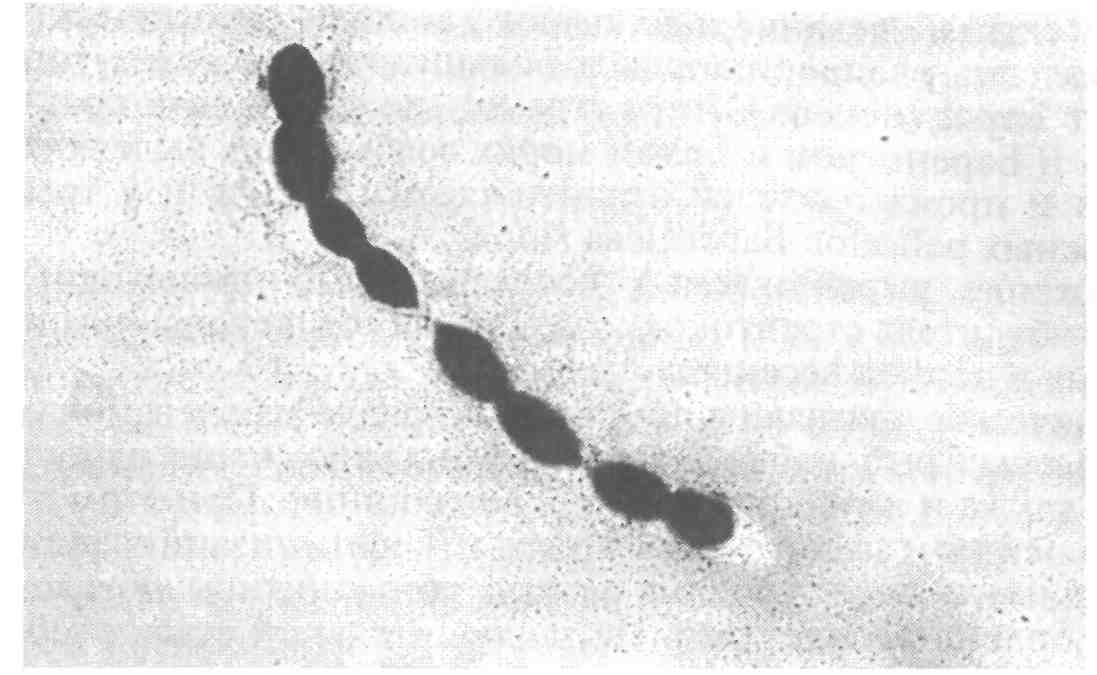 Рис. 29. Streptococcus sp, — возбудитель стрептококкоза В России заболевание наблюдают у молоди атлантического лосося. Болезнь распространена в большинстве морских товарных хозяйств Европейского Севера страны, где выращивают радужную форель. В Баренцевом и Белом морях возбудитель выделяли у по-катника и производителей атлантического лосося и у трески из прибрежных районов Баренцева моря. Заражение выращиваемых лососевых рыб происходит через воду. Возбудитель стрептококкоза выделяется из воды, ила и ракообразных в период весеннего паводка. Клинические признаки и патогенез. В начале заболевания у молоди лососевых рыб наблюдают экзофтальмию, чаще одностороннюю, а также и внутриглазные кровоизлияния. При этом отмечают гиперемию глазного дна, ириса и кератинизацию роговицы. Экзофтальм и последующий разрыв конъюнктивы обусловливаются скоплением экссудата. На заключительной стадии заболевания может происходить выпадение глаз. Заболевание сопровождается анемичностью жабр, гиперемией и гнойными узелками в ротовой полости и на внутренних сторонах жаберных крышек, воспалением ануса. Пораженная рыба пуглива. При вскрытии обнаруживают гиперемию печени и кишечника, бледность сердечной мышцы, светлые предпочки и отек заднего отдела почки, светлую окраску и зернистость селезенки. Селезенка может быть атрофированной или, наоборот, увеличенной. Встречаются рыбы с поражением и гиперемией головного мозга и внутричерепным экссудатом, рыхлостью мозговой ткани. Гистологическими методами установлено расширение кровеносных сосудов, кровоизлияния на поверхности мозга, разрыхление твердой и мягкой мозговой оболочек, некроз клеток внутреннего слоя зрительных долей среднего мозга, воспаление зрительного нерва. При хронической форме заболевания после выпадения глаза рыба может выжить, глазная впадина при этом зарастает пигментированной тканью. Для каждого вида рыб есть свойственные только ему клинические признаки стрептококкоза, но наиболее общими и типичными являются патология глаз, мозга и почечной ткани. Поражения глаз, зрительного нерва, головного мозга свидетельствуют о высокой специфичности возбудителя заболевания, так как такие патологии нетипичны для прочих бактериальных инфекций рыб. Диагноз. Его ставят на основании клинических признаков болезни, патологоанатомических изменений и результатов микробиологического исследования рыбы. Меры борьбы. Они недостаточно разработаны. Соблюдение ве-теринарно-санитарных норм и улучшение культуры рыбоводства сдерживают распространение заболевания. Для лечения стрептококкоза рыб используют эритромицин. В России были начаты работы по созданию вакцины против стрептоккокоза. Профилактически в корм добавляют культуру ацидофильной палочки (0,1 — 1,0 % суточного рациона корма в течение Юдней). 6.5. ЭПИТЕЛИОЦИСТОЗ (МУКОФИЛЕЗ) Эпителиоцистоз — довольно редкое заболевание карпа, а также других более чем 25 видов пресноводных и морских рыб, широко распространенное в мире, ранее известное как мукофилез. Этиология. В 1981 г. венгерские ученые на основании электронно-микроскопических исследований жабр карпа, пораженных му-кофилюсом, установили, что этот организм представляет собой одну увеличенную клетку хозяина, внутри которой находится огромное число мельчайших включений прокариотной природы, близких по строению к риккетсиям или хламидиям. Сходный возбудитель, обнаруженный в 1969 г. в США у лепоми-са (Lepomis macrochirus), поражал только эпителиальные клетки жабр, которые приобретали вид мелких цист, в связи с чем заболевание получило название эпителиоцистиса. По аналогии болезнь карпа стали называть не мукофилезом, а эпителиоцистисом (epitheliocystis). Проведенные в России в середине 90-х годов исследования на карпе подтвердили результаты исследований венгерских ученых. Дальнейшие исследования показали, что данное заболевание широко распространено среди различных видов рыб, как пресноводных, так и морских. Согласно последним данным американских ученых, проводивших комплексные ультраструктурные, биохимические и иммунологические исследования возбудителя эпителиоцистиса белого осетра, он ближе к хламидиям, чем к риккетсиям. Ультраструктурные исследования возбудителей из разных рыб-хозяев показали, что они имеют определенные различия. Это позволяет предположительно рассматривать их как отдельные виды или формы. Немногочисленные попытки экспериментального заражения рыб пока не увенчались успехом. Эпизоотология. Интересно, что массовое поражение рыб отмечается только при искусственном культивировании и не встречается в естественных условиях. Вспышки эпителиоцистиса сопровождаются либо высокой смертностью рыб, либо заболевание становится хроническим с незначительным отходом. Заболевание карпа эпителиоцистисом отмечено в хозяйствах Венгрии, Израиля и Испании, Причем в отдельных случаях наблюдалась гибель молоди. Вспышки заболевания у карпа в прудовых хозяйствах Украины были зарегистрированы в конце 70-х годов XX в. Молодь карпа поражается уже На 14—15-й день после выклева. С ростом рыб интенсивность инвазии возрастает, достигая максимума к середине лета при температуре 24—26 "С. При этом возможна гибель сильно зараженных рыб. Отход обычно наблюдается в течение 7—Ю дней. С понижением температуры происходит постепенное освобождение рыбы от возбудителя. Возможно повторное заражение годовиков весной следующего года, но уже с низкой степенью поражения рыб. В середине 90-х годов в России заболевание отмечали в ряде прудовых и тепловодных хозяйств. Повышенные плотности посадки рыб способствуют заражению, размножению и накоплению возбудителя, что приводит к гибели сильно зараженных особей. 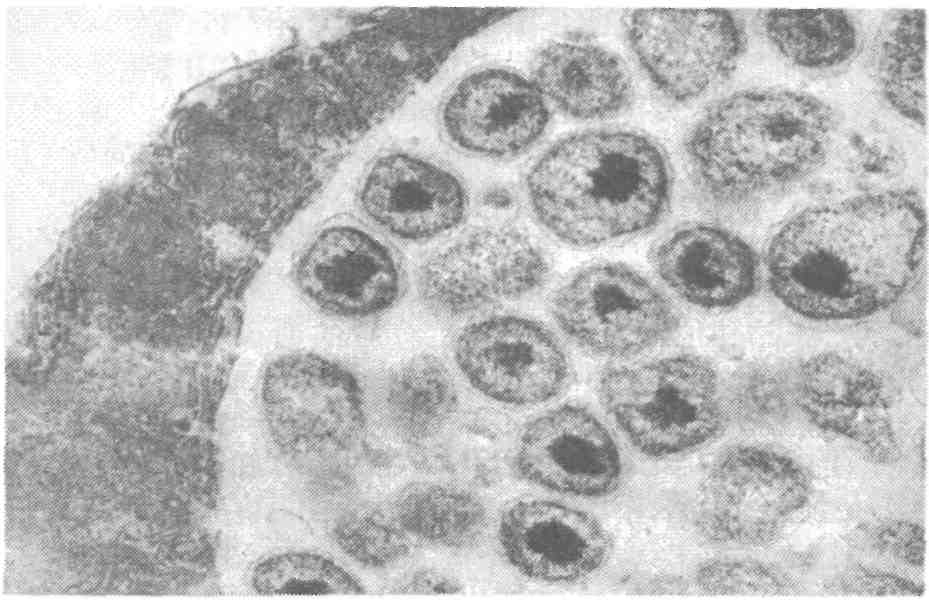 Рис. 30. Возбудитель эпителиоцистоза Клинические признаки. В пораженных жабрах карпа при микроскопии отмечают наличие мелких и белых округлых цист. На гистологических срезах в зависимости от степени развития и зрелости микроорганизмов эпителиальные клетки жабр имеют различные величину и характер окрашивания. Пораженные клетки увеличиваются в размерах до 50 мкм и приобретают мелкозернистую структуру. При электронной микроскопии в них видно скопление огромного числа включений размером около 2—5 мкм, у которых отсутствует настоящее ядро и есть многослойная, сложно устроенная монолитная оболочка (рис. 30). Очевидно, что на этой стадии возбудитель при разрушении клетки попадает в воду и заражает других рыб. Жизненный цикл этого патогенного микроорганизма еще не изучен, в первую очередь неясны пути его проникновения в организм хозяина и время, которое проходит от начала заражения до завершения развития. Меры борьбы. Они не разработаны. При вспышке заболевания положительные результаты дает улучшение условий содержания рыб, включая увеличение проточности и внесение извести по воде в прудах из расчета 100—200 кг/га. КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАНИЯ 1. Назвать основные бактериальные болезни карпа. 2. Перечислить основные заболевания, вызываемые энтеробактериями. 3. Какие болезни рыб вызывают миксобактерии? 4. При каких бактериальных заболеваниях на рыбоводные хозяйства накладывают карантин? 5. Назвать основные методы борьбы с бактериальными инфекциями. |
