Державна установа інститут фармакології та токсикології намн україни
 Скачать 0.69 Mb. Скачать 0.69 Mb.
|
|
РОЗДІЛ 7 ФАРМАКОКІНЕТИЧНІ МЕХАНІЗМИ ФОРМУВАННЯ ТОЛЕРАНТНОСТІ ДО ДІЇ АНТИКОНВУЛЬСАНТІВ Поряд із своєрідними змінами функціонування нейромедіаторних систем мозку, причинами формування толерантності до дії антиконвульсантів можуть бути зсуви ряду фармакокінетичних параметрів цієї групи лікарських препаратів. Теоретично це може бути пов’язано з кількісним перерозподілом протисудомних засобів у крові і мозку та змінами активності ферментів метаболізму ліків, в першу чергу ферментів системи цитохрому Р-450. Тому в наступній частині роботи були проведені дослідження, спрямовані на визначення вмісту антиконвульсантів у крові і мозку нетолерантних тварин і тварин, толерантних до дії протисудомних препаратів. Крім того, вивчався вплив антиконвульсантів на тривалість сну, викликаного дією барбітуратів (гексенал) у нетолерантних і толерантних тварин, що давало можливість оцінити функціональний стан ферментативної системи Р-450. Кількісні зміни вмісту протисудомних препаратів у крові і мозку визначалися в дослідах на білих щурах, яким за 1 год до забору крові і декапітації внутрішньочеревно вводилися: фенобарбітал в дозі 20 мг/кг, карбамазепін – 125 мг/кг, вальпроат натрію – 155 мг/кг, топірамат – 300 мг/кг, ламотриджин – 30 мг/кг. Вказані антиконвульсанти в цих же дозах внутрішньочеревно вводилися білим мишам при вивченні їх впливу на тривалість гексеналового сну. Гексенал вводився внутрішньочеревно в дозі 100 мг/кг, в/ч, через 1 год після протисудомних засобів. Параметри сну (тривалість бокового положення тварин) порівнювалися з даними контролю, а також між нетолерантними і толерантними тваринами. Толерантність до дії антиконвульсантів формувалася шляхом щоденного, одноразового їх введення: фенобарбіталу протягом 7 днів; карбамазепіну, депакіну, топірамату і ламотриджину – протягом 14 днів. Зазначені протисудомні препарати вводилися внутрішньочеревно. 7.1 Фенобарбітал Проведені досліди показали, що при введенні фенобарбіталу тваринам, толерантним до цього антиконвульсанта (на 8-й день після попереднього 7-денного введення препарату), його вміст у крові в 2,3 рази вище, ніж у нетолерантних тварин (відповідно 88,29±8,4 мкг/мл і 38,34±4,58 мкг/мл при р<0,05 (рис. 9). Це дає підставу для висновку про те, що при тривалому введенні фенобарбіталу на фоні розвитку толерантності спостерігається ефект його кумуляції. Тому підвищення дози фенобарбіталу для подолання терапевтичної резистентності до його протисудомної дії є недоцільним, оскільки при цьому можливе наростання побічних і токсичних ефектів без очікуваного підвищення лікувальної активності. Вміст фенобарбіталу в мозку після його внутрішньочеревного введення визначався в лівій і правій півкулях (без мозочка). Такий підхід був виправданий у зв’язку з наявністю даних про переважну (домінантну) дію різних протисудомних препаратів на ліву чи праву півкулю головного мозку. У зв’язку з цим не виключена можливість нерівномірного надходження (розподілу) антиконвульсантів в півкулі мозку. Через 1 год після внутрішньочеревного введення фенобарбіталу в дозі 20 мг/кг нетолерантним тваринам у лівій і правій півкулях мозку визначається приблизно однакова кількість препарату, що відповідно складає 18,66±1,68 мкг/г і 19,26±1,73 мкг/г (табл. 7.1). 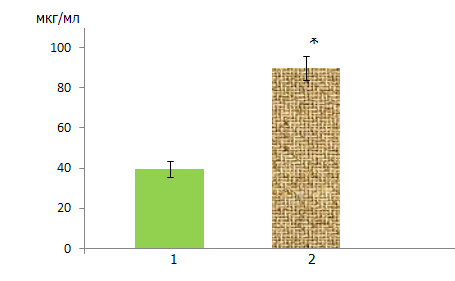 Рис. 9. Вміст фенобарбіталу в крові білих щурів при введенні препарату нетолерантним тваринам і тваринам, толерантним до дії фенобарбіталу (n=6) Позначення: 1 – нетолерантні тварини; 2 – толерантні тварини. Примітка: * – р<0,05 між нетолерантними і толерантними тваринами. Таблиця 7.1 Вміст фенобарбіталу в мозку білих щурів при в/ч введенні препарату нетолерантним і толерантним тваринам (М±m; n=6)
Примітка: * – р<0,05 між нетолерантними і толерантними тваринами. При порівнянні вмісту фенобарбіталу в крові і мозку можна констатувати помірну біодоступність препарату, тому що співвідношення кров/мозок складає 2:1. У тварин, яким вводився фенобарбітал на фоні сформованої толерантності до цього препарату, його кількість у тканинах головного мозку була в 2 рази більша, ніж у нетолерантних тварин (табл. 7.1). Відмінності в рівні фенобарбіталу в лівій і правій півкулях у толерантних тварин не виявлені. Таким чином, при введенні фенобарбіталу толерантним тваринам його кількість у крові і мозку в 2 рази більше, ніж у нетолерантних тварин, що також свідчить про кумулятивний ефект препарату. Кількісні зміни вмісту ліків в органах і тканинах можуть бути пов’язані з ферментативною активністю ферментів системи цитохрому Р-450. Як згадувалося вище, про функціональний стан ферментів системи цитохрому Р-450 опосередковано можна судити за тривалістю гексеналового сну, який визначається за тривалістю бокового положення тварин при внутрішньочеревному введенні гексеналу в дозі 100 мг/кг. Ці досліди були проведені на білих мишах, поділених на 3 групи (по n=6 в кожній групі): контроль – інтактні миші, яким в/ч вводився гексенал в дозі 100 мг/кг; нетолерантні тварини, яким за 1 год до гексеналу (100 мг/кг) в/ч вводився фенобарбітал (20 мг/кг); тварини, яким попередньо протягом 7 днів вводився фенобарбітал (20 мг/кг), а на 8-й день фенобарбітал в цій же дозі вводився за 1 год до гексеналу. Результати дослідів наведені в таблиці 7.2. З даних таблиці видно, що при одноразовому введенні фенобарбіталу нетолерантним тваринам тривалість гексеналового сну не змінюється. Проте введення цієї ж дози фенобарбіталу толерантним тваринам призводить до зменшення тривалості гексеналового сну як по відношенню до контролю (в 2,4 рази), так і у порівнянні з нетолерантними тваринами (в 2,3 рази). Таблиця 7.2 Вплив фенобарбіталу на гексеналовий сон у нетолерантних і толерантних тварин (М±m; n=6)
Примітки: * – р<0,05 відносно контролю; ◊ – р<0,05 відносно нетолерантних тварин. Вважається, що зниження тривалості барбітуратного сну під впливом будь-якого препарату пов’язано з індукцією ферментів системи Р-450. Тому отримані нами дані можуть свідчити про те, що тривале введення фенобарбіталу призводить до підвищення активності ферментів Р-450, тобто в даному випадку фенобарбітал проявляє властивості індуктора Р-450. У цій ситуації слід очікувати зниження рівня фенобарбіталу в крові і мозку толерантних тварин. Проте отримані результати вказують на те, що вміст фенобарбіталу в крові і мозку толерантних тварин не знижується, а більш, ніж у 2 рази, підвищується (рис. 10). Ці уявні протиріччя можна пояснити наступним чином. Під впливом тривалої дії фенобарбіталу відбувається індукція Р-450, що знижує тривалість гексеналового сну, тим більше, що в метаболізмі фенобарбіталу і гексеналу бере участь одна і та сама ізоформа Р-450, а саме СУР 2С19. Паралельно з цим підвищується внутрішня спорідненість (афінітет) транспортних білків крові до фенобарбіталу, внаслідок чого є можливим утворення ковалентного зв’язку, що в кінцевому рахунку призводить до ефекту кумуляції препарату. 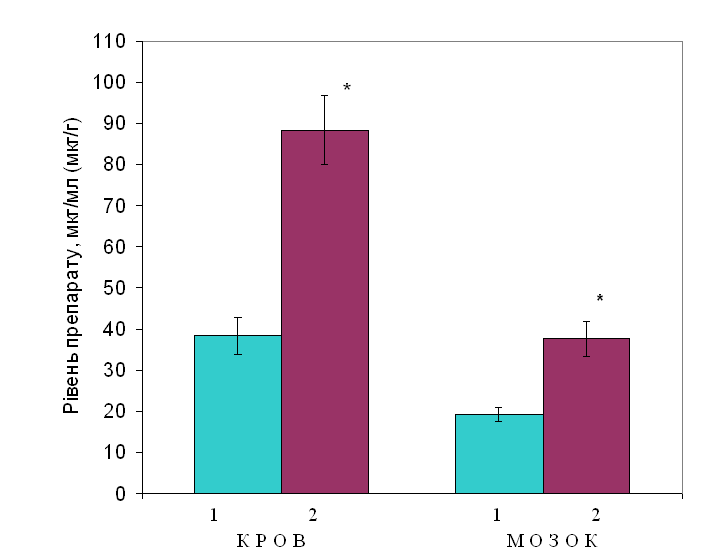 Рис. 10. Вміст фенобарбіталу в крові та мозку білих щурів при введенні препарату нетолерантним тваринам і тваринам, толерантним до дії фенобарбіталу (n=6) Позначення: 1 – нетолерантні тварини; 2 – толерантні тварини. Примітка: * – р<0,05 між нетолерантними і толерантними тваринами. Аналогічні процеси, ймовірно, проходять в тканинах мозку, але вже на рівні білкових субодиниць ГАМК-рецепторів. У цих умовах тривала активація ГАМК-рецептора викликає явище десенситизації, що попереджує генерацію гальмівного постсинаптичного потенціалу (ГПСП) і як наслідок зниження снодійного і протисудомного ефекту у толерантних тварин. Схематичне уявлення особливостей дії фенобарбіталу при його тривалому введенні наведені на рис. 11. Виходячи з наведених даних та їх обговорення, можна зробити висновок про те, що для подолання терапевтичної резистентності до протисудомного впливу фенобарбіталу шляхом підвищення його дози не тільки не показано, але й протипоказано, оскільки це призводить до підсилення побічних і токсичних ефектів препарату, без очікуваного покращення лікувальної дії.
ефект кумуляції препарату К  Р Р О В ефект кумуляції препарату
індукція Р-450 Рис. 11. Схема особливостей дії фенобарбіталу при його тривалому введенні 7.2 Карбамазепін Особливості фармакокінетичних параметрів карбамазепіну при розвитку толерантності до дії препарату оцінювалася за зміною його вмісту у крові та мозку, а також впливу на барбітуратний сон. При визначенні рівня карбамазепіну в крові та мозку препарат вводився внутрішньочеревно за 1 год до забору крові і декапітації. При цьому порівнювалася кількість карбамазепіну в крові та мозку у нетолерантних тварин і тварин, толерантних до дії препарату. Толерантність формувалася шляхом щоденного введення карбамазепіну (125 мг/кг, в/ч) протягом 14 днів. На 15-й день препарат вводився за 1 год до декапітації. Проведені дослідження показали, що у тварин, толерантних до дії карбамазепіну, вміст препарату в крові різко знижується і визначається лише у вигляді слідів: з 51,63±1,51мкг/мл у нетолерантних тварин до 0,026±0,001 у толерантних (рис. 12). Паралельно з цим у толерантних тварин рівень карбамазепіну у лівій і правій півкулях значно знижується і стає меншим, ніж у нетолерантних тварин в 400 раз (табл. 7.3). 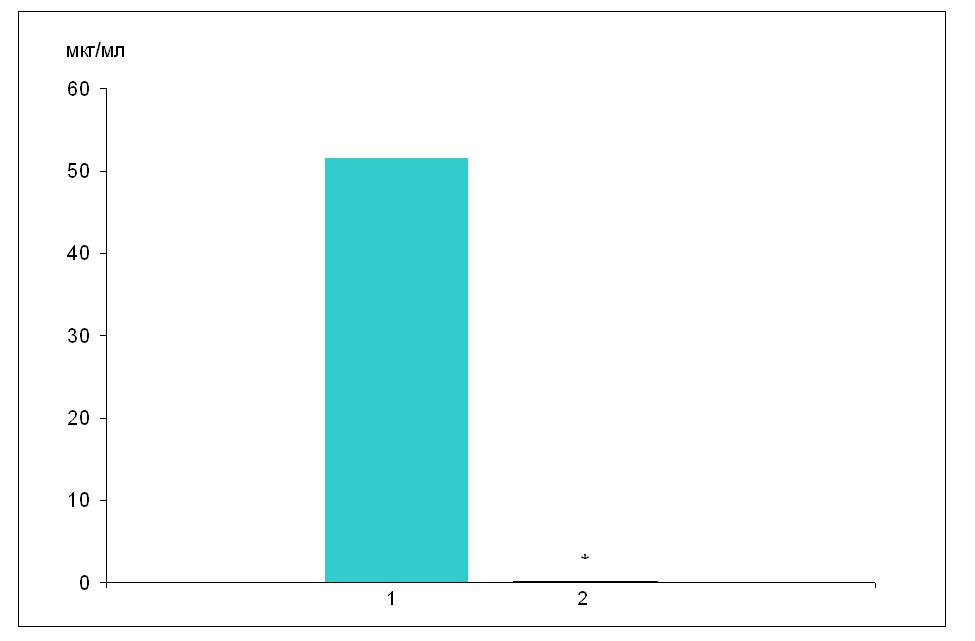 Рис. 12. Рівень карбамазепіну у крові нетолерантних тварин і тварин, толерантних до протисудомної дії препарату (n=6) Позначення: 1 – нетолерантні тварини; 2 – толерантні тварини. Примітка: * – р<0,05 між нетолерантними і толерантними тваринами. Таблиця 7.3 Вміст карбамазепіну в мозку нетолерантних тварин і тварин, толерантних до дії препарату (М±m; n=6)
Примітка: * – р<0,05 між нетолерантними і толерантними тваринами. Таким чином, спостерігається задовільний збіг зниження рівня карбамазепіну в крові і мозку тварин, толерантних до протисудомної дії даного препарату (рис. 13). Власне, практично відсутність молекул карбамазепіну у мозку толерантних тварин є об’єктивним фактором, що пояснює причину розвитку терапевтичної резистентності при тривалому застосуванні препарату. 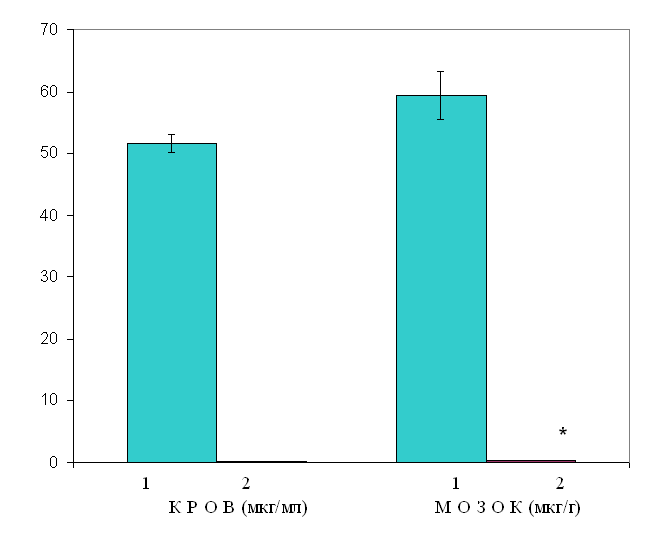 Рис. 13. Співвідношення рівня карбамазепіну у крові і мозку нетолерантних і толерантних тварин Позначення: 1 – нетолерантні тварини; 2 – толерантні тварини. Примітка: * – р<0,05 між нетолерантними і толерантними тваринами. Одна з причин кількісних зсувів вмісту карбамазепіну в крові і мозку толерантних тварин може бути пов’язана зі змінами активності ферментів системи цитохрому Р-450. Опосередкованим показником функціонального стану ферментів Р-450 є визначення впливу карбамазепіну на тривалість барбітуратного сну (гексеналового). Досліди проведені на білих мишах. Контрольним тваринам внутрішньочеревно вводився гексенал у дозі 100 мг/кг і реєструвалася тривалість сну. Дослідній групі тварин за 1 год до гексеналу в/ч вводився карбамазепін у дозі 125 мг/кг. Другу дослідну групу складали тварини, толерантні до дії карбамазепіну. Толерантність формувалася шляхом щоденного в/ч введення карбамазепіну (125 мг/кг) протягом 14 днів. На 15-й день карбамазепін (125 мг/кг) вводився за 1 год до гексеналу. Отримані результати показали, що у нетолерантних тварин карбамазепін дещо збільшував тривалість гексеналового сну, проте ці зміни були недостовірними. У толерантних тварин карбамазепін знижував тривалість гексеналового сну по відношенню до нетолерантних на 25%, але ці зміни також були статистично недостовірними (табл. 7.4). Таблиця 7.4 Вплив карбамазепіну на тривалість гексеналового сну (М±m)
Отже, в даному випадку можна вважати, що у толерантних тварин спостерігається лише тенденція прояву карбамазепіна як індуктора Р-450. Пояснити це можна тим, що барбітурати є субстратом для ізоформи Р-450 – 2С19, тоді як карбамазепін – для ізоформ 3А4, 2С8 і 2В6. Виходячи з отриманих даних, можна зробити висновок про те, що значне зниження рівня карбамазепіну у крові і мозку толерантних тварин лише частково пов’язане з індукцією ізоформи 2С19. Можливо це обумовлено індукцією специфічних для карбамазепіну ізоформ Р-450 (3А4, 2С8 і 2В6) і/або функціональними змінами транспортних білків, зокрема, зі зниженням їх афінітету до молекул карбамазепіну. Отримані результати показують, що навряд чи буде виправданим підвищення дози карбамазепіну як засобу подолання толерантності. Крім того, слід відмітити рівноважну біодоступність карбамазепіну у нетолерантних тварин, оскільки співвідношення його концентрації у крові і мозку складає 1:1. Не відмічено також міжпівкульних відмінностей у вмісті карбамазепіну у нетолерантних тварин при його в/ч введенні (табл. 7.4). 7.3 Вальпроат натрію При дослідженні фармакокінетичних параметрів вальпроату натрію у нетолерантних тварин була встановлена його середня біодоступність, оскільки співвідношення концентрації препарату кров/мозок складає 7:1. Через 1 год після внутрішньочеревного введення білим щурам вальпроату натрію в дозі 155 мг/кг, його рівень у крові становив 220 мкг/мл, у мозку – 32 мкг/г) (рис. 14). Міжпівкульних кількісних відмінностей вмісту вальпроату натрію не виявлено (табл. 7.5). 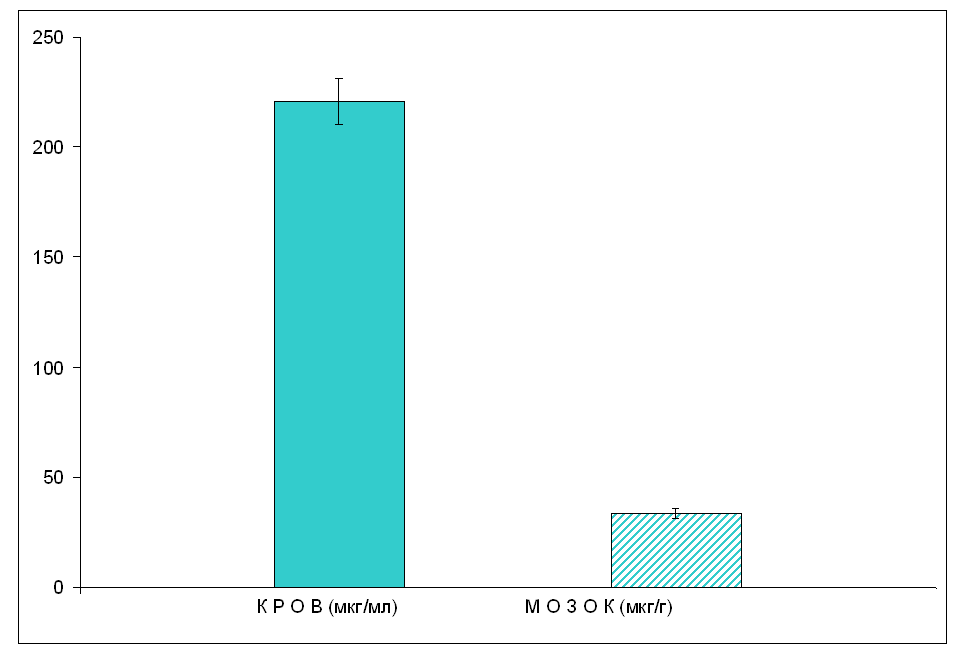 Рис. 14. Вміст вальпроату натрію у крові і мозку нетолерантних тварин через 1 год після в/ч введення препарату у дозі 155 мг/кг Таблиця 7.5 Вміст вальпроату натрію у крові нетолерантних і толерантних тварин через 1 год після в/ч введення препарату в дозі 155 мг/кг
У наступних серіях дослідів визначався вміст вальпроату натрію у крові і мозку тварин, толерантних до протисудомної дії даного антиконвульсанта. Толерантність формувалася шляхом щоденного в/ч введення вальпроату натрію у дозі 155 мг/кг, протягом 14 днів. На 15-й день вальпроат натрію у дозі 155 мг/кг вводився за 1 год до забору тканин для дослідження. Отримані результати показали, що у крові толерантних тварин вальпроат натрію не визначається (рис. 15). 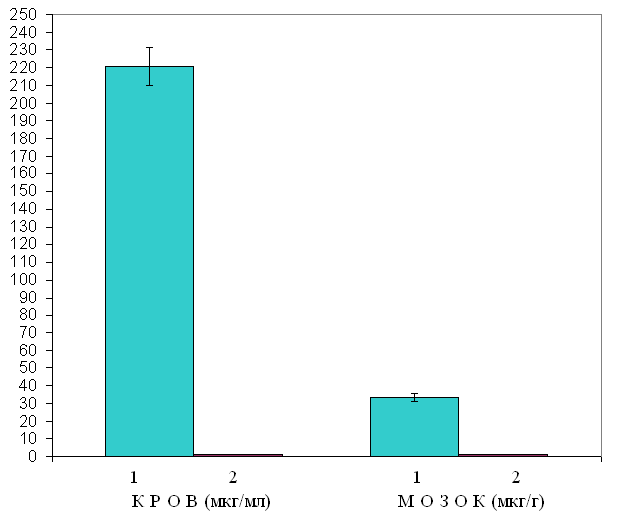 Рис. 15. Співвідношення рівня вальпроату натрію у крові і мозку нетолерантних і толерантних тварин Позначення: 1 – нетолерантні тварини; 2 – толерантні тварини. Аналогічна картина спостерігається при дослідженні вмісту вальпроату натрію у лівій і правій півкулях мозку. При цьому у мозку толерантних тварин вальпроат натрію також не визначався (табл. 7.5). Таким чином, у крові толерантних тварин по відношенню до нетолерантних, рівень вальпроату натрію знижується до нуля і тому препарат не надходить до тканин головного мозку (рис. 16), що призводить до припинення його протисудомної дії, тобто розвитку толерантності (терапевтичної резистентності). 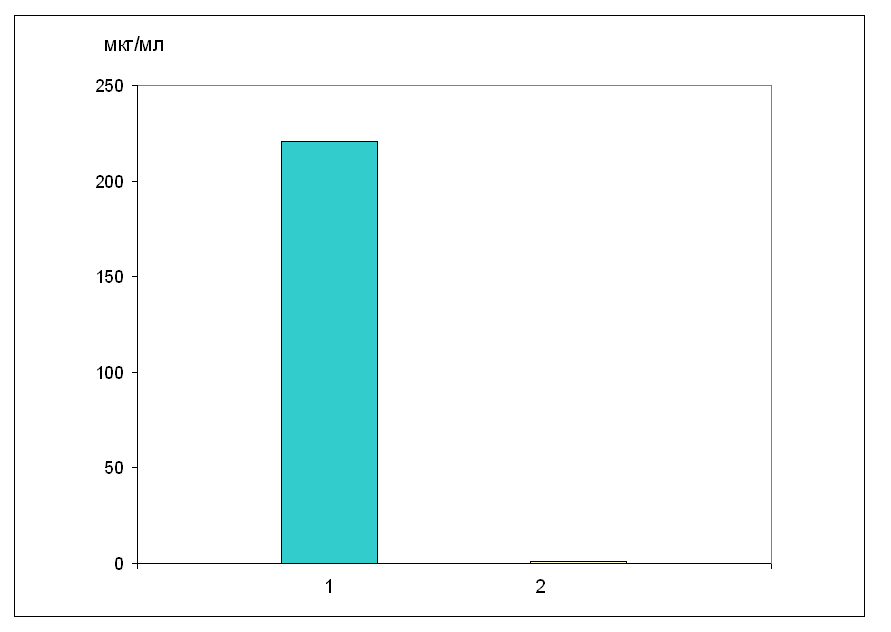 Рис. 16. Вміст вальпроату натрію у крові нетолерантних і толерантних тварин через 1 год після в/ч введення препарату у дозі 155 мг/кг Як вказувалося вище, однією з альтернатив, що призводить до зниження концентрації лікарського препарату в організмі, є індукція ферментів цитохрому Р-450. З цією метою вивчався вплив вальпроату натрію на тривалість барбітуратного сну (гексеналового), що є опосередкованим показником функціонального стану ферментів Р-450. Досліди проводилися на білих мишах, які були розділені на 3 експериментальні групи. Перша група – контрольна, в якій реєструвалася тривалість сну у інтактних тварин під впливом в/ч введення гексеналу у дозі 100 мг/кг. У другій групі визначався вплив одноразово введеного вальпроату натрію, в/ч, у дозі 155 мг/кг на тривалість барбітуратного сну. У третій групі вивчалася тривалість барбітуратного сну у тварин, толерантних до дії вальпроату натрію. Толерантність формувалася шляхом щоденного, внутрішньочеревного введення вальпроату натрію у дозі 155 мг/кг, протягом 14 днів. На 15-й день вальпроат натрію вводився за 1 год до снодійної дози гексеналу. Отримані результати наведені в таблицях 7.7. Вальпроат натрію при введенні інтактним тваринам достовірно знижує тривалість гексеналового сну на 12%. В аналогічних умовах, але на фоні толерантності до дії вальпроату натрію, тривалість гексеналового сну по відношенню до контролю I знижується в значно більшій мірі і складає 44% (табл. 7.6). Таблиця 7.6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
