Державна установа інститут фармакології та токсикології намн україни
 Скачать 0.69 Mb. Скачать 0.69 Mb.
|
|
Вплив вальпроату натрію на тривалість гексеналового сну (М±m; n=6)
Примітки: * – р<0,05 відносно контролю I; ◊ – р<0,05 відносно контролю II. Виражене зниження тривалості барбітуратного (гексеналового) сну у тварин, толерантних до дії вальпроату натрію, опосередковано свідчить, що в цих умовах даний антиконвульсант проявляє властивості індуктора ферментів цитохрому Р-450. Це може бути причиною зниження рівня вальпроату натрію у крові і мозку толерантних тварин майже до нуля і робить обґрунтованим висновок про недоцільність підвищення дози вальпроату натрію з метою подолання терапевтичної резистентності до даного препарату. 7.4 Ламотриджин Проведені дослідження показали високу біодоступність ламотриджину. При внутрішньочеревному введенні препарату інтактним білим щурам у дозі 30 мг/кг через 1 год співвідношення вмісту препарата кров/мозок складає 1:1,3 (18,39±0,74 мкг/мл у крові та приблизно 24 мкг/г в мозку). Міжпівкульних відмінностей вмісту ламотриджину при його в/ч введенні не виявлено (в лівій півкулі 25,72±1,53 мкг/г, в правій – 23,56±1,42 мкг/г). Толерантність до дії ламотриджину формувалася щоденним, внутрішньочеревним введенням препарату у дозі 30 мг/кг, протягом 14 днів. На 15-й день ламотриджин вводився за 1 год до забору біологічного матеріалу (кров, мозок), у якому визначався вміст даного препарату. Проведені дослідження показали, що у толерантних тварин по відношенню до нетолерантних, вміст ламотриджину у крові достовірно зростає на 12% (рис. 17). Паралельно з цим рівень ламотриджину у мозку толерантних тварин зростає на 30% (табл. 7.7). Таким чином, розвиток толерантності до дії ламотриджину формується на фоні підвищеного вмісту препарата в крові, що природно призводить до зростання його рівня у тканинах мозку. При цьому приблизно зберігається співвідношення вмісту препарата кров/мозок (1:1,5), як і у нетолерантних тварин (рис. 18). 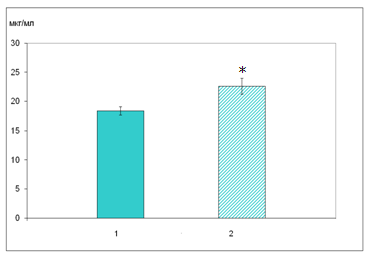 Рис. 17. Вміст ламотриджину у крові нетолерантних і толерантних тварин при в/ч введенні препарату в дозі 30 мг/кг (n=6) Позначення: 1 – нетолерантні тварини; 2 – толерантні тварини. Примітка: * – р<0,05 відносно нетолерантних тварин. Таблиця 7.7 Рівень ламотриджину у мозку нетолерантних тварин і тварин, толерантних до дії препарату (М±m; n=6)
Примітка: * – р<0,05 між нетолерантними і толерантними тваринами. 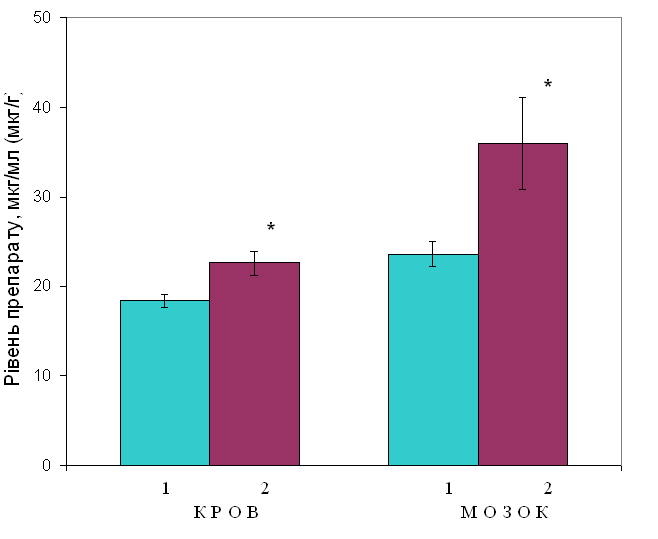 Рис. 18. Співвідношення вмісту ламотриджина в крові і мозку нетолерантних і толерантних тварин (n=6) Позначення: 1 – нетолерантні тварини; 2 – толерантні тварини. Примітка: * – р<0,05 між нетолерантними і толерантними тваринами. У наступній частині вивчався вплив ламотриджину у нетолерантних і толерантних тварин на тривалість гексеналового сну. Толерантність формувалася шляхом щоденного введення ламотриджину у дозі 30 мг/кг, протягом 14 днів. На 15-й день за 1 год до гексеналу (100 мг/кг, в/ч) вводився ламотриджин (30 мг/кг) і порівнювалася тривалість сну між контрольними тваринами, нетолерантними і толерантними до дії ламотриджину. Результати дослідів наведені в таблиці 7.8. Ламотриджин достовірно знижує тривалість гексеналового сну у нетолерантних тварин на 20%. Цей ефект проявляється ще в більшій мірі у толерантних тварин. У цьому випадку тривалість гексеналового сну відносно нетолерантних тварин знижується в 2 рази і майже в 3 рази відносно контролю. Зниження тривалості гексеналового сну під впливом ламотриджину особливо сильно виражена у тварин, толерантних до дії ламотриджину, і є опосередкованим показником того, що даний антиконвульсант проявляє властивості індуктора функціональної активності ферментів системи цитохрому Р-450 (табл. 7.8). Таблиця 7.8 Вплив ламотриджину на тривалість гексеналового сну (М±m; n=6)
Примітки: * – р<0,05 відносно контролю I; ◊ – р<0,05 відносно контролю II. Отримані результати, наведені у цьому розділі, показують, що у тварин, толерантних до дії ламотриджину, спостерігається підвищення рівня препарату у крові і мозку відносно нетолерантних, що свідчить про кумулятивний ефект. При цьому відзначається певна невідповідність між підвищенням вмісту препарата у тканинах організму (кров, мозок) і його здатністю проявляти властивості індуктора Р-450. Пов’язано це, можливо, з тим, що ламотриджин є селективним субстратом для УДФ- глюкуронозілтрансферази, експресія якого під впливом препарату знижується з одночасною індукцією ізоформи 2С19, вибірковою для барбітуратів, що і проявляється у зниженні тривалості гексеналового сну. Таким чином, можна припустити, що кумулятивний ефект ламотриджину у толерантних тварин викликає тривалий, тонічний вплив на відповідні рецепторні структури нейронів мозку, що призводить до зниження їх чутливості, тобто десенситизації. У таких умовах спостерігається нівелювання протисудомної активності, вираженої у вигляді толерантності (терапевтичної резистентності). Все це експериментально обґрунтовує недоцільність підвищення дози ламотриджину з метою подолання терапевтичної резистентності. 7.5 Топірамат При дослідженні фармакокінетичних параметрів топіратату встановлена середня біодоступність препарату у тканині мозку. Співвідношення вмісту топірамата кров/мозок при внутрішньочеревному введенні препарату інтактним білим щурам у дозі 300 мг/кг складає 3,5:1 (рис. 19) з рівномірним розподілом у лівій і правій півкулях мозку, відповідно 21,11±2,34 і 19,40±1,84 мкг/г (табл. 7.9). Достовірних відмінностей у рівні топірамату у крові нетолерантних тварин і тварин, толерантних до дії топірамату не виявлено. При цьому вміст топірамату у крові складав у нетолерантних тварин 72,76±7,74 мкг/мл, у толерантних – 57,43±12,25 (р>0,05). Толерантність до дії топірамату формувалася щоденним, внутрішньочеревним введенням препарату у дозі 300 мг/кг, протягом 14 днів. На 15-й день за 1 год до забору біологічних тканин топірамат вводився у дозі 300 мг/кг. 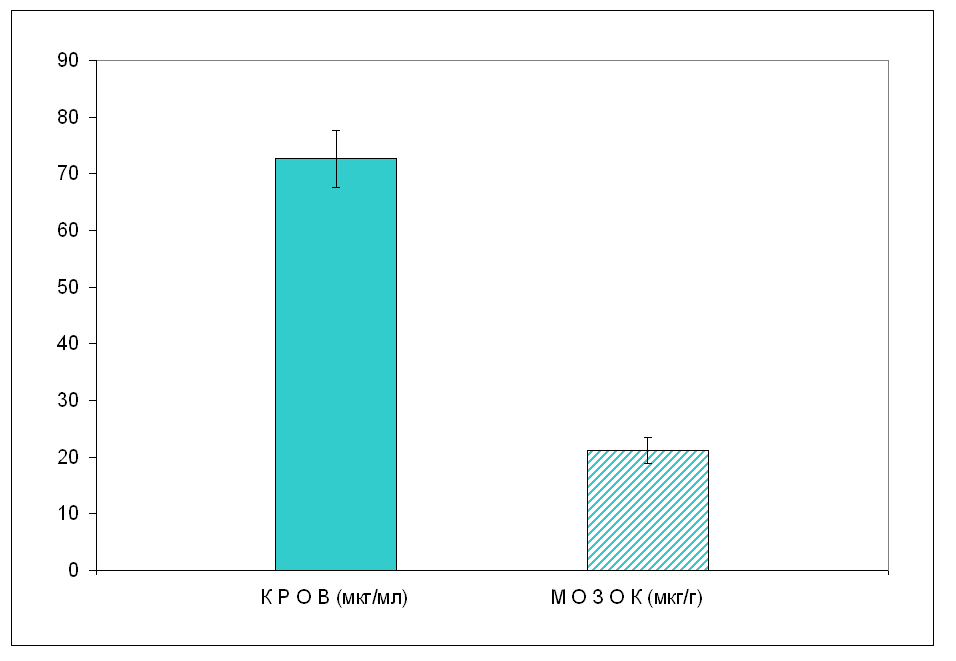 Рис. 19. Співвідношення вмісту топірамата у крові і мозку білих щурів при в/ч введенні препарату у дозі 300 мг/кг, 1 год після введення (n=6) Співвідношення вмісту топірамата у крові і мозку толерантних тварин скорочувалося по відношенню до нетолерантних з 3,5:1 до 1,5:1, що може свідчити про кумулятивний ефект. Це підтверджується тенденцією до підвищення рівня топірамату у лівій півкулі толерантних тварин на 43% і достовірним зростанням кількості препарату у правій півкулі на 48%. Міжпівкульних відмінностей у вмісті топірамату у лівій і правій півкулях мозку толерантних тварин не виявлено (табл. 7.9). Таблиця 7.9 Вплив топірамату в мозку нетолерантних тварин і тварин, толерантних до дії препарату (М±m; n=6)
Примітка: * – р<0,05 між нетолерантними і толерантними тваринами. При вивченні впливу топірамату на тривалість барбітуратного сну у білих мишей було встановлено, що препарат підвищує тривалість гексеналового сну. Топірамат у дозі 300 мг/кг, введений за 1 год до гексеналу (100 мг/кг, в/ч), підвищує тривалість гексеналового сну у нетолерантних тварин і тварин, толерантних до дії препарату, приблизно на 150% (табл. 7.10). Таблиця 7.10 Вплив топірамату на тривалість гексеналового сну (М±m; n=6)
Примітка: * – р<0,05 відносно контролю I. Однозначне підвищення тривалості барбітуратного сну слугує опосередкованим доказом того, що топірамат проявляє властивості інгібітора ферментів системи цитохрому Р-450. Аналіз отриманих результатів показує, що розвиток толерантності до дії протисудомних засобів формується на фоні своєрідних змін фармакокінетичних параметрів досліджуваних антиконвульсантів. При цьому спостерігається як спільність, так і розбіжності спрямованості цих змін, що, ймовірно, визначається відмінностями хімічної структури досліджуваних антиконвульсантів і нюансами механізмів їх протисудомної дії. Узагальнена схема фармакокінетичних параметрів досліджуваних протисудомних препаратів у тварин, толерантних до їх дії наведена в табл. 7.11. З даних наведеної схеми видно односпрямованість змін у крові і мозку толерантних тварин щодо вмісту кожного антиконвульсанта (підвищення у випадку фенобарбітала і ламотриджина та зниження у випадку карбамазепіна і депакіна). Зниження рівня карбамазепіну і депакіну у крові і мозку толерантних тварин добре узгоджується з проявом властивостей індуктора Р-450 у цих препаратів. Підвищення вмісту топірамата у мозку толерантних тварин узгоджується з проявом властивостей інгібітора Р-450. У той же час фенобарбітал і ламотриджин у толерантних тварин проявляють властивості індуктора Р-450, проте рівень цих антиконвульсантів у крові і мозку не знижується, а підвищується, що можливо пов’язано з ефектом кумуляції цих препаратів. Таблиця 7.11 Схематичне узагальнення особливостей фармакокінетичних параметрів антиконвульсантів при формуванні толерантності до їх дії
Примітка: ↑ – зміни в сторону зростання показників, ↓ – зміни в сторону зниження показників, 0 – немає змін. Висновки до розділу 7 Толерантність до дії антиконвульсантів формується на фоні змін вмісту цих препаратів у крові і мозку тварин. Вміст депакіну і карбамазепіну у крові і мозку толерантних тварин практично не визначається. При цьому обидва препарати, причому це особливо виражено у депакіна, проявляють властивості індукторів Р-450, що пояснює причину зниження рівня препаратів у тканинах мозку і, як наслідок, припинення їх протисудомної дії. Кількість фенобарбіталу і ламотриджину у крові і мозку толерантних тварни зростає і це відбувається, незважаючи на те, що обидва препарати проявляють властивості індуктора Р-450. Отже, у даному випадку мова йде про ефект кумуляції фенобарбіталу і ламотриджину, що не попереджує розвиток толерантності до їх дії. Топірамат проявляє властивості інгібітора Р-450, що може бути причиною підвищення рівня препарату у мозку толерантних тварин. Публікації в наукових виданнях за результатами експериментальних досліджень, наведеними в даному розділі дисертаційної роботи: 1. Мовчан О.Д. Фармакокінетичні параметри антиконвульсантів у тварин, толерантних до їх протисудомної дії / О.Д. Мовчан // Фармакологія та лікарська токсикологія. – 2012. – № 4 (29). – С. 27-31. 2. Мовчан О.Д. Фармакокінетичні механізми розвитку толерантності до депакіну та карбамазепіну / О.Д. Мовчан // Клінічна фармація. – 2013. – Т. 17, № 3. – С. 62-65. 3. Мовчан О.Д. Фармакокінетичні параметри формування толерантності до дії антиконвульсантів / О.Д.Мовчан / Загальнотерапевтична практика: нові технології та міждисциплінарні питання: матеріали науково-практичної конференції з міжнародною участю, 7 листопада 2013 р.: тези доповідей. – Харків, 2013. – С. 213. АНАЛІЗ ТА УЗАГАЛЬНЕННЯ ОТРИМАНИХ РЕЗУЛЬТАТІВ Розвиток толерантності до дії ксенобіотиків, до яких, у тому числі, відносяться і лікарські препарати, є природною, захисною реакцією організму і відноситься до розряду загальнобіологічних проблем [28, 180]. У клінічній і експериментальній фармакології розрізняють первинну і вторинну толерантність до дії лікарських засобів, що у медичній практиці визначається як терапевтична резистентність [15, 16]. Первинна резистентність пов’язана з питаннями генетичного поліморфізму генів, відповідних за синтез білків відповідних рецепторів, і трактується в плані фармакогенетики [12, 19, 20, 163]. Вторинна резистентність формується при тривалому застосуванні лікарських препаратів [15, 108, 177, 178, 179]. Більшість неврологічних захворювань характеризується хронічним, прогредієнтним перебігом і тому вимагає тривалого, часто протягом всього життя, застосування нейропсихофармакологічних засобів. До таких захворювань відноситься епілепсія, основним засобом лікування якої є фармакотерапія з використанням антиконвульсантів [73]. Згідно численних клінічних даних первинна терапевтична резистентність до дії протисудомних препаратів реєструється в межах 25-30% випадків лікування епілепсії, що обумовлено, як вказувалося вище, генетичним поліморфізмом [8, 9, 150, 151]. Проте, у зв’язку з тим, що фармакотерапія епілепсії пов’язана з тривалим, інколи протягом років, застосуванням антиконвульсантів, виникають об’єктивні передумови до розвитку вторинної резистентності до дії протисудомних засобів. Тому проблема фармакотерапевтичної резистентності, а отже і ефективності лікування, охоплює всю популяцію хворих на епілепсію. Все це виправдовує необхідність дослідження різних аспектів, пов’язаних з толерантністю до дії антиконвульсантів. Метою даної роботи було вивчення закономірностей механізмів розвитку толерантності до протисудомної дії антиконвульсантів при їх тривалому введенні та визначення на цій основі шляхів подолання терапевтичної резистентності до даної групи лікарських засобів. Для дослідження були вибрані базові (фенобарбітал, карбамазепін, вальпроат натрію) і препарати другої лінії (топірамат, ламотриджин) протисудомні препарати, які постійно й широко застосовуються для лікування епілепсії [85, 86, 117, 118]. Дослідження проведені на білих мишах і білих щурах, яким внутрішньочеревно вводили вказані антиконвульсанти в експериментальних протисудомних дозах: фенобарбітал, 20 мг/кг, карбамазепін, 125 мг/кг, вальпроат натрію, 155 мг/кг, топірамат, 300 мг/кг, ламотриджин, 30 мг/кг [243, 244, 245, 246, 247]. Експериментальні судомні напади моделювалися шляхом введення хемоконвульсантів (коразол, пікротоксин, бікукулін, тіосемікарбазид, стрихнін, каїнова кислота) і використанням максимального електрошоку (МЕШ) [248, 254, 255, 256]. Основним критерієм розвитку толерантності до дії антиконвульсантів слугувало зниження або припинення протисудомної активності препарату при його тривалому введенні [28, 254]. Для вивчення механізмів розвитку толерантності визначалися зміни параметрів фармакодинаміки і фармакокінетики досліджуваних протисудомних препаратів. Проведені дослідження показали, що при тривалому введенні фенобарбіталу, карбамазепіну, вальпроату натрію, ламотриджину і топірамату розвивається толерантність до їх протисудомної дії. При цьому встановлені певні закономірності і особливості формування толерантності для кожного антиконвульсанта щодо тривалості їх введення та використаної експериментальної моделі судомних нападів. Розвиток толерантності на моделі хемоконвульснтних судом спостерігався через 7-14 днів після щоденного введення фенобарбіталу, карбамазепіну, вальпроату натрію, ламотриджину і топірамату. Причому припинення протисудомної активності фенобарбіталу наступало найшвидше і реєструвалося через 7 діб щоденного введення препарату. Для карбамазепіну, вальпроату натрію і топірамату цей період складав 14 діб. На моделі електроіндукованих судомних станів (МЕШ) формування толерантності до дії антиконвульсантів спостерігалося при більш тривалому введенні цих препаратів. Для фенобарбіталу, карбамазепіну, вальпроату натрію – 21 день, для ламотриджину – 14 днів. У експериментальній епілептології вважається, що судомні стани, викликані хемоконвульсантами, екстраполюються на відтворення малих клінічних форм епілепсії, тоді як електроіндуковані судомні стани асоціюються з генералізованими формами судомних нападів (grand mal). У зв’язку з цим отримані нами дані дають підставу зробити заключення про те, що при лікуванні малих форм епілепсії формування терапевтичної резистентності до дії антиконвульсантів настає швидше і це створює додаткові труднощі при лікуванні petit mal. В загальному це положення узгоджується з відповідними даними клінічної епілептології [27, 41]. У клінічній практиці для подолання терапевтичної резистентності розповсюдженим підходом є перехід на комбіновану фармакотерапію епілепсії (з використанням 2-3-х антиконвульсантів) або заміна одного протисудомного препарату на інший [93, 95, 78, 97]. Проте при цьому не враховується можливість формування перехресної толерантності між різними протисудомними препаратами. Перехресна толерантність реєструється, коли не відтворюються фармакологічні ефекти препарату, введеного на тлі сформованої толерантності до іншого препарата, з тієї ж фармакотерапевтичної групи. На експериментальних моделях хемоконвульсантних судомних станів (коразол, тіосемікарбазид) встановлена пряма і перехресна толерантність між фенобарбіталом, карбамазепіном, вальпроатом натрію і топіраматом. Про це свідчить той факт, що не проявляється протисудомна активність карбамазепіну, вальпроату натрію і топірамату у випадку, якщо вказані препарати вводилися тваринам, у яких попередньо була сформована толерантність до дії фенобарбіталу. Не відтворювалися ефекти фенобарбіталу, вальпроату натрію і топірамату у тварин, толерантних до карбамазепіну. У тварин, толерантних до вальпроату натрію, не проявлялася протисудомна активність фенобарбіталу, карбамазепіну і топірамату. Протисудомний ефект фенобарбіталу, карбамазепіну і вальпроату натрію не відтворювався при їх введенні тваринам, толерантним до дії топірамату. Разом з тим при використанні моделі електроіндукованих судом (МЕШ) не спостерігалося перехресної толерантності між фенобарбіталом, карбамазепіном і ламотриджином. Екстраполюючи отримані результати на проблеми клінічної епілептології, можна зробити висновок про те, що і в даному випадку виникають труднощі при лікуванні малих форм епілепсії. Пов’язано це з встановленим феноменом перехресної толерантності між різними антиконвульсантами, що проявляється в першу чергу на моделях хемоконвульсантних судом, які є експериментальною моделлю petit mal. У той же час перехресна толерантність на моделях генералізованих судомних припадків (МЕШ) не реєструється, принаймні між фенобарбіталом, карбамазепіном або ламотриджином. Для пояснення цього явища можна висунути гіпотетичне припущення, яке пов’язане з тим, що акумулювання антиконвульсантної активності визначалася їх дією на різні ланки генерації і проведення нервового імпульсу. Мова йде про можливість як синаптичного (дендро-аксональною), так і аксонального типу впливу протисудомних засобів. У такому випадку можна припустити, що епілептична клінічна форма petit mal розвивається переважно на синаптичному рівні, а генералізовані судомні напади пов’язані з патоморфологічними і патофізіологічними змінами аксонального проведення нервового імпульсу, що призводить до швидкого розповсюдження судомної активності по транскалозальних, комісуральних і асоціативних зв’язках структур головного мозку. У кінцевому підсумку це призводить до гіперсинхронізованого епілептогенного «вибуху» у вигляді розгорнутого великого судомного нападу. На синаптичному рівні антиконвульсанти пригнічують судомну активність шляхів активації ГАМК-ергічної передачі і відновлення співвідношення гальмівних ГАМК-ергічної і гліцинергічної систем мозку зі збуджуючою – глутаматергічною. Рецепторні процеси сенситизації/десенситизації досить рухливі і їх зміни можуть призводити до ефекту толерантності, а однакова мішень для дії різних антиконвульсантів, переважно ГАМК-ергічна, може визначати формування перехресної толерантності. Іонні механізми аксонального проведення нервового збудження більш консервативні. Тому на цьому рівні зниження їх чутливості потребує тривалішого впливу протисудомного засобу, а відсутність явища перехресної толерантності обумовлено, ймовірно, селективною дією антиконвульсантів на іонну провідність різних ділянок оболонок нервових провідників. Очевидно, у клінічній патофізіології епілепсії присутнє порушення вигляду і функції мієлінової оболонки нервових провідників. Про це опосередковано свідчать дані щодо наявності поліморфізму гена MOG-4 у хворих на епілепсію [261]. Враховуючи, що експресія MOG-4 пов’язана з біосинтезом основного білка мієліну, можна припустити наявність дисфункції мієлінової оболонки в нервових провідниках речовини головного мозку у даного контингенту хворих. У свою чергу дисфункція мієлінової оболонки порушує ізоляцію нервових провідників, що призводить до миттєвого електротонічного розповсюдження судомної активності. На електроенцефалограмі це реєструється у вигляді генералізованих судомних розрядів, що клінічно проявляється великим судомним нападом. Встановлені форми наявності толерантності і перехресної толерантності при тривалому застосуванні антиконвульсантів піднімають питання про розробку шляхів подолання терапевтичної резистентності і раціонального використання існуючих протисудомних препаратів. Терапевтичною основою визначення таких підходів можуть бути дослідження, спрямовані на вивчення можливих механізмів формування толерантності. Механізми зниження або припинення протисудомної дії антиконвульсантів, очевидно, пов’язані головним чинам зі змінами у різних ланках синаптичної передачі і/або особливостями фармакокінетики протисудомних засобів, які настають у результаті їх тривалого застосування. Проведені дослідження показали, що механізми протисудомної дії антиконвульсантів (фенобарбіталу, карбамазепіну, вальпроату натрію, топірамату, ламотриджину) пов’язані з їх впливом на патогенетичні нейромедіаторні ланки епілептогенезу. У першу чергу ГАМК-, глутамат-, гліцин- і серотонінергічної систем мозку. Це підтверджується тим, що досліджені антиконвульсанти у різній мірі вираженості попереджують судомну дію неконкурентних (коразол, пікротоксин) і конкурентних (бікукулін) ГАМК-рецепторів, блокатора синтезу ГАМК – тіосемікарбазиду, антагоніста гліцинових рецепторів – стрихніну і агоніста глутаматних рецепторів – каїнової кислоти, а також нівелюють серотонінергічні ефекти лібератора серотоніну – резерпіну. У тварин, толерантних до дії антиконвульсантів, не проявляється протисудомна дія, головним чином, до ГАМК-ергічних хемоконвульсантів – коразолу, пікротоксину, бікукуліну, тіосемікарбазиду. Ці дані є безперечним доказом участі ГАМК-ергічної системи у формуванні толерантності до дії антиконвульсантів. Можна припустити, що при тривалому застосуванні антиконвульсантів відбувається постійний, тонічний їх вплив на ГАМК-рецептори. Це призводить до втрати чутливості рецепторів, десенситизація яких припиняє їх здатність генерувати гальмівний постсинаптичний потенціал (ГПСП), в результаті чого протисудомна активність антиконвульсантів не відтворюється, що реєструється у вигляді толерантності, а у клінічному плані – терапевтичної резистентності. Серотонінергічна система, поряд з ГАМК-ергічною, забезпечує в нейрональних ансамблях головного мозку гальмівну фукцію. Тому активація серотонінергічної системи може бути фактором зниження судомної активності мозку і клініко-електроенцефалографічного припинення судомного нападу. Ряд антиконвульсантів, наприклад, фенобарбітал і вальпроат натрію, проявляють серотонінергічну дію, яка нівелюється в умовах сформованої толерантності до цих препаратів. Ці дані дають підставу зробити заключення про участь серотонінергічної системи у механізмах розвитку толерантності, зокрема, щодо фенобарбіталу і вальпроату натрію. Розвиток толерантності до антиконвульсантів при тривалому введенні може бути пов’язаний не тільки зі змінами в нейрохімічних механізмах їх дії, але з особливостями фармакокінетичних параметрів протисудомних препаратів у цих умовах. Зрозуміло, що зміна кількості молекул лікарського препарату в області його дії може бути причиною підвищення або зниження фармакологічної активності. Тому важливим є порівняння рівня антиконвульсантів у крові і мозку нетолерантних тварин і тварин, толерантних до дії протисудомних засобів. Встановлено, що при формуванні толерантності до дії карбамазепіну і вальпроату натрію, рівень цих препаратів у крові і мозку експериментальних тварин знижується до нуля, що власне пояснює відсутність протисудомної активності, тобто терапевтичної резистентності. Така ситуація можлива при зміні активності ферментів метаболізму лікарських препаратів, у першу чергу, ферментів системи цитохрому Р-450. У наших дослідженнях з використанням опосередкованого показника стану функціональної активності Р-450, а саме тривалості барбітуратного сну, виявлено, що у толерантних тварин карбамазепін і вальпроат натрію проявляють властивості вираженого індуктора Р-450. Нині вважається досить об’єктивним і прогресивним підхід, коли при тривалому застосуванні лікарського засобу, у тому числі антиконвульсантів, проводиться моніторинг концентраціі застосування препарату. Як показали наші дослідження, при формуванні толерантності, у крові різко знижується вміст карбамазепіну і вальпроату натрію. Здавалося б, що у такій ситуації для подолання терапевтичної резистентності необхідно збільшити дозу даних протисудомних засобів. Проте на фоні толерантності відбувається підвищення індуктивного впливу вальпроату натрію і карбамазепіну на активність ферментів Р-450, що ще в більшій мірі буде підсилювати метаболічну активацію цих препаратів. Ось чому навряд чи буде доцільним підвищення дози карбамазепіну і вальпроату натрію з метою подолання терапевтичної резистентності. Цей висновок підтверджується даними, згідно з якими підвищення дози карбамазепіну та вальпроату натрію на 50% від ефективної у нетолерантних тварин не проявляє протисудомної активності в умовах сформованої толерантності. Топірамат як у нетолерантних, так і у толерантних тварин проявляє властивості інгібітора Р-450. При розвитку толерантності вміст топірамату зростає у крові і мозку. Тому і в даному випадку невиправданим буде підвищення дози топірамату з метою подолання резистентності, тобто замість очікуваного терапевтичного ефекту можна лише підсилити прояви побічної і токсичної дії препарату. Припинення протисудомної дії топірамату при його тривалому введенні може бути пов’язане зі збільшенням концентрації топірамату в області синапса і постійного впливу на відповідні рецептори нейронів головного мозку, що є фактором десенситизації, а отже, зниження ГПСП (гальмівного постсинаптичного потенціалу). При розвитку толерантності до дії фенобарбіталу і ламотриджину, ці препарати проявляють властивості індукторів Р-450. Разом з цим концентрація фенобарбіталу і ламотриджину у крові і мозку зростає, що робить недоцільним підвищення дози фенобарбіталу і ламотриджину з метою подолання терапевтичної резистентності. Таким чином, на підставі отриманих результатів досліджень можна зробити заключення про те, що при тривалому введенні фенобарбіталу, карбамазепіну, вальпроату натрію, ламотриджину і топірамату формується толерантність до їх протисудомної дії. Більше того, встановлений факт наявності перехресної толерантності між вказаними антиконвульсантами. При цьому виявлені як загальні закономірності розвитку толерантності відносно всіх досліджуваних антиконвульсантів, так й індивідуальні відмінності в цьому плані для кожного протисудомного препарата. Пов’язано це з особливостями механізмів дії окремих антиконвульсантів і з своєрідністю їх метаболізму, опосередкованого у першу чергу ферментативною системою цитохрому Р-450. Отримані у цьому напрямку дані підтверджують вказані положення і експериментально обґрунтовують практичні рекомендації щодо конкретних підходів подолання терапевтичної резистентності при лікуванні різних клінічних форм епілепсії. ВИСНОВКИ Робота вирішує теоретичну і практичну задачу лікування резистентних форм епілепсії шляхом встановлення фармакодинамічних і фармакокінетичних ланок механізмів формування толерантності та експериментально обґрунтовує раціональне застосування антиконвульсантів за умов терапевтичної резистентності. 1. Тривале введення фенобарбіталу, карбамазепіну, вальпроату натрію, топірамату та ламотриджину призводить до розвитку толерантності до їх протисудомної дії на моделях хемоконвульсантних та електроіндукованих (МЕШ) судом. Найбільш швидко толерантність формується при використанні хемоконвульсантних моделей судом (коразол, тіосемікарбазид), які асоціюються з petit mal і реєструються через 7 діб при щодобовому введенні фенобарбіталу і 14 діб при введенні карбамазепіну, вальпроату натрію, топірамату. На моделі МЕШ, яка екстраполюється на grand mal, толерантність розвивається при 21-денному введенні фенобарбіталу і карбамазепіну та 14-денному введенні ламотриджину. 2. З використанням хемоконвульсантних моделей судом спостерігається розвиток прямої та зворотної перехресної толерантності між фенобарбіталом, карбамазепіном, вальпроатом натрію та топіраматом. У методиці МЕШ перехресна толерантність не реєструється між фенобарбіталом, карбамазепіном та ламотриджином. 3. При підвищенні доз антиконвульсантів на 50% відносно початкової дози, ефективної у нетолерантних тварин, та введенні в умовах сформованої толерантності, їх протисудомна активність не проявляється. 4. Нейрофармакологічний аналіз із застосуванням селективних аналізаторів (ГАМК-; гліцин-; глутамат- та серотонінергічної) синаптичної передачі, а саме пентилентетразола, пікротоксина, бікукуліна, тіосемікарбазида; стрихніна; каїнової кислоти та резерпіна показав важливу роль змін функціонування ГАМК-ергічної системи у механізмах формування толерантності до дії досліджуваних антиконвульсантів. При введенні пентилентетразолу та пікротоксину судомний синдром реєструється у 100% толерантних тварин, бікукуліну – у 62,5%, тіосемікарбазиду – у 80%. 5. Розвиток толерантності до дії антиконвульсантів при їх тривалому введенні формується на тлі суттєвих змін вмісту досліджуваних препаратів у крові та тканинах головного мозку. Карбамазепін і вальпроат натрію у толерантних тварин практично не визначається. Кількість інших антиконвульсантів зростає: фенобарбіталу на 57% у крові і на 49% у мозку, ламотриджину на 12% у крові і на 30% у мозку та топірамату на 46% у мозку. 6. Фенобарбітал, карбамазепін, вальпроат натрію та ламотриджин знижують на 56,2%, 23,9%, 35,3%, 54,1%, відповідно, а топірамат збільшує на 3,9% тривалість барбітуратного сну у тварин, толерантних до дії вказаних антиконвульсантів. Ці дані опосередковано свідчать про те, що фенобарбітал, карбамазепін, вальпроат натрію та ламотриджин у толерантних тварин проявляють властивості індукторів, а топірамат – інгібітора ферментів системи цитохрому Р-450. 7. Особливості та певні закономірності розвитку толерантності до дії протисудомних засобів визначаються як загальними, так і специфічними для кожного антиконвульсанта фармакодинамічними та фармакокінетичними механізмами формування терапевтичної резистентності, що повинно враховуватися у тактиці підходів лікування фармакорезистентної епілепсії. СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ 1. Мар’єнко Л.Б. Про сучасний стан класифікації епілептичних нападів та епілепсії / Л.Б. Мар’єнко // Клінічна фармація, фармакотерапія та медична стандартизація. – 2013. – № 2. – С. 130-136. 2. Мартинюк В.Ю. Епілепсія в сучасному суспільстві: від якісної медичної допомоги до соціальної адаптації / В.Ю. Мартинюк, С.М. Харчук, А.Є. Дубенко [та ін.] // Здоров’я України. – 2015. – [Електронний ресурс]. – Режим доступу: http://health-ua.com/stati/neurology/epilepsiya-v-suchasnomu-suspilstvi-vid-yakisnoyi-medichnoyi-dopomogi-do-sotsialnoyi-adaptatsiyi.html 3. Опрышко В.И. Исследование взаимодействия карбамазепина и тиотриазолина на модели фармакорезистентной эпилепсии / В.И. Опрышко // Запорожский медицинский журнал. – 2008. – № 4 (49). – С. 31-35. 4. French J.A. Refractory epilepsy: clinical overview / J.A. French // Epilepsia. – 2007. – V. 48 (Suppl 1). – P. 3-7. 5. Moshé S.L. Epilepsy: new advances / S.L. Moshé, E. Perucca, P. Ryvlin [et al.] // The Lancet. – 2015. – V. 385, № 9971. – P. 884-898. 6. Sirven J.I. Evaluation and management of drug-resistant epilepsy / J.I. Sirven // UpToDate. – 2016. – [Електронний ресурс]. – Режим доступу: http://www.uptodate.com/contents/evaluation-and-management-of-drug-resistant-epilepsy 7. Wilne A. Modern Treatment of Drug-Resistant Epilepsy / A. Wilne // Neurology Reviews. – 2015. – [Електронний ресурс]. – Режим доступу: http://www.neurologyreviews.com/home/article/modern-treatment-of-drug-resistant-epilepsy/59210366894c4275fa43fed6d77c2bc1.html 8. Карлов В.А. Фармакорезистентность и толерантность при эпилепсии / В.А. Карлов // Журнал неврологии и психиатрии. – 2008. – № 10. – С. 75-80. 9. Bodalia P.N. Comparative efficacy and tolerability of anti-epileptic drugs for refractory focal epilepsy: systematic review and network meta-analysis reveals the need for long term comparator trials / P.N. Bodalia, A.M. Grosso, R. Sofat [et al.] // Br J Clin Pharmacol. – 2013. – V. 76, № 5. – P. 649-667. 10. Swanborough N. Medication for epilepsy / N. Swanborough // Epilepsy society. – 2015. – [Електронний ресурс]. – Режим доступу: http://www.epilepsysociety.org.uk/medication-epilepsy 11. Эпилепсия. Информационный бюллетень, № 999. – ВОЗ, 2016. – [Електронний ресурс]. – Режим доступу: http://медулица.рф/news/voz/ epilepsiya.-informacionnyy-byulleten-999-fevral-2016/ 12. Карлов В.А. Эпилепсия у детей и взрослых женщин и мужчин: Руководство для врачей / В.А. Карлов. – М.: ОАО «Медицина», 2010. – 720 с. 13. Орос М.М. Можливості та перспективи фармакогенетики в лікуванні епілепсії / М.М Орос, В.І. Смоланка // Міжнародний неврологічний журнал. – 2012. – № 6. – С. 119-126. – Режим доступу: http://nbuv.gov.ua/j-pdf/Mnzh_2012_6_17.pdf 14. Löscher W. Drug resistance in epilepsy: Why is a simple explanation not enough? / W. Löscher, G.J. Sills // Epilepsia. –2007. – V. 48. – Р. 2370-2372. 15. Громов Л.А. Общие и частные проблемы терапевтической резистентности / Л.А. Громов // Рациональная фармакотерапия. – 2011. – № 2. – С. 13-17. 16. Балашов А.М. К вопросу о резистентности к фармакотерапии / А.М. Балашов // Журнал неврологии и психиатрии. – 2009. – № 1. – С. 90-91. 17. Дубенко А.Є. Деякі фармакогенетичні аспекти лікування хворих на епілепсію / А.Є. Дубенко, М.М. Орос, В.І. Смоланка // Здоров’я України. –2013. – № 12. – С. 22-24. 18. Cohen N. Pharmacogenomics and Personalized Medicine / N. Cohen. – Humana Press, 2010. – 528 p. 19. Liao G. A genomic “roadmap” to “better” drugs / G. Liao, X. Zhang, D.J. Clark [et al.] // Drug Metab Rev. – 2008. – V. 40, № 2. – P. 225-239. 20. Pandolfo M. Genetics of epilepsy / М. Pandolfo // Semin Neurol. - 2011. – V. 31 (5). – Р. 506-518. 21. Siddiqui A. Association of multidrug resistance in epilepsy with a polymorphism in the drug-transpor-ter gene ABCB1 / А. Siddiqui, R. Kerb., M.E. Weale [et al.] // N. Engl. J. Med. – 2011. – V. 348, № 15. – P. 1442-1448. 22. Tao H. Role of glyoxalase I gene polymorphisms in late-onset epilepsy and drug-resistant epilepsy / H. Tao, L. Si, X. Zhou [et al.] // Journal of the Neurological Sciences. – 2016. – [Електронний ресурс]. – Режим доступу: http://www.jns-journal.com/article/S0022-510X%2816%2930052-1/abstract 23. Литовченко Т.А. Резистентные эпилепсии: причины и методы лечения / Т.А. Литовченко // НейроNews. – 2010. – № 6. – С.21-26. 24. Рудакова И.Г. Фармакорезистентная эпилепсия поддается лечению / И.Г. Рудакова, Ю.А. Белова, А.С. Котов // Вестник эпилептологии. – 2013. – № 1. – С. 3-7. 25. Rogawski M.A. Intrinsic severity as a determinant of antiepileptic drug refractoriness / M.A. Rogawski, M.R. Johnson // Epilepsy Currents. – 2008. – V. 8. – Р. 127-130. 26. Конспект невролога. Часть 5: Эпилепсия / Редакторы-составители А.Ю. Заславский, Н.В. Куприненко. – Донецк: Издатель Заславский А.Ю., 2010. – 64 с. 27. Зенков Л.Р. Клиническая эпилептология (с элементами нейрофизиологии): Руководство для врачей / Л.Р. Зенков. – М.: ООО «Медицинское информационное агентство», 2010. – 408 с. 28. Pocock N. Evidence for tolerance to antiepileptic drugs / N. Pocock // Epilepsia. – 2006. – V. 47, № 10. – Р. 1253-1284. 29. Ochoa J.G. Antiepileptic Drugs / J.G. Ochoa // Medscape. – 2015. – [Електронний ресурс]. – Режим доступу: http://emedicine.medscape.com /article/1187334-overview 30. Fisher R.S. Epileptic seizures and epilepsy: definitions proposed by the International League Against Epilepsy (ILAE) and the International Bureau for Epilepsy (IBE) / R.S. Fisher, van E. Boas, W. Blume [et al.] // Epilepsia. – 2005. – V. 46, № 4. – P.470-472. 31. Brodie M.J. Fast facts: epilepsy / M.J. Brodie, S.C. Schachter, P. Kwan. – Oxford: Health Press, 2009. – 30 р. 32. Shorvon S.D. The treatment of epilepsy / S.D. Shorvon. – Oxford: Blackwell Publishers, 2009. – 966 р. 33. Мар’єнко Л.Б. Підсумки 9-го Європейського конгресу з епілептології (27 червня – 1 липня 2010 року, Греція, о. Родос) / Л.Б. Мар’єнко, В.І. Харитонов, С.К. Євтушенко. – 2010. – [Електронний ресурс]. – Режим доступу: http://www.mif-ua.com/archive/article/15008 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
