Кормление сельскохозяйственных живонтных. Химический состав кормов и физиологическое значение отдельных веществ
 Скачать 1.49 Mb. Скачать 1.49 Mb.
|
|
ГЛАВА 5. КОМПЛЕКСНАЯ ОЦЕНКА ПИТАТЕЛЬНОСТИ КОРМОВ 5.1. ПРОТЕИНОВАЯ ПИТАТЕЛЬНОСТЬ КОРМОВ К середине девятнадцатого века в исследованиях на животных были получены первые экспериментальные данные о неодинаковой питательности различных белков. Однако до начала двадцатого века продолжало существовать мнение, что протеины различных кормовых продуктов одинаковы по питательности. При этом для оценки белковой питательности корма необходимо было знать содержание в нем переваримого белка. И только благодаря классическим исследованиям Осборна, Менделя и академика Д.Н. Прянишникова была определена химическая природа белков. Установлено, что различные белки по своей питательности неодинаковы и обусловлено это их аминокислотным составом и структурой. В дальнейших исследованиях авторам удалось установить благоприятное воздействие аминокислот триптофана и лизина на рост лабораторных животных при добавлении их к основному рациону, состоящему из неполноценного белка зерна кукурузы. Значительный вклад в выяснение влияния отдельных аминокислот на рост животных внес Роуз (1936). Им были установлены незаменимые аминокислоты и доказана возможность замены кормового протеина смесями чистых аминокислот в питании животных. Первые данные об аминокислотном составе кормов в нашей стране были получены в 1934 году Д.Н. Прянишниковым. В последующем под руководством академика И. С. Попова были составлены и опубликованы в 1962 г. таблицы по аминокислотному составу различных кормов. Протеиновая питательность кормов определяется качеством протеина, которое для свиней и птицы характеризуется уровнем, соотношением и доступностью незаменимых аминокислот, а для жвачных животных - растворимостью, расщепляемостью и аминокислотным составом белков. Следовательно, под протеиновой питательностью следует понимать свойство корма удовлетворять потребность животных в аминокислотах. Протеиновую питательность кормов измеряют для жвачных животных в сыром и переваримом протеине, а для свиней и птицы - в сыром, переваримом протеине и аминокислотах. 53 Наукой и практикой животноводства накоплен большой фактический материал о неодинаковой питательной ценности протеина разных кормов. Для оценки качества протеина кормов предложено много биологических и химических методов. Основным способом определения качества протеина является биологический метод, который позволяет определить биологическую ценность протеинов или белков при скармливании растущим животным на фоне стандартного рациона и их влиянии на синтез белков в организме и приросты массы тела. Впервые биологический метод оценки качества протеина предложен Томасом-Митчеллом (1924, 1944). В основе метода лежит определение отложенного азота (в %) в организме животного, используемого на поддержание жизни и рост, который определяется по формуле: 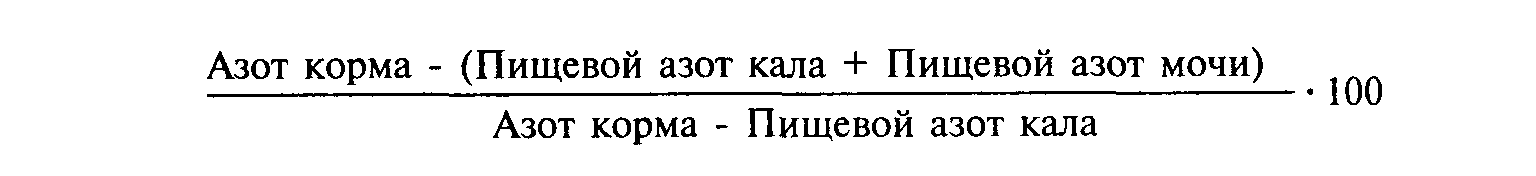 Используя данный метод в опытах на свиньях, получили следующие показатели биологической ценности белков отдельных кормов: молоко - 84-95, казеин молока - 78-92, рыбная мука - 74, ячмень - 71, кукуруза - 54, соевый шрот - 67, льняной шрот - 61, картофель - 73, люпин - 55 и сено люцерновое, клеверное -79-81. Однако надо отметить, что применение метода Томаса-Митчелла для определения биологической ценности протеинов является очень сложным и основано на двух независимых формах белкового обмена в организме животного (экзогенном - распаде кормового протеина и эндогенном - распаде тканевых белков), что является неверным (И.С. Попов, 1957). В нашей стране Всероссийским научно-исследовательским институтом животноводства разработан способ определения биологической ценности протеина различных кормов (1967), основанный на балансе азота в организме животного: Коэффициент использования протеина корма показывает степень использования переваренного азота в организме животного и характеризует биологическую ценность протеина. Наряду с биологическими методами оценки питательности протеина кормов существуют и химические методы, основанные на определении аминокислотного состава протеинов методом хроматографических и микробиологических анализов. Один из 54 таких методов предложили Блок и Митчелл (1946), в основе которого лежит сравнительный анализ аминокислотного состава протеина кормов и белков яйца. Исследованиями установлена высокая степень корреляции между аминокислотным составом протеина и данными, полученными в опытах на животных. Мак-Лаугланом и др. (1963) разработан более упрощенный химический метод, позволяющий оценивать питательность протеина кормов по сравнительному содержанию в них и в полноценном белке яйца лизина, метионина и лейцина. Приведенные выше методы оценки питательной ценности протеина кормов имеют один очень существенный недостаток, связанный с отсутствием данных о доступности аминокислот тех или иных протеинов для животных разных видов, разного направления продуктивности, возраста, физиологического состояния и особенностей белкового обмена в организме в зависимости от способов и технологии заготовки кормов, их хранения и подготовки к скармливанию. Поступающие в пищеварительный тракт животного белки растительного, микробного и животного происхождения представляют собой сложные полимерные химические соединения, состоящие из 22 аминокислот различного сочетания. Перевариваются кормовые белки неодинаково. Наибольшей переваримостью отличаются протоплазматические белки, а наименьшей - белки ядерных элементов растительных, микробных и животных клеток. Аминокислоты протеинов натуральных кормов и микробиологического синтеза представляют собой оптически активные /-формы и используются организмом животного на синтез собственно белков. Аминокислоты химического синтеза представлены двумя оптическими изомерами - / и rf-форм, uf-формы аминокислот биологически не активны и разрушаются в организме. На переваримость протеина отдельных кормовых средств, в частности зерен бобовых растений (сои, гороха и др.), оказывают отрицательное влияние содержащиеся в них ингибиторы, которые снижают активность протеолитических ферментов. Разрушение ингибиторов протеолитических ферментов бобовых зерновых достигается методом их тестирования - нагревания до 100° С при высоком давлении. Образовавшиеся в процессе переваривания протеина кормов различные аминокислоты всасываются в кровь и используются в основном животными для образования необходимых аминокислот в процессе биосинтеза собственных белков. Неиспользованные аминокислоты дезаминируются, освободившиеся аминные группы идут на синтез мочевины или мочевой кислоты (у птиц) и гиппуровой кислоты (у лошадей), которые выводятся с мочой 55 из организма, остатки аминокислот после дезаминирования используются организмом для энергетических целей. Из двадцати двух аминокислот, необходимых для жизнедеятельности животного организма, синтезируется в достаточном количестве только половина из них. Эти аминокислоты считаются заменимыми. Другие же аминокислоты не синтезируются в организме животного и считаются незаменимыми (табл. 15). 15. Классификация аминокислот Незаменимые Заменимые Аргинин, валин, гистидин, изолеи- Аланин, аспарагиновая кислота, цин, лейцин, лизин, метионин, глутаминовая кислота, глицин*, триптофан, треонин, фенилаланин пролин, серин, тирозин, цитрулин, цистин**, цистеин * Глицин - незаменимая аминокислота только в питании цыплят. ** Цистин - полузаменимая серосодержащая аминокислота, она может заменить на 30-50% в обмене белков организма незаменимую серосодержащую аминокислоту - метионин. Поэтому для обеспечения максимального роста молодых животных или получения наивысшей продуктивности они должны быть обеспечены полноценным кормовым белком, содержащим все необходимые незаменимые аминокислоты. Такие протеины являются наиболее биологически ценными. Из всех незаменимых аминокислот наиболее дефицитными по уровню содержания в протеинах кормов растительного происхождения являются лизин, метионин+цистин и триптофан. Эти аминокислоты получили название критических или особо незаменимых и имеют очень важное значение в питании животных (табл.16). 16. Содержание критических незаменимых аминокислот в протеинах организма животного и кормовых средств, % (по В.Н. Баканову и В. К. Менъкину, 1989)
Продолжение табл. 16
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
