История урологии
 Скачать 6.12 Mb. Скачать 6.12 Mb.
|
|
Основной скрининговый тест для выявления РПЖ - определение ПСА. Последний представляет собой гликопротеин серин-протеазу, которая в норме продуцируется в протоках и ацинусах предстательной железы. Большая часть его попадает в семенной проток, участвуя в разжижении спермы. Не более 0,1 % от всего количества проникает в кровь, где у большинства здоровых мужчин его концентрация не превышает 4 нг/мл. ПСА является не онко-, а орга-носпецифичным маркером (специфичность 92 %, чувствительность 72 %). Его уровень зависит от возраста и может повышаться у больных с ДГПЖ, при острой задержке мочеиспускания, остром простатите, после эякуляции, массажа простаты, катетеризации мочевого пузыря и хирургических вмешательств на предстательной железе. В связи с этим рекомендуется определять ПСА до пальцевого ректального исследования предстательной железы. Высокие значения ПСА указывают на вероятность РПЖ, но не означают, что у больного имеется данное заболевание. Даже при ПСА менее 4 нг/мл вероятность развития РПЖ колеблется от 10 до 20 %, а в диапазоне так называемой серой зоны - от 4 до 10 нг/мл - он выявляется в 30-35 %. При превышении ПСА 10 нг/мл риск выявления РПЖ возрастает до 60-65 %. Более важно не однократное, а динамическое определение ПСА. Время удвоения и скорость роста ПСА являются наиболее точными предсказателями РПЖ и служат показаниями к биопсии простаты. ПСА используется не только для диагностики, но и для наблюдения за эффективностью лечения. Увеличение ПСА (биохимический рецидив) выше минимального значения, достигнутого после радикального лечения, свидетельствует о местном рецидиве РПЖ или появлении метастазов.
Недостаточная специфичность ПСА и необходимость биопсии предстательной железы с целью верификации диагноза привела к необходимости поиска новых методов диагностики РПЖ. Молекулярно-генетические исследования позволили найти новый маркер этого заболевания, а именно РСА 3 (Prostate cancer antigen 3) - продукт гена DD3, гиперэкспрессия которого определяется в 95 % опухолевых клеток. Он обнаруживается в моче больных с РПЖ, полученной после массажа предстательной железы (рис. 11.40). РСА3 в отличие от ПСА  Рис. 11.40. Методика определения РСА3: 1 - массаж предстательной железы, 2 - порция мочи, полученная после массажа; 3 - взятие мочи для ее исследования на РСА3 является специфическим маркером РПЖ и позволяет со значительно большей точностью отобрать пациентов для выполнения биопсии простаты. В анализах крови в зависимости от стадии заболевания выявляются анемия, повышение СОЭ, в моче - гематурия, а с присоединением инфекции - лейко-цитурия, ложная протеинурия. При исследовании эякулята может обнаруживаться большое количество эритроцитов (гемоспермия). Основными методами визуализации предстательной железы являются различные модификации УЗИ, КТ, МРТ, которые помогают установить окончательный диагноз и стадию заболевания. Трансректальное УЗИ является стандартным методом диагностики РПЖ. Классический эхографический признак РПЖ - гипоэхогенные участки в периферической зоне простаты (рис. 11.41). Прорастание опухоли в семенные пузырьки и мочевой пузырь определяется в виде нарушения структуры указанных органов (рис. 11.42). 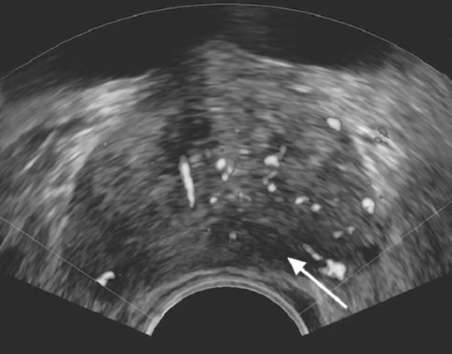 Рис. 11.41. Трансректальная сонограмма. РПЖ (стрелка) 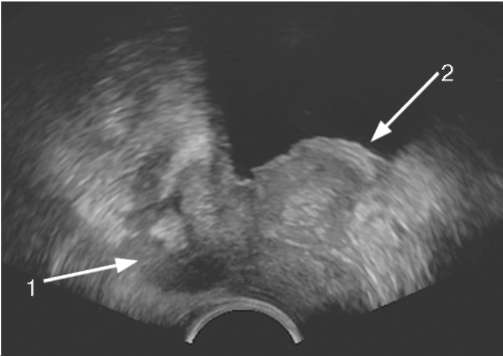 Рис. 11.42. Трансректальная сонограмма. РПЖ с инвазией в семенные пузырьки (1) и стенку мочевого пузыря (2) По сравнению с ректальным пальцевым исследованием данный метод обладает более высокой чувствительностью и прогностической ценностью. Трехмерная трансректальная сонография с использованием цветовой и усиленной доплерографии в режиме реального времени позволяет получить объемное изображение простаты и оценить ее кровоснабжение (рис. 64, 65, см. цв. вклейку).
КТ недостаточно информативна в ранней диагностике РПЖ, так как ткань неизмененной простаты и опухоли по своей плотности практически не отличаются друг от друга. Ее применяют для выявления регионарных (тазовые лимфоузлы) и отдаленных (кости, легкие) метастазов у пациентов с гистологически подтвержденным РПЖ. Значение позитронной эмиссионной томографии в ранней диагностике РПЖ до конца не изучено. Из-за низкой метаболической активности злокачественные клетки плохо накапливают изотоп и мало отличаются от неизмененных участков простаты. Метод показал свою эффективность при диагностике регионарных и отдаленных метастазов до и после радикальной простатэктомии. МРТ за счет различной интенсивности сигнала от мягких тканей таза дает более четкое изображение мочевого пузыря, семенных пузырьков, простаты, прямой кишки и окружающей клетчатки. Именно поэтому она применяется для диагностики ранних стадий РПЖ, а также с целью уточнения локализации и распространенности опухоли (прорастание за пределы простаты, метастазы в регионарные лимфатические узлы и кости). МРТ с эндоректальным датчиком позволяет повысить точность стадирования РПЖ. Одновременная магниторезонансная спектроскопия простаты дает возможность получить изображения, отражающие концентрацию метаболитов в простате (томография по химическим сдвигам).  Рис. 11.43. Трансректальный ультразвуковой датчик (1) с направляющей насадкой (2) для иглы и биопсийный пистолет (3)  Рис. 11.44. Игла для выполнения биопсии предстательной железы 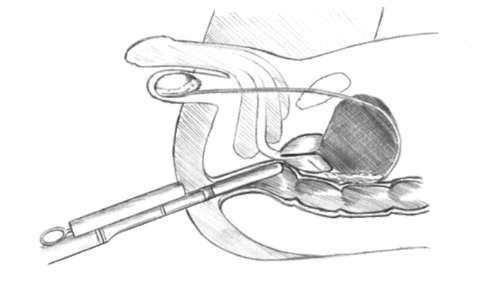 Рис. 11.45. Трансректальная мультифокальная биопсия предстательной железы Остеосцинтиграфия и рентгенография костей выполняются для выявления костных метастазов у больных с установленным РПЖ. Окончательно установить диагноз и стадию РПЖ позволяет мультифо-кальная биопсия предстательной железы специальной иглой через прямую кишку под контролем трансректального ультразвукового датчика (рис. 11.43,
11.44, 11.45). Подготовка к биопсии предстательной железы заключается в про- филактическом назначении антибактериальных препаратов и очистительной клизмы. Как правило, ее выполняют под местной анестезией (парапростати-ческая блокада 2% раствором лидокаина или введение геля с анестетиком в прямую кишку). Количество вколов и полученного биопсийного материала варьирует от 12 до 14 (рис. 11.46). При больших объемах предстательной железы или необходимости повторного исследования выполняют сатурационную биопсию, включающую 24 и более вколов. Трансректальная биопсия позволяет установить патоморфологиче-ский диагноз, определить объем, распространенность и степень дифференци-ровки (по шкале Глисона) опухоли. Показаниями к первичной биопсии простаты являются: ПСА более 4 нг/мл, выявление подозрительных участков при пальцевом ректальном исследовании, наличие гипоэхогенных зон при трансректальной соно-графин, скорость прироста ПСА более 0,75 нг/мл в год и время удвоения его менее 12 мес. Повторную биопсию простаты выполняют при простатической инт-раэпителиальной неоплазии высокой степени, отрицательных результатах первичной биопсии, отсутствии снижения ПСА после антибактериальной терапии при хроническом простатите и сохраняющихся показаниях к данному исследованию. Осложнения трансректальной пунк-ционной биопсии простаты встречаются нечасто. К ним относятся обострение инфекционного процесса в предстательной железе и мочевыводящих путях, повреждение мочеиспускательного канала, мочевого пузыря, семенных пузырьков, проявляющееся болями в промежности, гематурией, гемоспер-мией и в редких случаях образованием парапростатических гематом.  Рис. 11.46. Количество и локализация вколов при биопсии предстательной железы
Лечение РПЖ разделяется на консервативное и оперативное. Консервативная терапия включает назначение медикаментозных препаратов, применение лучевой терапии и малоинвазивных высокотехнологичных методов лечения. Динамическое наблюдение (отсроченное лечение) оправдано за пожилыми больными при выявлении локализованного (T1-T2b, N0, M0) высокоили умеренно дифференцированного (G≤ 7) РПЖ с высоким риском смерти от сопутствующих заболеваний и ожидаемой продолжительностью жизни менее 10 лет. Опухолеспецифическая выживаемость этих пациентов в течение 10 лет составляет 87 %, а при низкодифференцированных опухолях - 34 %. Активное наблюдение проводится за больными с локализованным РПЖ (T1-T2b, N0, M0) и низким риском прогрессирования (G ≤ 7, ПСА < 10-20 нг/мл). При этом вопрос о радикальном лечении остается открытым. Появление признаков про-грессирования заболевания (удвоение ПСА в сроки от 2 до 4 лет или увеличение G > 7 в период от 1 до 4 лет) делает его целесообразным. Медикаментозная терапия включает назначение гормональных препаратов. Прием их увеличивает выживаемость и улучшает качество жизни больных. Гормонотерапию, которая направлена на андрогенную депривацию, используют как самостоятельный метод, так и в сочетании с лучевым или оперативным лечением, то есть она является составной частью комбинированного лечения РПЖ. Андрогенная депривация включает применение: 1) двусторонней орхэктомии; 2) агонистов лютеинизирующего рилизинг-гормона; 3) эстрогенов; 4) антиандроге-нов; 4) максимальной (комбинированной) андрогенной блокады. Двусторонняя орхэктомия (хирургическая кастрация) - основной способ («золотой стандарт») гормональной депривации при РПЖ. Основными показаниями к ней являются невозможность проведения радикального лечения при локализованной опухоли (Т1-2N0M0); местно-распространенный (T3-4N0M0) и метастатический РПЖ (T1-4N1M0N1-4N0M1). К преимуществам двусторонней орхэктомии относятся быстрое снижение концентрации тестостерона в сыворотке крови (концентрация его падает на 95 % в течение 3-12 ч), простота выполнения и низкая стоимость лечения. Двусторонняя орхэктомия эффективна у 80-85 % больных с первично выявленным гормонально-чувствительным РПЖ. Ее побочные действия и осложнения включают перепады артериального давления, остеопороз, мышечную гипотонию, нарушения липидного обмена, гинекомастию и нервно-психические расстройства.
В качестве медикаментозной терапии назначают агонисты лютеинизирующего рилизинг-гормона - синтетические аналоги нативного гипоталамического лютеинизирующего рилизинг-гормона. После введения этих препаратов отмечается кратковременное повышение концентрации тестостерона на 3-5-й день (синдром вспышки) с последующим снижением ее на 21-28-й день до посткастрационного уровня. Для профилактики синдрома вспышки у больных с метастатическим РПЖ перед введением агониста лютеинизирующего рили-зинг-гормона и в течение первой недели терапии назначают антиандрогены. Показания, побочные эффекты и осложнения данного вида лечения такие же, как при двусторонней орхэктомии. Кроме того, он используется в качестве нео-адъювантной терапии перед радикальным оперативным или лучевым лечени- ем. Основными агонистами лютеинизирующего рилизинг-гормона являются гозерелин, трипторелин и бусерелин. Эстрогены были первой группой гормональных препаратов, которые стали применять для лечения РПЖ, однако они обладают выраженными побочными эффектами, наиболее опасным из которых является кардиоваскулярная токсичность. В связи с этим лечение эстрогенами в настоящее время в клинической практике используют редко. Наиболее эффективный препарат этой группы - диэтилстильбэстрол. Антиандрогены являются конкурентами тестостерона и дегидротестос-терона на уровне рецепторов предстательной железы. Блокируя действие андрогенов, они вызывают апоптоз и угнетают рост опухоли. Различают стероидные (ципротерон - по 100-150 мг/сут или по 250-300 мг/сут внутрь ежедневно, мегестрол, хлормадинон) и нестероидные (флутамид - по 250 мг 3 раза в сутки перорально; нилутамид - по 150 мг 2 раза в сутки перорально в течение 4 нед, в дальнейшем в дозе 150 мг/сут; бикалутамид - по 50 или 150 мг/сут перорально ежедневно) антиадрогены. К их побочным эффектам относятся сердечно-сосудистые осложнения, снижение либидо и потенции, гинекомастия, болезненность грудных желез и гастроинтестинальные расстройства.
Гормональная терапия эффективна у 80-90 % пациентов с РПЖ и позволяет добиваться ремиссии заболевания или стабилизации опухолевого процесса в течение длительного времени. Из средств консервативной терапии РПЖ наибольший эффект оказывает максимальная андрогенная блокада, которая заключается в сочетании хирургической или медикаментозной кастрации с назначением антиандрогенов. Гормонорефрактерный (резистентный к гормональной терапии) РПЖ развивается в результате потери зависимости опухолевых клеток от уровня тестостерона из-за мутации андрогенных рецепторов, гиперэкспрессии андрогенных рецепторов вследствие амплификации генов, стимуляции рецепторов факторами роста и активаторами протеинкиназы. Такая форма РПЖ плохо поддается лечению и имеет неблагоприятный прогноз. Средняя продолжительность жизни больных не превышает 6-12 мес. Для его лечения применяют различные варианты терапии, направленные на патогенетические механизмы развития гормон-рефрактерности: отмену или замену антиандрогенов, назначение препаратов, блокирующих синтез андрогенов надпочечников (кетоконазол, ами-ноглутатемид), назначение больших доз антиандрогенов (бикалутамид в дозе 150 мг), ингибиторов факторов роста и протеинкиназы. Используют также моно- и полихимиотерапию (эстрамустин, винбластин, этопозид, доцетаксел, цисплатин, доксорубицин) в различных режимах. Лучевая терапия широко применяется при любых стадиях РПЖ как в качестве самостоятельного метода, так и в сочетании с медикаментозным и оперативным лечением. Цель лучевой терапии - максимально точное достижение терапевтической дозы ионизирующего излучения в ткани предстательной железы при минимальном воздействии на окружающие органы и ткани. Среди существующих методов радиационного лечения лучшим считается трехмерная конформная дистанционная лучевая терапия с модуляцией интенсивности
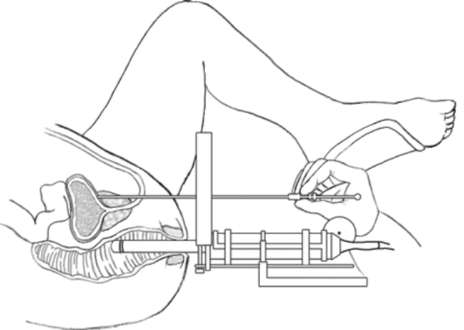 Рис. 11.47. Промежностная брахитерапия излучения. Она позволяет максимально увеличить суммарную дозу облучения - до 86 Гр с учетом индивидуальных границ и формы простаты, точно и равномерно распределить ее по всему объему органа. В результате удается существенно уменьшить лучевую нагрузку на мочевой пузырь и прямую кишку и тем самым значительно сократить число осложнений, характерных для стандартной (конвенциальной) дистанционной лучевой терапии. Рецидивом болезни после проведенной лучевой терапии принято считать три последовательных повышения уровня ПСА после минимального его значения, достигнутого по окончании лучевой терапии. Промежностная брахитерапия (рис. 11.47), являясь одним из видов лучевой терапии, в то же время открыла эру новых высокотехнологичных и малоинва-зивных методов лечения РПЖ. Она показана при местно локализованном раке простаты и органе небольших размеров. Брахитерапия заключается в имплантации в предстательную железу радиоактивных микроисточников (зерен), что обеспечивает длительное внутритканевое лучевое воздействие на опухоль. Применяют временную (высокодозную) и постоянную (низкодозную) бра-хитерапию. Для временного введения используют изотоп 192Ir; после подведения необходимой дозы к предстательной железе радиоактивные иглы удаляют. Высокодозную брахитерапию используют при местно-распространенном РПЖ (T3N0M0) в сочетании с дистанционным облучением. Постоянную брахитерапию применяют при локализованном РПЖ (T1c-Т2a, ПСА < 10 нг/мл, G < 7) и объеме простаты более 50 см3. В предстательную железу вводят радиоактивные зерна (гранулы) 125I, а реже 103Pd. Благодаря более гомогенному распределению ионизирующего излучения брахитерапия позволяет подвести более высокую суммарную очаговую дозу непосредственно к предстательной железе с меньшим лучевым воздействием на окружающие ткани, чем при дистанционной лучевой терапии.
Радиоактивные источники внедряют через промежность под контролем трансректального УЗИ (рис. 11.48) или компьютерного томографа. Обзорная рентгенограмма костей таза позволяет определить количество, локализацию и распределение радиоактивных зерен, имплантированных в предстательную железу (рис. 11.49). Брахитерапия противопоказана при опухолях с плохим прогнозом сумма баллов по шкале Глисона > 7), объеме предстательной железы более 50 см3. При наличии инфравезикальной обструкции и больших размерах простаты ее проводят с предварительной ТУР большей части объема простаты. У больных с местно-распространенным РПЖ брахитерапию выполняют только в комбинации с дистанционным облучением, при этом радиоактивные источники имплантируют через 2 нед после наружной лучевой терапии. 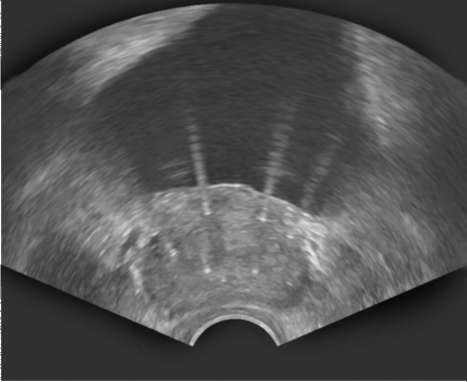 Рис. 11.48. Трансректальная сонограмма после проведения промежностной брахитерапии РПЖ. В ткань предстательной железы имплантированы радиоактивные микроисточники 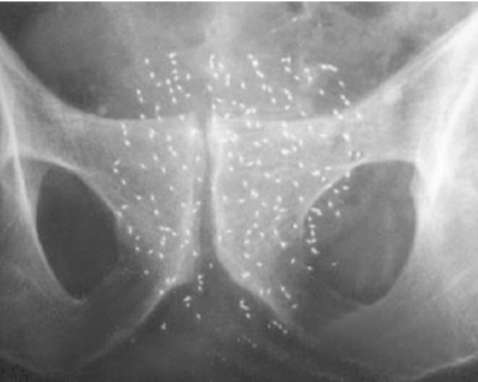 Рис. 11.49. Обзорная рентгенограмма костей таза после проведения промежностной брахитерапии РПЖ. Множественные радиоактивные зерна в предстательной железе К наиболее частым осложнениям лучевой терапии относятся гематурия, недержание мочи и пострадиационные уретрит, цистит, проктит. Высокотехнологичным методом лечения РПЖ является высокофокусиро-ванная ультразвуковая аблация предстательной железы (High Intensity Focused Ultrasound - HIFU) (рис. 11.50). Она также используется при локализованном раке с небольшим объемом предстательной железы и является альтернативой брахитерапии и радикальной простатэктомии. Ультразвуковая абла-ция заключается в фокусировании генерируемых эндоректальным датчиком ультразвуковых волн на ткань предстательной железы. При этом происходят локальное повышение температуры (до 100 °С) и некроз клеток в зоне воздействия.
У пациентов с локализованным РПЖ и небольшим ее объемом лучевые методы лечения (брахитерапия) и высокофокусированная ультразвуковая терапия по своим результатам приближаются к радикальной простат-эктомии. Хирургическое лечение. Радикальное оперативное лечение локализованного РПЖ заключается в удалении единым блоком предстательной железы с семенными пузырьками, простатическим отделом мочеиспускательного канала, парапростатичес-кой жировой клетчаткой, фасциями, а также в расширенной лимфаденэк-томии. Данная операция показана  Рис. 11.50. Лечение пациента с РПЖ сфокусированным ультразвуком на аппарате Ablatherm пациентам с локализованным РПЖ (T1b-T2N0M0), низким и промежуточным риском прогрессирования (G ≤ 7, ПСА < 20 нг/мл) и ожидаемой продолжительностью жизни более 10 лет. Дискутабельным остается вопрос о ее выполнении с паллиативной целью при локально инвазивном РПЖ (Т3) для удаления основной массы опухоли и повышения эффективности консервативных методов лечения. В настоящее время в зависимости от доступа и используемого оборудования различают позадилонную, промежностную, лапароскопическую и роботассистированную радикальную простатэктомию. Радикальная про-статэктомия вне зависимости от доступа и объема органа в настоящее время является основным и наиболее эффективным методом лечения локализованного РПЖ. Среди открытых операций наибольшее распространение получила позадилонная простатэктомия, которая в отличие от промежност-ной позволяет достичь лучшей визуализации операционного поля, широко, в пределах здоровых тканей, удалить простату вместе с семенными пузырьками, дистальными отделами семявыносящих протоков, жировой клетчаткой и, что немаловажно, выполнить тазовую лимфодиссекцию. Лучшей модификацией ее является разработанная P. Walsh в 1982 году техника, позволяющая сохранить сосудисто-нервные пучки и тем самым уменьшить кровопотерю, достичь лучшего удержания мочи и сохранить потенцию.
За последние годы в результате внедрения в урологию современного высокотехнологичного оборудования все чаще радикальную простатэктомию стали выполнять лапароскопическим или роботассистированным способом (рис. 70, см. цв. вклейку). Осложнениями радикальной простатэктомии являются кровотечения, травма прямой кишки, стриктура уретроцистоанастомоза, недержание мочи и эректильная дисфункция. Прогноз и послеоперационное наблюдение. Прогноз при ранних стадиях опухоли, своевременном и адекватном лечении благоприятный. Пятилетняя безрецидивная выживаемость больных с I-II стадией РПЖ после проведения радикального лечения (радикальной простатэктомии или лучевой терапии) составляет 70-90 %, общая выживаемость - 85-97 %. При выявлении заболевания на стадии метастазирования средний период до прогрессирования процесса на фоне лечения составляет 24-36 месяцев. Вне зависимости от стадии заболевания и вида лечения за всеми больными РПЖ следует проводить послеоперационное диспансерное наблюдение. Оно предусматривает регулярные, каждые 3 месяца в течение первого года, а в последующем каждые 6 месяцев, посещения врача - уролога-онколога. При каждом визите пациенту проводят пальцевое ректальное исследование, выполняют определение уровня ПСА, клинические, биохимические анализы крови, мочи и сонографию. Повышение уровня ПСА после радикальной про-статэктомии более 0,2 нг/мл требует особой настороженности и более тщательного обследования пациента, так как может свидетельствовать о рецидиве заболевания. 11.7. ОПУХОЛИ ЯИЧКА И ЕГО ПРИДАТКА Эпидемиология. Опухоли яичка составляют 1-2 % всех злокачественных новообразований у мужчин в возрасте от 14 до 44 лет и являются основной причиной смерти от онкологических заболеваний в этой возрастной группе. Риск развития рака яичка наиболее высок у молодых мужчин в возрасте 20-30 лет.
В России заболеваемость раком яичка составляет 0,5 % от всех злокачественных новообразований у мужчин и 4,1 % от злокачественных опухолей мочеполовой системы. Этиология и патогенез. Основными факторами риска развития рака яичка являются 1) эндокринные факторы (за счет влияния эстрогенов в период внутриутробного развития гонад или их повышенного содержания в окружающей среде, загрязненной пестицидами); 2) крипторхизм, инфекционно-воспалительные заболевания и травмы, приводящие к атрофии яичка; 3) генетические факторы. У атрофированных яичек снижается выработка тестостерона, что по механизму отрицательной обратной связи стимулирует гормональную активность гипоталамуса. Повышение уровня гонадотропина сопровождается увеличением частоты мутаций и развитием герминогенных опухолей. Крипторхизм увеличивает вероятность развития рака яичка в 5 раз и более. При двусторонней аномалии этот риск увеличивается в 10 раз. Травма как фактор риска развития рака яичка способствует образованию опухоли за счет выделяющихся в посттравматическом периоде цитокинов. Имеются данные о высокой вероятности развития рака яичка у ближайших родственников. Классификация. Гистологически, согласно классификации ВОЗ, выделяют: ■ герминогенные опухоли (развивающиеся из семенного эпителия) - семи-ному, сперматоцитарную семиному, эмбриональный рак, опухоль желточного мешка, полиэмбриому, хорионэпителиому, тератому; ■ опухоли стромы полового тяжа (негерминогенные опухоли) - лейдигому, сертолиому, гранулезноклеточную опухоль; ■ смешанные опухоли. Герминогенные опухоли яичка составляют 90-95 % от всех его новообразований, около половины из них приходится на семиномы. В клинической практике наиболее важно разделение всех герминогенных опухолей яичка на семиномы и несеминомы, что существенно влияет на выбор тактики лечения.
Симптоматика и клиническое течение. Симптомы опухолей яичка включают местные и общие проявления заболевания. В начальных стадиях оно может протекать бессимптомно. К местным признакам относятся увеличенная соответствующая половина мошонки за счет пальпируемой округлой, плотной, малоболезненной опухоли, в которой плохо дифференцируется придаток яичка, инфильтрация семенного канатика, увеличенные паховые лимфатические узлы. По мере увеличения размера яичка присоединяется болевой синдром. Боли локализуются в соответствующей половине мошонки и иррадиируют по ходу семенного канатика. К общим симптомам относятся слабость, утомляемость, снижение массы тела, а также проявления заболевания, обусловленные метастазами опухоли в различные отдаленные лимфатические узлы. При физикальном обследовании можно выявить метастазы в надключичные лимфатические узлы, а также пальпировать их конгломерат через переднюю брюшную стенку. При поражении лимфатических узлов средостения больной жалуется на одышку, кашель. Сдавливание этими увеличенными узлами нижней полой вены и проходящих рядом лимфатических сосудов приводит к отекам нижних конечностей. Негерминогенные опухоли яичка могут протекать с дисгормональными нарушениями. У детей наблюдаются гирсутизм, преждевременное развитие костной и мышечной систем, частые эрекции, преждевременное закрытие зон роста костей. Эти симптомы связаны с гиперпродукцией андрогенов опухолью. У взрослых опухоль также проявляется симптомами эндокринного дисбаланса, однако при этом отмечается феминизация: гинекомастия, снижение либидо, эректильная дисфункция. Это связано с выработкой опухолью эстрогенов. Диагностика и дифференциальная диагностика. Новообразование яичка выявляется по данным объективного исследования, сонографии и определения опухолевых маркеров сыворотки крови.
Пальпация органов мошонки позволяет оценить размеры, консистенцию новообразования, его связь с придатком яичка, кожей мошонки. С помощью диафаноскопии можно отличить увеличение мошонки в результате тканевого образования от жидкостного, каким является гидроцеле (рис. 84, см. цв. вклейку). УЗИ мошонки выявляет новообразования яичка даже размерами 1-2 мм. Семиномные опухоли характеризуются гипоэхогенностью и четкими очертаниями, им не свойственны кистозные включения. Несеминомные опухоли визуализируются в виде полиморфных образований, часто содержащих кистоз-ные включения и кальцинаты. Большое значение для диагностики опухолей яичка имеют три основных он-комаркера: α -фетопротеин (АФП), β-субъединица хорионического гонадотропина (βХГ) и лактатдегидрогеназа (ЛДГ). Определение их уровня в сыворотке крови позволяет диагностировать опухоль яичка на ранних стадиях, выработать так- тику лечения, оценить его эффективность и контролировать вероятность развития рецидивов заболевания. Лучевые методы диагностики и МРТ дают возможность установить стадию заболевания, выявить локализацию и распространенность метастазов в забрюшинные лимфоузлы (рис. 11.51) и органы, а также провести дифференциальный диагноз с другими заболеваниями органов мошонки. Опухоли яичка следует дифференцировать с гидроцеле, орхоэпи-дидимитом, перекрутом яичка. Реже опухоль яичка могут симулировать паховая грыжа, сперматоцеле, гематома. 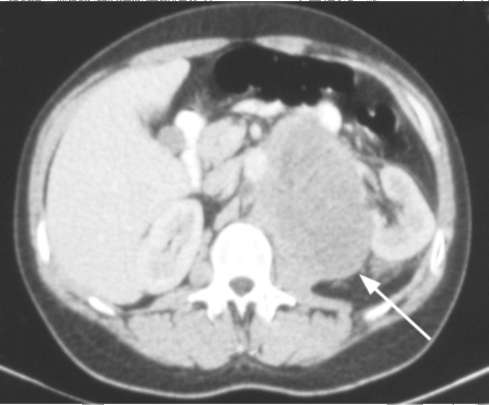 Рис. 11.51. КТ. Метастатическое поражение забрюшинных лимфоузлов при опухоли яичка (стрелка) Лечение рака яичка комбинированное. Наилучшие результаты дает сочетание хирургического лечения с химио- и лучевой терапией. Первым этапом лечения всех опухолей яичка является наиболее радикальное удаление первичного очага - орхифуникулэктомия. Операцию выполняют через паховый доступ, с первоначальной перевязкой и пересечением семенного канатика в области внутреннего пахового кольца (за счет чего достигается абластичность), после чего семенной канатик и яичко со всеми оболочками удаляют единым блоком. Данную операцию при раке яичка следует проводить как можно раньше, так как ее роль заключается не только в удалении опухоли, но и в морфологической верификации диагноза. Данные о гистологическом строении опухоли во многом определяют дальнейшую тактику лечения.
Стандартный метод лечения больных семиномой - орхифуникулэктомия с последующим облучением парааортальных и ипсилатеральных тазовых лимфоузлов. Химиотерапия показана только больным с метастазами в лимфоузлы и отдаленными метастазами. Тактика лечения больных несеминомными гер-миногенными опухолями яичка определяется гистологическим строением опухоли, уровнем опухолевых маркеров до и после орхифуникулэктомии и стадией заболевания. Герминогенные опухоли яичка особенно чувствительны к химиотерапии. В зависимости от стадии заболевания и гистологического строения опухоли назначают два курса лечения и более. Основные препараты - цисплатин, винблас-тин, блеомицин, этопозид. Прогноз зависит от гистологической структуры опухоли, стадии заболевания, возраста больного, концентрации опухолевых маркеров. Наиболее благоприятный прогноз при семиноме, менее благоприятный - при эмбриональном раке и тератобластоме, наихудший - при хориоэпителиоме и смешанных опухолях с элементами хориоэпителиомы. Прогноз для пациентов молодого возраста хуже, чем для лиц старшей возрастной группы. В начальных стадиях заболевания частота рецидивов составляет менее 5 %, смертность не превышает 1 %. Опухоли придатка яичка встречаются очень редко. Они могут быть доброкачественными и злокачественными, первичными и метастатическими (из желудка, предстательной железы и др.). Наиболее часто встречаются эпителиальные аденоматоидные образования. Опухоль обычно локализуется в хвосте придатка, реже в его теле. Она определяется в виде округлой формы плотного бугристого, иногда состоящего из нескольких узлов образования. Диагностику и дифференциальную диагностику с фуникуло- и сперматоцеле и опухолями яичка проводят на основании пальпаторных данных, УЗИ и биопсии.
Лечение злокачественных опухолей оперативное и заключается в орхифу-никулэктомии (гемикастрации). После операции назначают адъювантную хи-мио- и лучевую терапию. При доброкачественной опухоли производят резекцию придатка или эпидидимэктомию. Прогноз при своевременном лечении благоприятный. 11.8. ОПУХОЛИ ПОЛОВОГО ЧЛЕНА Опухоли полового члена делят на эпителиальные и неэпителиальные (мелано-ма, саркома, эндотелиома), доброкачественные и злокачественные. Среди эпителиальных новообразований чаще всего встречается рак полового члена. Он представляет собой разновидность рака кожи и морфологически является плоскоклеточным (ороговевающий - в большинстве случаев или неороговевающий). В России рак полового члена составляет 0,2 % в структуре всей онкологической патологии. Наибольшая заболеваемость приходится на возраст 70-80 лет. Этиология и патогенез. К предраковым заболеваниям полового члена относят лейкоплакию, остроконечные кондиломы, опухоль Бушке-Левенштейна (гигантская остроконечная кондилома) и carcinoma in situ - эритроплазию Кей-ра и болезнь Боуэна. Считается, что определенную роль в развитии рака полового члена играют 16 и 18 типы вируса папилломы человека, которые обнаруживаются у 70-80 % пациентов с этим заболеванием. К факторам риска развития рака пениса относят баланопостит и поддерживающий его фимоз. Сужение крайней плоти приводит к повышенному скоплению смегмы в пре-пуциальном мешке, которая после присоединения инфекции разлагается, меняет свой состав и приобретает канцерогенные свойства. Круговое иссечение крайней плоти (циркумцизия), особенно в странах с жарким климатом и дефицитом воды, значительно снижает риск развития рака полового члена. После иссечения крайней плоти в детском возрасте рак полового члена является казуистикой.
Симптоматика и клиническое течение. На ранних стадиях рак полового члена не причиняет больному значительных физических страданий. Нередко пациенты из-за чувства стыдливости и низкого уровня медицинской культуры обращаются за врачебной помощью, когда заболевание принимает распространенный характер. Этому способствует также фимоз, при котором опухолевый процесс определенное время может оставаться незамеченным. Первым признаком рака полового члена служит появление на внутренней поверхности крайней плоти или головки безболезненного новообразования в виде эрозии, язвы, трещины, узелка или участка индурации (рис. 81, см. цв. вклейку). Дальнейший рост опухоли и начинающийся ее распад характеризуются появлением геморрагического отделяемого, а присоединение инфекции - зудом и жжением в пораженной области. Вовлечение в неопластический процесс наружного отверстия уретры сопровождается затрудненным, болезненным мочеиспусканием. У пациентов с распространенными формами заболевания определяется метастатическое поражение лимфатических узлов. Для рака полового члена характерно лимфогенное метастазирование. Регионарными являются пахово-бедренные и подвздошные лимфатические узлы. Отдаленные метастазы (в легкие, печень, кости, головной мозг и др.) наблюдаются редко. Классификация рака полового члена выполняется по системе ТNМ. Диагностика и дифференциальная диагностика проводятся на основании жалоб, анамнеза, данных осмотра и пальпации. У больных с поздними стадиями рака полового члена установление диагноза трудностей не вызывает. Выявить рак пениса при его начальных проявлениях не всегда легко. Больные нередко получают лечение по поводу венерических заболеваний, папилломатоза или хронического баланопостита, а у пациентов с сопутствующим фимозом опухоль обнаруживают только после иссечения суженной крайней плоти. Окончательно установить диагноз позволяет гистологическое исследование биопсийного материала, которое всегда должно предшествовать лечению рака полового члена. Метастазы опухоли распознают с помощью КТ и МРТ.
Лечение комбинированное и включает радикальное удаление опухоли, хи-мио- и лучевую терапию. В начальных стадиях заболевания можно выполнять органосохраняющие операции, малоинвазивные вмешательства (лазерная или криодеструкция). Производят круговое иссечение крайней плоти, резекцию головки полового члена либо ограничиваются близкофокусной рентгенотерапией. Радикальное оперативное лечение включает различного объема ампутацию полового члена и операцию Дюкена (двустороннюю пахово-бедренную лимфаден-эктомию). Хирургическое вмешательство комбинируют с адъювантной или неоадъювантной лучевой или химиотерапией (5-фторурацил, цисплатин, ме-тотрексат, винбластин и др.). Больным с неоперабельными опухолями назначают симптоматическую, паллиативную лучевую или химиотерапию. Прогноз зависит от стадии рака полового члена. Для больных с локализованной стадией заболевания при своевременном и адекватно проведенном лечении он благоприятен: пятилетняя выживаемость достигает 60-70 %. Профилактика заключается в регулярном соблюдении гигиены (удалении смегмы), а при сужении крайней плоти - выполнении циркумцизии. Контрольные вопросы 1. С какой частотой встречаются опухоли почки? Как их классифицируют? 2. Перечислите местные и общие симптомы рака паренхимы почки. 3. С чем и как проводят дифференциальную диагностику почечно-клеточ-ного рака? 4. Каковы абсолютные показания для органосохраняющего лечения опухолей почки? 5. Какие высокотехнологичные и малоинвазивные методы лечения рака почки применяются в настоящее время? 6. Как проводится диагностика и дифференциальная диагностика опухоли Вильмса? 7. Какова эпидемиология рака почечной лоханки и мочеточника? Что такое балканская нефропатия? 8. В чем значение эндоскопических методов в диагностике и лечении опухолей верхних мочевых путей?
9. Что является показанием к органосохраняющему лечению опухолей почечной лоханки? Какими методами его проводят? 10. С какой частотой встречается рак мочевого пузыря? Что относят к факторам риска этого заболевания? 11. Как проводят современную диагностику опухолей мочевого пузыря? 12. Какова тактика лечения неинвазивного и мышечно-инвазивного рака мочевого пузыря? 13. Перечислите основные методы деривации мочи при радикальной цис-тэктомии. 14. Каков прогноз при раке мочевого пузыря? 15. Каков патогенез ДГПЖ? 16. Назовите принципы медикаментозной терапии ДГПЖ. 17. Какие существуют малоинвазивные методы лечения ДГПЖ? 18. Приведите Международную классификацию РПЖ. 19. Каково значение ПСА в диагностике РПЖ? 20. Когда показана биопсия предстательной железы? 21. Какие существуют современные методы лечения локализованного РПЖ? 22. Приведите классификацию опухолей яичка. 23. Какова локализация метастазов семиномы? 24. В чем заключается комбинированное лечение рака яичка? 25. Перечислите предраковые заболевания полового члена. Клиническая задача 1 Пациентка, 58 лет, направлена на консультацию к урологу диспансерным врачом. Известно, что при очередном профилактическом осмотре во время со- нографии выявлено патологическое образование в проекции левой почки (рис. 11.52). Больная жалоб не предъявляет. Объективно: общее состояние удовлетворительное, температура тела нормальная, АД 120/80 мм рт. ст., живот мягкий, безболезненный во всех отделах. Почки не пальпируются, поколачивание по поясничной области безболезненно с обеих сторон. Анализы крови и мочи в норме. Установите диагноз с интерпретацией сонограммы и приведите его обоснование. Предложите план дообследования и тактику лечения. 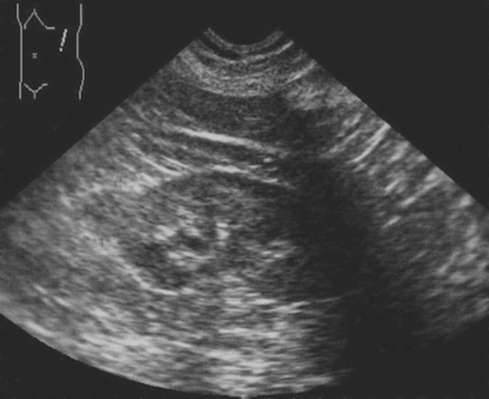 Рис. 11.52. Сонограмма почки больной 58 лет
Клиническая задача 2 Родители мальчика 3 лет обратились к педиатру с жалобами на увеличение живота ребенка, наличие в правых его отделах объемного образования. Подобные явления стали отмечать около 4 месяцев назад, однако в первое время значения этому не придавали. При объективном осмотре кожные покровы не изменены. Визуально определяется увеличение и асимметрия живота за счет выбухания правой его половины. В правом подреберье пальпируется плотное безболезненное смещаемое объемное образование. В анализах отмечаются умеренный лейкоцитоз, увеличение СОЭ, микрогематурия. Установите диагноз и проведите дифференциальную диагностику. Какова тактика дальнейшего обследования и лечения? 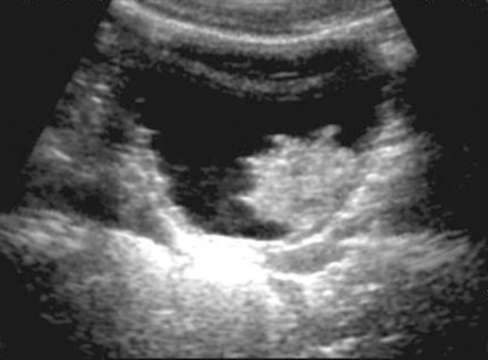 Рис. 11.53. Сонограмма мочевого пузыря больного 48 лет Клиническая задача 3 Больной С., 48 лет, обратился к урологу с жалобами на примесь крови в моче на протяжении всего мочеиспускания. Впервые макрогематурия возникла 3 ме- сяца назад, а затем периодически появлялась и носила кратковременный характер. К врачу не обращался, не обследовался. Известно, что пациент работает в нефтеперерабатывающей отрасли, курит с 18 лет. При осмотре общее состояние удовлетворительное. Живот мягкий, при пальпации безболезненный во всех отделах. Почки не определяются, поколачивание по поясничной области безболезненно с обеих сторон. Наружные половые органы не изменены. Клинические и биохимические анализы крови в норме. Анализ мочи: цвет - красный, ре- акция кислая, лейкоциты - 1-2 в поле зрения, эритроциты покрывают все поле зрения. Больному выполнено ультразвуковое исследование почек и мочевого пузыря (рис. 11.53). Что вы видите на сонограмме? Установите предварительный диагноз. Какие методы исследования позволят его подтвердить? Клиническая задача 4
Больной, 68 лет, жалуется на частое затрудненное мочеиспускание слабой струей, ноктурию до 3-4 раз за ночь. Подобные явления с тенденцией к ухудшению отмечает в течение трех лет. Лечился амбулаторно: принимал тамсу-лозин, гентос, растительные препараты. За последний год появилось чувство неполного опорожнения мочевого пузыря. Дважды были острые задержки мочи, которые устраняли путем катетеризации. При ректальном пальцевом исследовании предстательная железа увеличена, эластичной консистенции, срединная бороздка сглажена. При лабораторном исследовании выполнен анализ крови и мочи: креатинин крови в пределах нормы, ПСА - 2,5 нг/мл. Трансректальное УЗИ - объем предстательной железы 70 см3, объем остаточной мочи 120 мл. Установите диагноз. Какова должна быть тактика лечения? Клиническая задача 5 Больной, 67 лет, обратился к врачу с жалобами на затрудненное мочеиспускание, вялую струю мочи, необходимость 2-3 раза просыпаться ночью, чтобы помочиться. Анализ крови на ПСА - 15,7 нг/мл. При пальпации предстательная железа увеличена, в правой доле имеется уплотнение. Установите предварительный диагноз. Какие методы исследования позволят его подтвердить? Клиническая задача 6 Больной, 27 лет, госпитализирован с жалобами на увеличение правой половины мошонки, боли в правом яичке. Из анамнеза известно, что в детском возрасте ему выполняли операцию по низведению правого яичка. Ноющие боли в правом яичке беспокоят пациента около 6 месяцев, в последнее время отмечается быстрое увеличение правой половины мошонки в размерах. При осмотре: температура тела 36,6 °С, со стороны внутренних органов без особенностей. При пальпации органов мошонки определяется значительное увеличение размеров правого яичка, консистенция его неоднородная, с участками уплотнений. Анализ мочи и крови в норме.
Установите диагноз. Предложите тактику обследования и лечения больного. |
