История урологии
 Скачать 6.12 Mb. Скачать 6.12 Mb.
|
|
Рис. 11.31. Трансабдоминальная сонограмма во фронтальной (а) и саггитальной (б) проекциях. ДГПЖ с выраженным внутрипузырным ростом (стрелка) 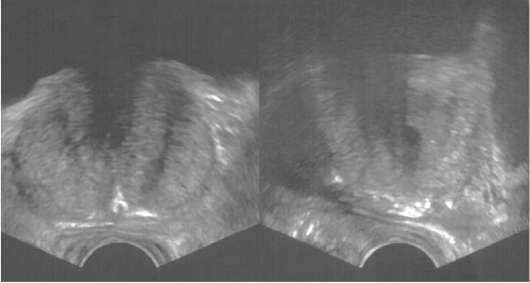 Рис. 11.32. Трансректальная сонограмма. ДГПЖ объем мочи Vcomp мл. Результаты исследования считаются достоверными, если оно проводилось не менее 2 раз в условиях физиологического наполнения мочевого пузыря до 200-350 мл при появлении естественного позыва к мочеиспусканию. Снижение Qmax до значений менее 15 мл/с свидетельствует об инфравезикальной обструкции или недостаточности сократительной функции детрузора (рис. 11.33). Для дифференциальной диагностики этих состояний выполняют цисто-метрию (измерение внутрипузырного давления), с помощью которой уточняют истинную причину замедленного мочеиспускания. Обзорная и экскреторная урография позволяет обнаружить у больных с ДГПЖ вторичные камни в мочевом пузыре, степень нарушения функционального состояния верхних мочевых путей и почек. Гидроуретеронефроз развивается в результате деформации и сдавливания увеличенной и отечной предстательной железой мочепузырного треугольника и устьев. Это проявляется характерными крючкообразными изгибами предпузырных отделов мочеточников (симптом рыболовных крючков). На нисходящей цистограмме определяется округлый дефект наполнения в области шейки мочевого пузыря (рис. 11.34). Мультиспиральная КТ и МРТ дают подробное представление о состоянии предстательной железы и расположенных рядом органов, но ввиду достаточной информативности вышеуказанных методов исследования чаще применяются для дифференциальной диагностики заболеваний предстательной железы.
 Рис. 11.33. Урофлуограмма при ДГПЖ 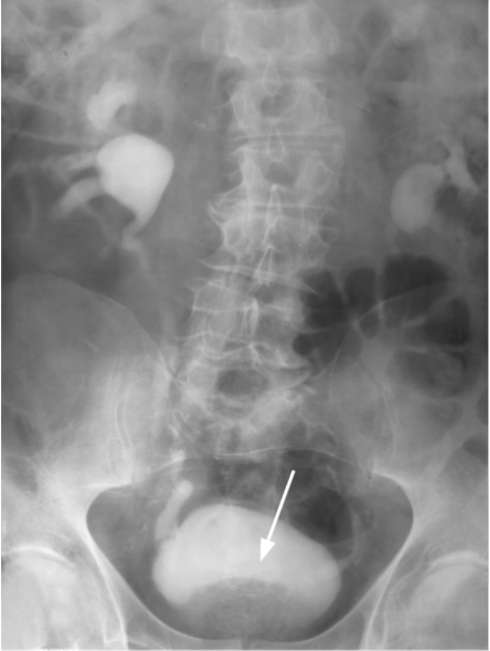 Рис. 11.34. Экскреторная урограмма. Округлый дефект в шейке мочевого пузыря, обусловленный ДГПЖ (стрелка) Заключительным этапом диагностики, а скорее первым этапом эндоскопического оперативного лечения ДГПЖ является уретроцистоскопия. Она позволяет определить размеры, количество долей гиперплазирован-ной предстательной железы, ход и деформацию мочеиспускательного канала и характерные для нее изменения в мочевом пузыре (трабекуляр-ность стенки, ложные дивертикулы, камни). Дифференциальная диагностика. ДГПЖ следует отличать от других заболеваний предстательной железы, мочевого пузыря, мочеиспускательного канала и нейрогенных расстройств мочеиспускания, имеющих сходную ирритативную и обструктивную симптоматику. Простатит и воспалительные заболевания нижних мочевых путей (цистит, уретрит) могут проявляться аналогичными расстройствами мочеиспускания. Однако при них, в отличие от ДГПЖ, отсутствует обструктивная симптоматика. Инфекция мочевых путей всегда сопровождается лейкоцитурией и бактериурией. Рак предстательной железы часто сочетается с доброкачественной гиперплазией. Однако они развиваются из различных отделов простаты и являются отдельными самостоятельными заболеваниями. При раке предстательная железа также увеличена, но в отличие от ДГПЖ ректальное пальпаторное исследование выявляет плотные бугристые участки. Как правило, при раке отмечаются высокие цифры ПСА (> 4 нг/мл). К сонографическим признакам рака простаты относятся гипоэхогенные участки в периферических зонах предстательной железы. Окончательно установить диагноз позволяет трансректальная мультифо-кальная биопсия простаты. Сходная обструктивная симптоматика имеет место при сужениях, камнях и опухолях мочеиспускательного канала. Правильно установить диагноз позволяют диагностическое бужирование, ретроградная уретрография и уретроскопия.
Нейрогенные расстройства мочеиспускания характеризуются наличием в анамнезе неврологических заболеваний, соответствующей им симптоматики и отсутствием увеличения предстательной железы. Для дифференциальной диагностики выполняют урофлоуметрию, комплексное уродинамическое исследование, электромиографию и др. Факторы риска (прогрессирования) ДГПЖ. В настоящее время доказано, что ДГПЖ является медленно прогрессирующим заболеванием. Средний прирост объема простаты у пациентов с ДГПЖ без лечения в течение четырех лет составляет примерно 15 %, а при ПСА более 1,5 нг/мл достигает 20 %. Согласно рекомендациям Европейской ассоциации урологов и совещания Совета экспертов РФ по лечению ДГПЖ, к доказанным факторам риска прогрессирова-ния заболевания относятся: ■ объем предстательной железы ≥ 30 см3; ■ уровень ПСА ≥ 1,5 нг/мл; ■ наличие СНМП (IPSS > 7 баллов); ■ возраст ≥ 50 лет. Дополнительными прогностическими критериями считаются скорость потока мочи менее или равная 10-12 мл/с, объем остаточной мочи более 50 мл, эпизоды острой задержки мочеиспускания, хроническая почечная недостаточность, инфекция мочевых путей, неэффективность консервативной терапии. Перечисленные факторы в три раза и более увеличивают вероятность острой задержки мочеиспускания и риск оперативного лечения. Лечение. Динамическое наблюдение показано только пациентам со слабо-выраженными СНМП, которые мало влияют на качество их жизни. Оно допустимо при IPSS < 7, ПСА < 1,5 нг/мл и объеме предстательной железы менее 30 см3. Больные должны 1 раз в 3 месяца обращаться к урологу и проходить контрольное обследование, так как субъективная оценка пациентом (особенно в пожилом возрасте) СНМП (IPSS и QOL), как правило, не соответствует истинной клинической картине ДГПЖ.
Основными критериями к назначению медикаментозной терапии являются определение риска прогрессировать заболевания и обеспокоенность пациента по поводу появления и нарастания СНМП. Переход от динамического наблюдения к медикаментозному лечению ДГПЖ обоснован при IPSS > 7, ПСА > 1,5 нг/мл и объеме предстательной железы более 30 см3 даже при отсутствии других факторов прогрессирования заболевания. Эффективность медикаментозной терапии при неосложненном течении ДГПЖ составляет до 80 %. В зависимости от сроков медикаментозного лечения ДГПЖ задачи делятся на: 1) краткосрочные - уменьшение СНМП и профилактика острой задержки мочеиспускания; 2) долгосрочные - улучшение уродинамики, предотвращение хирургических вмешательств, осложнений и прогрессирования заболевания; 3) общие - сохранение и улучшение качества жизни, минимизация побочных эффектов лечения. Лекарственная терапия должна быть направлена на все компоненты инфра-везикальной обструкции: ■ уменьшение размеров предстательной железы (статический компонент обструкции); ■ расслабление гладкомышечных элементов, ее капсулы, шейки мочевого пузыря и задней уретры (динамический компонент); ■ устранение ишемии детрузора (трофический) и снятие отека простаты (воспалительный компонент). Идеального препарата для лечения ДГПЖ нет, поэтому подбирать терапию надо строго индивидуально с учетом ее эффективности и безопасности. В настоящее время предложено большое количество лекарственных средств для лечения ДГПЖ: 1) α-адреноблокаторы (α-АБ): селективные (α1) - празозин, альфузозин, доксазозин, теразозин и др.; суперселективные (α1А) - тамсулозин; 2) ингибиторы 5-α-редуктазы: синтетические - финастерид, дутастерид; растительные - экстракты Serenoa repens, Pygeum africanum и др.;
3) тканевые препараты - простаты экстракт (раверон, простатилен); 4) полиеновые антибиотики - леворин, ипертрофан; 5) гормоны: аналоги лютеинезирующего рилизинг-гормона - гозерелин (золадекс), бусерелин; антиандрогены - флутамид, бикалутамид (касодекс), ципротерон (андрокур); гестагены - депостат; андрогены, эстрогены, антиэстрогены, ингибиторы ароматазы, антагонисты пролактина; 6) фитопрепараты - экстракты пальмы сабал, уртирон, масло семян тыквы и др.; 7) гомеопатические средства - афала. Среди большого арсенала лекарственных препаратов только α1-адреноблокаторы и ингибиторы 5-α-редуктазы являются основными средствами медикаментозного лечения ДГПЖ. Их эффективность доказана международными исследованиями и многолетней клинической практикой. Применение α-ад-реноблокаторов приводит к расслаблению гладкомышечных элементов шейки мочевого пузыря и простаты, устранению гипоксии и улучшению энергетического метаболизма в детрузоре. Они представляют собой препараты первой линии лечения больных ДГПЖ при наличии СНМП (IPSS > 8-35), так как: 1) обеспечивают быстрое симптоматическое улучшение (по шкале IPSS) уже на 1-2-й неделе лечения независимо от размеров простаты; 2) эффективны в отношении обструктивных и ирритативных симптомов; 3) не влияют на уровень ПСА; 4) удобны в применении (прием 1 или 2 раза в сутки). Желаемого результата при использовании всех α-адреноблокаторов, за исключением тамсулози-на, можно добиться за счет увеличения дозы и кратности приема препарата. В клинической практике используют селективные α-адреноблокаторы (теразозин, доксазозин, альфузозин и др.) и суперселективные α1А-адренобло-каторы (тамсулозин). Все селективные α-адреноблокаторы имеют примерно одинаковую клиническую эффективность и частоту побочных реакций (10-16 %) в виде недомогания, слабости, головокружения, головной боли, ортостатической гипотензии (2-5 %), тахикардии и тахиаритмии. Наименьшими побочными явлениями обладает тамсулозин.
α1-Адреноблокаторы устраняют динамический компонент инфравезикаль-ной обструкции, но не влияют на прогрессирование ДГПЖ. Замедляют рост предстательной железы ингибиторы 5-α-редуктазы II типа - финастерид и ду-тастерид. Аналогичным механизмом действия, но со значительно меньшей эффективностью обладают растительные препараты - экстракты Serenoa repens, Pygeum africanum и др. При длительной, не менее 6-12 мес, терапии ингибиторами 5-α-редуктазы риск прогрессирования ДГПЖ снижается почти на 70 %, так как уменьшаются объем простаты, выраженность СНМП (IPSS), уровень ПСА, вероятность острой задержки мочеиспускания и риск оперативного вмешательства. Среди редких нежелательных явлений терапии следует отметить эректильную дисфункцию, снижение либидо, уменьшение объема эякулята и гинекомастию. Прием ингибиторов 5-α-редуктазы снижает кровоток в простате 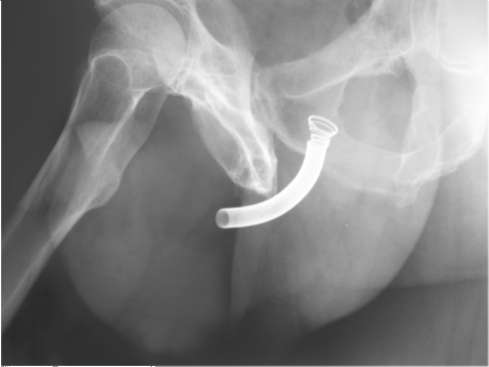 Рис. 11.35. Обзорная рентгенограмма. Спиралевидный металлический эндопротез, установленный больному с ДГПЖ в простатический отдел уретры и уменьшает гематурию, связанную с самим заболеванием и хирургическими вмешательствами на простате. Пациентам с ДГПЖ, имеющим СНМП (IPSS >8-35), и с установленным риском прогрессирования заболевания (объем простаты более 30 см, уровень ПСА от 1,5 до 10 нг/мл) показана наиболее эффективная комбинированная терапия α-адреноблокатора-ми и ингибиторами 5-α редуктазы, так как она обеспечивает быстрое симптоматическое улучшение и уменьшение объема предстательной железы. Остальные лекарственные средства относятся к препаратам второго ряда и применяются в лечении боль- ных ДГПЖ как вспомогательные средства для уменьшения выраженности симптомов или в комплексной терапии в сочетании с α1-адреноблокаторами и/или ингибиторами 5-α-редуктазы.
Малоинвазивные методы лечения: установка постоянных, временных (съемных) или рассасывающихся стентов (эндопротезов) в простатическом отделе уретры под эндовидеорентгенологическим контролем (рис. 11.35), термальные методы - используются при абсолютных противопоказаниях к хирургическим вмешательствам. Уретральные стенты препятствуют сдавливанию просвета мочеиспускательного канала гиперплазированной тканью простаты, но имеют высокий риск осложнений, связанный с инкрустацией солями, инфекцией и болевым синдромом. Многочисленные термальные методы основаны на физическом воздействии на гиперплазированную ткань высоких и низких температур от тепловых, радиочастотных (электромагнитных), лазерных и ультразвуковых источников, установленных в уретре или прямой кишке на уровне простаты. В зависимости от вида и фокуса излучения по мере повышения температуры от 42-45 до 120 °C в ткани гиперплазированной простаты возникают морфологические изменения, характеризующиеся нарушением микроциркуляции, разрушением о -адренорецепторов, подавлением клеточной пролиферации, дистрофией и образованем очагов некроза с их последующим склерозированием. К неэндоскопическим методам электромагнитного воздействия относятся трансректальная (40-42 °C) и трансуретральная гипертермия (40-45 °C), трансуретральная термотерапия (45-70 °C), термодеструкция или термоаб-лация (70-82 °C). Трансуретральная радиочастотная термотерапия (TUMT) и термодеструкция (TUNA) приводят к образованию очагов коагуляционного некроза в глубине простаты. В отличие от вышеперечисленных методов высокоинтенсивный фокусированный ультразвук (HIFU) с помощью специального трансректального зонда и компьютерной программы наведения позволяет создать локальное повышение температуры до 80-120 °C. В результате деструк-
ция возникает только в заданных точках простаты, не затрагивая окружающие органы и ткани. Наименее безопасной считается интерстициальная лазерная коагуляция, которая заключается в непосредственном введении в ткань простаты остроконечных световодов, нагревающих ее до 66-100 °C. Хирургическое лечение. Показаниями к оперативному лечению ДГПЖ являются: ■ отсутствие эффекта от длительной медикаментозной терапии с нарастанием обструктивных и ирритативных симптомов, отрицательно влияющих на повседневную активность пациента; ■ увеличение количества остаточной мочи (более 100 мл); ■ повторяющиеся острые задержки мочеиспускания; ■ рецидивирующая инфекция мочевыводящих путей; ■ камни мочевого пузыря; ■ неоднократная макрогематурия, рефрактерная к терапии ингибиторами 5-а-редуктазы; ■ гидроуретеронефроз и хроническая почечная недостаточность. Оперативное вмешательство не следует выполнять на ранних стадиях ДГПЖ, когда преобладают ирритативные симптомы, так как оно не приносит облегчения больному. Выделяют паллиативные и радикальный методы оперативного лечения ДГПЖ. При паллиативных методах предстательная железа не удаляется (эпицисто-стомия - троакарная или открытая) или удаляется только ее часть (ТУР предстательной железы и ее модификации - электроинцизия, электровапоризация, роторезекция и лазерная вапоризация). Радикальный метод - аденомэктомия (простатэктомия), которая может быть выполнена как эндоскопически (трансуретрально) - трансуретральная аденомэк-томия с электроэнуклеацией гиперплазированной предстательной железы единым блоком или удалением всей аденоматозной ткани путем трансуретральных срезов, так и открытым способом (чреспузырным или позадилонным доступом). Данные оперативные вмешательства выполняют как в экстренном, так и в плановом порядке. Показаниями к экстренной операции служат острая задержка мочеиспускания, в том числе с наличием ложного хода уретры после неудачной катетеризации мочевого пузыря, и профузная макрогематурия. Она может быть выполнена паллиативно или радикально. Выбор объема экстренной операции зависит от длительности задержки мочеиспускания, наличия и обострения воспалительных заболеваний мочеполовых органов, функционального состояния мочевых путей и почек и выраженности сопутствующей патологии.
Степень увеличения гиперплазированной простаты не служит показанием к хирургическому лечению, но является определяющим фактором при выборе между эндоскопическим и открытым методами операции. Аденомэктомия - единственный радикальный метод лечения ДГПЖ. Эпицистостомия (надлобковое дренирование мочевого пузыря) заключается в установке в мочевой пузырь через его переднюю стенку дренажной трубки (катетеров Пеццера, Фолея). Она может быть выполнена открытым способом - 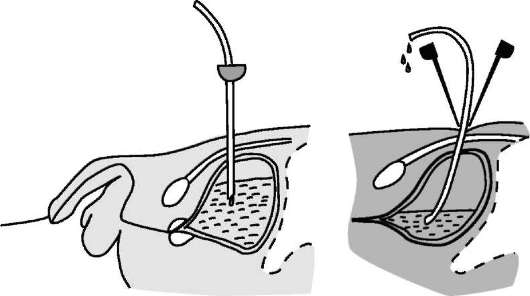 Рис. 11.36. Троакарная эпицистостомия путем высокого сечения мочевого пузыря или в результате пункции его троакаром, по которому в полость мочевого пузыря устанавливают дренажную трубку, после чего троакар удаляют (рис. 11.36). Последний способ предпочтителен. Эпицистостомию выполняют при острой и хронической задержке мочеиспускания как временную меру для улучшения функции мочевых путей и почек и купирования обострения мочевой инфекции. У ослабленных больных с высоким риском хирургических вмешательств надлобковый дренаж может оставаться пожизненно. После надлобкового дренирования мочевого пузыря необходимо проводить мониторинг объема циркулирующей жидкости, АД, концентрации электролитов в связи с возможным развитием угрожающих жизни нарушений водно-электролитного и кислотно-основного баланса. Иногда эпицистостомия в результате декомпрессии мочевого пузыря может спровоцировать кровотечение из расширенных вен его стенки. Трансуретральная электрорезекция предстательной железы - один из основных методов лечения ДГПЖ. Данным методом можно резецировать или удалить предстательную железу любых размеров, однако ее оптимальный объем не более 80 см3, так как ТУР большей по объему гиперплазированной ткани удлиняет время вмешательства, сопровождается большей кровопотерей и может привести к ТУР-синдрому. Техника операции заключается в послойном срезании кусочков простаты с эвакуацией их через тубус резектоскопа (см. 4.9, рис. 5-10 на цв. вклейке). Модификациями классической ТУР являются элект-роинцизия простаты (рассечение ее долей), электровапоризация (выпаривание тканей предстательной железы) и роторезекция.
|
