Издательский дом Питер
 Скачать 5.79 Mb. Скачать 5.79 Mb.
|
|
Глава 5. ФИЗИОЛОГИЯ КРОВИ Кровь — функциональная система организма, состоящая из костного мозга, периферической крови, селезенки, лимфатических узлов и печени. 5.1. Кроветворение В костном мозге взрослого человека происходит кроветворение (гемопоэз), в результате которого образуются клетки периферической крови (рис. 14). В эмбриональном периоде кроветворение происходит в печени, селезенке и костном мозге. Особенность крови — быстрое обновление клеточного состава. Ежедневно заменяется 1x1011 клеток крови, при этом продолжительность циркуляции: — эритроцита — 100-120 дней; — тромбоцита — 7-12 дней; — гранулоцита — менее 10 ч. Основа кроветворения — стволовые клетки, способные к самообновлению и дифференцировке в клетки крови всех типов. Стволовые клетки определяются функционально по способности генерировать несколько ростков кроветворения. Морфологически стволовые клетки, вероятно, идентичны лимфоцитам. Их количество по разным оценкам составляет 1 на 106 или 1 на 107 миелокариоцитов (ядросодержащих клеток костного мозга). Костномозговые полости у ребенка имеются почти во всех костях. У взрослого костный мозг сохраняется в грудине, ребрах, позвонках и костях таза. Красный цвет костного мозга обусловлен активной пролиферацией эритроидного ростка. Также в костном мозге происходит миелопоэз и мегакариоцитопоэз. Лимфопоэз преимущественно происходит в тимусе, селезенке, лимфатических узлах и лимфоидной ткани, ассоциированной с кишечником (миндалины, аденоиды, пейеровы бляшки). Продукция эритроцитов, лейкоцитов и тромбоцитов осуществляется в специальных областях гемопоэтического индуктивного микроокружения. Эти области ограничены стромальными клетками и включают внутрикостные  Рис. 14. Схема кроветворения [Эмерсон С. Д., 2000]. (Подробности в тексте.) Кроветворение___________________________________167 клетки, лимфоидные клетки, остеобласты, остеокласты, макрофаги и их растворимые факторы роста (цитокины). Селезенка является центральным органом иммунологического распознавания (лимфатический «суперузел» с уникальным сложным механизмом фильтрации крови). Функции селезенки: — эмбриональный (у взрослых — патологический) гемопоэз; — удаление утративших морфофункциональную полноценность эритроцитов (дефектные, изношенные, покрытые антителами, с патологическими включениями, паразитами); — ремоделирование эритроцитов (для повторной циркуляции); — повторное использование железа; — концентрирование тромбоцитов; — регуляция объема крови; — первичный бактериальный фильтр; — удаление гранулоцитов, содержащих бактерии; — Т-зависимое и Т-независимое развитие В-лимфоцитов; — продукция антител. Лимфатические узлы реагируют на местный антигенный стимул. Лимфатический узел представляет собой агрегат В-лимфоидных фолликулов, в каждом из которых происходит экспансия В-клеточных клонов. Т-лимфоциты, расположенные вокруг этих фолликулов, функционируют совместно с В-клетками и друг с другом. Также в иммунном ответе участвуют макрофаги, барьерные и энд отел нал ьные клетки. В тимусе (вилочковой железе) из костномозговых протимоцитов формируются Т-лимфоциты (Т-клетки). Как только лимфоциты развиваются в зрелые Т-клетки, они начинают циркулировать по организму. В основном их иммунная функция реализуется в лимфатических узлах, где они индуцируют созревание В-клеток и их превращение в плазматические клетки, секретирующие антитела. Некоторые другие аспекты иммунной функции Т-клеток осуществляются в нелимфоидных тканях. Гемопоэтические факторы роста (колониестимулирующие факторы) — специфические гемопоэтические гормоны (гликопротеины), контролирующие все этапы деления, дифференцировки и созревания клеток крови. Выделяют как стимуляторы, так и ингибиторы гемопоэза. Для трансфузионной медицины принципиальное значение имеет возможность клинического применения рекомбинантных препаратов колониестимулирующих факторов для корреции цитопений. Самообновление и начальный этап дифференцировки стволовых клеток невозможны без тесного контакта со стромальными клетками. Эта гетерогенная группа клеток состоит из фибробластов, эндотелиальных клеток, остеобластов и адипоцитов, локализованных на внутрикостной поверхности кост- 168 ___ ___________Глава 5. Физиология крови номозговой полости. Стромальные клетки обеспечивают гемопоэтические клетки двумя тесно связанными между собой необходимыми элементами: — растворимыми гемопоэтическими факторами роста; — связанными с мембраной молекулами присоединения (прикрепления). Регуляция синтеза колониестимулирующих факторов (КСФ) двойственна. Для поддержания базального уровня кроветворения стромальные клетки в небольшом количестве постоянно продуцирует КСФ, ответственные за начальный этап гемопоэза: — интерлейкин-6 (ИЛ-6); — гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ); — фактор стволовых клеток (ФСК); — Flt-3-лиганд (Flt-3L). Секреция КСФ значительно возрастает в ответ на различные стимулы, например инфекцию. Бактериальные и вирусные продукты активируют моноциты, которые затем секретируют интерлейкин-1 (ИЛ-1), фактор некроза опухоли а (ФНО-а), гранулоцитарный колониестимулирующий фактор (Г-КСФ) и собственный макрофагальный колониестимулирующий фактор (М-КСФ). Эти продукты в свою очередь стимулируют дополнительную секрецию КСФ. ИЛ-1 наряду с антигенной стимуляцией специфических рецепторов активирует Т-клетки к секреции ГМ-КСФ и интерлейкина-3 (ИЛ-3). ИЛ-1 и ФНО-а стимулируют фибробласты и эндотелиальные клетки стромального микроокружения костного мозга к увеличению секреции ими ИЛ-6 и ГМ-КСФ, а также к секреции больших количеств Г-КСФ. Эти гемопоэтические ростовые факторы (цитокины), таким образом, непосредственно увеличивают количество циркулирующих нейтрофилов, моноцитов и плазматических клеток, а также активируют эти клетки в процессе созревания. Генерация каждой специфической линии зрелых клеток крови регулируется определенным набором гемопоэтических факторов роста. Хотя наборы гемопоэтических факторов роста, стимулирующие специфическое созревание субпопуляций клеток крови, перекрываются по своим функциям, каждый из них имеет характерные отличия. Эритропоэз. В процессе созревания эритроцита происходит 18 делений клеток-предшественников. Первые 8-10 делений происходят под действием ГМ-КСФ и ФСК, продуцирующихся местно в стромальном микроокружении костного мозга. Кроме того, эти этапы могут быть специфически усилены ИЛ-3, который производят активированные Т-лимфоциты. Исследования тканевых культур позволили выявить два вида начальных эритроидных предшественников: бурстобразующая эритроидная единица (БОЕ-Э) и являющаяся продуктом ее дифференциации колониеобразующая эритроидная единица (КОЕ-Э). Последняя дает начало проэритробласту, самому раннему из эритроидных клеток-предшественников, морфологически Кроветворение ______________________________169 различимых в костном мозге. После 4-5 митотических делений и соответствующих морфологических изменений проэритробласт становится зрелой безъядерной эритроидной клеткой, которая циркулирует в периферической крови в течение 90-120 дней, после чего удаляется селезенкой и другими структурами ретикулоэндотелиальной системы. Обязательным фактором роста, необходимым на заключительных стадиях дифференцировки эритроидного ростка (8-10 делений, начиная со стадии КОЕ-Э), является эритропоэтин (ЭП), задача которого состоит в поддержании эритроцитной массы в соответствии с потребностями организма в кислороде. ЭП — почечный гормон гликопротеиновой природы, контролирующий и регулирующий эритроидную дифференциацию. Наиболее вероятное место продукции ЭП — клетки капилляров клубочка. До 10 % ЭП у взрослого человека продуцируется клетками печени, что имеет важное значение при почечной патологии. Дефицит кислорода, возникающий при гипоксии, приводит к высвобождению простагландинов и/или простациклина, активации аденилатциклазы, повышению уровня цАМФ в почках и усилению биосинтеза ЭП. Эритропоэз у здорового человека наряду с образованием необходимого числа эритроидных предшественников (общий эритропоэз) сопровождается разрушением части эритроидных клеток (неэффективный эритропоэз). Неэффективный эритропоэз (обычно не более 3-8 %) является одним из физиологических механизмов регуляции равновесия в системе эритрона при постоянно меняющейся потребности организма в эритроцитах. При различных анемиях неэффективный эритропоэз увеличивается до 50 %. Эритропоэтин индуцирует супрессию апоптоза эритроидных предшественников, соответственно при малой концентрации эритропоэтина создаются условия обширной гибели эритроидных клеток на всех стадиях дифференцировки. Конечный эффект действия ЭП состоит в повышении образования клеток эритрона. О клиническом применении ЭП см. главу 12. Гранулоцитопоэз. Ранние деления, в результате которых полипотентные клетки-предшественники становятся коммитированными в отношении определенных линий, регулируются синергичными взаимодействиями ГМ-КСФ, ФСК и ИЛ-3. Заключительные стадии нейтропоэза и моноцитопоэза индуцируются гранулоцитарным колониестимулирующим фактором (Г-КСФ) и макрофагальным колониестимулирующим фактором (М-КСФ) соответственно. Как описано ранее, несмотря на постоянный уровень базальной секреции КСФ стромальными фибробластами, которые выстилают эндостальную поверхность костного мозга, секреция ГМ-КСФ и Г-КСФ существенно повышается при воспалении в ответ на секрецию ИЛ-1 и ФНО-а моноцитами. Продукция эозинофилов в основном индуцируется интерлейкином-5 (ИЛ-5), а также, в меньшей степени, ИЛ-3 и ГМ-КСФ. Базофилы и тучные клетки непосредственно стимулируются ФСК и ИЛ-3. 170 Глава 5. Физиология крови Мегакариоцитопоэз. Начальные стадии в развитии клеток-предшественников мегакариоцитов индуцируются тромбопоэтином (ТПО) в сочетании с ФСК и в меньшей степени интерлейкином-11 (ИЛ-11). ТПО непосредственно также стимулирует окончательное созревание мегакариоцитов и «отшнуровывание» тромбоцитов. Главную роль в процессе отшнуровывания тромбоцитов играет ИЛ-11. В-лимфопоэз. Начальные стадии в пролиферации и дифференцировке предшественников В-клеток индуцированы интерлейкином-7 (ИЛ-7) и ФСК. С момента образования распознаваемых пре-В и В-клеток дальнейшая дифференцировка и деление стимулируются растворимым интерлейкином-4 (ИЛ-4) и ИЛ-6 при участии иммуноглобулинового антигенного рецептора и Fc-рецептора. После образования антителопродуцирующих плазматических клеток ИЛ-6 и ГМ-КСФ стимулируют дополнительную пролиферацию и секрецию антител. Т-лимфопоэз. Первоначально пре-Т-клетки подвергаются сложной негативной и позитивной селекции в тимусе, в процессе которой они «обучаются» отличать чужеродные антигены. Возникающие в результате зрелые Т-клетки являются субъектами антиген- и цитокининдуцированной активации и экспансии. Стимуляция антигеном в присутствии интерлейкина-2 (ИЛ-2) или антигеном в сочетании со стимуляцией вспомогательными макрофагами или дендритными клетками, которые экспрессируют В7-1 или В7-2, ведет к прямой активации и CD4+ и CD8+ Т-клеток. В обобщенном виде клеточные мишени действия цитокинов в кроветворении представлены в табл. 18. 5.2. Эритроциты Эритроцит является высокоспециализированной клеткой, основная задача которой состоит в транспортировке кислорода из легких в ткани и двуокиси углерода (СО2) — обратно в легкие. Клетка имеет форму двояковогнутого диска, что обеспечивает наибольшую площадь поверхности газообмена. Диаметр эритроцита составляет 8 мкм, однако особенности клеточного скелета и структуры мембраны позволяют ему претерпевать значительную деформацию и проходить через капилляры с просветом в 2-3 мкм. Такая деформационная способность обеспечивается за счет взаимодействия между протеинами мембраны и цитоплазмы (рис. 15). Дефекты этих протеинов ведут к морфологическим и функциональным нарушениям эритроцитов (сфероцитоз, эллиптоцитоз, пиропойкилоцитоз, стоматоцитоз). Таблица 18 Клеточные мишени действия цитокинов в кроветворении [Владимирская Б. К, Румянцев А. Г., 2000]
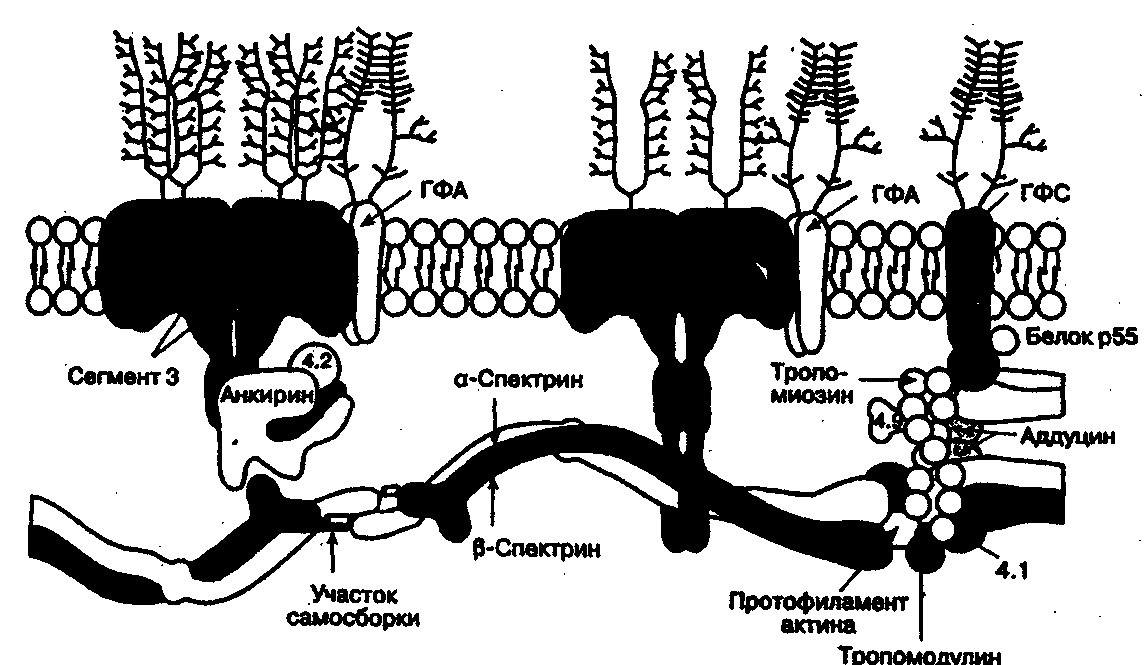 Рис. 15. Структура мембраны эритроцита [Handin R.I. et al., 1995]. ГФА - гликофорин А; ГФС - гликофорин С. Эритроцита___________________________________ 173 Мембрана эритроцита, помимо барьерной функции, содержит каналы и насосы для транспорта натрия, калия, глюкозы, окисленного глютатиона и других мелких молекул. Мембрана эритроцита представляет собой двойной слой липидных молекул, гидрофильные группы которых ориентированы к наружной и внутренней поверхностям мембраны. К гликолипидам мембраны эритроцита относят важные для трансфузиолога антигены системы группы крови АВО. Кроме липидов, мембрана эритроцита содержит значительное количество белков. Гликофорин A(PAS-1, MN-сиалогликопротеин) соединен с внутриклеточным белком — спектрином, обеспечивает отрицательный заряд клеточной поверхности, несет антигены MN и рецепторы к некоторым лигандам. Гликофорин В (PAS-3, Ss-сиалогликопротеин) участвует в обеспечении деформируемости мембраны, несет антигены S, s, U. С внутренней стороны мембраны ряд белков стабилизирует липидный бислой и формирует цитоскелет (спектрин, актин, глюкозо-3-фосфатдегидро-геназа). Зрелый эритроцит не имеет цитоплазматических органелл и ядра и поэтому не способен к синтезу протеинов и липидов, окислительному фосфо-рилированию и обеспечению цикла трикарбоновых кислот. Он получает большую часть энергии через анаэробный путь Эмбдена-Мейергофа и сохраняет ее в виде АТФ. В зависимости от степени окислительной стимуляции через гексозомонофосфатный шунт отводится соответствующее количество глюкозы с образованием восстановленных соединений (глютатион и никотин-амидадениндинуклеотидфосфат [НАДФ]). Приблизительно 98 % массы белков цитоплазмы эритроцита составляет гемоглобин (НЬ), молекула которого связывает и транспортирует кислород. Гемоглобин представляет собой гетеродимерный тетрамер, состоящий из двух цепей глобина типа а и двух цепей другого типа (Р, у или 8), соединенных с четырьмя участками тема. Гем — это одиночная молекула протопорфирина IX, связанного с атомом железа (рис. 16). Каждый тетрамер гемоглобина может обратимо связывать и транспортировать не более четырех молекул кислорода. К наиболее характерным типам гемоглобина относятся: НЬ А (а2Р2, основной гемоглобин взрослого человека), Hb F (а2у2, фетальный гемоглобин) и НЬ А2 (ас282, второстепенный гемоглобин взрослого) (табл. 19). Смена гемоглобина F на гемоглобин А происходит во время рождения ребенка; к 4-6 мес уровень фетального гемоглобина в крови — менее 1 %. Гемоглобин составляет 95 % сухого вещества и занимает 33 % объема эритроцита. Когда эритроциты проходят по капиллярам легких, гемоглобин практически полностью (94-100 %) насыщается кислородом. Ярко-красный цвет артериальной крови обусловлен большим количеством кислорода в эритроцитах. 174 Глава 5. Физиология крови 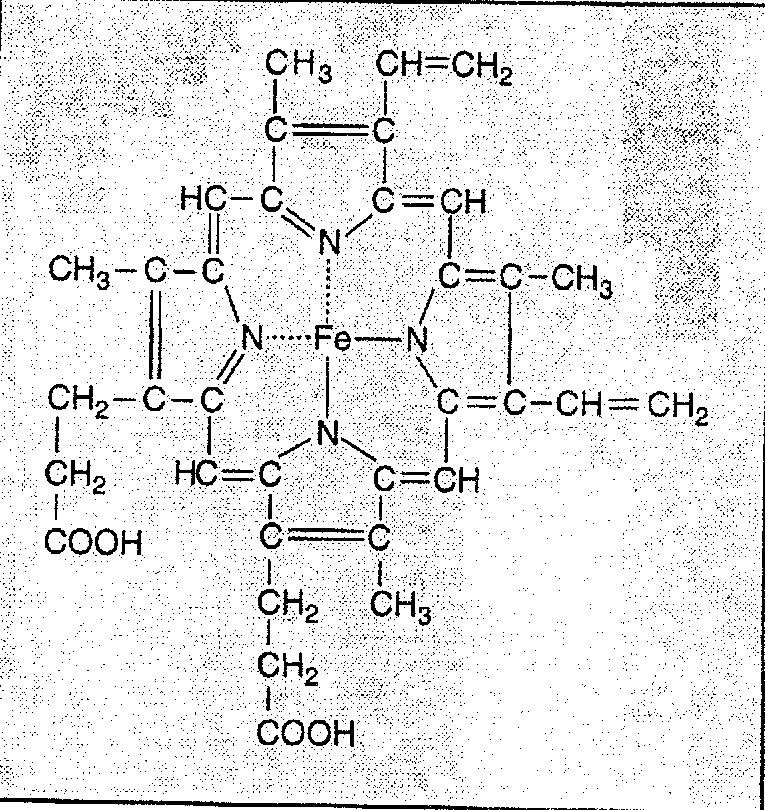 Рис. 16. Молекула гема. В состав молекулы гемоглобина входят четыре таких молекулы гема. Эритроциты 175 Таблица 19 Гемоглобины человека
В тканевых капиллярах эритроциты отдают кислород и забирают углекислый газ, который транспортируют в легкие для вывода из организма (рис. 17). Кривая диссоциации кислорода представляет процент насыщения гемоглобина кислородом при различном напряжении этого газа (рис. 18). Сигмоидальная форма этой кривой обусловлена взаимодействием между субъединицами тетрамера гемоглобина. Главным регулятором сродства гемоглобина к О2 является 2, 3-дифосфоглицериновая кислота (2,3-ДФГ), промежуточный продукт гликолиза. 2,3-ДФГ снижает сродство гемоглобина к О2, что приводит к сдвигу кривой кислородной диссоциации вправо и к усиленному поступлению О2 в ткани. Сдвиг кривой вправо может быть так же вызван увеличением температуры и рСО2, а так же снижением рН (ацидоз). Фетальный гемоглобин слабо связывается с 2,3-ДФГ и поэтому характеризуется более высокой кислородсвязывающей способностью по сравнению с гемоглобином А. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
