конспект лекций.Химия(органическая химия).dos. конспект лекций.Химия(органическая химия). Конспект лекций по дисциплине для студентов, обучающихся по специальностям и направлениям 050100. 62Естественнонаучное образование
 Скачать 1.49 Mb. Скачать 1.49 Mb.
|
|
ЛЕКЦИЯ 6. УГЛЕВОДОРОДЫ. АЛКАНЫ План 1. Классификация углеводородов. 2. Алканы. 3. Гомологический ряд, номенклатура, получение. 4. Изомерия, строение. 5. Свойства. Углеводороды - органические соединения, состоящие из атомов двух элементов - углерода и водорода. Поэтому общую формулу углеводородов можно представить в виде СхНy. Классификацию органических веществ, рассмотренную ранее, можно распространить и на углеводороды. Изучение углеводородов начинается с класса ациклических предельных соединений - алканов. КЛАССИФИКАЦИЯ УГЛЕВОДОРОДОВ УГЛЕВОДОРОДЫ     Алифатические Циклические 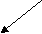  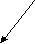      Предельные Непредельные Ароматические Алициклические Алканы Алкены Циклоалканы Арены Алкины Алкадиены АЛКАНЫ Алканы (парафины) - насыщенные или предельные углеводороды с открытой углеродной цепьюи общей формулой – СnH2n+2. Гомологический ряд: метан - СН4 этан - СН3-СН3 пропан - СН3-СН2-СН3 бутан - СН3-СН2-СН2-СН3 пентан - СН3-СН2-СН2-СН2-СН3 и т. д. Номенклатура. Названия нормальных алканов, за исключением четырех членов ряда (метан, этан, пропан, бутан) образованы от греческих и латинских числительных с добавлением суффикса -ан. Разветвленные углеводороды называют по номенклатуре ИЮПАК. Общая формула радикалов СnH2n+1. Названия радикалов образуют, заменяя суффикс «ан» в названии соответствующего алкана на суффикс «ил». Например, СН4 – метан, радикал СН3 – метил. Подробно материал по этому разделу представлен в []. При наличии в алкане или алкильном радикале фрагмента СН3-СН(СН3)- к его названию добавляют префикс изо, фрагмента СН3 -С(СН3)2- префикс нео, например, СН3-СН(СН3)-СН3 - изобутан, СН3-С(СН3)2-СН3 - неопентан. По рациональной номенклатуре алканам дают названия как производным метана, полученным в результате замещения одного или нескольких атомов водорода на алкильные радикалы. Например, пропан СН3-СН2-СН3 по рациональной номенклатуре будет иметь название - диметилметан. Нахождение и применение алканов в природе. Алканы широко распространены в природе, являются главными компонентами нефти, природного газа, попутного нефтяного газа, горючих сланцев, природных восков, озокерита. Основные области применения алканов указываются при рассмотрении свойств этих соединений. Получение алканов. 1. Промышленные способы получения: а) переработка различными методами природных источников (перегонка и крекинг нефти, риформинг, пиролиз); б) гидрирование ненасыщенных углеводородов:  в) синтез Фишера-Тропша: 2. Лабораторные способы получения: а) реакция Вюрца: 2RHal + 2Na → R-R + 2NaHal б) декарбоксилирование солей карбоновых кислот: в) электролиз солей карбоновых кислот (синтез Кольбе): 2RCOONa + 2H2O → R-R + 2CO2 + 2NaOH + H2 г) восстановление галогеналканов, карбонильных соединений: RHal + H2 → R-H + HHal Изомерия алканов. 1. Структурная изомерия Для алканов, начиная с бутана, существуют структурные изомеры, отличающиеся строением углеродной цепи. Например, молекулярной формуле С4Н10 соответствует два соединения - СН3-СН2-СН2-СН3 нормальный бутан и СН3-СН(СН3)-СН3 изобутан (2-метилпропан). Число изомеров возрастает с увеличением числа атомов углерода в составе молекулы. Таблица 4. Количество структурных изомеров алканов
Атомы углерода в молекулах алканов подразделяются на первичные, вторичные, третичные, четвертичные в зависимости от числа соседних С-атомов. 2. Конформационная изомерия Этот вид изомерии характерен для углеводородов с числом атомов углерода два и более. Например, молекула этана существует в виде двух пространственных конформационных изомеров заслоненной и заторможенной конформаций: 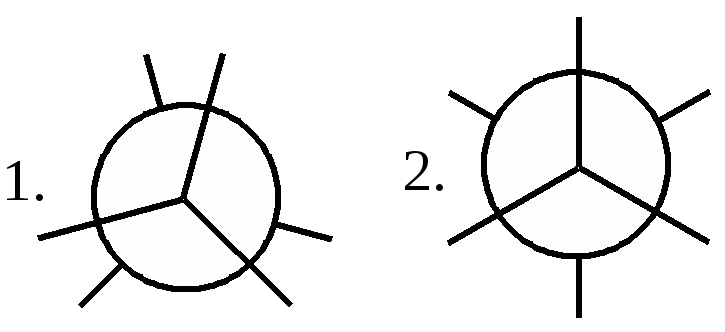 1. заслоненная конформация этана; 2. заторможенная конформация этана. Молекулы с длинными углеродными цепями существуют, в основном, в форме зигзагообразных конформаций. При этом близко оказываются атомы 1-5 или 1-6, что способствует циклизации углеводородной цепи. 3. Оптическая изомерия Молекулы разветвленных алканов (С7 и более) могут быть хиральными с одним или несколькими асимметрическими атомами углерода. Например: 1 2 3 4 5 6 СН3 - СН2 – *СН – СН2 – СН2 – СН3 3-метилгексан │ СН3 Это соединение существует в виде двух оптических изомеров - энантиомеров (R, S-конфигурации). Строение алканов. Согласно теории гибридизации для атомов углерода в предельных углеводородах характерна sp3-гибридизация. Поэтому в соединениях данного типа существуют только ковалентные σ-связи: С-С (sp3-sp3 - перекрывание) и С-Н(sp3-s - перекрывание). Ковалентные связи в алканах мало поляризуемые, неполярные. Дипольные моменты молекул предельных соединений равны нулю. В связи с этим межмолекулярные взаимодействия очень слабые, что и предопределяет физические свойства алканов. Для σ-связей С-Н и С-С характерна высокая прочность (ЕС-С - 347 кДж/моль; ЕС-Н - 415 кДж/моль), которая зависит от типа атомов углерода. Наименее прочными является связи у третичного атома углерода, что делает такие связи наиболее уязвимыми в химических превращениях. Пространственное строение алканов обусловлено тетраэдрической конфигурацией атомов углерода (валентный угол – 109028/). Физические свойства. Поскольку межмолекулярные взаимодействия в алканах очень слабые, для них характерны низкие температуры кипения и плавления, низкая плотность (меньше воды). В гомологическом ряду физические константы углеводородов закономерно увеличиваются. Разветвления углеродной цепи понижают значения указанных характеристик. Алканы практически нерастворимы в воде, однако легко растворяются в мало полярных и неполярных органических растворителях. Жидкие углеводороды имеют «бензиновый» запах. Химические свойства. Алканы обладают низкой реакционной способностью (парафины - «низкое сродство»). Их превращения осуществляются в жестких условиях. Причем гомолитический разрыв связей требует значительно меньших энергетических затрат, чем гетеролитический разрыв, поэтому для алканов характерны радикальные реакции (замещение атомов водорода, расщепление углеродного скелета, окисление). Однако в полярных средах могут происходить гетеролитические реакции. В обычных условиях алканы устойчивы к действию концентрированных кислот и щелочей, окислителей, щелочных металлов. 1. Реакции радикального замещения (SR) Для реакций данного типа характерен цепной радикальный механизм, который включает в себя стадии: 1. инициирования Х:Х → 2Х. 2. развитияцепи R-Н + Х. → Н-Х + R. R. + Х:Х → R-Х + Х. На каждой стадии генерируется радикал, что характерно для цепных реакций. 3. обрыва цепи R. + R. → R-R R. + Х. → R-Х Х. + Х. → Х-Х Стабильность радикалов увеличивается в ряду: метильный < первичный < вторичный < третичный: 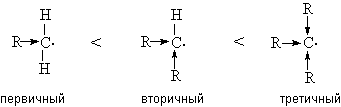 К реакциям данного типа относятся реакции галогенирования, нитрования, сульфохлорирование. а) галогенирование Стадией, определяющей скорость реакции, является стадия отщепления водорода атомом галогена. Реакционная способность галогенов по отношению к алканам уменьшается в ряду: F2 >Cl2 >Br2 >I2 Фторирование протекает с большим выделением энергии, что приводит к полному разрушению (осмоление, деструкция) органической молекулы. При хлорировании углеводородов, как правило, образуется смесь монохлорпроизводных, т.е. реакции протекают нерегиоселективно. Зная относительную реакционную способность С-Н связей (перв-С-Н < втор-C-Н < трет- С-Н = 1,0:3,8:5,0) и количество С-Н связей определенного типа, можно рассчитать состав смеси продуктов хлорирования. Бромирование алканов, в отличие от хлорирования, протекает региоселективно; в первую очередь образуются третичные бромпроизводные, что соответствует ряду относительной стабильности алкильных радикалов. Иодирование – процессы эндотермические, обратимые, поэтому на практике их не проводят. Моно- и полизамещенные галогеналканы широко используются в качестве растворителей (хлороформ, дихлорэтан, четыреххлористый углерод и т.д.) и для органических синтезов. б) сульфохлорирование Сульфохлорирование осуществляют действием смеси хлора и диоксида серы (IV) при УФ-облучении: RH + SO2 + Cl2 → RSO2Cl + HCl RSO2Cl + 2NaOH → RSO2О-Na+ + NaCl + H2O Алкилсульфохлориды (далее акилсульфонаты) используются как поверхностно-активные вещества (ПАВ). в) нитрование Нитрование алканов проводят в жидкой (10-20% раствор НNО3, 120-1500С) и газовой фазах (концентрированная НNО3 , 450-4750 С). При нагревании алканов с разбавленной азотной кислотой (реакция Коновалова) происходит образование нитросоединений, в первую очередь у наиболее реакционноспособного третичного атома углерода: 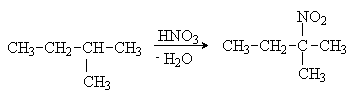 Газофазное нитрование протекает неселективно с образованием смеси как продуктов замещения водорода, так и продуктов расщепления С-С связей: Нитроалканы широко используются в качестве растворителей и для органических синтезов. 2. Окисление При комнатной температуре даже такие сильные окислители, как KMnO4 и K2Cr2O7, не действуют на алканы. а) полное окисление (горение) При высоких температурах в присутствии избытка кислорода алканы сгорают с образованием углекислого газа и воды: 2CnH2n+2 + (3n + 1)O2 → 2nCO2 + (2n + 2)H2O + ΔН Реакция сопровождается выделением большого количества теплоты, вследствие чего алканы широко используются как источники энергии (топливо для бытовых и промышленных нужд, для двигателей различного типа ). б) неполное окисление Неполное каталитическое (катализаторы - соединения марганца, кобальта, более низкая температура - не выше 2000С) окисление алканов кислородом сопровождается образованием спиртов, кетонов, карбоновых кислот:  В реакции в первую очередь принимают участие наиболее реакционноспособные третичные или вторичные атомы углерода. Окисление используется в промышленности для синтеза ценных кислородсодержащих соединений и их смесей. 3. Крекинг (от англ. Сrack - растрескивать, ломать) - расщепление углеводородов нефти. Крекинг является важнейшим методом химической переработки нефти, дает ценное химическое сырье и различные виды топлива. Осуществляют крекинг при температуре 450-6000С либо в присутствии катализаторов (алюмосиликатов) при более низких температурах. Процесс сопровождается разрывом связей С-Н и С-С с образованием насыщенных и ненасыщенных углеводородов с меньшей длиной цепи: СН3-СН2-СН2-СН2-СН3 → СН3-СН3 + СН3-СН=СН2 4. Изомеризация (протекает в присутствии катализаторов - кислот Льюиса):  5. Дегидрирование: ЗНАЕТЕ ЛИ ВЫ, ЧТО -Химик-органик Михаил Иванович Коновалов в 1888 году открыл реакцию нитрования, его имя реакция носит и поныне. По словам Н.Д. Зелинского, М.И. Коновалов «оживил химических мертвецов». -Академик Н.Н. Семенов (Россия) и С.-Н. Хиншелвуд (Англия) за цикл работ по разработке теории цепных реакций в 1956 году удостоены Нобелевской премии. -Метан - болотный, рудничный газ, основной компонент природного и нефтяного газа, применяется как высококалорийное топливо и сырье для промышленных синтезов: водорода, ацетилена, нитрометана, синтез-газа и т. д. Составляет основу атмосферы некоторых планет, например, Сатурна, Юпитера. -Пропан С3Н8 и бутан С4Н10 легкосжижаемые газы, используются в быту в виде баллонного газа. Пропан - автомобильное топливо, бутан - сырье для получения каучуков. -Парафин - смесь твердых алканов С18-С35, без запаха, цвета, вкуса, жирный на ощупь продукт, получаемый из нефти. -Вазелин - мазеобразная масса без вкуса и запаха, получаемая расплавлением парафина в минеральном масле. -Озокерит - горный воск-минерал, состоящий из углеводородов предельного ряда, желтого, зеленого или бурого цвета, применяется в лакокрасочной, парфюмерной промышленности, медицине. -Загрязнение атмосферы, почвы, водоемов, подземных вод происходит при добыче, транспортировке жидких и газообразных углеводородов, переработке, производстве, применении алканов. -При галогенировании при температуре более 3000С на 1 квант света образуется несколько тысяч молекул хлорметана. - Добавление тетраэтилсвинца в бензин снижает способность детонировать (антидетонатор). Для удаления его с внутренних стенок цилиндра добавляют 1,2-дибромэтан, при этом образуется летучий тетрабромид свинца, который удаляется с выхлопными газами, является сильным ядом. Более безопасный, но дорогой, антидетонатор - циклопентадиенилпентакарбонил марганца С5Н5Мп(СО)5, повышает октановое число топлива до135. ЛЕКЦИЯ 7. НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ План 1. Алкены: а) гомологический ряд, номенклатура, получение; б) изомерия, строение; в) свойства. 2. Алкадиены. 3. Алкины. К непредельным (ненасыщенным) углеводородам относятся соединения, в составе которых присутствуют кратные углерод-углеродные связи: двойные С=С или тройные С≡ С (алкены, диены, алкины). Термин «непредельные» связан со способностью этих соединений вступать в реакции присоединения с разрывом кратных связей и с образованием соединений предельного (насыщенного) характера. | ||||||||||||||||||||
