конспект лекций.Химия(органическая химия).dos. конспект лекций.Химия(органическая химия). Конспект лекций по дисциплине для студентов, обучающихся по специальностям и направлениям 050100. 62Естественнонаучное образование
 Скачать 1.49 Mb. Скачать 1.49 Mb.
|
|
Физические свойства. Галогенпроизводные углеводородов не образуют водородных связей, поэтому для них характерны низкие значения температур кипения и плавления, при обычных условиях они являются газами или жидкостями со своеобразными запахом, в воде практически не растворяются. Физические свойства очень сильно зависят от природы и числа атомов галогена в составе молекулы. Химические свойства. Для галогенпроизводных углеводородов характерны высокая реакционная способность и разнообразие химических превращений, поэтому они широко используются в органическом синтезе для получения разнообразных органических соединений. Основные типы реакций, характерные для галогенпроизводных, – это реакции нуклеофильного замещения (SN) и отщепления (E), реакции с металлами, причем различие в реакционной способности галогенпроизводных разного типа в этих реакциях очень велико. Галогенпроизводные, содержащие кратные связи или бензольное кольцо, вступают также в реакции, характерные для ненасыщенных и ароматических углеводородов, с учетом влияния на эти реакционные центры атома галогена. 1. Нуклеофильное замещение (SN). Реакции нуклеофильного замещения легко происходят в полярных растворителях и сопровождаются гетеролитическим расщеплением σ-связи С-Наl. Реакции нуклеофильного замещения SN в общем виде можно представить следующим образом: R-Наl + :N → R-N + Hal- субстрат нуклеофил продукт уходящая группа Примеры нуклеофилов: а) О-содержащие - щелочи, вода(гидролиз), алкоголяты, спирты (алкоголиз); б) N-содержащие - амины, аммиак (аммонолиз), нитриты; в) S-содержащие - сероводород, сульфиды щелочных металлов, роданиды; г) С-содержащие - циановодород, цианиды щелочных металлов, ацетилениды щелочных металлов; д) амбидентные нуклеофилы - нитраты, нитриты, цианиды, роданиды. Реакционная активность галогенпрозводных в реакциях нуклеофильного типа уменьшается в следующем направлении: бензил- и аллилгалогениды > алкилгалогениды (третичные> вторичные >первичные) > винил- и арилгалогениды; в зависимости от природы галогена - иодпрозводные > бромпроизводные > хлорпроизводные > фторпроизводные. Реакции нуклеофильного замещения у атома углерода в состоянии sp3-гибридизации протекают по двум механизмам: бимолекулярное нуклеофильное замещение (SN2) и мономолекуляное нуклеофильное замещение (SN1). Бимолекулярное нуклеофильное замещение протекает в одну стадию. Разрыв старой σ-связи С-НаI и образование новой σ-связи С-N происходят одновременно. Скорость реакции зависит от концентрации и субстрата, и нуклеофила. Реакции SN2-типа более характерны для первичных алкилгалогенидов. Если нуклеофильное замещение происходит у асимметрического атома углерода, то имеет место обращение конфигурации, т.е. в результате реакции образуется продукт противоположной конфигурации. Мономолекулярное нуклеофильное замещение протекает в две стадии. На первой стадии под действием растворителя в субстрате происходит гетеролитический разрыв σ-связи С-Hal, в результате чего образуется карбокатион. Процесс протекает медленно и определяет скорость реакции в целом. На второй стадии карбокатион быстро реагирует с нуклеофилом, давая продукт замещения. Скорость реакции зависит только от концентрации субстрата, поскольку нуклеофил не участвует в лимитирующей стадии процесса. Реакции SN1-типа более характерны для бензил- и аллилгалогенидов, третичных алкилгалогенидов. Если нуклеофильное замещение происходит у асимметрического атома углерода, то, как правило, образуется рацемическая смесь. Сила нуклеофила зависит от ряда факторов: 1) отрицательно заряженные нуклеофилы сильнее, чем нейтральные молекулы - OH- > H2O; RO- > ROH; NH2- > NH3; 2) для элементов одного периода с ростом электроотрицательности атома нуклеофильность уменьшается: NH2- > OH- > F- и R3C- > RNH2- > RO- > F-; 3) электронодонорные заместители увеличивают, а электроноакцепторные – уменьшают нуклеофильность реагента. Например, для кислородсодержащих нуклеофилов установлен следующий ряд реакционной способности: RO- > OH- > RCOO- > ArO-. 4) для элементов одной подгруппы с возрастанием заряда ядра нуклеофильность реагента увеличивается: RS- >RO- и I- > Вr- > Cl- > F-. На скорость и механизм реакций нуклеофильного замещения оказывает влияние природа растворителя. Протеканию реакции по механизму SN1 способствуют сильноионизирующие растворители. К ним относятся полярные протонные растворители (вода, спирты, карбоновые кислоты); влияние растворителя на SN2-реакции проявляется в меньшей степени. Реакции нуклеофильного замещения галогена широко используются в органическом синтезе. С их помощью можно замещать атомы галогенов галогенпроизводных на другие функциональные группы или углеводородные радикалы и получать таким образом любые классы органических соединений: спирты, простые эфиры, сложные эфиры, тиолы, сульфиды, амины, нитрилы и нитросоединения и т.д. Винил- и арилгалогениды инертны по отношению к нуклеофильным реагентам. Замещение галогена в галогенбензолах возможно только в очень жестких условиях. Введение в кольцо электроноакцепторных заместителей в орто- и пара-положения к галогену активизируют галогенарены в SN-реакциях. 2. Реакции отщепления (Е). Реакции отщепления и нуклеофильного замещения всегда протекают параллельно, поскольку реагенты в этих реакциях являются нуклеофилами и основаниями. Соотношение продуктов отщепления и замещения зависит от природы реагентов и условий проведения реакции. Протеканию реакции отщепления способствуют высокая основность реагента, малополярные растворители, высокая температура. Реакции отщепления более характерны для галогеналканов, при этом склонность галогенпроизводных к реакциям отщепления возрастает в ряду: первичные < вторичные < третичные. Отщепление протекает под действием сильных оснований – концентрированных растворов гидроксидов щелочных металлов в спирте, алкоголятов или амидов щелочных металлов. Основания отщепляют протон у менее гидрированного ß-углеродного атома, при этом образуется наиболее замещенный при двойной связи алкен (правило Зайцева): СН3 -СН2-СНBr-СН3 + КОН (спирт) → СН3-СН=СН-СН3 + КBr Реакции Е-типа могут протекать по мономолекулярному (Е1) или бимолекулярному (Е2) механизмам. 3. Взаимодействие с металлами. Галогенпроизводные углеводородов реагируют с металлами с образованием металлорганических соединений или продуктов их дальнейшего превращения. Наиболее известные превращения - это взаимодействие с щелочными и щелочноземельными металлами. а) Реакция Вюрца Реакция используется для получения углеводородов: 2 R-Br + 2Nа → R-R + 2NаBr б) Образование магнийорганических соединений (реактива Гриньяра): R- Br + Mg (абсолют. эфир) → R-Mg Br Реактив Гриньяра широко используется в органическом синтезе для получения спиртов, карбонильных соединений, карбоновых кислот. Применение галогенпроизводных соединений: 1. растворители неполярных и слабополярных веществ - смол, жиров, восков, лаков, каучуков, битумов, серы и др.; 2. как хладоагенты, распылители (фреоны) нашли широкое применение в бытовых холодильниках, кондиционерах и аэрозольных бытовых баллончиках; 3. антипирены (противопожарные средства), используются для защиты от возгорания древесины, тканей, пластмасс и т.д.; 4. крупнотоннажные производства полимеров - поливинилхлорида, политетрафторэтилена; 5. сырье для получения глицерина, фенола, пикриновой кислоты, лекарственных средств, инсектицидов. Знаете ли вы, что -В 1847 году Дж. Симпсон, русский хирург Н.И. Пирогов впервые хлороформ использовали для общего наркоза. -В 1855 г. французский химик Шарль Адольф Вюрц разработал способ получения углеводородов нагреванием галогеналканов с металлическим натрием. -В 1875 г. выдающимся русским химиком Александром Михайловичем Зайцевым открыта закономерность в направлении реакций отщепления, которая носит название правило Зайцева. -Хлороформ НССl3 , хлорэтан используются в качестве анестезирующих веществ, арены с галогеном в боковой цепи - лакриматоров. -Пестициды - полихлорпроизводные ароматических и алициклических углеводородов, например ДДТ - дихлордифенилтрихлорэтан , гексохлоран, хлордан, дильдрин, характеризуются высокой токсичностью, высокой стойкостью к разрушению. -1,4-дихлорбензол - средство от моли, кристаллическое вещество со сладким запахом, пары тяжелее воздуха, проникают в толщу одежды. -Отравляющие вещества - иприт, диоксин. -Политетрафторэтилен (тефлон) (-СF2 - СF2 -)n - полимер, устойчивый к действию концентрированных кислот, щелочей, окислителей, поэтому его называют «кожей носорога», «алмазным сердцем» . ЛЕКЦИЯ 10. СПИРТЫ. ФЕНОЛЫ План 1. Классификация гидроксилпроизводных углеводородов. 2. Предельные одноатомные спирты (алканолы). 3. Многоатомные спирты. 4. Фенолы. 5. Простые эфиры. Гидроксилпроизводными углеводородов называются соединения, которые образуются в результате замещения в молекуле углеводорода одного или нескольких атомов водорода на гидроксильные группы. Г непредельные спирты, например СН2=СН-СН2-ОН, ароматические спирты - Гидроксилпроизводные, содержащие связь С(sр2)-ОН, называются енолами R-СН=СН-ОН и фенолами По числу гидроксильных групп, содержащихся в молекуле, спирты и фенолы могут быть одно (одна ОН-группа)-, двух (две ОН-группы)-, трех- и многоатомными. Нахождение в природе. В отличие от галогенопроизводных углеводородов спирты и фенолы, их производные широко представлены в растительном и животном мире. Высшие спирты встречаются в свободном виде (например, цетиловый спирт С16Н33ОН), в составе сложных эфиров с высшими жирными кислотами (спермацет, воски). Непредельные спирты являются составной частью эфирных масел. Природными циклическими спиртами являются ментол и холестерин. Глицерин входит в состав природных растительных и животных жиров и масел. Фенолы и их простые эфиры входят в состав эфирных масел многих душистых растений, например чабреца, тимьяна, тмина, аниса, эстрагона, укропа и т.д. Многоатомные фенолы и их производные - душистые вещества растений (например гвоздики, мускатного ореха), составная часть гликозидов растений, дубильных веществ чая, кофе и т.д. 1. Предельные одноатомные спирты (алканолы). Общая формула СnН2n+1ОН. Номенклатура. По заместительной номенклатуре гидроксильная группа в названии спиртов обозначается суффиксом -ол. По радикально-функциональной номенклатуре в названии указывают радикал и добавляют -овый спирт: С2Н5ОН - этанолили этиловый спирт, СН3-СН2-СН2-ОН - пропанол-1 или пропиловый спирт. Получение: а) гидролиз галогеналканов. Галогеналканы в реакциях с водой или водным раствором щелочи легко образуют спирты (см. «Галогенпроизводные углеводородов»): С2Н5Вr + NаОН(водный раствор) →С2Н5ОН + NаВr. б) гидратация алкенов. Присоединение воды к алкенам происходит в присутствии катализатора (см. «Алкены»): С в) гидрирование карбонильных соединений. Каталитическое гидрирование альдегидов и кетонов приводит к образованию спиртов (см. «Альдегиды и кетоны»): СН3-СН=О + Н2 → СН3-СН2-ОН Катализаторы: Ni, Pt, Pd. г) реакции магнийорганических соединений. Легко происходит присоединение магнийорганических соединений к альдегидам и кетонам (см.«Альдегиды и кетоны»): Из метаналя образуется первичный спирт, из альдегидов - вторичные спирты, кетонов - третичные спирты. Особенность реакций этого типа - продукты реакции - спирты содержат больше атомов углерода по сравнению с исходными карбонильными соединениями. д) гидрирование оксида углерода (II). В зависимости от природы катализатора и условий реакции получают метанол или смесь различных спиртов (синтол): СО + 2Н2 → СН3-ОН. Катализаторы: ZnO, Co и другие. е) спиртовое брожение углеводов. Глюкоза в присутствии дрожжей подвергается брожению с образованием этилового спирта и углекислого газа: С6Н12О6 → 2СН3-СН2-ОН + 2СО2 Изомерия. Для предельных спиртов характерна структурная изомерия: изомерия углеродной цепи, расположения гидроксильной группы в цепи. По положению гидроксильной группы в цепи различают первичные (R-СН2-ОН), вторичные (R2СН-ОН) и третичные (R3С-ОН) спирты. Для спиртов характерна межклассовая изомерия (метамерия), спиртам изомерны простые эфиры с общей формулой R-O-R. Спирты, содержащих в молекуле асимметрический атом углерода, существуют в виде оптических изомеров, например бутанол-2 СН3-СН2-СНОН-СН3 (см. «Оптическая изомерия»). Строение. В спиртах атомы углерода и кислорода находятся вsр3 - гибридизации. Спирты содержат две полярные σ-связи: С-О (sр3-sр3-перекрывание) и О-Н (sр3 -s -перекрывание). Диполи этих связей направлены в сторону атома кислорода, причем дипольный момент связи О-Н выше, чем связи С-О. Алканолы являются полярными соединениями: δ- δ+ Ассоциация молекул спиртов осуществляется за счет образования межмолекулярных водородных связей: , в результате спирты, по сравнению с углеводородами и галогенпроизводными углеводородов, имеют более высокие температуры кипения и плавления. Образование водородных связей между молекулами спиртов и воды способствует растворению этих соединений в воде. Химические свойства. Химические свойства спиртов обусловлены наличием в молекуле полярных связей С-О и О-Н и неподеленных электронных пар на атоме кислорода. а) кислотные свойства Спирты являются слабыми О-Н-кислотами. Ряд кислотности: RСООН > НОН > RОН. В водном растворе кислотность самих спиртов уменьшается в следующем направлении: метанол > первичные > вторичные > третичные. Кислотные свойства спиртов проявляются в образовании солей (алкоголятов или алкоксидов) при взаимодействии с металлами: 2С2Н5ОН + 2Nа → 2 С2Н5О- Nа+ + Н2 этанол этилат(этоксид) натрия В водных растворах соли гидролизуются с образованием спиртов и щелочей: С2Н5О- Nа+ + НОН → С2Н5ОН + NаОН б) основные и нуклеофильные свойства Основные и нуклеофильные свойства спиртов обусловлены неподеленной электронной парой на атоме кислорода. Основные свойства увеличиваются в следующем направлении метанол < первичные < вторичные < третичные спирты и проявляются в образовании оксониевых солей: С2Н5ОН + Н+ → С2Н5ОН2+. Образование оксониевых солей играет важную роль в реакциях нуклеофильного замещения и отщепления. Таким образом, спирты являются амфотерными соединениями. Слабые нуклеофильные свойства спиртов и алкоголятов проявляются в реакциях -алкилирования - взаимодействия со спиртами и алкоголятами с образованием простых эфиров (реакция Вильямсона, протекает при нагревании): СН3Br + С2Н5ОNа → С2Н5ОСН3 + NаBr метилбромид этилат натрия метоксиэтан, -ацилирования - взаимодействия с карбоновыми кислотами и их производными с образование сложных эфиров (реакция этерификации, протекает в присутствии катализатора): СН3СООН + С2Н5ОН ↔ СН3СООС2Н5 + НОН уксусная кислота этанол этилацетат, -с карбонильными соединениями - образование полуацеталей и ацеталей: этаналь метанол 1-метоксиэтанол 1,2-диметоксиэтанол. Алкоголяты по сравнению со спиртами являются более сильными основаниями и нуклеофилами. в) реакции замещения гидроксильной группы (нуклеофильное замещение - SN ) Часто в этих реакциях ОН-группу модифицируют с помощью минеральных кислот или кислот Льюиса (образование оксониевых солей RОН2+). Модифицированная гидроксильная группа легко замещается на атом галогена, амино- и алкоксигруппу и другие группы. Реакционная активность спиртов в этих реакциях увеличивается в следующем направлении: первичные < вторичные < третичные. Примеры реакций. Замещение гидроксильной группы на атом галогена: R-ОН + SOCl2 → R-Cl + НCl + SО2 R-ОН + РНal5 → R-Нal + Н-Нal + РОНal3 R-ОН + Н-Нal → R-Нal + НОН Реакционная активность галогеноводородов увеличивается в направлении НСl < НBr <НJ. Однако иодоводород практически не используют в реакциях этого типа, поскольку он легко восстанавливает спирты до углеводородов. Замещение гидроксильной группы на амино- и алкоксигруппу: R-ОН + Н-NН2 → R- NН2 + НОН R-ОН + RО-Н → R-О-R + НОН. Взаимодействие с минеральными кислотами с образованием сложных эфиров: R-ОН + Н-ОNО2 → R-ОNО2 + НОН алкилнитрат R-ОН + Н-ОSО3 → R-ОSО3 + НОН алкилсульфат Реакции нуклеофильного замещения протекают по мономолекулярному (SN 1) или бимолекулярному (SN2) механизму. г) реакции отщепления гидроксильной группы (Е-типа, дегидратация спиртов) Отщепление воды происходит при нагревании в присутствии катализатора - серной или фосфорной кислот, оксида цинка или алюминия. Дегидратация спиртов с образованием алкенов протекает в соответствии с правилом Зайцева: гидроксильная группа отщепляется от α-углеродного атома, водород - от менее гидрированного β-атома углерода спирта: 1-бутанол 2-бутен Реакционная активность спиртов увеличивается в следующем направлении: первичные < вторичные < третичные. Реакции отщепления протекают по мономолекулярному (Е1) или бимолекулярному ( Е2) механизму. д) окисление спиртов В реакциях окисления более активны первичные спирты, третичные спирты в аналогичных условиях не окисляются. Окислители: перманганат калия или бихромат калия в кислой среде.Первичные спирты окисляются с образованием альдегидов и далее - карбоновых кислот, вторичные спирты - кетонов: R-ОН + [ О ] → R-СН=О → R-СООН R2СН-ОН + [ О ] → R2С=О Первичные и вторичные спирты могут быть превращены в карбонильные соединения при дегидрировании. Реакции протекают при 400-5000С в присутствии катализатора - Cu/Аg:  2. Многоатомные спирты Наиболее важные представители двухатомных и трехатомных спиртов 1 1,2,3-пропантриол(глицерин) Геминальные многоатомные спирты (две гидроксильные группы при одном атоме углерода) неустойчивы и переходят, теряя воду, в карбонильные соединения (правило Эльтекова). Многоатомным спиртам присущи все характерные свойства спиртов, однако присутствие нескольких гидроксильных групп влияет на физические и химические свойствах этих соединений. Так, увеличение числа гидроксильных групп в молекулах спиртов сопровождается увеличением числа межмолекулярных водородных связей и, следовательно, повышением температур кипения и плавления, растворимости в воде, вязкости. а) Кислотные свойства Кислотные свойстваспиртов возрастают в направлении алканолы <диолы <триолы. Диолы и триолы взаимодействуют с металлами, щелочами с образованием моно-, ди-, тризамещенных солей. Качественной реакцией на многоатомные спирты является взаимодействие с гидроксидом меди (II), в результате которого образуется внутрикомплексная (хелатного типа) соль меди (II), водный раствор которой имеет васильковый цвет: В реакциях нуклеофильного замещения многоатомные спирты образуют моно-, ди- и тризамещенные производные: б) Образование галогенопроизводых НО-СН2-СН2-ОН + РСl5 →НО-СН2-СН2 -Сl Сl -СН2-СН2 — Сl этиленгликоль 2-хлорэтанол 1,2-дихлорэтан в) Образование сложных эфиров неорганических и органических кислот  глицерин тринитрат глицерина Тринитрат глицерина широко используется в производстве взрывчатых веществ, например динамита.  глицерин тристеарин (триглицерид) Сложные эфиры глицерина и высших карбоновых кислот называются жирами. При действии на глицерин фосфорной кислоты образуется смесь глицерофосфатов. Глицерофосфаты являются структурными компонентами фосфолипидов. г) Дегидратация Для этиленгликоля возможна внутри- и межмолекулярная дегидратация:  этиленгликоль виниловый спирт уксусный альдегид этиленгликоль диоксан При дегидратации глицерина образуется непредельный альдегид - пропеналь (акролеин):  глицерин акролеин д)Окисление Окисление многоатомных спиртов проходит по стадиям и в зависимости от природы окислителя сопровождается образованием разнообразных продуктов. Например, при окислении этиленгликоля образуются следующие соединения: Примерами многоатомных спиртов, содержащих четыре, пять и шесть гидроксильных групп, могут служить соответственно эритриты, пентиты и гекситы. 3. Фенолы Общая формула гомологического ряда одноатомных фенолов СnH2n-7OH (Ar-OH). Простейшие представители этого ряда: фенол 4-метилфенол(п-крезол) 4-этилфенол Двухатомные фенолы: гидрохинон резорцин пирокатехин Трехатомные фенолы: оксигидрохинон флороглюцин пирогаллол Получение а) выделение из продуктов переработки каменного угля и нефти (каменноугольная смола, подсмольная вода); б) сплавление солей арилсульфоновых солей со щелочами: в) окисление изопропиларенов Кумольный способ (метод П.Г. Сергеева-Р.Ю.Удриса, 1942г.) является основным способом получения фенолов. Метод основан на окислении изопропилбензола (кумола) с последующим разложением продукта реакции - гидропероксида кумола:  г) разложение арилдиазониевых солей При нагревании арилдиазониевых солей в водных растворах образуются фенолы: [ Ar-N+ ≡N]X- + H2O → Ar-OH + N2 + HX. д) замещение атома галогена в арилгалогенидах Реакция протекает в жестких условиях с небольшим выходом фенола: Строение. Атом кислорода гидроксильной группы фенолов находится в sр2-гибридизации, одна неподеленная электронная пара атома кислорода расположена на р-орбитали. Взаимное влияние бензольного кольца и гидроксильной группы (р,π-сопряжение) приводит, по сравнению со спиртами, к некоторым изменениям в характеристиках (длина, полярность) σ-С-О и О-Н-связей (см. «Электронные эффекты»): и R → ОН Фенол и его гомологи являются полярными веществами. При этом дипольный момент в отличие от спиртов направлен в сторону бензольного кольца, гидроксильная группа выступает в качестве электронодонорной группы (+М -эффект >- J -эффект). Она повышает электронную плотность в орто- и пара-положениях бензольного кольца. Физические свойства. Фенолы - бесцветные кристаллические вещества (фенол) или жидкости (крезолы) со своеобразным, сильным и устойчивым запахом, на воздухе в результате окисления постепенно темнеют. Фенолы мало растворимы в воде, водный раствор фенола называют «карболовой кислотой» или «карболкой». Многоатомные фенолы хорошо растворимы в воде и других полярных растворителях. Химические свойства. Поскольку спирты и фенолы имеют одинаковую функциональную группу, для них характерны некоторые общие химические свойства: кислотные свойства, окисление. Однако в фенолах, по сравнению со спиртами, более подвижен атом водорода гидроксильной группы (усиление кислотных свойств) и менее подвижна сама гидроксильная группа (не характерны реакции нуклеофильного типа). Наряду с общими химическими свойства для фенолов характерны специфические свойства - электрофильное замещение атомов водорода в бензольном кольце (о-, п-положениях, см. «Арены»). а) кислотные свойства Фенолы слабые ОН-кислоты, однако в результате р,π-сопряжения поляризуемость О-Н- связи и устойчивость сопряженного фенолят-иона увеличиваются, что приводит к усилению кислотных свойств фенолов: кислоты> фенолы > вода> спирты. Электронодонорные группы (заместители 1 рода) в ароматическом кольце кислотные свойства понижают, электроноакцепторные группы (заместители 2 рода) - усиливают:так, кислотные свойства о-нитрофенола в тысячу раз, а 2,4,6- тринитрофенола (пикриновая кислота) в миллион раз больше кислотных свойств фенола. При взаимодействии с металлами, щелочами фенолы образуют соли - феноляты Ar-ОМе, растворимые в воде (рН > 7). В водных растворах с хлоридом железа (III) фенолы образуют окрашенные комплексные соединения (фенол - фиолетовое, крезол - синее, пирокатехин - зеленое и т.д.). б) алкилирование и ацилирование В реакциях этого типа большую реакционную активность проявляют феноляты, например щелочных металлов. При взаимодействии с галогенпроизводными углеводородов образуются простые эфиры: С6Н5ОNа + СН3-Cl → С6Н5О-СН3 + NаCl фенол метоксифенол(анизол) В реакциях ацилирования с галогенангидридами, ангидридами карбоновых кислот фенолы образуют сложные эфиры: фенолят натрия фенилацетат Реакции этерификации для фенолов в отличие от спиртов не характерны. в) электрофильное замещение(SE ) Гидроксильная группа в фенолах является орто-, пара-ориентантом, активирующим ароматическое кольцо к электрофильной атаке. В случае малоактивных электрофильных реагентов SE -реакции проводят с фенолятами. Для фенолов характерны как общие реакции ароматических соединений (галогенирование, сульфирование, нитрование, ацилиривание и алкилирование), так и специфические - взаимодействие со слабыми электрофилами - углекислым газом, карбонильными соединениями. Некоторые реакции протекают без катализатора с образованием моно-, ди- и тризамещенных соединений. Примеры реакций: 1. Легко в отсутствии катализатора происходит галогенирование, особенно бромирование, с образованием 2.4.6 -трибромфенола 2. При нитровании фенола получаются нитрофенолы, конечным продуктом нитрования является 2,4,6-тринитрофенол (пикриновая кислота) 3. Сульфирование фенола ведет к образованию фенолсульфоновых кислот, соотношение изомеров определяется температурным режимом реакции:  4. Алкилирование и ацилирование в ароматическое кольцо протекает в присутствии катализаторов - минеральных кислот или кислот Льюиса с образованием, в основном, п-изомеров. 5. Взаимодействие со слабыми электрофилами: Продукты второй реакции в присутствии кислот вступают в дальнейшие превращения с образованием высокомолекулярных соединений - фенолформальдегидных смол. Взаимодействие с кетонами (например, ацетоном) приводит к соединениям, которые широко используются для получения полимеров высокой прочности (лексан, мерлон) - материала для изготовления пуленепробиваемых стекол, жилетов. г) Окисление Фенолы очень легко окисляются; чем больше гидроксильных групп в составе фенолов, тем легче они окисляются. Окисление сопровождается разрушением ароматической структуры и образованием хинонов. Например, окисление двухатомного фенола - гидрохинона приводит к образованию п-бензохинона: Хиноны широко распространены в природе и играют роль антибиотиков, пигментов, витаминов, коферментов. 4. Простые эфиры Простые эфиры можно рассматривать как производные спиртов, в которых атом водорода гидроксильной группы замещен на углеводородный радикал. Получение. 1. Взаимодействие алкоголятов с галогенпроизводными (синтез Вильямсона): R-Hal + R/O-Na+ → R-OR/ + NaHal. 2. Межмолекулярная дегидратация спиртов (в присутствии серной кислоты): ROН + ROН → R-OR + Н2О. Химические свойства. Простые эфиры обладают низкой реакционной способностью. Их реакции можно разделить на три группы: реакции по атому кислорода, реакции по С-Н-связи в α-положении, реакции с разрывом связи С-О. Атом кислорода с неподеленными парами электронов обусловливает основные свойства простых эфиров. Простые эфиры являются слабыми основаниями и образуют оксониевые соединения при взаимодействии с сильными протонными кислотами и кислотами Льюиса. При длительном хранении простых эфиров на свету образуются гидропероксиды – нестабильные взрывоопасные соединения. Поэтому перед использованием простые эфиры необходимо проверять на присутствии пероксидов. Реакции с разрывом связи С-О протекают в жестких условиях в присутствии сильных кислот. Алкоголят анион RO- является сильным основанием и плохой уходящей группой, поэтому его отщепление возможно только после предварительного превращения в хорошую уходящую группу путем протонирования. Применение спиртов и фенолов: -Метиловый спирт(очень ядовит) - растворитель, сырьё для получения формальдегида, полимеров, лекарственных препаратов, добавка к моторному топливу. -Этиловый спирт - сырье для органического синтеза, растворитель, дезинфицирующее средство, компонент спиртных напитков. -Этиленгликоль (очень ядовит) - в производстве антифризов - водных растворов этиленгликоля, имеющих очень низкую температуру замерзания (например, температура замерзания 66%-го раствора составляет -600С). Используют этиленгликоль для получения полимеров (например, полиэтилентерефталата, из которого изготавливают пластиковые емкости), синтетических волокон (например, лавсан), взрывчатых веществ. -Глицерин используют для получения взрывчатых веществ, лекарственных средств (сосудорасширяющее средство), в косметической, парфюмерной, кондитерской промышленности. -Фенолы используют для получения взрывчатых веществ, формальдегидных смол (бакелит или новолак, резол, резолит, резит). Знаете ли вы,что -В XVIII веке А. Лавуазье установил качественный состав этилового спирта. -В 1833 году Й.Я.Берцелиус определил количественный состав этанола и предложил все спирты называть алкоголями. -В1834 году Ж.Б. Дюма из продуктов сухой перегонки древесных опилок выделил метиловый или древесный спирт. -В 1858 году М. Бертло синтетическим путем получил метиловый спирт. -В 1779 году шведский химик Карл Шееле при нагревании оливкового масла с кислотой выделил маслянистую жидкость, сладкую на вкус, и назвал «глицерин» (от греч. Glуkeros - сладкий). -В 1846 году итальянский химик Асканьо Собреро получил тринитрат глицерина («гремучее масло»). -В 1847 году Н.Н. Зинин впервые использовал тринитроглицерин в Крымской войне. -В 1866 году шведский инженер-химик, изобретатель и промышленник Альфред Нобель изобрел динамит, смесь 75% нитроглицерина и 25% инфузорной земли (природная глина «кизельгур»). -При разложении 4 моль нитроглицерина выделяется 650л газообразных веществ - СО2. Н2О, О2, N2 и большое количество энергии. -В 1834 году немецкий химик Фридлиб Фердинанд Рунге из продуктов перегонки каменноугольной смолы выделил фенол. -В 1871 году английский химик П. Вульф получил пикриновую кислоту, которую использовали в качестве красителя, для получения взрывчатых веществ (мелеит, медит, тимоза). -В 11 веке в Италии получали этиловый спирт, который служил лекарством, называли его «жизненной водой», утешавшей человеческое тело, возвращающей старикам молодость. -В средние века обнаружили, что при перегонке вина отгоняется бесцветная горючая жидкость, обладающая как и вино свойством опьянения. Остаток после перегонки этим свойством не обладает. Эту жидкость назвали spiritus vini - дух вина, отсюда и название- винный спирт. -В XV веке впервые слово «алкоголь» применил к этиловому спирту немецкий врач и естествоиспытатель Теофраст Парацельс ( араб. Al-kuhl - тонкий порошок). -Метиловый спирт - сильный яд, 5- 10мл спирта при попадании в организм вызывает слепоту, доза в 30 мл смертельна для человека. -При метаболизме этанола в организме человека выделяется около 770кДж/моль энергии, т.е. алкогольные напитки весьма калорийны. -Пирокатехин является структурным элементом многих биологически активных веществ, например катехоламинов. Монометиловый эфир пирокатехина, гваякол, используется как лекарственное средство для лечения заболеваний верхних дыхательных путей. -Резорцин применяется как антисептическое средство при лечении кожных заболеваний. -Гидрохинон является структурным элементом природных соединений, например витаминов группы Е. Восстановительная способность гидрохинонового фрагмента используется в окислительно-восстановительных процессах, сопровождающих дыхание. Сам гидрохинон служит исходным веществом в синтезе многих лекарственных средств. ЛЕКЦИЯ № 11. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ План 1. Классификация карбонильных соединений. 2. Гомологический ряд, номенклатура, получение. 3. Изомерия, строение. 4. Свойства. Производные углеводородов, содержащие карбонильную группу, называются карбонильными соединениями. Если карбонильная группа соединена с углеводородным радикалом и водородом, то такие соединения называются альдегидами (группа - альдегидная группа), если с двумя радикалами - соединения называются кетонами (группа - кетогруппа). В зависимости от природы радикала альдегиды и кетоны бывают алифатическими (предельные и непредельные альдегиды Общая молекулярная формула предельных альдегидов и кетонов СnН2nО. Гомологический ряд альдегидов: Н2С=О - метаналь, муравьный альдегид, формальдегид(formica-муравей) СН3-СН=О - этаналь, уксусный альдегид, ацетальдегид СН3-СН2-СН=О - пропаналь, пропионовый альдегид СН3-СН2-СН2-СН=О - бутаналь, масляный альдегид, бутираль и т.д. Г пропанон, диметилкетон, ацетон бутанон-2, метилэтилкетон пентанон-2, метилпропилкетон и т.д. Номенклатура. По номенклатуре ИЮПАК названия карбонильных соединений образуют от названия углеводорода, добавляя суффикс -аль или -он. Номенклатура ИЮПАК для карбонильных соединений рассмотрена ранее (см. «Номенклатура органических соединений»). Альдегиды также можно называть по названию кислот, в которые они переходят при окислении: муравьиный альдегид - муравьиная кислота, уксусный альдегид - уксусная кислота и т.д. Некоторые альдегиды и кетоны имеют тривиальные названия. В цепи альдегидов и кетонов атомы углерода могут быть обозначены буквами греческого алфавита:α, β, γ и т.д., например γ β α СН3-СН2-СН2-СН=О. Нахождение в природе. Карбнильные соединения широко распространены в растительном и животном мире, входят в состав эфирных масел, содержатся во многих цветах, фруктах, плодах, душистых и пряных растениях. Получение. Большинство реакций получения карбонильных соединений рассмотрены ранее при изучении химических свойств алкенов, алкинов, галогенпроизводных углеводородов, спиртов. Примеры: 1. окисление алкенов(озонолиз)  2. окисление первичных и вторичных спиртов  3. гидролиз геминальных дигалогенпроизводных углеводородов Из дигалогенпроизводных с атомами галогена при первичном атоме углерода образуются альдегиды, при вторичном - кетоны. 4. гидратация алкинов 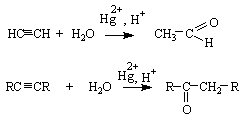 5. термическое разложение кальциевых и бариевых солей карбоновых кислот 6. дегидрирование спиртов 7. оксосинтез. В промышленности значительное количество альдегидов получают присоединением оксида углерода (II) и водорода к углеводородам ряда этилена. Например, из пропилена может быть получена смесь масляного и изомасляного альдегидов СН3-СН=СН2 + СО + Н2 → СН3-СН2-СН2-СНО + (СН3)2СН-СНО Изомерия. Для карбонильных соединений характерна структурная изомерия: различное строение углеродной цепи и различное расположение карбонильной группы в цепи. В связи с этим кетоны и альдегиды с одинаковым числом углеродных атомов являются структурными изомерами. Для карбонильных соединений характерна кето-енольная таутомерия, обусловленная существованием двух изомерных форм, находящихся в растворе в динамическом равновесии. Например, для ацетона СН3-С-СН3 СН2 =С-СН3 || | кето-форма енол Содержание в смеси кето-формы, как более стабильной формы, практически всегда больше енольной формы. Строение. Физические свойства. Атомы углерода и кислорода карбонильной группы находятся в sр2-гибридизации. Двойная связь С=О, подобно связи С=С, представляет собой комбинацию σ-(sр2-sр2- перекрывание) и π-(р-р-перекрывание) связей. При этом связь в карбонильной группе, в отличие от двойной связи в алкенах, характеризуется высокими полярностью и поляризуемостью R → НСδ+ = Оδ-, что является причиной повышенной реакционной способности альдегидов и кетонов, склонности к гетеролитическому расщеплению связей. Альдегиды и кетоны - полярные соединения. Ассоциация молекул происходит только за счет диполь-дипольного взаимодействия, поскольку образование межмолекулярных водородных связей для карбонильных соединений не характерно. Поэтому, в отличие от спиртов, карбонильные соединения имеют более низкие значения температур кипения и плавления, они менее растворимы в воде. Химические свойства. Химические свойства карбонильных соединений исключительно разнообразны. Многочисленные реакции, в которые они способны вступать, позволяют получать вещества многих классов. Наиболее характерные реакции карбонильных соединений - реакции нуклеофильного присоединения (АN), окисления-восстановления. а) реакции нуклеофильного присоединения (АN) Реакционная активность карбонильных соединений в реакциях этого типа зависит от величины эффективного положительного заряда на карбонильном атоме углерода. Чем больше величина заряда, тем выше реакционная активность соединений в реакциях АN-типа. Изменение активности в ряду метаналь > предельные альдегиды > предельные кетоны > ароматические альдегиды > ароматические кетоны обусловлено увеличением электронодонорного характера радикалов, связанных с карбонильной группой. Реакции нуклеофильного присоединения протекают в две стадии. Процесс начинается с атаки нуклеофила карбонильного атома углерода. Образующийся на первой стадии тетраэдрический интермедиат присоединяет электрофил и дает продукт присоединения: А Примеры реакций. Присоединение спиртов. Присоединение одной молекулы спирта сопровождается образованием так называемых полуацеталей - неуствойчивых простых эфиров, которые при дальнейшем взаимодействии со спиртом (при нагревании и присутствии катализатора, например HСl) переходят в ацетали. Ацетали устойчивы и могут быть выделены в чистом виде. Это обычно приятно пахнущие, труднорастворимые в воде жидкости. Ацетали в присутствии кислот гидролизуются, образуя исходный спирт и альдегид; в щелочной среде гидролиз не происходит.  Присоединение синильной кислоты. В реакции образуются α-гидроксинитрилы (циангидрины), которые широко используются для получения аминов, α-гидроксикарбоновых кислот, причем получаемые соединения содержат на один атом углерода больше по сравнению с исходными карбонильными соединениями. Плоды некоторых растений (например, горький миндаль) содержат циангидрины. Присоединение магнийорганических соединений. Реакция лежит в основе получения спиртов разной природы и с большим числом атомов углерода в их составе: В реакциях с метаналем образуются первичные спирты, с альдегидами - вторичные спирты, с кетонами - третичные спирты. Аналогично протекают реакции карбонильных соединений с ацетиленом и ацетиленидами с образованием непредельных диолов. Взаимодействие с гидросульфитом натрия используют для выделения карбонильных соединений из реакционной смеси: Реакция характерна для альдегидов и тех кетонов, у которых при карбонильной группе находится метильный радикал. В кислой и щелочной средах нерастворимые в воде гидросульфитные соединения разлагаются с образованием исходных карбонильных соединений. Взаимодействие с соединениями типа NH2-X (Х - Н, -NН2 , -ОН и другие). Особенность реакций с указанными нуклеофилами - продукты присоединения легко отщепляют молекулу воды с образованием более устойчивых соединений: П Взаимодействие с галогенидами фосфора. В результате этой реакции образуются гем-дигалогенпроизводные, при гидролизе которых вновь образуются карбонильные соединения: |
