конспект лекций.Химия(органическая химия).dos. конспект лекций.Химия(органическая химия). Конспект лекций по дисциплине для студентов, обучающихся по специальностям и направлениям 050100. 62Естественнонаучное образование
 Скачать 1.49 Mb. Скачать 1.49 Mb.
|
|
Малеиновая кислота(цис-бутендиовая кислоты) в природе не встречается. Кислота и ее ангидрид широко используются в органическом синтезе. Терефталевая кислота- крупнотоннажный промышленный продукт, применяют для получения целого ряда полимеров - например, волокно лавсан, полиэтилентерефталат (ПЭТФ), из которого изготавливают пластиковые посуду, бутыли и т.д. ЛЕКЦИЯ № 13. ГЕТЕРОФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ План 1. Номенклатура, изомерия, строение, свойства гидроксикислот. 2. Номенклатура, изомерия, строение, свойства оксокислот. Гетерофункциональные соединения - производные углеводородов, содержащие различные функциональные группы, причем природа этих групп и их количество могут быть разными. Некоторые биологически важные гетерофункциональные органические соединения - метаболиты, биорегуляторы, структурные элементы биополимеров, лекарственные средства. Наиболее распространенными гетерофункциональными соединениями являются гидрокси-, оксо- и аминокислоты. 1. Гидроксикислоты Гидроксикислоты - гетерофункциональные соединения, содержащие карбоксильную и гидроксильную группы. Эти соединения могут быть алифатическими или ароматическими. По взаимному расположению функциональных групп различают α-, ß-, γ-, δ - и т.д. гидроксикислоты. Названия гидроксикислот составляют по общим правилам номенклатуры ИЮПАК (см. «Номенклатура» ) Однако для многих кислот широко используют тривиальные названия: 2-гидроксиэтановая кислота 2-гидроксипропановая кислота гидроксиуксусная кислота α-гидроксипропионовая кислота гликолевая кислота молочная кислота 3- гидроксипропановая кислота β- гидроксипропионовая кислота В природе широко распространены полигидроксикарбоновые кислоты (содержат несколько гидроксильных групп) и гидроксиполикарбоновые кислоты (содержат несколько карбоксильных групп): НООС-СН2-СН(ОН)-СООН 2-гидроксибутандиовая, 2-гидроксиянтарная кислота, яблочная кислота НООС-СН(ОН)-СН(ОН)-СООН 2,3-дигидроксибутандиовая, винная кислота НООС-СН2- С(ОН))(СООН)-СН2-СООН 3-гидрокси-3-карбоксипентандиовая кислота, лимонная кислота. Получение: а) из природного сырья; б) щелочной гидролиз галогензамещенных кислот (см. «Галогенпроизводные углеводородов»); в) циангидриный синтез 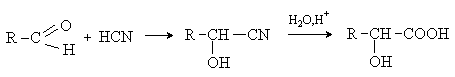 г) взаимодействие аминокислот с азотистой кислотой 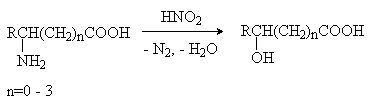 д) присоединение воды к непредельным кислотам 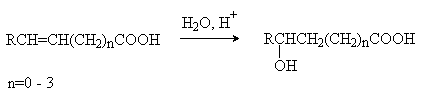 Изомерия. Структурная изомерия гидроксикарбоновых кислот обусловлена изомерией углеродного скелета и изомерией положения гидроксильной группы (например, α-гидроксипропионовая и β- гидроксипропионовая кислоты). Молекулы всех α-гидроксикарбоновых кислот, кроме гликолевой кислоты, содержат асимметрический атом углерода (хиральный центр) и, следовательно, могут существовать в виде пары энантиомеров:  Некоторые кислоты содержат два асимметрических атома углерода (хлоряблочная, винная кислоты) и, следовательно, могут существовать в виде как энантиомеров, так и диастереомеров (см. «Изомерия»). Химические свойства. Гидроксикислоты дают реакции, характерные для карбоксильной и гидроксильной групп, при этом могут участвовать как одна, так и обе функции. 1. Кислотность. Благодаря -I- эффекту гидроксильной группы гидроксикислоты по силе превосходят обычные карбоновые кислоты. По мере удаления ОН-группы от карбоксильной ее влияние на кислотные свойства уменьшается. 2. По карбоксильной группе гидроксикислоты образуют соли (соли и эфиры молочной кислоты называются лактатами, винной - тартратами, лимонной - цитратами, яблочной - малатами), сложные эфиры, галогенангидриды; по ОН-группе гидроксикислоты образуют галогензамещенные кислоты (SN-замещение), сложные эфиры (SN-замещение), оксокислоты (окисление). 3. Специфические свойства Свойства обусловлены присутствием обеих групп и их взаимным расположением. а) Отношение гидроксикислот к нагреванию. α-гидроксикарбоновые кислоты при нагревании образуют продукты межмолекулярной дегидратации - циклические сложные эфиры, называемые лактидами: ß-гидроксикислоты при нагревании переходят в α,ß-непредельные кислоты: γ,δ-гидроксиокислоты претерпевают внутримолекулярное ацилирование с образованием циклических сложных эфиров - лактонов: γ-гидроксимасляная кислота γ-бутиролактон б) Образование комплексных соединений. α-гидроксикислоты образуют окрашенные хелатные комплексы с ионами переходных металлов (Cu2+ , Fe3+ и др.): в) Отношение к серной кислоте. В присутствии концентрированной серной кислоты α-гидроксикислоты разлагаются с образованием муравьиной кислоты и соответствующего карбонильного соединения - альдегида или кетона:  Нахождение в природе и применение кислот: -Гликолиевая кислота содержится во многих растениях, например, свекле и винограде. -Молочная кислота широко распространена в природе, является продуктом молочнокислого брожения углеводов, при этом образуется рацемическая D,L-молочная кислота. В мышцах человека при интенсивной работе образуется и накапливается L(+)-молочная (мясо-молочная) кислота - продукт расщепления и дальнейшего превращения полисахарида гликогена. -Яблочная кислотасодержится в незрелых яблоках, рябине, фруктовых соках. Является ключевым соединением в цикле трикарбоновых кислот. В организме образуется путем гидратации фумаровой кислоты и далее окисляется до щавелевоуксусной кислоты. -Лимонная кислота содержится в плодах цитрусовых, винограде, крыжовнике, листьях табака. Является ключевым соединением в цикле трикарбоновых кислот. -Винная кислота имеет 3 стереоизомера: D-винную кислоту, L-винную кислоту и оптически неактивную мезовинную кислоту (см. «Изомерия»). D-винная кислота содержится во многих растениях, например в винограде и рябине. -Сорбиновая кислота(2,4-гексадиеновая) кислота СН3–СН=СН–СН=СН-СООН была получена из ягод рябины (на латыни – sorbus). Эта кислота - прекрасный консервант, поэтому ягоды рябины не плесневеют. -Салициловая кислота - ароматическая гидроксикарбоновая кислота (фенолкарбоновая кислота), широко распространена в природе . Салициловая кислота и ее сложные эфиры (салол, аспирин) широко используются в медицине, кислота - консервант пищевых продуктов. 2. Оксокислоты Оксокислоты - гетерофункциональные соединения, содержащие карбоксильную и карбонильную (альдегидную или кетонную) группы. В зависимости от взаимного расположения этих групп различают α -, ß -,δ-, γ - и т.д. оксокарбоновые кислоты. Для получения оксокислот применимы обычные методы введения карбоксильной и оксогрупп. Химические свойства. Оксокислоты проявляют свойства, характерные для карбоксильной и карбонильной групп. Причем оксокислоты - более сильные кислоты, чемгидроксикислоты, легко подвергаются декарбоксилированию с образованием карбонильных соединений: CH3-CO-CH2-COOH → CH3-CO-CH3 + CO2 . ß-Оксокислоты и их эфиры обладают специфическими свойствами, которые связаны с их повышенной СН-кислотностью. ß-оксокислоты существуют в виде двух таутомерных форм: кетонной и енольной, причем содержание енольной формы в равновесной смеси значительное (кето-енольная таутомерия). Енольные формы дополнительно стабилизируются за счет образования внутримолекулярной водородной связи. Например, кето-енольные формы ацетоуксусного эфира:  92,5% кетоформа 7,5% енольная форма и щавелевоуксусной кислоты:  ЛЕКЦИЯ № 14. УГЛЕВОДЫ План 1. Классификация углеводов. 2. Моносахариды. Состав, свойства. 3. Дисахариды. Состав, свойства. 4. Полисахариды. Состав, свойства. Углеводами называются соединения с общей формулой Сn (Н2О) m, где n ≥ 4. Углеводы широко распространены в животном и растительном мире, они играют важную роль во многих жизненных процессах. До 80% сухого вещества растений приходится на углеводы, до 2% сухого вещества - в животных организмах. В растениях углеводы образуются в результате фотосинтеза в зеленом листе: hν 6СО2 + 6Н2О → С6Н12О6 + 6О2 хлорофилл Организм животных и человека неспособен синтезировать углеводы, поэтому удовлетворяет потребность в них с различными пищевыми продуктами растительного происхождения (в сутки взрослому человеку необходимо 400-500г углеводов). Углеводы делятся на два вида: простые или моносахариды, монозы (не подвергаются гидролизу) и сложные - ди-, олиго- и полисахариды (способны гидролизоваться до моносахаридов). Моносахариды являются гетерофункциональными соединениями, в молекулах которых содержатся карбонильная группа (альдозы и кетозы) и несколько гидроксильных групп. По числу атомов углерода в составе моноз выделяют триозы (3 атома углерода), тетрозы, пентозы, гексозы. Например, альдопентоза или кетопентоза, альдогексоза или кетогексоза. В основу наименований моносахаридов в большинстве случаев положены тривиальные названия, которые имеют окончание - оза. Для углеводов характерны особенности в строении, следовательно, и в свойствах. В молекуле моносахарида имеется несколько асимметрических атомов углерода, поэтому для них характерна оптическая изомерия - наличие антиподов, диастереоизомеров, которые можно представить в виде проекций Фишера. Общее число стереоизомеров (N) определяют по формуле: N= 2n, где n - число асимметрических атомов углерода. Принадлежность моносахаридов к D- или L-ряду определяется по расположению ОН-группы у последнего асимметрического атома углерода. Если эта группа расположена справа относительно углеродного скелета, что соответствует стандарту - D-глицериновому альдегиду (см. «Изомерия»), то моносахариды относятся к D-ряду, если слева - к L- ряду: 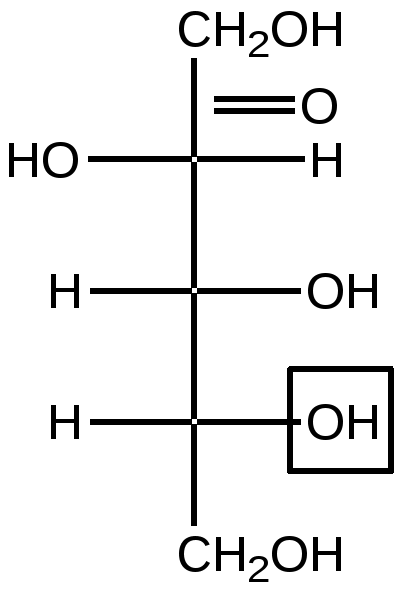  D-фруктоза L-фруктоза Природные монозы, за редким исключением, являются представителями D-ряда. Эпимеры - оптические изомеры (диастереомеры), отличающиеся положением гидроксильной группы у одного асимметрического атома углерода:   эпимер D-фруктозы - D-псикоза эпимер L-фруктозы - L-псикоза Углеводам присуще явление таутомерии - подвижного равновесия открытой ﴾оксикарбонильной﴿ и циклической ﴾полуацетальной﴿форм. В циклической форме атом углерода с полуацетальным гидроксилом становится асимметрическим и поэтому его пространственное строение дает два изомера - α- и β-формы. Образование циклических форм происходит за счет присоединения спиртового гидроксила у 4-го или 5-го атома углерода к карбонильной группе углевода, при этом образующаяся пятичленная циклическая форма называется фуранозной, шестичленная - пиранозной. При углероде карбонильной группы появляется новый гидроксил (ОН) - гликозид или полуацетальный: 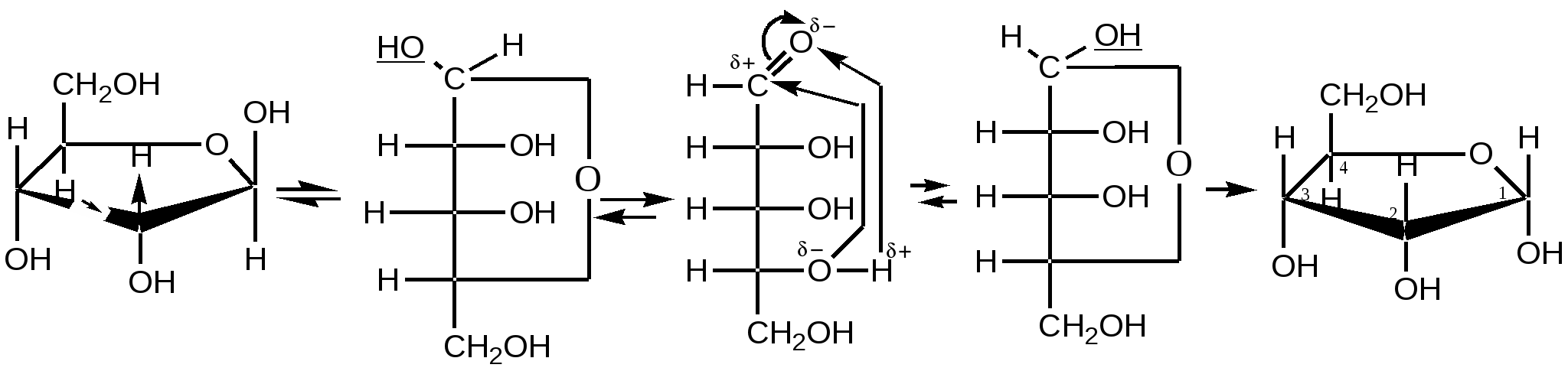 ß,D-рибофураноза α,D-рибофураноза α- и β - формы являются диастереомерами (аномеры). Уα-формы гликозид и гидроксил у последнего асимметрического атома углерода расположены по одну сторону углеродной цепи, а у β-формы - по разные стороны:  α, D-рибопираноза D-рибоза ß,D-рибопираноза Название циклических форм углеводов составляют согласно схеме - корень углевода + название цикла (5-членный - фуран, 6-членный - пиран) + окончание -оза: рибофураноза и рибопираноза. Переход аномеров из одной формы в другую (α Циклическая форма моноз в реакциях проявляет свойства многоатомных спиртов (образование солей, простых и сложных эфиров, окисление, дегидратация) (см. «Многоатомные спирты»). При этом полуацетальный гидроксил наиболее активен и при взаимодействии со спиртами образует полуацетали, которые в классе углеводов называются гликозидами (природные гликозиды: солонин, амигдалин, сердечные гликозиды и т.д.). Дисахариды (биозы) классифицируют на восстанавливающие и невосстанавливающие. Восстанавливающие дисахариды образуются за счет полуацетального гидроксила одной молекулы монозы и любого другого спиртового гидроксила (гликозид-гликозная связь) другой молекулы: 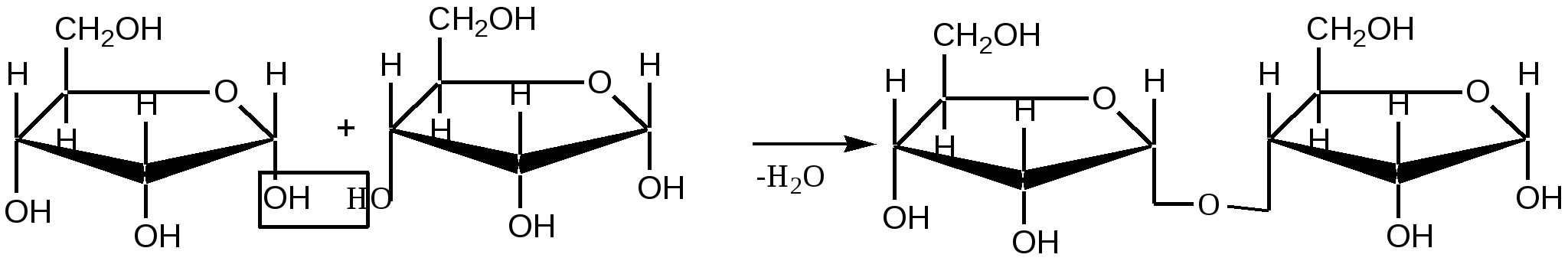 α,D-рибофураноза 3(α,D-рибофуранозидо)α,D-рибофураноза 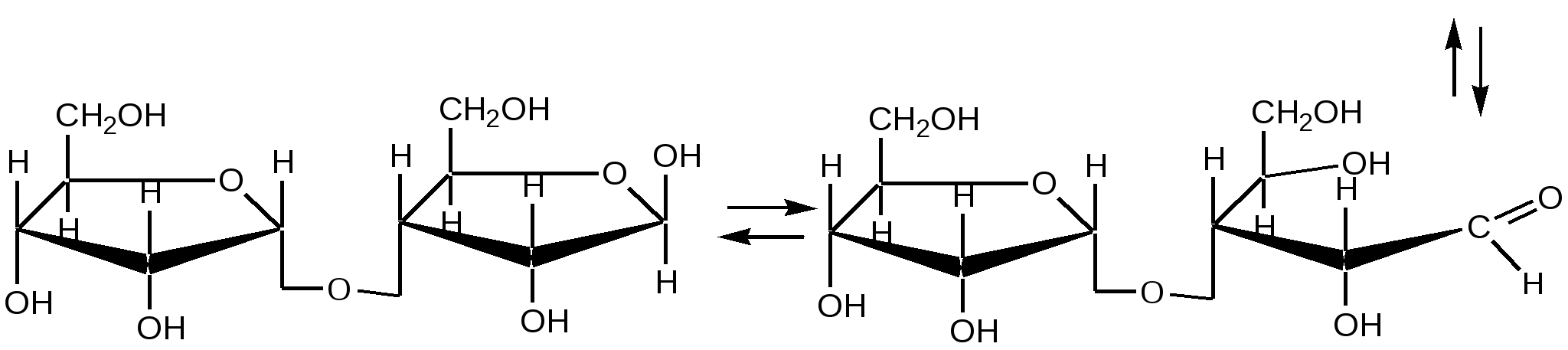 3(α,D-рибофуранозидо)β,D-рибофураноза В полученных дисахаридах остается один свободный полуацетальный гидроксил, за счет которого в водных растворах возможно существование таутомерных форм, т.е. восстанавливающие дисахариды в водном растворе мутаротируют. Восстанавливающие дисахариды, как и моносахариды, легко вступают в реакции по карбонильной группе (окисление, восстановление, нуклеофильное присоединение и т.д.). Невосстанавливающие дисахариды образуются в результате взаимодействия полуацетальных гидроксилов двух молекул моноз (гликозид-гликозидная связь):  α,D-рибофураноза 1(α,Dрибофуранозидо)α,D-рибофуранозид В полученном дисахариде отсутствует полуацетальный гидроксил, поэтому углевод в водном растворе не образует таутомерных форм (не мутаротирует). Такие дисахариды проявляют свойства только многоатомных спиртов. Полисахариды (полиозы) образуются из моносахаридов в циклической форме. Относятся они к невосстанавливающим углеводам и дают реакции только в циклической форме подобно многоатомным спиртам. Важнейшими полисахаридами являются крахмал, целлюлоза, гликоген, построенные из фрагментов D-глюкозы. В растениях встречаются и другие полисахариды, содержащие фрагменты D-галактозы, D-маннозы, D-фруктозы и т.д. Крахмал - запасный углевод растений, накапливается в зернах и клубнях растений. Крахмал состоит из двух полисахаридов - амилозы и амилопектина. Амилоза - биополимер неразветвленного строения, построен из остатков α,D-глюкозы. Амилопектин построен также из остатков α,D-глюкозы, но имеет разветвленную макромолекулу (ответвление у шестого атома углерода остатка α,D-глюкозы). Крахмал широко применяется в различных отраслях промышленности. Из него получают сироп и глюкозу, он является главной составной частью пищевых продуктов (хлеб, крупа, мука, картофель, кукуруза). Из крахмала в ферментативных процессах получают этиловый и бутиловый спирты, молочную и лимонную кислоты и др. Используют крахмал в текстильной промышленности и для получения клеев и красок. Гликоген («животный крахмал») запасный полисахарид животных, накапливается в печени, мышцах, по строению сходен с амилопектином, но имеет более разветвленную структуру. Целлюлоза - полисахарид, содержащийся в растениях (чистая целлюлоза - хлопок, вата, фильтровальная бумага) и состоящий из остатков β,D-глюкозы. Используют целлюлозу для получения бумаги, фотопленок, цветных лаков, искусственных волокон (вискоза, ацетатный шелк и др.), взрывчатых веществ, спиртов и т.д. Крахмал, гликоген расщепляются ферментами, например желудочно-кишечного тракта, целлюлоза - только бактериями (почвенные, желудочно-кишечного тракта, грибы и т.д.), которые гидролизуют и окисляют целлюлозу до углекислого газа, завершая таким образом круговорот органического углерода на Земле. |
