конспект лекций.Химия(органическая химия).dos. конспект лекций.Химия(органическая химия). Конспект лекций по дисциплине для студентов, обучающихся по специальностям и направлениям 050100. 62Естественнонаучное образование
 Скачать 1.49 Mb. Скачать 1.49 Mb.
|
|
Непредельные кислоты Непредельные кислоты - карбоновые кислоты, содержащие в углеводородном радикале кратные связи (двойные или тройные). Наибольшее значение имеют непредельные моно- и дикарбоновые кислоты с двойными связями. Номенклатура и изомерия. Названия для непредельных кислот составляют по номенклатуре ИЮПАК, однако чаще всего применяют тривиальные названия: СH2=CH-CОOH - 2-пропеновая или акриловая кислота CH3-CH=CH-CОOH - 2-бутеновая или кротоновая кислота СH2=C(СH3)-CОOH - 2-метилпропеновая или метакриловая кислота CH2=CH-CH2-CОOH - 3-бутеновая или винилуксусная кислота CH3-(СН2)7-CH=CH-(СН2 )7-CОOH - олеиновая кислота СН3 -(СН2)4 -CH=CH-СН2 -CH=CH-(СН2 )7-CОOH - линолевая кислота СН3-СН2-CH=CH-СН2-CH=CH-СН2-CH=CH-(СН2)7-CОOH- линоленовая кислота. Структурная изомерия непредельных кислот обусловлена изомерией углеродного скелета (например, кротоновая и метакриловая кислоты) и изомерией положения двойной связи (например, кротоновая и винилуксусная кислоты). Непредельным кислотам с двойной связью, так же как и этиленовым углеводородам, свойственна и геометрическая или цис-транс изомерия. Химические свойства. По химическим свойствам непредельные кислоты аналогичны моно- и дикарбоновым кислотам, но имеют ряд отличительных особенностей, обусловленных наличием в молекуле кратных связей и карбоксильной группы и их взаимным влиянием. Непредельные кислоты, особенно содержащие кратную связь в α-положении к карбоксильной группе, являются более сильными кислотами, чем предельные. Так, непредельная акриловая кислота (К=5,6*10-5) в четыре раза сильнее пропионовой кислоты (К=1,34*10-5). Непредельные кислоты вступают во все реакции по месту кратных связей, свойственные непредельным углеводородам. а) Электрофильной присоединение: 1. галогенирование βCH2=αCH-COOH + Br2 → СH2 Br- CHBr-COOH пропеновая кислота α,β-дибромпропионовая к-та Это качественная реакция на непредельные кислоты, по количеству израсходованного галогена (брома или иода) можно определить количество кратных связей. 2. гидрогалогенирование αCH2 δ+ = βCHδ-→COOH + Нδ+ - Brδ- → СH2 Br-CH2-COOH У α,β-непредельных кислот реакция присоединения протекает против правила Марковникова. б) Гидрирование В присутствии катализаторов (Pt, Ni) водород присоединяется по месту двойной связи и непредельные кислоты переходят в предельные: CH2=CH-COOH + Н2 → CH3-CH2-COOH акриловая кислота пропионовая кислота Процесс гидрирования (гидрогенизация) имеет большое практическое значение, особенно для превращения высших непредельных жирных кислот в предельные; на этом основано превращение жидких масел в твердые жиры. в) Окисление В условиях реакции Вагнера (см. «Алкены») непредельные кислоты окисляются до дигидроксикислот, при энергичном окислении - до карбоновых кислот. Нахождение в природе и применение кислот: а) акриловая CH2=CH-COOH и метакриловая CH2=C(СH3)-COOH кислоты - бесцветные жидкости с острыми запахами. Кислоты и их сложные (метиловые) эфиры легко полимеризуются, на этом основано их использование в промышленности полимерных материалов (органического стекла). Нитрил акриловой кислоты - акрилонитрил CH2=CH-C≡N применяют в производстве синтетического каучука и высокомолекулярной смолы полиакрилонитрила (ПАН), из которой получают синтетическое волокно нитрон (или орлон) - один из видов искусственной шерсти. б) высшие непредельные кислоты -цис-олеиновая кислота в виде эфира с глицерином входит в состав почти всех жиров животного и растительного происхождения, особенно высоко содержание олеиновой кислоты в оливковом («прованском») масле - до 80 % , калиевые и натриевые соли олеиновой кислоты являются мылами; -цис, цис-линолевая и цис, цис-линоленовая кислоты в виде эфира с глицерином входят в состав многих растительных масел, например в соевое, конопляное, льняное масло. Линолевая и линоленовая кислоты называются незаменимыми кислотами, поскольку не синтезируются в организме человека. Именно эти кислоты обладают наибольшей биологической активностью: они участвуют в переносе и обмене холестерина, синтезе простагландинов и других жизненно важных веществ, поддерживают структуру клеточных мембран, необходимы для работы зрительного аппарата и нервной системы, влияют на иммунитет. Отсутствие в пище этих кислот тормозит рост животных, угнетает их репродуктивную функцию, вызывает различные заболевания. Сложные эфиры кислот используют в производстве лаков и красок (высыхающие масла). Ароматические монокарбоновые кислоты К Важнейшие представители: бензойная кислота фенилуксусная кислота транс-коричная кислота Ароматические кислоты являются более сильными кислотами, чем предельные кислоты (кроме муравьиной кислоты). Для кислот этого типа характерны все реакции насыщенных карбоновых кислот в карбоксильной группе и реакции электрофильного замещения в бензольном кольце (карбоксильная группа - заместитель 2 рода, м-ориентант). Нахождение в природе и применение кислот: Ароматические кислоты используют для получения красителей, душистых и лекарственных веществ; сложные эфиры кислот содержатся в эфирных маслах, смолах и бальзамах. Бензойная кислота и ее натриевая соль содержатся в плодах калины, рябины, бруснике, клюкве, придают им горьковатый вкус, обладают бактерицидными свойствами, широко используются в консервировании пищевых продуктов. Амид о-сульфобензойной кислоты называют сахарином , он слаще сахара в 400 раз. Производные карбоновых кислот. Общая формула производных карбоновых кислот: 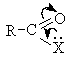 , где Х: - Hal, -ООС-R, -OR, -NH2. , где Х: - Hal, -ООС-R, -OR, -NH2.Для производных карбоновых кислот наиболее характерны реакции нуклеофильного замещения (SN). Поскольку продукты этих реакций содержат ацильную группу R-С=О, реакции называют ацилированием, а карбоновые кислоты и их производные - ацилирующими реагентами. В общем виде процесс ацилирования может быть представлен следующей схемой: 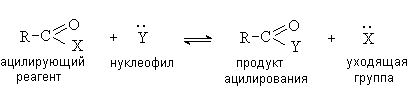 По ацилирующей способности производные карбоновых кислот располагаются в следующий ряд: 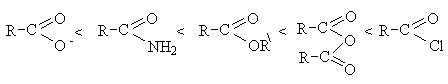 соли < амиды < сложные эфиры <ангидриды <галогенангидриды В этом ряду предыдущие члены могут быть получены из последующих ацилированием соответствующего нуклеофила (например, спирта, аммиака и т.д.). Все функциональные производные могут быть получены непосредственно из кислот и превращаются в них при гидролизе. Амиды, в отличии от других производных карбоновых кислот, образуют межмолекулярные водородные связи и являются твердыми веществами (амид муравьиной кислоты HCONH2 - жидкость). С Методы получения. Основной способ получения сложных эфиров - реакции нуклеофильного замещения: а) реакция этерификации R-СООН + RО-Н ↔ R-СО-ОR + Н2 О Реакцию проводят в присутствии катализатора - минеральной кислоты. Реакции этерификации обратимы. Для смешения равновесия в сторону образования сложного эфира используют избыток одного из реагентов или удаление продуктов из сферы реакции. б) ацилирование спиртов галогенангидридами и ангидридами в) из солей карбоновых кислот и алкилгалогенидов R-COONa + RCl → RCOOR + NaCl Номенклатура. По номенклатуре ИЮПАК название сложных эфиров составляют следующим образом: СН3 -СН2 -СН2 -СО-ОСН3 углеводород радикал радикал+углеводород+оат - метилбутаноат. Если указывают тривиальные названия ацильных остатков , то название данного эфира - метилбутират. Эфиры можно называть по радикально-функциональной номенклатуре - метиловый эфир масляной кислоты. Физические свойства. Сложные эфиры представляют собой бесцветные жидкости, нерастворимые в воде и обладающие по сравнению с исходными кислотами и спиртами низкими температурами кипения и плавления, что обусловлено отсутствием в эфирах межмолекулярных водородных связей. Многие сложные эфиры обладают приятным запахом, часто запахом ягод или фруктов (фруктовые эссенции). Химические свойства. Для сложных эфиров наиболее характерны реакции нуклеофильного замещения (SN),протекающие в присутствии кислотного или основного катализатора. Важнейшими SN-реакциями являются гидролиз, аммонолиз и переэтерификация. Кислотный гидролиз сложных эфиров - реакция обратимая, щелочной гидролиз протекает необратимо. RCOOR + Н2О(Н+) ↔ RCOOН + ROH RCOOR + NaOH → RCOO- Na+ + ROH Жиры Жиры (триглицериды) - сложные эфиры, образованные глицерином и высшими предельными и непредельными кислотами. Из жиров выделено несколько десятков разнообразных предельных и непредельных кислот; почти все они содержат неразветвленные цепи углеродных атомов, число которых, как правило, четное и колеблется от 4 до 26. Однако именно высшие кислоты, преимущественно с 16 и 18 углеродными атомами - главная составная часть всех жиров. Из предельных высших жирных кислот наиболее важны пальмитиновая С15Н31СООН и стеариновая С17Н35СООН, из непредельных - олеиновая С17Н33СООН (с одной двойной связью), линолевая С17Н31СООН (с двумя двойными связями) и линоленовая С17Н29СООН (с тремя двойными связями). Непредельные кислоты, содержащие в радикале фрагмент (-СН2-СН=СН-), называются незаменимыми. Простые триглицериды содержат остатки одинаковых, смешанные - разных жирных кислот. Названия составляют на основе названий ацильных остатков, входящих в их состав жирных кислот:   трипальмитин диолеостеарин Значение жиров исключительно велико. Прежде всего они - важнейшая составная часть пищи человека и животных наряду с углеводами и белковыми веществами. Наибольшей пищевой ценностью обладают растительные масла, которые наряду с незаменимыми жирными кислотами содержат необходимые для организма фосфолипиды, витамины, полезные фитостерины (предшественники витамина D). Суточная потребность взрослого человека в жирах 80-100г. Жиры практически не растворимы в воде, но хорошо растворимы в спирте, эфире и других органических растворителях. Температура плавления жиров зависит от того, какие кислоты входят в их состав. Жиры, содержащие преимущественно остатки предельных кислот (животные жиры - говяжье, баранье или свиное сало), имеют наиболее высокие Тпл. и представляют собой твердые или мазеобразные вещества. Жиры, содержащие преимущественно остатки непредельных кислот (растительные масла - подсолнечное, оливковое, льняное и т.д.), жидкости с более низкими температурами плавления. Химические свойства триглицеридов определяются наличием сложноэфирной связи и ненасыщенностью: а) гидрогенизация (гидрирование) жиров Присоединение водорода по месту двойных связей в остатках кислот ведут в присутствии катализатора - мелкораздробленного металлического никеля при 160-2400С и давлении до 3 атм. При этом жидкие жиры и масла превращаются в твердые насыщенные жиры - саломас, который широко применяют в производстве маргарина, мыла, глицерина. б) гидролиз жиров  При щелочном гидролизе (омылении) жиров образуются соли жирных кислот (мыла) и глицерин, при кислотном - жирные кислоты и глицерин. При щелочном гидролизе (омылении) жиров образуются соли жирных кислот (мыла) и глицерин, при кислотном - жирные кислоты и глицерин.в) присоединение и окисление Трилглицериды, содержащие остатки ненасыщенных жирных кислот, вступают в реакции присоединения по двойной связи (бромирование, иодирование) и окисления перманганатом калия. Обе реакции позволяют определить степень ненасыщенности жиров. Все жиры являются горючими веществами. При их горении выделяется большое количество тепла: 1г жира при горении дает 9300кал. Знаетели вы, что -В 1906году русским ученым С.А. Фокиным разработан, а в 1909г. им же осуществлен в промышленном масштабе метод гидрогенизации (отверждение) жиров. -Маргарин ( с греч. - «жемчуг») получен в 1869 году. Различные его сорта получают, смешивая саломас с молоком, а в некоторых случаях - с яичным желтком. Получается продукт, по внешнему виду напоминающий сливочное масло, приятный запах маргарина достигается введением в его состав специальных ароматизаторов – сложных композиций различных веществ, непременной составной частью которых является диацетил (бутандион) - жидкость желтого цвета, содержится в коровьем масле. -Однако встречаются и животные жиры, содержащие значительное количество непредельных кислот и представляющие собой жидкие вещества (ворвань, тресковый жир или рыбий жир). -Растительные жиры- масла добывают из семян и мякоти плодов различных растений. Они отличаются высоким содержанием олеиновой и других непредельных кислот и содержат лишь незначительное количество стеариновой и пальмитиновой кислот (подсолнечное, оливковое, хлопковое, льняное и др. масла). Лишь в некоторых растительных жирах преобладают предельные кислоты, и они являются твердыми веществами (кокосовое масло, масло какао и др.). -Сложные эфиры фруктовых эссенций обладают приятным запахом фруктов, цветов, например изоамилацетат - запахом груш, амилформиат - вишен, этилформиат - рома, изоамилбутират - ананасов и т.д. Их применяют в кондитерском производстве, при изготовлении безалкогольных напитков, в парфюмерии. -Из полиметилметакрилата готовят исключительно ценный синтетический материал - органическое стекло (плексиглас). Последнее превосходит силикатное стекло по прозрачности и по способности пропускать УФ-лучи. Его используют в машино- и приборостроении, при изготовлении различных бытовых и санитарных предметов, посуды, украшений, часовых стекол. Благодаря физиологической индифферентности полиметилметакрилат нашел применение для изготовления зубных протезов и т.п. -Винилацетат - эфир винилового спирта и уксусной кислоты. Его получают, например, при пропускании смеси паров уксусной кислоты и ацетилена над ацетатами кадмия и цинка при 180-220оС: СН3-СООН + СН≡СН → СН3-СО-О-СН=СН2 Винилацетат – бесцветная жидкость, легко полимеризуется, образуя синтетический полимер - поливинилацетат (ПВА), применяется для изготовления лаков, клеев, искусственной кожи. Дикарбоновые кислоты Дикарбоновые кислоты содержат две карбоксильные группы. Наиболее известными являются кислоты линейного строения, содержащие от 2 до 6 атомов углерода: НООС-СООН - этандиовая (номенклатура ИЮПАК) или щавелевая кислота (тривиальная номенклатура) НООС-СН2 -СООН - пропандиовая или малоновая кислота НООС-СН2-СН2-СООН - бутандиовая или янтарная кислота НООС-СН2-СН2-СН2-СООН - пентандиовая или глутаровая кислота НООС-СН2-СН2-СН2-СООН - адипиноавя кислота Физические свойства.Двухосновные кислоты - кристаллические вещества с высокими температурами плавления, причем у кислот с четным числом атомов углерода она выше; низшие кислоты растворимы в воде. Химические свойства. По химическим свойствам двухосновные кислоты аналогичны монокарбоновым кислотам, но имеют ряд отличительных особенностей, обусловленных наличием в молекулах двух карбоксильных групп и их взаимным влиянием. Дикарбоновые кислоты более сильные кислоты, чем монокарбоновые кислоты с тем же числом атомов углерода: Кион. щавелевой кислоты (Н2С2О4) - 5,9 •10-2 , 6,4•10-5, уксусной кислоты - 1,76 •10-5 . По мере увеличения расстояния между карбоксильными группами кислотные свойства дикарбоновых кислот уменьшаются. Дикарбоновые кислоты могут образовывать два ряда солей - кислые, например НООС-СООNa и средние - NaООС-СООNa. Дикарбоновые кислоты имеют ряд специфических свойств, которые определяются наличием в молекуле двух карбоксильных групп. Например, отношение дикарбоновых кислот к нагреванию. Превращения дикарбоновых кислот при нагревании зависят от числа атомов углерода в их составе и определяются возможностью образования термодинамически стабильных пяти- и шестичленных циклов. При нагревании щавелевой и малоновой кислот происходит декарбоксилирование с образованием монокарбоновых кислот: НООС-СООН→ НСООН + СО2 и далее НСООН → СО + Н2 О НООС-СН2 -СООН → СН3-СООН + СО2 Янтарная, глутаровая кислоты при нагревании легко отщепляют воду с образованием пяти- и шестичленных циклических ангидридов:  Адипиновая кислота при нагревании декарбоксилирует с образованием циклического кетона - циклопентанона: Дикарбоновые кислоты взаимодействуют с диаминами и диолами с образованием соответственно полиамидов и полиэфиров, которые используются в производстве синтетических волокон. Наряду с насыщенными дикарбоновыми кислотами известны непредельные, ароматические дикарбоновые кислоты. Нахождение в природе и применение кислот: Щавелевая кислота широко распространена в растительном мире. В виде солей содержится в листьях щавеля, ревеня, кислицы. В организме человека образует труднорастворимые соли (оксалаты), например оксалат кальция, которые отлагаются в виде камней в почках и мочевом пузыре. Применяют как отбеливающее средство: удаление ржавчины, красок, лака, чернил; в органическом синтезе. Малоновая кислота (сложные эфиры и соли - малоноаты) содержится в некоторых растениях, например сахарной свекле. Широко используется в органическом синтезе для получения карбоновых кислот. Янтарная кислота (соли и сложные эфиры называются сукцинатами) участвует в обменных процессах, протекающих в организме. Является промежуточным соединением в цикле трикарбоновых кислот. В 1556 году немецким алхимиком Агриколой впервые выделена из продуктов сухой перегонки янтаря. Кислота и ее ангидрид широко используются в органическом синтезе. Фумаровая кислота (НООС-СН=СН-СООН - транс-бутендиовая кислота), в отличие от цис-малеиновой, широко распространена в природе, содержится во многих растениях, много - в грибах, участвует в процессе обмена веществ, в частности в цикле трикарбоновых кислот. |
