|
|
конспект лекций.Химия(органическая химия).dos. конспект лекций.Химия(органическая химия). Конспект лекций по дисциплине для студентов, обучающихся по специальностям и направлениям 050100. 62Естественнонаучное образование
Номенклатура. Названия алифатических аминокислот составляют по номенклатуре ИЮПАК, некоторые кислоты имеют тривиальные названия.
  

аминоэтановая 2-аминопропановая 3-аминопропановая
аминоуксусная α-аминопропионовая ß-аминопропионовая
глицин аланин
Изомерия. Для аминокислот характерны сруктурная и оптическая изомерия.
Структурная изомерия: а) изомерия углеродного скелета; б) изомерия положения аминогруппы (например, α- и ß-аминопропионовые кислоты).
Некоторые аминокислоты содержат асимметрический атом углерода и могут существовать в виде пары энантиомеров. Например,
 
α-аминокислота L-ряд D-ряд
S-конфиг. R-конфиг. S-конфиг. R-конфиг.
Большинство природных α-аминокислот принадлежит к стерическому L-ряду (S-конфигурация). Аминокислоты D-ряда обнаружены в некоторых антибиотиках.
Получение.
а) Аминирование галогензамещенных карбоновых кислот, применяется для получения аминокислот любого типа:

б) Присоединение аммиака к α, ß-непредельным карбоновым кислотам
(получения ß-аминокислот):

в) Образование и гидролиз аминонитрилов (получения α-аминокислот):

г) Восстановительное аминирование оксокислот:

д) Из оксимов циклических кетонов перегруппировкой Бекмана:
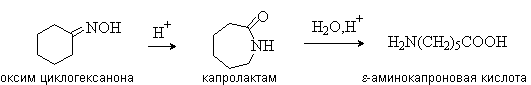
Метод используется для синтеза ε-аминокислот.
е) Восстановление нитроароматических кислот:

Химические свойства.
Аминокислоты дают реакции, характерные для карбоксильной и аминогрупп, проявляют специфические свойства, обусловленные наличием двух функциональных групп и их взаимным расположением.
а) Кислотно-основные свойства
Молекулы аминокислот имеют две функциональные группы, противоположные по характеру, кислую карбоксильную группу и основную аминогруппу, являются амфотерными соединениями. В кристаллическом состоянии существуют в виде внутренних солей, т.е. биполярных ионов:
 
Для ароматических аминокислот образование биполярных ионов менее характерно из-за меньшей основности аминогруппы.
Аминокислоты - нелетучие кристаллические вещества с высокими температурами плавления. Они нерастворимы в неполярных органических растворителях и растворимы в воде. Их молекулы обладают большими дипольными моментами.
Поведение биполярного иона в водных растворах:
в кислой среде аминокислоты присоединяют протон и существуют преимущественно в виде катионов
Н3N+-R-COO- + H+ ↔ Н3N+-R-COOH,
в щелочной среде биполярный ион отдает протон и превращается в анион
Н3N+-R-COO- + OH- ↔ Н2N-R-COO- + HOH.
Значение рН, при котором молекула аминокислоты находится в растворе в виде биполярного иона, называется изоэлектрической точкой. Для α-аминокислот рН
6,1.
Диаминокарбоновые кислоты или аминодикарбоновые кислоты также образуют внутренние соли, но из-за присутствия второй амино- или карбоксильной группы сохраняют основную или кислую реакцию.
б) Реакции карбоксильной группы
Аминокислотам присущи характерные свойства карбоновых кислот - образование солей

,
сложных эфиров

,
образование галогенангидридов и ангидридов требует предварительной защиты аминогруппы, например ацилированием.
в) Реакции аминогруппы
Аминокислоты дают все реакции первичных аминов (см. «Амины») - взаимодействие с азотистой кислотой, алкилирование и ацилирование в щелочной среде.
г) Реакции с одновременным участием карбоксильной и аминогрупп:
1. образование пептидной связи

, полученное соединение называется дипептидом.
2. отношение к нагреванию α-аминокислот (образование дикетопиперазинов):
,
β-аминокислот (образование непредельных кислот):
Н3N+-CH2-CHR-COO- → CH2=CR-COOH + NH3,
γ, δ, ε-аминокислот (образование циклических амидов - лактамов):

д) действие окислителей на α-аминокислоты сопровождается образованием альдегидов:

Пептиды. Петиды - это полиамиды - продукты поликонденсации, построенные из α-аминокислот. По числу аминокислотных остатков в молекуле пептида различают дипептиды, трипептиды, тетрапептиды и т.д. Пептиды, содержащие до 10 аминокислотных остатков, называют олигопептидами, более 10 аминокислотных остатков - полипептидами. Природные полипептиды, включающие более 100 аминокислотных остатков, называют белками.
Название пептида строят на основе тривиальных названий входящих в его состав аминокислотных остатков, которые перечисляют, начиная со свободной аминогруппы. При этом в названиях всех аминокислот, за исключением последней, суффикс «ин» заменяют на суффикс «ил».
Белки наряду с нуклеиновыми кислотами играют важную роль в живой природе. Число белков велико, разнообразны и их функции. Существуют простые белки (протеины) и сложные белки (протеиды), содержащие и небелковую часть.
Различают несколько уровней организации белковых макромолекул: первичная, вторичная, третичная и четвертичная.
Первичная структура - это полипептидная цепь с определенной последовательностью аминокислотных остатков.
Вторичная структура - это определенная пространственная форма полипептидной цепи: α-спираль и структура складчатого листа (β- структура). Вторичная структура образована водородными связями
N-Н...О=С.
Третичная структура характеризует пространственное расположение α-спирали или другой формы вторичной структуры.
Четвертичная структура характеризует ассоциацию нескольких полипептидных цепей.
Поскольку белки построены из молекул α-аминокислот, то они по химическим свойствам им подобны. Белки обладают амфотерными свойствами. Существуют качественные реакции, определяющие особенности в строении молекулы белка. Для белков характерно явление осаждения: обратимое осаждение или высаливание и необратимое осаждение или денатурация.
Знаете ли вы,что
- В 1820 году французский химик Анри Браконно в результате длительного нагревания кожи, сухожилий получил первую аминокислоту, сладкую на вкус - гликоколл (глицин).
-В 1838 году голландский химик Г. Мульдер обнаружил в составе этого соединения азот.
-В 1843 году Э Хорсфорд установил формулу этого вещества.
-п-Аминобензойная кислота (ПАБК) способствует росту микроорганизмов, является витамином, обеспечивающим нормальный обмен веществ, её сложные эфиры - анестетики (анестезин, новокаин).
-γ-Аминомасляная кислота (ГАМК) - принимает участие в метаболических процессах в головном мозге и является нейромедиатором.
-Глутаминовая кислота и ее соли используют в качестве пищевых добавок, усиливающих вкус и аромат продуктов. Впервые эти соединения из сушенных водорослей выделил в 1909 году японский ученый К. Икеда.
-Глицин используется в качестве лекарственного средства, укрепляющего организм и стимулирующего работу головного мозга.
-Аспартам - дипептид, синтетический заменитель сахара, слаще которого в 300 раз. Добавляют в газированные напитки, жевательную резинку; вызывает некоторые заболевания, нарушает обмен веществ.
-В 1963 году из отдельных аминокислот осуществлен синтез природного белка - инсулина (гормон поджелудочной железы, регулирует в организме содержание глюкозы в крови).
ЛЕКЦИЯ № 17.
ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
План
1. Классификация.
2. Пятичленные гетероциклы.
3. Шестичленные азотсодержащие гетероциклы.
Гетероциклическими называют соединения, молекулы которых содержат циклы, включающие наряду с атомами углерода один или несколько гетероатомов. Гетероциклы – самый многочисленный класс органических соединений, на долю которого приходится около 2/3 всех известных природных и синтетических органических веществ. К гетероциклам относятся многие алкалоиды, витамины, природные пигменты. Они являются структурными фрагментами молекул нуклеиновых кислот и белков. Более 60% наиболее известных и широко употребляемых лекарственных препаратов являются гетероциклическими соединениями.
Классификация.
Гетероциклы классифицируют по следующим основным признакам:
а) по природе и числу гетероатомов;
б) по размеру цикла;
в) по степени ненасыщенности.
Наибольшее распространение в природе имеют пяти- и шестичленные гетероциклы, содержащие в качестве гетероатомов азот, кислород и серу.
По степени ненасыщенности различают насыщенные, ненасыщенные и ароматические гетероциклы. Гетероциклы неароматического характера по своим свойствам сходны с соответствующими ациклическими соединениями (аминами, амидами, простыми и сложными эфирами и т.д.). 5- и 6-членные гетероциклы, замкнутая сопряженная система которых включает (4n + 2) электронов, обладают ароматическим характером. Такие соединения по свойствам родственны бензолу и относятся к ароматическим гетероциклическим соединениям. Для них, как и для бензоидных систем, наиболее характерны реакции электрофильного замещения. Именно ароматические гетероциклические соединения широко распространены в природе.
Номенклатура. Присутствие гетероатома в цикле указывается специальными префиксами: О-оксо, S-тиа, N-аза. Согласно номенклатуре ИЮПАК величину цикла обозначают суффиксами: 5-членный - ол, 6-членный -ин.Для многих гетероциклических соединений сохраняются тривиальные названия.
Пятичленные гетероциклы с одним гетероатомом:

тиофен фуран пиррол (тиол) (оксол) (азол)
Положения 2,5 в названиях замещенных гетероциклов указывают буквой α; 3,4 - β.
Получение. а) Пиррол, фуран, тиофен и их производные получают синтетически, при переработке некоторых природных продуктов,например белков, углеводов, а также выделяют из каменноугольной смолы.
б) Взаимные каталитические превращения. Над катализатором Al2О3 при нагревании до 400-5000С возможны превращения (цикл Юрьева):

Реакцию открыл в 1936 году Ю.К. Юрьев.
Строение. Молекулы пиррола, фурана и тиофена плоские, содержат систему сопряженных связей и гетероатом с неподеленной электронной парой. Общее количество электронов в кольце равно 6 (4 π-электрона от двух двойных связей и 2р от гетероатома), что соответствует правилу Хюккеля. Таким образом, эти соединения имеют ароматические характер. Неподеленная электронная пара на гетероатоме действует как электронодонор, поэтому на углеродных атомах цикла электронная плотность увеличивается, а на гетероатоме - уменьшается. Делокализация электронов в гетероциклах по сравнению с бензолом меньше и уменьшается в следующем направлении: бензол > тиофен > пиррол > фуран.


Физические и химические свойства. Пиррол, фуран и тиофен - бесцветные жидкости с приятным запахом.
Общие химические свойства.
а) Реакции электрофильного замещения. Реакционная активность уменьшается в следующем направлении – пиррол > фуран > тиофен ≈ бензол. Реакции электрофильного замещения (галогенирование, нитрование, сульфирование, алкилирование и ацилирование - см. «Арены») осуществляются в положении 2 (α), протекают в отсутствии ионов водорода Н+ и действия очень слабых электрофилов.
Нитрование:

б) Каталитическое гидрирование. Водород присоединяется в присутствии катализаторов (Ni,Pt,Pd) при нагревании, при этом образуются тетрагидропроизводные (тетрафуран, тетрапиррол, тетратиофен):

Природные соединения гетероциклов. Пиррол образует порфирины (содержат 4 молекулы пиррола), которые входят в состав природных соединений, например гема - небелковой части гемоглобина, хлорофилла, витамина В12. Группировка пиррола с бензолом (индол) содержится в триптофане, серотонине, некоторых алкалоидах (резерпин, лизергиновая кислота и т.д.).
Наиболее важные пятичленные гетероциклы с двумя атомами азота:
 
пиразол имидазол
Соединения проявляют амфотерные свойства.
Имидазол (1,3-диазол) входит в состав пуриновых оснований, из него получают лекарственные препараты - антипирин, амидопирин, анальгин и т.д.
Знаете ли вы, что
-Красное вещество крови гемоглобин . Переносящий кислород из легких в каждую клетку тела, является хромопротеидом, состоящим из белка глобина и окрашенной в красный цвет небелковой части — гема. Гем является порфирином, содержащим Fe (III). Строение гемв выяснил и осуществил синтез Г.Фишер в 1927 году.
-Хлорофиллы в процессе фотсинтеза трансформируют световую энергию в химическую. Его структуру установили в 1913-1938 годах; полный синтез осуществлен Р.Вудвордом в 1956 году.
-Строение витамина В12 — темно-красного кристаллического вещества, установлено Д.Кроуфтом в 1950 году, полный синтез витамина осуществлен Р.Вудвордом в 60-десятых годах 20 века. Это одно из выдающихся достижений органического синтеза.
Шестичленные азотсодержащие гетероциклы с одним и двумя гетероатомами:
Пиридин (азин) – 6-членный ароматический гетероцикл с одним атомом азота.
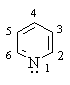
Ароматическая система пиридина включает 6 π-электронов и подобна ароматической системе бензола: каждый атом цикла подает в ароматический секстет один р-электрон. Неподеленная пара электронов азота в силу своей пространственной ориентации в сопряжении не участвует:

Атом азота действует как акцептор и понижает электронную плотность на атомах углерода цикла в положениях 2, 4, 6:

Химические свойства пиридина определяются наличием ароматической системы (электрофильное замещение в 3 и 5 положениях кольца, по активности в этих реакциях уступает бензолу) и основного атома азота (образует соли). Нуклеофильное замещение протекает в положениях 2,4 или 6. Пиридин и метилпиридины (пиколины) — бесцветные жидкости с неприятным запахом, получают из каменноугольной смолы и широко используют в органическом синтезе. При окислении алколоида — никотина впервые была получена никотиновая кислота (3-карбоксипиридин), являющаяся провиамином, а её амид — витамином РР. Недостаток этого витамина вызывает заболевание кожи, называемое пеллагрой.
Пиримидин (1,3-диазин) – 6-членный ароматический гетероцикл с двумя атомами азота:
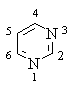
Ароматическая система пиримидина подобна ароматической системе пиридина.
Важную биологическую роль играют гидрокси- и аминопроизводные пиримидина: урацил, тимин и цитозин – нуклеиновые основания; входят в состав нуклеозидов, нуклеотидов, нуклеиновых кислот. Существуют в таутомерных оксо- и гидроксиформах:
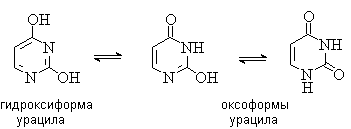
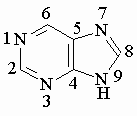
Пурин – ароматическое гетероциклическое соединение, содержащее конденсированные пиримидиновый и имидазольный циклы:
Пурин, подобно имидазолу, существует в виде двух таутомерных форм. Более стабильной является форма с атомом водорода в положении 7:
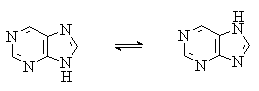
Гидрокси- и аминопроизводные пурина: аденин и гуанин - нуклеиновые основания; входят в состав нуклеозидов, нуклеотидов, в том числе нуклеотидных коферментов, нуклеиновых кислот.
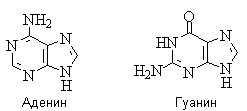
Для аденина известны две таутомерные формы, являющиеся результатом миграции протона между атомами азота имидазольного цикла. У гуанина существуют таутомерные гидрокси- и оксоформы:
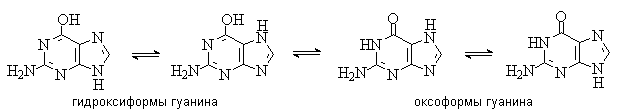
Стабильными таутомерными формами гуанина являются оксо-формы.
Нуклеиновые кислоты (ДНК и РНК) – биополимеры, которые содержатся в клетках любого живого организма и выполняют важнейшие функции по хранению и передаче генетической информации, участвуют в механизмах ее реализации в процессе синтеза клеточных белков.
В результате последовательного гидролитического расщепления ДНК и РНК можно выделить следующие структурные компоненты: полинуклеотиды → нуклеотиды (рибоза или 2-дезоксирибоза + азотистое основание + фосфорная кислота) → нуклеозиды (азотистое основание + углевод) → азотистое основание.

β,D-рибофураноза 2-дезокси-β,D-рибофураноза
Знаете ли вы, что
-Никотин — бесцветное масло с запахом табака, является главным алкалоидом табака. Впервые в чистом виде получен в 1828 г., структура определена в 1893 г., а синтез в 1904 г. Никотин — сильнейший яд, летальная доза для человека 40 мг. В малых дозах никотин повышает кровяное давление, возбуждает центральную нервную сисему, в больших дозах вызывает паралич нервной системы.
Библиографический список
1. Иванов, В.Г. Органическая химия: учеб. пособие для вузов / В.Г. Иванов, В.А. Горленко. – М.: Издательский центр «Академия», 2009. -624с.
2. Грандберг, И.И. Органическая химия: учеб. для вузов / И.И. Грандберг. - М.: Дрофа, 2002. -672с.
3. Артеменко, А.И. Органическая химия: учеб. для вузов / А.И. Артеменко. - М.: Высшая школа, 2009. -420с.
4. Денисов, В.Я. Органическая химия: учеб. для вузов / В.Я.Денисов, Д.Л. Мурышкин, Т.В. Чуйкова. – М.: Высшая школа, 2009. -544с.
5. Петров, А.А. Органическая химия: учеб. для вузов / А.А. Петров. -С-Пб.: Иван Федоров, 2002. -400с.
6. Ким, А.М. Органическая химия. Учеб. пособие для вузов / А.М. Ким.- Новосибирск: Сиб. унив. изд-во,
2004. -842 с.
7. Травень, В.Ф. Органическая химия: учеб. для вузов. в 2 ч. / В.Ф.Травень. - М.: Академкнига, 2005. Т. 1. 727 с., Т. 2. -582 с.
8. Хаускрофт, К. Современный курс общей химии: учеб. для вузов в 2 т. / К.Хаускрофт, Э. Констебл. - М.: Мир, 2002. Т. 1. -539 с., Т. 2. -528с.
9. Несмеянов, А.Н.Начало органической химии: учеб. для вузов / А.Н.Несмеянов, Н.А.Несмеянов. - М.: Химия, 1974. Т.1.-623с., Т.2. -744с.
10. Днепровский, А.С. Теоретические основы органической химии: учеб. для вузов / А.С. Днепровский, Т.И. Темникова. – Л.: Химия, 1991. -560с.
11. Робертс, Дж. Органическая химия: учебник для вузов / Дж. Робертс, М. Касерио. – М.:Мир, 1978. Т.1. -842с., Т.2. -888с.
12. Степаненко, Б.Н. Курс органической химии: учеб. для вузов / Б.Н. Степаненко. – М.: Высшая школа, 1981, -794с.
13. Органическая химия: учеб. для вузов / В.Л. Белобородов, С.Э.Зурабян, А.П. Лузин, Н.А.Тюкавкина; под ред. Н.А.Тюкавкиной. – М.: Дрофа, 2004. -640с.
14. Березин, Б.Д. Курс современной органической химии: учеб.пособие для вузов / Б.Д. Березин, Д.Б. Березин. – М.: Высш. шк., 2001. -768с.
15. Потапов, В.М. Стереохимия: учебное пособие для вузов / В.М. Потапов. – М.: Химия, 1976. -320с. |
|
|
 Скачать 1.49 Mb.
Скачать 1.49 Mb.