Производство ВМС на предпр. НХ. Производство ВМС на предпр. Лекции по курсу производство вмс на предприятиях нефтехимии
 Скачать 2.6 Mb. Скачать 2.6 Mb.
|
|
Сухие смолы. Выделение неотвержденных КФС встречает большие трудности, поскольку смола является гидрофильным веществом, легко абсорбирующим влагу и смешивающимся с водой в любых соотношениях. Сухие КФС получают различными методами: 1) охлаждением раствора до осаждения смолы, при этом твердое вещество после фильтрования подвергается сушке в тонком слое; 2) отгонкой воды при пониженном давлении до получения вязкогс сиропа, твердеющего при охлаждении; порошкообразный продукт получают измельчением смолы; 3) сушкой раствора смолы, например, в распылительной сушилке не прерывного действия. Последний метод получил наиболее широкое применение. Сушку в распылительной камере проводят воздухом, нагреваемым топочными газами в рекуператоре до 150-250°С. 45-55 %-ный водный раствор смолы, полученный при мольном отношении мочевина: формальдегид = 1:2 и продолжительности конденсации 2,5-3,5 ч, подается на вращающийся диск сушилки или распыляется через форсунку на капли диаметром 50-150 мкм навстречу току воздуха. Вода испаряется, а сухая порошкообразная смола оседает на дно камеры и выводится из нее шнеком или пневмотранспортером. В некоторых случаях для снижения липкости порошка и уменьшения склонности к потере растворимости в раствор смолы перед распылением вводят 2-5 % аэросил и других минеральных добавок. Порошок КФС белого цвета с размером частиц 20-30 мкм имеет насыпную плотность 400-600 кг/м3. Он хорошо растворяется в воде, а при хранении адсорбирует 12-15 % влаги из воздуха. В связи с этим порошки хранят в герметичной таре. Порошкообразные смолы широко используются для изготовления фанеры, дре весноволокнистых плит и древеснослоистых пластиков. КФС бесцветны. Они сочетают в себе достаточно высокую теплостойкость и удовлетворительные диэлектрические свойства со светостойкостью и способностью легко окрашиваться в любой цвет. Смолы всех типов способны отверждаться на холоду и при нагревании, а также в присутствии органических кислот, кислых солей и кислых эфиров. КФС широко используются в качестве связующих в пресс-порошках, применяемых для изготовления деталей электроарматуры и строительных деталей, для пропитки бумаги при производстве декоративного облицовочного материала, в качестве клеев для склеивания и пропитки древесины и тканей, для проклейки бумаги и картона. На основе КФС получают пористые материалы, отличающиеся высокими тепло- и звукоизоляционными показателями и низкой кажущейся плотностью. Аналогично КФС готовят и меламиноформальдегидные смолы. Применяют их для тех же целей, но они обладают повышенной механической прочностью, водостойкостью и теплостойкостью. Производство КФС на основе карбамидоформальдегидных концентратов Применение карбамидоформальдегидных концентратов (КФК) не содержащих метанола взамен формалина для получения КФС позволяет существенно сократить энергозатраты производства за счет исключения стадии концентрирования-сушки смолы и образования надсмольных вод при синтезе, увеличить производительность оборудования, значительно сократить количество выбросов метанола в окружающую среду при производстве древесно-стружечных плит. Свойства карбамидоформальдегидных концентратов представлены в табл. 12.1.   Применение аминоформальдегидных смол Клеи. КФС и МЛФС широко используются для изготовления клеев. По внешнему виду они могут быть пастообразными, вязкими (сиропообразными) или твердыми (порошками). Применяются смолы как холодного, так и горячего отверждения. Добавлением катализаторов можно снизить температуру отверждения смолы или получить клеи холодного отверждения. Катализаторами служат аммониевые соли сильных кислот (например, хлорид аммония) и некоторые кислоты (муравьиная, щавелевая, нефтяные сульфокислоты). В растворах смол соли этих кислот реагируют со свободным формальдегидом, освобождаясоответствующую сильную кислоту: Это приводит к снижению рН клея, что ускоряет конденсацию и отверждение. Особенно быстро смола отверждается при рН < 3. Лаки и эмали. Применение КФС и МЛФС для лаков становится возможным после их модификации, которая осуществляется двумя путями: 1) этерификацией метилольных производных спиртами (бутиловым, гексиловым, октиловым и др.) и 2) совмещением этерифицированных смол с другими смолами (полиэфирными, эпоксидными) и маслами (касторовым и др.). Модифицированные смолы пригодны для изготовления лаков горячей и холодной (воздушной) сушки, эмалей и пропиточных растворов для получения слоистых пластиков с повышенными водостойкостью и эластичностью. Покрытия из таких смол обладают большой твердостью, хорошим глянцем, эластичностью, бензо- и маслостойкостью, красивым внешним видом. На поверхность изделий лаки и краски наносят распылением, окунанием или обливом. Обработка бумаги и ткани. Бумага, обработанная водными растворами КФС и МЛФС, приобретает повышенную прочность в мокром состоянии. Для придания несминаемости тканям из искусственного шелка, льна, шерсти, хлопка и смешанных волокон (хлопка и вискозного волокна) их пропитывают 8-10%-ным водным раствором диметилолкарбамидас последующей конденсацией ее на волокне при пропускании через горячие каландры. Связующее. Из древесных отходов, обработанных КФС, могут быть изготовлены плиты для полов, спинки и сиденья для стульев, дверные и оконные переплеты и другие изделия. Для изделий, внешний вид которых имеет первостепенное значение, применяются тонкоизмельченные древесные отходы. Твердый бензин. Твердый бензин представляет собой брикеты, содержащие до 95 % масс. жидкого горючего и 5 % масс. смеси КФС с казеином и ПВС. Все компоненты после растворения образуют раствор, который смешивают с бензином, и получают эмульсию на установках периодического или непрерывного действия. Эмульсия при добавлении отвердителей (например, смеси формальдегида и щавелевой кислоты) способна отверждаться и принимать форму сосуда, в который она налита. После сушки от воды брикеты представляют собой твердое топливо, находящее применение в технике и в быту. ЛЕКЦИЯ 21. Технология производства фенолоальдегидных смол. Исходные продукты. Особенности взаимодействия фенолов с альдегидами. Отверждение и строение фенолоальдегидных смол. Производство новолачных смол. Производство резольных смол периодическим методом. Свойства и применение фенолоальдегидных смол. Технология производства фенолоальдегидных смол Фенолоальдегидные смолы являются основой широкого ассортимента полимерных и композиционных материалов, которые используются в различных отраслях промышленности, в быту и получили название фенопласты. Исходными продуктами для их приготовления являются фенолы (фенол, крезол, ксиленол, резорцин), ани лин и альдегиды (формальдегид, фурфурол). В зависимости от свойств фенолоаль- дегидные смолы делят на две группы: термопластичные (новолачные) и термореак тивные (резольные) смолы. Они являются дешевыми и самыми «старыми» смолами, получившими в настоящее время широкое распространение, особенно для изготов ления порошковых, волокнистых и листовых пресс-материалов. Производство фе-нолоформальдегидных смол (ФФС) и фенопластов в мире ежегодно растет на 2-3 %. Расширению использования фенопластов в последние годы способствовало развитие прогрессивных методов их переработки в изделия: литье под давлением, скоростное и литьевое прессование, применение ротационных электроподогревателей. Фенопласты выпускаются в крупнотоннажном объеме. Несмотря на широкое применение фенопластов в машиностроении, электро- и ра диотехнике, строительстве, фенопласты все же характеризуются недостаточной механической прочностью, неоднородностью диэлектрических свойств и нуждаются в упрочнении и модификации. Упрочнение фенопластов достигается как введением волокнистых наполнителей, использованием бумаги, хлопчатобумажных и стеклянных тканей, так и модификацией ФФС другими смолами, термопластичными и термореактивными полимерами. В результате получаются высококачественные материалы, обладающие термостойкостью, негорючестью, химической стойкостью, тропикоустойчивостыо. Исходные продукты Фенол — кристаллический продукт с характерным запахом. На воздухе под действием света он постепенно окрашивается в красноватый цвет, плавится при 40,9 °С, является очень слабой кислотой (константа ионизации при 25 °С 1,3•10-10), легко перегоняется с водяным паром, гигроскопичен. Примесь воды резко снижает его температуру плавлепия. Так, фенол, содержащий 5 % воды, плавится уже при 24 °С. При обычной температуре фенол растворяет до 27% воды, при 85°С он смешивается с водой в любых соотношениях. Фенол каменноугольный извлекают из каменноугольной смолы, образующейся при коксовании угля. Крезол (трикрезол) представляет собой смесь трех изомеров (37-40 % м-крезола, до 35 % о-крезола и 25 % п-крезола): 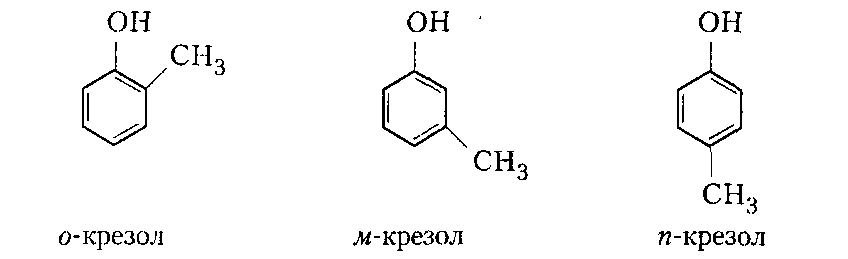 Крезол — темная маслянистая жидкость, перегоняющаяся при 185-210°С. Крезол значительно слабее, чем фенол; растворяется в воде, но растворяется хорошо в водных растворах щелочей и спирте. Ценность трикрезола, который трудно разделить на изомеры, определяется содержанием .м-крезола, который способен образовывать термореактивные смолы; о- и п-крезолы дают только термопластичные продукты. Ксиленолы отгоняют из наиболее высококипящей фракции среднего масла после выделения фенола и крезола в виде темной маслянистой жидкости с неприятным запахом, кипящей в пределах 210-225°С. Ксиленол содержит шесть изомеров. Ценность его определяется присутствием 3,5-ксиленола, способного к образованию термореактивных смол: 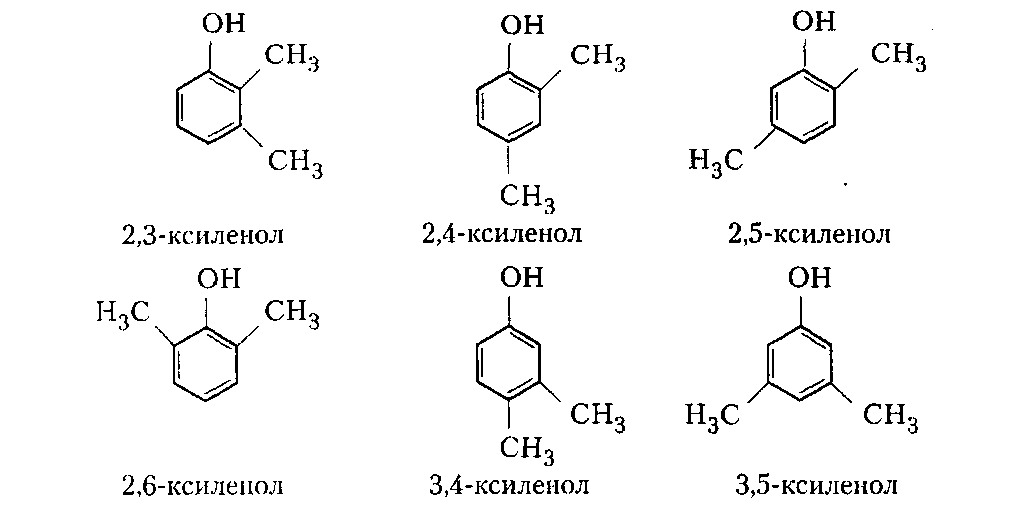 Хотя м-крезол и 3,5-ксиленол взаимодействуют с формальдегидом более энергично, чем фенол, но технические продукты, содержащие изомеры, реагируют более медленно. Резорцин (м-дигидроксибензол) — кристаллическое вещество со слабым специфическим запахом, кипящее при 276,5°С, слабая кислота (константа ионизации при 18 °С 3,6•10-10). При действии света и влажного воздуха резорцин краснеет. Он хорошо растворяется в воде, этиловом спирте, глицерине. Водные растворы резорцина на воздухе темнеют. Фурфурол — бесцветная маслянистая жидкость с характерным запахом, темнеющая на воздухе, кипящая при 162 °С: 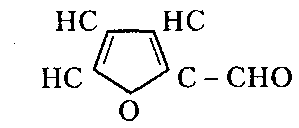 Фурфурол хорошо растворяется в спирте и ацетоне, хуже в воде, но при 20°С в раствор переходит 8,2 % фурфурола и при 90 °С — 16,6 %. Сам он является очень хорошим растворителем многих органических веществ, в том числе и синтетических полимеров. Фурфурол получают из растительного сырья: стержней кукурузных початков, подсол нечной лузги, камыша, хлопковой шелухи, а также из продуктов гидролиза древесины. ОСОБЕННОСТИ ВЗАИМОДЕЙСТВИЯ ФЕНОЛОВ С АЛЬДЕГИДАМИ. ОТВЕРЖДЕНИЕ И СТРОЕНИЕ ФЕНОЛОАЛЬДЕГИДНЫХ СМОЛ Взаимодействие фенолов с альдегидами представляет собой реакцию поликонденсации. На образование смол и их свойства влияют: 1) химическое строение исходных продуктов; 2) мольное соотношение фенола и альдегида; 3) кислотность реакционной среды. Химическое строение исходных продуктов. Фенолы и альдегиды в зависимости от химического строения обладают разной функциональностью и реакционной способностью. Гидроксильная группа в бензольном ядре фенолов способствует большей подвижности атомов водорода, находящихся в орто- и пара-положениях к гидроксильной группе. Атомы водорода в метаположении практически не вступают в химические реакции при получении ФФС. Таким образом, благодаря наличию трех подвижных атомов водорода фенолы являются очень реакционно-способными трифункциональными соединениями: 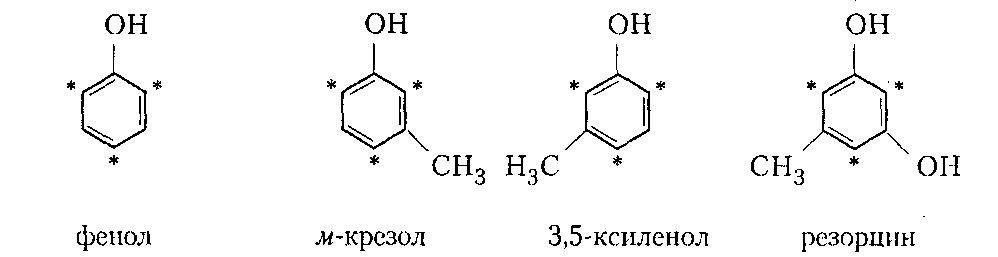 По реакционноспособным центрам в молекулах фенолов происходит присоединение альдегидов и образование фенолоформальдегидных смол (олигомеров), способных в определенных условиях либо превращаться в неплавкое и нерастворимое состояние (термореактивные смолы), либо оставаться плавкими и растворимыми (термопластичные смолы). Термореактивпые смолы получают на основе трифункциональных фенолов, термопластичные смолы могут быть получены из сырья, содержащего дифункциональные фенолы: о- и п-крезолы; 2,3-, 2,5- и 3,4-ксиленолы. Из альдегидов только формальдегид и фурфурол способны образовывать неплавкие и нерастворимые смолы с трифункциональными фенолами. Другие альдегиды (уксусный, масляный и т. п.) непригодны для получения термореактивных смол из-за пониженной активности и пространственных затруднений протекания реакции. Процесс поликонденсации фенолов с альдегидами проходит как в кислой, так и в ще лочной средах с образованием разных по строению продуктов. Наиболее распространенными являются ФФС, полученные из фенола и формальдегида. Условия их образования и отверждения (превращения в неплавкое и нерастворимое состояние) определяются двумя основными факторами: мольным соотношением исходных компонентов и кислотностью реакционной среды. Мольное соотношение фенол : формальдегид. Этим фактором в первую очередь определяется строение начальных продуктов реакции конденсации. Так, при соотношении фенол : формальдегид = 1:1 в начале реакции образуются главным образом о- и п-моногидроксибензиловые спирты, преимущественно о-гидроксибензиловый спирт (салигенин): Моногидроксибензиловые спирты, имеющие одну метилольную группу, способны вступать во взаимодействие между собой и с фенолом. В первом случае образуются термопластичные смолы линейного строения, а во втором — изомерные дигидроксидифенилметаны: 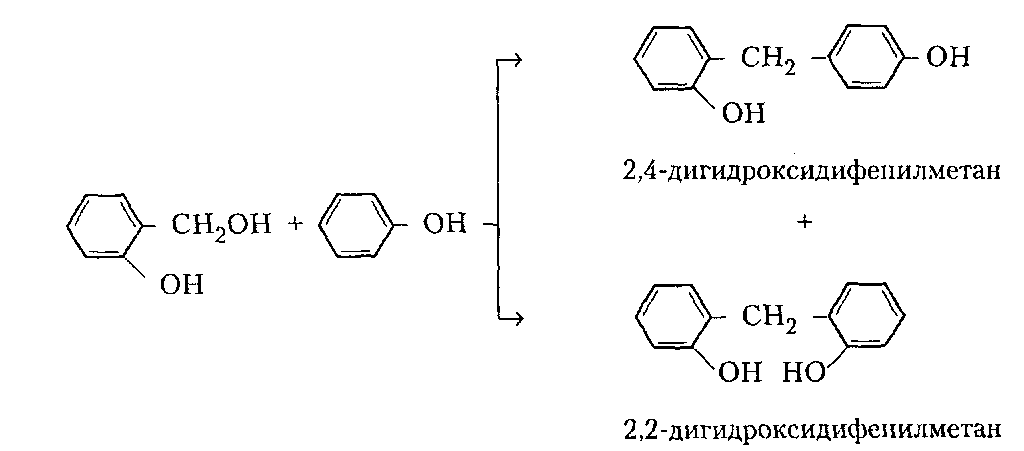 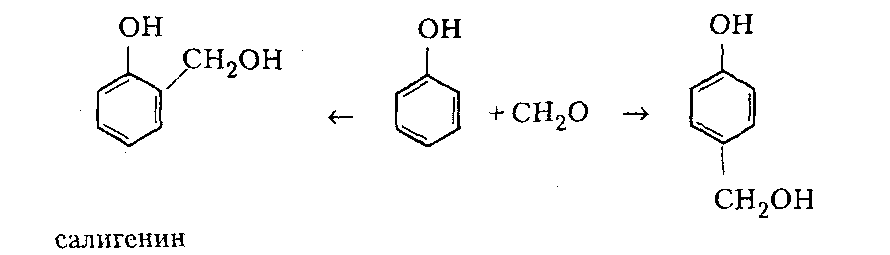 При мольном соотношении формальдегид : фенол = 2:1 и выше вначале образуются многоатомные метилолфенолы (фенолоспирты), из которых при дальнейшем нагревании получаются неплавкие и нерастворимые смолы: Кислотность среды. Этот фактор оказывает существенное влияние на ход процесса. В кислой среде (рН < 7) образующиеся из фенола и формальдегида фенолоспир ты неустойчивы и быстро конденсируются друг с другом или с фенолом (особенно при нагревании), образуя термопластичные смолы. В щелочной среде (рН > 7) фенолоспирты устойчивы, дальнейшая их конденсация происходит лишь при нагревании или при добавлении кислых катализаторов. 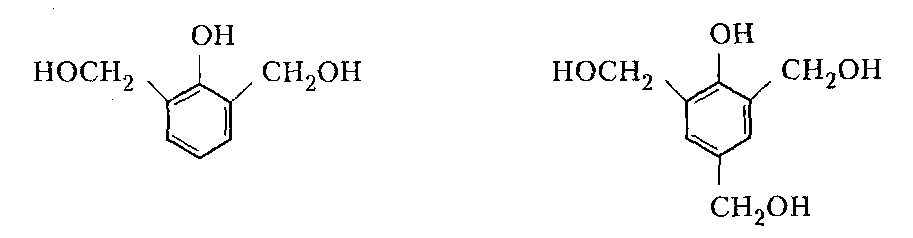 При различных соотношениях фенола и формальдегида в щелочной среде образуются только термореактивные смолы, причем в случае недостатка альдегида часть фенола остается растворенной в смоле (в виде так называемого «свободного фенола»), Новолачные смолы (НС) получают конденсацией формальдегида как с три- так и с дифункциональными фенолами в присутствии кислого катализатора. Трифункциональиые фенолы необходимо брать в избытке: мольное соотношение фенол: формальдегид составляет 6:5 или 7:6. Уменьшение избытка фенола приводит к образованию резольной смолы даже в кислой среде, а увеличение его снижает молекулярную массу смолы. Образование НС протекает через дигидроксидифенилметаны, из которых при дальнейшей реакции с формальдегидом и фенолом получается смола: Смолы состоят из разветвленных молекул различной длины, получаемых конденсацией в орто- и пара-положениях к гидроксилу фенольного ядра. При фракционировании смолы обнаруживается большой разброс молекулярных масс отдельных фракций. Например, из смолы со средней молекулярной массой 640 можно получить ряд фракций с молекулярной массой 200-8000. В НС фенольные ядра связаны метиленовыми мостиками. Гидроксильные группы не участвуют в реак ции образования смолы, а эфирные связи почти отсутствуют. Образование НС может быть представлено следующим образом: При поликонденсации фенола с формальдегидом (например, в отношении 1:0,5) в присутствии солей двухвалентных металлов (Mn, Cd, РЬ, Zn и др.) при рН 4-7 образуются НС линейного строения (ортоноволаки), в которых до 80% фенольных ядер связаны метиленовыми мостиками в орто-ортоположении. Ортоноволаки также образуются при нагревании до температуры кипения смеси фенола с параформом. Все они отличаются от обычных НС повышенной скоростью отверждения при добавлении уротропина (в 4-5 раз) и используются для изготовления быстропрессующихся пресс-материалов. На основе некоторых алкилированных фенолов, например п-третбутилфенола, также получаются НС линейного строения: 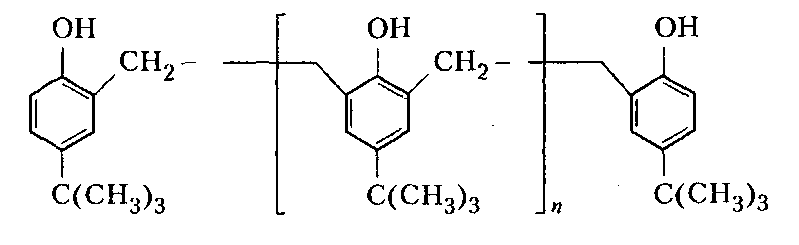 В зависимости от условий получения НС различаются по фракционному составу, размеру молекул и их разветвленности, а следовательно, но температуре плавления, содержанию свободного фенола, растворимости и вязкости растворов. Цвет смолы зависит от чистоты сырья и от применяемого катализатора. Минеральные кислоты (соляная и серная) вызывают потемнение смол, тогда как при использовании органических кислот (щавелевая) получаются светлые продукты. Наличие свободных реактивных центров в НС (в орто- и пара-положении к гидроксилу фенольного ядра) определяет способность этих смол переходить в неплавкое и нерастворимое состояние при обработке формальдегидом или гексаметилентетрамином (ГМТА). Следы воды, содержащиеся в новолачных смолах разлагают ГМТА до образования аммиака и формальдегида, а также вызывают гидролиз ГМТА с обра зованием аминометилольных соединений NH(CH2OH)2 и N(CH2OH)3. Взаимодействуя с фенольными ядрами аминометилольные соединения образуют вторичные и третичные бензиламины. На первой стадии отверждения НС образуются промежуточные продукты, содержащие диметилениминовые мостики -СН2-NH-СН2-. Установлено, что НС, содержащая свободный фенол, реагирует с ГМТА таким образом, что сначала из свободного фенола и гексаметилентетрамина образуются производные дибензиламина и аммиак, а затем уже смола взаимодействует с производными дибензиламина с вы делением аммиака и сшитых продуктов. Наличие свободного фенола в смоле, таким образом, облегчает ее сшивание. Термически отвержденные смолы содержат до 6 % химически связанного азота, в том числе в форме азометиновых групп (-CH=N-), которые ответственны за желтый цвет продуктов реакции. Строение отвержденных НС может быть представлено следующим образом: 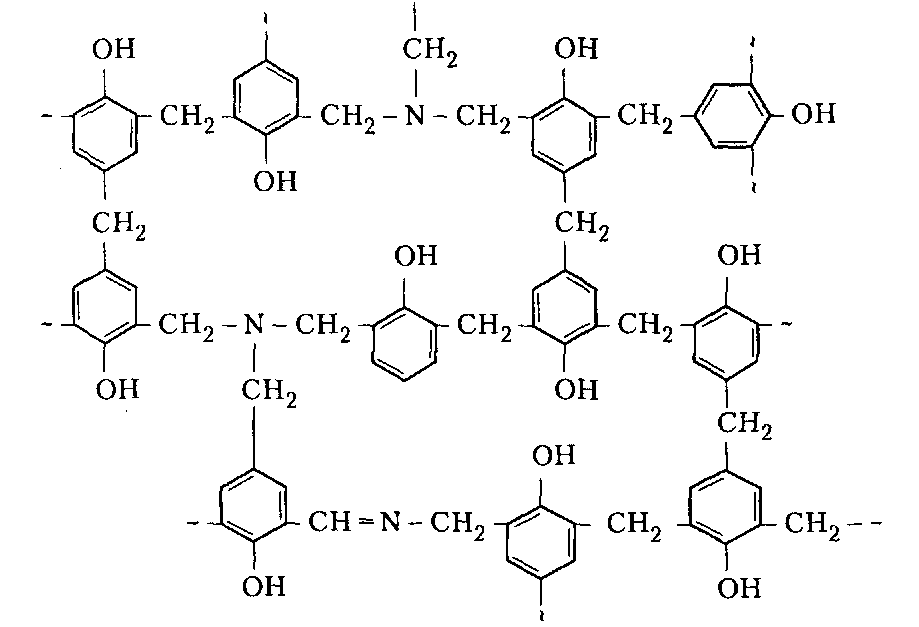 Резольные смолы (PC) получают при конденсации фенола с избытком формальдегида в присутствии оснований. Обычно при мольном отношении фенол: формальдегид = 6:7 на 1 моль прореагировавшего фенола приходтся до 1,5 моль формаль дегида. Образуются моно-, ди- и триметилолфенолы и часть фенола остается непрореагировавшей. На количество присоединенного формальдегида большое влияние оказывает катализатор: в присутствии сильных оснований (NaOH, КОН) в реакцию вступает больше формальдегида, чем в присутствии аммиака. 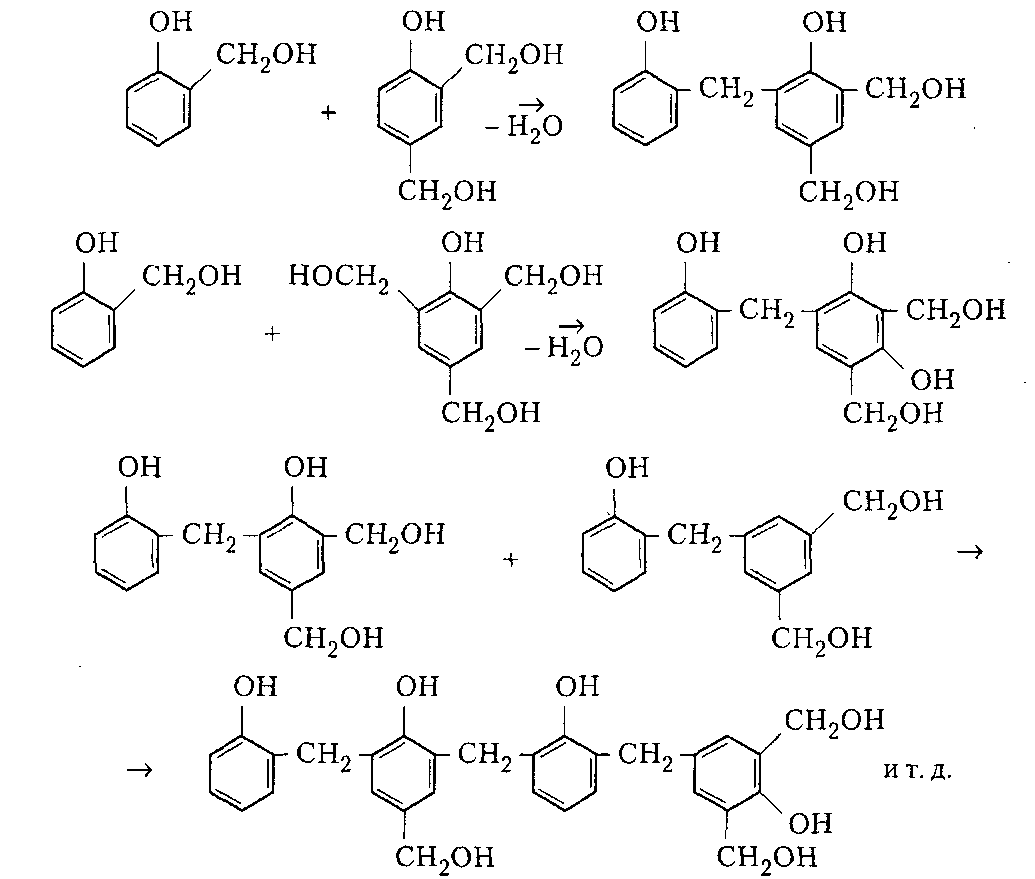 При низких температурах (20-70°С) в щелочной среде образовавшиеся фенолоспирты не вступают в дальнейшую реакцию конденсации, но при температурах выше 70°С фенолоспирты взаимодействуют друг с другом по схеме: Резольная смола — смесь линейных и разветвленных олигомеров с молекулярной массой от 400 до 1000. Общая формула PC: 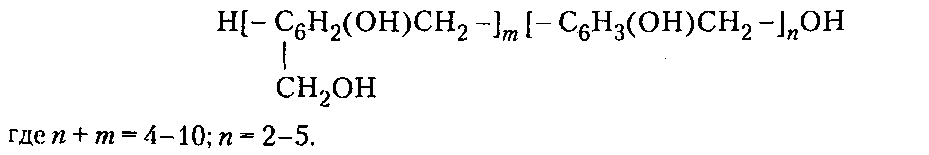 В PC, полученной в присутствии едкого натра или едкого кали, имеется некоторое количество простых эфирных связей -СН2-О-СН2- и при нагревании ее выделяется формальдегид. В случае применения аммиака простые эфирные связи не возникают и при нагревании смолы до 200°С формальдегид не выделяется. Нагревание способствует постепенному переходу PC сначала в резитол, а затем в резит. Стадия А (резол) — смола жидкая (содержит воду) или твердая (не содержит воды), растворяется в спирте, ацетоне и водных растворах щелочей; при нагревании переходит в неплавкое и нерастворимое состояние. Стадия В (резитол) — смола твердая и хрупкая на холоду, но эластичная, способная растягиваться в длинные нити при 120-125°С; лишь частично растворяется в спирте и ацетоне. Это свидетельствует о низкой концентрации поперечных связей. При 135°С образуется больше поперечных связей. При длительном нагревании резитол переходит в неплавкое и нерастворимое состояние. При 170 °С образуется продукт с высокой концентрацией поперечных связей в виде метиленовых мостиков. Все ранее возникшие эфирные связи -СН2-О-СН2- разрушаются и также переходят в метиленовые мостики. Стадия С (резит) — смола представляет собой твердый и хрупкий, неплавкий и нерастворимый продукт. Низкомолекулярные, растворимые фракции в ней отсутствуют или имеются в относительно небольших количествах. Строение резита можно представить следующим образом: 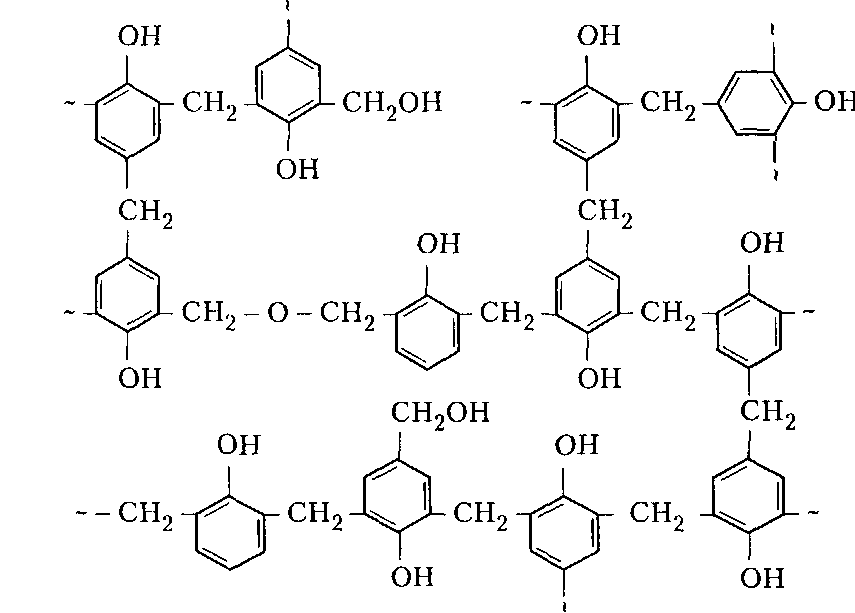 В отвержденной резольной смоле остается часть свободных метилольных групп, которые при дополнительном нагревании при высокой температуре реагируют друг с другом. Отверждение — поликонденсационный процесс, сопровождающийся выделени ем побочных продуктов реакции (воды, формальдегида). Протекание таких реакций обусловливает меньшую скорость отверждения по сравнению с НС. Чтобы повысить скорость отверждения PC, необходимо добавлять некоторые вещества: гексаметилентетрамин, окислы кальция и магния, минеральные кислоты, сульфокислоты и др. Предполагают, что в процессе горячего прессования они связывают гидроксильные группы фенольных ядер и являются, таким образом, дополнительным сшивающим агентом: 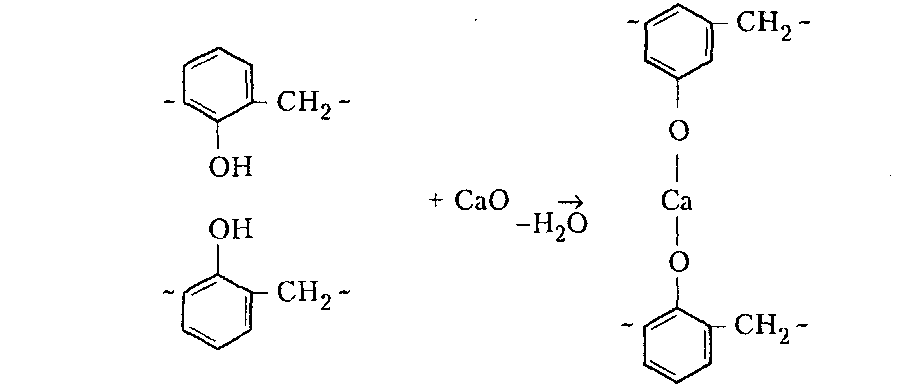 Таким образом, НС получают при рН < 7 при взаимодействии бифункциональных фенолов с формальдегидом или трифункциональных фенолов с формальдегидом в условиях недостатка последнего. PC образуется при рН > 7 в результате взаи модействия трифункциональных фенолов с формальдегидом, а также при рН < 7 из трифункциональных фенолов и формальдегида в условиях избытка последнего. НС превращается в резольную при обработке формальдегидом (в случае получения НС на основе трифункциональных фенолов), a PC — в новолачную при обработке фенолом в кислой среде. |
