|
|
М. В. Ломоносова Кафедра органической химии Помогаев А. И. Краткий курс органической химии учебное пособие
2. Химические свойства
Гидроксильная группа в фенолах, связана с атомом углерода ароматического кольца, электронное влияние которого на нее отличается от влияния алкильного остатка на гидроксильную группу в молекулах спиртов. Кроме индуктивного эффекта, вызванного большей электроотрицательностью атома кислорода, в фенолах наблюдается мезомерный эффект в результате р-π-сопряжения.

Гидроксильная группа, таким образом, проявляет по отношению к бензольному кольцу –Ι- и +Μ-эффекты, а бензольное кольцо по отношению к гидроксильной группе, соответственно, +Ι- и –Μ-эффекты.
2.1. Кислотно-основные свойства фенолов
Подобно спиртам фенолы являются амфотерными соединениями, однако как по кислотным, так и по основным свойствам фенолы отличаются от спиртов.
Фенолы являются более сильными кислотами, чем спирты. Так, для фенола рКа
10. Это обусловлено большей устойчивостью феноксид-аниона – сопряженного фенолу основания – за счет делокализации отрицательного заряда вследствие сопряжения.

Высокая кислотность фенолов по сравнению со спиртами и водой предполагает возможность их депротонирования с помощью более слабых, чем в случае спиртов, оснований. Так, фенол, будучи плохо растворимым в воде, растворяется в водном растворе едкого натра благодаря тому, что он взаимодействует со щелочью с образованием водорастворимой соли – фенолята натрия:

В неводной среде депротонирование фенола можно осуществить действием какого-либо алкоголята, например, этилата натрия в этиловом спирте. Равновесие этого кислотно-основного взаимодействия смещено вправо, поскольку фенол является более сильной кислотой, чем этанол.

Кислотные свойства замещенных фенолов зависят от электронной природы заместителей. Электроноакцепторные заместители стабилизируют соответствующие феноксид-анионы и, как следствие, увеличивают кислотные свойства фенолов. Электронодоноры, напротив, уменьшают кислотные свойства фенолов, поскольку дестабилизируют сопряженные основания. Так, в ряду пара-крезол, фенол и пара-нитрофенол кислотные свойства заметно увеличиваются, т.к. устойчивость соответствующих сопряженных оснований возрастает: метильная группа как донор (+I-эффект) не уменьшает отрицательный заряд на кислороде сопряженного пара-крезолу основания, а нитрогруппа – как акцептор (-I, -M) уменьшает отрицательный заряд на атоме кислорода пара-нитрофеноксид-аниона.

2,4,6-Тринитрофенол (пикриновая кислота), в которой присутствуют три сильных электроноакцепторных нитрогруппы, является по сравнению с фенолом уже сильной ОН-кислотой (рКа
1).
Оснóвные свойства фенолов выражены значительно слабее, чем основность спиртов, поскольку электронная плотность на атоме кислорода уменьшена за счет сопряжения с ароматическим кольцом.
2.2. Фенолы как нуклеофилы
В молекуле фенола присутствуют два нуклеофильных центра: атом кислорода гидроксильной группы, способный проявить в процессе химической реакции свойства донора электронов, поскольку имеет неподеленные пары электронов, и ароматическое кольцо, по которому могут протекать реакции электрофильного замещения.
2.2.1. Алкилирование и ацилирование фенолов по атому кислорода
Как О-нуклеофилы фенолы, подобно спиртам, могут вступать в реакции с такими электрофильными реагентами, как алкилгалогениды (алкилирующие агенты) и производные карбоновых кислот – ацилгалогениды и ангидриды карбоновых кислот (ацилирующие агенты).
Алкилирование фенолов до простых эфиров чаще всего осуществляют по методу Вильямсона, т.е. в реакцию с алкилгалогенидом вводят не сам фенол, а фенолят, О-нуклеофильные свойства которого благодаря отрицательному заряду на атоме кислорода выше, чем у фенола. Так, анизол (метилфениловый эфир) может быть получен либо реакцией фенолята натрия с метилиодидом, либо взаимодействием фенола с метилиодидом в щелочной среде.

метилфениловый эфир
(анизол)
Ацилирование фенолов до сложных эфиров происходит при действии на них галогеноангидридов карбоновых кислот или ангидридов карбоновых кислот. В первом случае реакция чаще всего катализируется основаниями, а во втором случае – кислотами. Например, фенилацетат можно получить взаимодействием фенола с ацетилхлоридом в присутствии едкого натра (или другого основания) или реакцией фенола с уксусным ангидридом в присутствии серной кислоты.

фениловый эфир уксусной кислоты
(фенилацетат)
В отличие от спиртов фенолы не ацилируются карбоновыми кислотами, т.е. в реакцию этерификации фенолы не вступают. Это обусловлено как низкой нуклеофильностью фенолов, так и низкой электрофильностью карбоновых кислот.
2.2.2. Реакции электрофильного замещения
Как ароматические соединения, фенолы вступают в реакции электрофильного замещения. Гидроксильная группа является одним из самых сильных активирующих заместителей (+М-эффект значительно больше –I-эффекта), поэтому реакционная способность фенолов в этих реакциях очень высока. Замещение происходит в пара- и орто-положения, поскольку гидроксильная группа, как все активирующие заместители, является ориентантом первого рода.
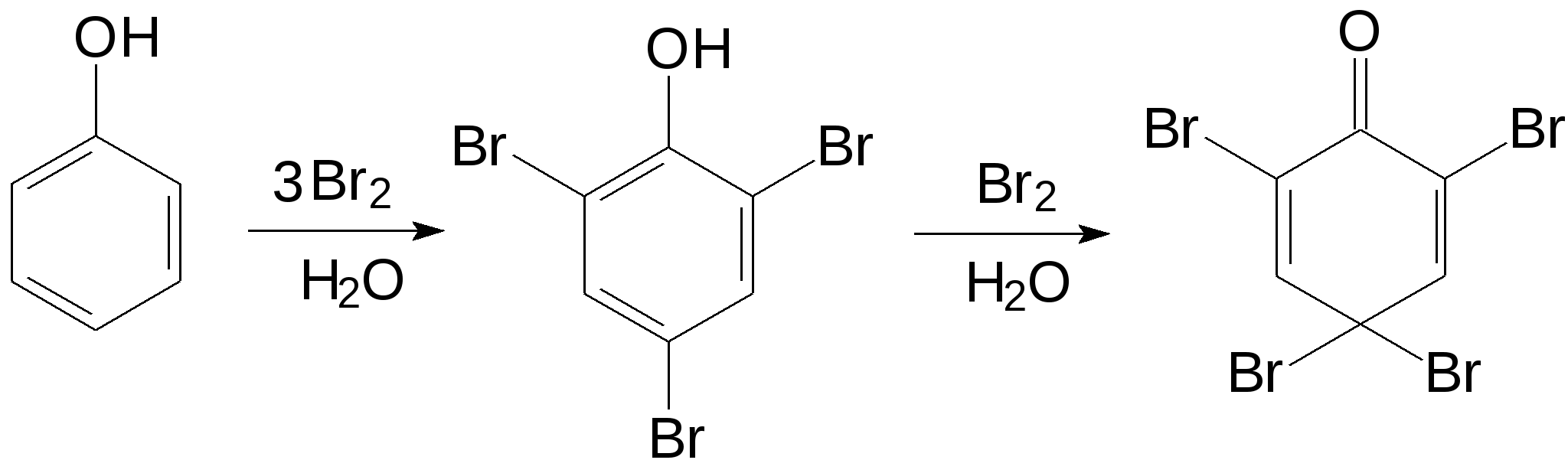 Высокая реакционная способность фенолов в реакциях ароматического электрофильного замещения позволяет осуществлять для них известные реакции в значительно более мягких условиях, чем для бензола. Так, бензол не обесцвечивает бромную воду, поскольку для его бромирования необходим катализатор, например, трибромид алюминия. Если же бромную воду добавить к фенолу, наступает почти мгновенное обесцвечивание, потому что фенол реагирует с бромом, причем так активно, что бромирование не ограничивается образованием продукта монозамещения, а идет дальше во все «активные» положения, и образуется 2,4,6-трибромфенол, который при дальнейшем взаимодействии с бромом может превратиться в 2,4,4,6-тетрабром-2,5-циклогексадиенон. Высокая реакционная способность фенолов в реакциях ароматического электрофильного замещения позволяет осуществлять для них известные реакции в значительно более мягких условиях, чем для бензола. Так, бензол не обесцвечивает бромную воду, поскольку для его бромирования необходим катализатор, например, трибромид алюминия. Если же бромную воду добавить к фенолу, наступает почти мгновенное обесцвечивание, потому что фенол реагирует с бромом, причем так активно, что бромирование не ограничивается образованием продукта монозамещения, а идет дальше во все «активные» положения, и образуется 2,4,6-трибромфенол, который при дальнейшем взаимодействии с бромом может превратиться в 2,4,4,6-тетрабром-2,5-циклогексадиенон.
Взаимодействием фенола с бромом в неполярном растворителе, например, в тетрахлорметане, можно осуществить монобромирование, причем в основном образуется пара-бромфенол.

Нитрование фенола разбавленной азотной кислотой при комнатной температуре приводит к смеси продуктов монозамещения – орто- и пара-нитрофенолов.

Сульфирование фенола концентрированной серной кислотой при 100О С происходит с образованием главным образом пара-фенолсульфокислоты.

Ацилирование фенолов по атому углерода ароматического кольца осуществляется, как и для других ароматических соединений, по Фриделю-Крафтсу. Например, взаимодействие фенола с ацетилхлоридом (хлорангидридом уксусной кислоты) в присутствии трихлорида алюминия приводит к продукту замещения на ацетильную группу в пара-положение:

Кроме обычных для всех ароматических соединений реакций электрофильного замещения, фенолы вступают также в некоторые другие реакции SE, характерные только для очень активированных производных бензола. Рассмотрим только два примера таких реакций.
Взаимодействие фенолов с альдегидами и кетонами происходит в кислой среде с образованием продукта электрофильного замещения, причем электрофил генерируется из потенциально электрофильного карбонильного соединения в результате протонирования. Так, при взаимодействии фенола с формальдегидом в качестве первичного продукта замещения образуются орто- и пара-гидроксибензиловые спирты:

салициловый спирт
Электрофильная частица в этой реакции образуется в результате следующего кислотно-основного взаимодействия:

Далее реакция протекает по обычному механизму электрофильного замещения через π- и σ-комплексы. На этом, однако, реакция не заканчивается. Как орто-, так и пара-гидроксибензиловые спирты в кислой среде также могут давать электрофильные частицы -соответствующие бензильные катионы, с которыми следующая молекула фенола реагирует опять по механизму электрофильного замещения (алкилирования) в орто- или пара-положения с образованием дигидроксидифенилметанов I - III.
 
I II
II III
Образовавшиеся дигидроксидифенилметаны (I - III) могут реагировать далее с формальдегидом и фенолом с образованием линейных и двухмерных полимеров. Эти реакции лежат в основе производства фенолформальдегидных полимерных материалов.
По аналогичному механизму происходит реакция в кислой среде между фенолом и ацетоном в соотношении 2:1 с образованием так называемого бисфенола А – промежуточного продукта в производстве эпоксидных смол.

2,2-ди(пара-гидроксифенил)пропан
(бисфенол А)
Из других реакций электрофильного замещения фенолов следует остановиться на реакции карбоксилирования – взаимодействии фенолятов с диоксидом углерода, при котором в молекулу фенолов вводится карбоксильная группа. Так, из фенолята натрия получают салициловую кислоту (орто-гидроксибензойную), ацетилированием которой уксусным ангидридом в кислой среде получают ацетилсалициловую кислоту (аспирин):

салициловая кислота «аспирин»
|
|
|
 Скачать 2.05 Mb.
Скачать 2.05 Mb.

















