Метода_(лабы_1-11). Механика и термодинамика
 Скачать 0.64 Mb. Скачать 0.64 Mb.
|
|
. Его эффективность принято характеризовать холодильным коэффициеном , который определяется как отношение теплоты, отнятой от охлаждаемого
Перепишем выражения для , используя экспериментально измеряемые величины давлений, для чего значения работы А12 и А12* определим графиче-ским способом. В рV-координатах (рис. 9.2) они равны площадям трапеций, основания которых р1 и p2 = р2* (либо p3 или р3*), а высоты (V2 V1) и (V2*V1) соответственно. Учитывая, что p1 p2 и p1 p2 2 p2 p1 2 p2 , получим nVT 2p2иSVT2p2. p3p3   проводимом опыте p3 > p3, поэтому отношение холодильных коэффициентов (nVT) / (SVT) > 1. Расчет изменения энтропии. Функция состояния,дифференциалом ко-торой является отношение Q / T, называется энтропией:
где c мольная теплоемкость газа, зависящая от типа политропного процес- са (адиабатный, изохорный, изобарный и т.п.). Отметим, что данное выраже-59 const ние справедливо лишь для обратимых процессов, то есть процессов, которые могут быть проведены в обратном направлении через те же промежуточные состояния, что и при прямом процессе; при этом тепловое состояние окру-жающей среды не изменяется (процесс без теплопотерь). Выразим изменение энтропии S через экспериментально определяемые в опыте величины давлений сначала для nVT-цикла. В политропном процессе (на участке 12) с учетом уравнения Пуассона Tp (1n )/ n
В изохорном процессе (на участке 23) изменение энтропии с учетом T3 T1и i 5,а также уравнения Пуассона равно:
Для SVT-цикла изменение энтропии в адиабатном процессе (на участке 12*)равно нулю.С учетом,что изменение энтропии в цикле также рано ну- лю, заключаем, что изменения энтропии в изохорном и изотермическом про-цессах равны по величине, но различаются знаком:
 Указания по подготовке к работе Занесите в бланк Протокола Таблицу 9.1 для записи однократно измеряемых в опыте величин и Таблицу 9.2 для определения показателя политропы. 60 Таблица 9.1. p2,Па V1,л t1,C T1, K Таблица 9.2. 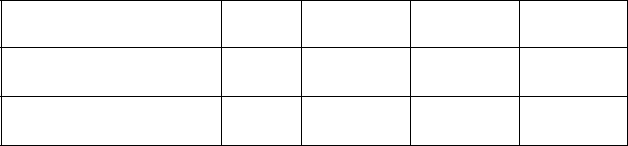 1 … … 10 p1 p3 Указания по проведению наблюдений Откройте кран на атмосферу и, когда стрелка манометра установится на нуле, закройте его. Откройте кран и, закрыв отверстие патрубка пальцем, нажмите кнопку на-соса и накачайте в баллон воздух до давления 0,8 0,9 предельного по шкале манометра, после чего закройте кран. Когда воздух в баллоне охла- дится до комнатной температуры (стрелка манометра остановится), запи-шите в Таблицу 9.2 установившееся избыточное давление p1. Откройте кран на атмосферу и, как только избыточное давление в баллоне упадёт до нуля, закройте кран. Когда воздух в баллоне нагреется до ком- натной температуры (перестанет уменьшаться давление в баллоне), запи-шите значение установившегося избыточного давления p3 в Таблицу 9.2 протокола. Действия, описанные в пп. 1, 2, выполните 10 раз. По барометру и термометру, имеющимися в лаборатории, измерьте атмосферное давление p2 и температуру воздуха T1. Объём баллона V1 ука-зан на панели установки. Все измеренные величины запишите в Таблицу 9.1 протокола. Задание по обработке результатов эксперимента Используя данные Таблицы 9.2, рассчитайте в делениях шкалы манометра избыточные давления p1 2. Рассчитайте показатель политропы n 61 Выразите избыточные давления Рассчитайте параметры состояния ( p,V , T ) в точках 1, 2 и 3 nVT-цикла, а также в точках 1, 2 и 3 SVT-цикла, используя уравнения политропического и адиабатического процессов. При расчётах используй-те экспериментальные значения изменения давления вершинах nVT- и SVT- циклов сведите в две отдельные таблицы. Постройте nVT- и SVT-циклы в координатах (р, V) на миллиметровой бу-маге в удобном масштабе. Рассчитайте изменения внутренней энергии, величину работы газа и поглощаемое (отдаваемое) им количество теплоты для всех процессов nVT цикла. Для участка 1-2 используйте при расчетах определенное в опыте значение мольной теплоемкости воздуха в политропном процессе. Проверьте выполнение первого начала термодинамики для каждой из ветвей цикла и всего цикла. Рассчитайте холодильные коэффициенты для nVT- и SVT-циклов. Сравни-те значения холодильных коэффициентов, полученные расчетным путем, с холодильными коэффициентами обратимого цикла Карно, построенного пределах тех же максимальных и минимальных температур циклов, т. е. Т1, Т2и Т2*соответственно.Обратите внимание,что холодильные коэффи-циенты обратимых циклов Карно меньше, чем холодильные коэффициен-ты рассматриваемых циклов. Используя уравнения состояния идеального газа, найдите число молей воздуха в сосуде по известным значениям p2, V1, T1 в Таблице 9.1. Счи-тается, что число молей газа при его сжатии и расширении в исследуемом цикле – постоянная величина. 62 Рассчитайте мольную теплоемкость cV воздуха при постоянном объеме, а по формуле (2) – его мольную теплоёмкость c в политропном процессе. Рассчитайте изменение энтропии всех процессов в nVT- и SVT-циклах. Контрольные вопросы Какой газ называют идеальным? Дайте определение степеней свободы молекул газа (поступательных, вращательных и колебательных). Как рассчитываются полные степени свободы молекул газа и чему они равны при невысоких температурах для одноатомного, двухатомного и многоатомного газов? Рассчитайте (с уче- том колебательных степеней свободы) полное число степеней свободы молекул O2 и CO2 . Какие циклы называют тепловыми, а какие холодильными? Какими па-раметрами принято характеризовать эффективность этих циклов? Что такое состояние вещества? Какие величины называют параметрами состояния? Напишите уравнение состояния идеального газа. Дайте определение термодинамических функций: работы газа A, его внутренней энергии U, количества теплоты Q, отдаваемой (получаемой) газом, энтропии S . Какие из этих функций являются функциями состояния, а какие функциями процесса? Чему равно изменение функций состояния в цикле? Какие процессы называют политропными? Дайте определение показателя политропы. Чему равны показатели политропы для изохорного, изобарного, изотермического и адиабатного процессов? Как экспериментально определяется показатель политропы в данной ра-боте? Докажите формулу, по которой он рассчитывается. Сформулируйте объединенный газовый закон, и, исходя из него, напиши-те уравнения изохоры, изобары и изотермы. 63 Сформулируйте первое начало термодинамики. Какой вид оно имеет для каждой из ветвей цикла, а также всего цикла? Напишите первое начало для изобарного, изохорного, изотермического и адиабатного процессов. Дайте определение удельной и мольной теплоемкостей вещества. Как они взаимосвязаны друг с другом? Каковы их размерности? Как можно вычислить теплоемкость идеального газа в произвольном по-литропном процессе через показатель политропы? Докажите эту форму-лу. Объясните, почему теплоемкость воздуха в политропном процессе в дан-ной работе отрицательна? Напишите уравнение Пуассона в переменных (p,V), (p,T) и (V,T). Дайте определение холодильного коэффициента. Как он вычисляется в цикле, изучаемом в данной работе? Как соотносятся холодильные коэффициенты nVT- и SVT- циклов? Ка- кой из них больше и почему? Покажите, что холодильный коэффициент (ХК) холодильника и КПД тепловой машины, работающих по взаимно обратным циклам, связаны соотношением 1 В каких интервалах изменяются ХК и КПД ? Может ли тепловая машина с высоким КПД, если ее цикл обратить, работать как хороший холодильник, и наоборот? Дайте термодинамическое и статистическое (формула Больцмана) опре-деление энтропии. Как можно вычислить ее изменение в произвольном политропном процессе? Какие формулировки второго начала термодинамики вам известны? Дай-те энтропийную формулировку второго начала. 64 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
