Методичка-Органічна хімія. Методичні вказівки для студентів до практичних занять. Заняття Тема Основи будови органічних сполук. Техніка безпеки. Ізомерія, номенклатура, класифікація органічних сполук
 Скачать 1.57 Mb. Скачать 1.57 Mb.
|
Теоретична частинаКарбоновими кислотами називаються похідні вуглеводнів, що містять в своєму складі одну або більше карбоксильних груп. Вони поділяються на аліфатичні, аліциклічні й ароматичні карбонові кислоти. Їх підрозділяють відповідно до числа карбоксильних груп на моно-, ди,-і полікарбонові. Серед аліфатичних розрізняють насичені і ненасичені кислоти. Назви кислот в основному дані за тривіальною номенклатурою. За замісниковою (ІЮПАК) назви карбонових кислот утворюють з назв вихідних вуглеводнів з тим самим числом атомів вуглецю, враховуючи і атом вуглецю карбоксильної групи, додаючи суфікс-ова та слово кислота. Ізомерія монокарбонових кислот структурна. Одержують монокарбонові кислоти: а) окисненням первинних спиртів і альдегідів; б) гідролізом гемінальних тригалогенопохідних вуглеводнів; в) гідролізом нітрилів; г) взаємодіє магнійорганічних сполук з СО2; д) окисненням і гідрокарбоксилуванням алканів. Реакційна здатність карбонових кислот визначається в основному наявністю в їх структурі карбоксильної групи. Виходячи з будови карбонових кислот, основні їх реакції можна умовно поділити на чотири типи: а) за участю зв’язку О- Н (кислотні властивості); б) реакції нуклеофільного заміщення за участю атома вуглецю карбонільної групи (взаємодія зі спиртами; взаємодія з галогенуючими реагентами (PCl3, PCl5, PBr3, SOCl2); взаємодія з аміаком і амінами). в) заміщення атомів водню при α- вуглецевому атомі (реакція Гелля-Фольгарда-Зелінського); г) окиснення та відновлення. До ненасичених карбонових кислот відносяться карбонові кислоти, які містять у вуглеводному радикалі кратний зв’язок. У номенклатурі ненасичених кислот широко використовують тривіальні назви. За замісниковою (ІЮПАК) назви ненасичених кислот утворюють аналогічно насиченим, використовуючи суфікс –ен (єн) для позначення подвійного зв’язку та суфікси –ин (ін) для позначення потрійного. Для добування ненасичених монокарбонових кислот можна використовувати багато методів як з методів синтезу насичених карбонових кислот. Крім того, використовують специфічні методи добування: а) гідрокарбоксилуванням алкінів (реакція Реппе); б) елімінування β-галоген- і β-гідроксикарбонових кислот. Реакційна здатність ненасичених монокарбонових кислот зумовлена наявністю у їх структурі карбоксильної групи, зокрема, вони утворюють солі, галогенангідриди, ангідриди, естери, аміди. По кратному зв’язку у вуглеводневому радикалі ненасичені кислоти виявляють ще властивості алкенів (алкінів). Ароматичні карбоновими (аренокарбоновими ) кислотами називають органічні кислоти, в яких карбоксильна група безпосередньо сполучена з ароматичним ядром. Ароматичні карбонові кислоти можна одержати тими самими способами, що й аліфатичні: а) окисненням алкіларенів; б) гідролізом тригалогенопохідних вуглеводнів; в) гідролізом нітрилів. Реакційна здатність аренмонокарбонових кислот зумовлена наявністю в їх структурі карбоксильної групи та бензольного ядра. По карбоксильні групі для них характерн6і реакції, властиві насиченим монокарбоновим кислотам (утворення солей, галогенангідридів, ангідридів, естерів та ін). За рахунок бензольного кільця аренмонокарбонові кислоти вступають у реакції електрофільного заміщення (нітрування, сульфування,галогенування), властиві ароматичним вуглеводням. Ідентифікацію проводять хімічними методами (утворення труднорозчинних солей з важкими металами, утворення естерів, виділення СО2, а для ненасичених з бромною водою або розчином KMnO4 ) і фізичними методами (УФ, ІЧ, ПМР-спектри). Практична роботаВластивості монокарбонових кислот. Дослід 1. Порівняння ступеня йонізації монокарбонових кислот. Кілька крапель або кристалів мурашиної, оцтової, трихлороцтової, монохлороцтової, бензойної і стеаринової кислот помістити у окремі пробірки, і прилити по 2 см3 води (якщо кислота не розчиняється, то нагріти). Після охолодження спостерігати за змінами в кожній пробірці. Вміст кожної пробірки випробувати універсальним індикатором. Результати спостережень та величини рН внести в дану таблицю. Осад нерозчинних кислот зберегти для другого досліду.
Дослід 2. Добування солей монокарбонових кислот. До нерозчинних у попередньому досліді кислот прилити розчину лугу. Що спостерігається? Зробити висновок. Написати рівняння реакції взаємодії даних кислот з лугом Дослід 3. Оксидація мурашиної кислоти. У пробірку помістити декілька крупинок натрій форміату , долити 3 краплі 2н розчину сульфатної кислоти і 2 краплі 0.1н розчину калій перманганату. Вміст пробірки закрити корком з Г-подібною трубкою, кінець якої опустити в розчин баритової або вапняної води. Приготовлену суміш нагріти. Що спостерігається? Написати рівняння реакції оксидації форміатної кислоти. Дослід 4. Доведення ненасиченості олеїнової або акрилової кислоти. В пробірку налити 1-5 крапель олеїнової або акрилової кислот і долити 3-4 крапель бромної води. Дослід повторити з розчином калій перманганату, нейтралізованого 2-3см3 розчину соди. Що спостерігається в обох випадках? Написати рівняння реакції з бромною водою та розчином калій перманганату. Дослід 5. Якісні реакції на карбонові кислоти. В окремі три пробірки помістити кілька крупинок натрій форміату, ацетату та бензоату, долити кілька крапель води і 1-2краплі розчину ферум (ІІІ) хлориду. Що спостерігається? Розчин ферум (ІІІ) ацетату нагріти (1-2 хвилин ) до утворення осаду у вигляді пластівців. Де змінилось забарвлення? Де використовується дана реакція? Написати рівняння реакції з ацетатною кислотою. Дослід 6. Утворення естерів. У пробірці змішати 2 см3 етанолу спирту і стільки ж ацетатної кислоти та долити 0,5 см3 конц. сульфатної кислоти. Помістити пробірку в гарячу воду (60-70˚С), і нагрівати не доводячи до кипіння. Охолодити пробірку і долити 2 см3 води. За запахом визначити естер. Дослід повторити з мурашиною (форміатною) кислотою. Написати рівняння реакцій утворених естерів. Дати їм назву. Дослід 7. Електропровідність та сила кислот. У склянку для визначення електропровідності налити розчину ацетатної кислоти. Опустити електроди приладу. Звернути увагу на яскравість загоряння лампочки. Проробити аналогічний дослід з розчином масляної та сульфатної кислот. Порівняти яскравість загоряння лампочки у всіх випадках. Прилад нарисувати в протокол. Зробити висновки. Кислоти розмістити в ряду зменшення їх сили. Дослід 8. Оксидація мурашиної (форматної) кислоти: ("реакція срібного дзеркала"). У пробірку налити 5-6 крапель аргентум нітрату і краплями приливати 5%-ний розчин аміаку до повного розчинення осаду. До утвореного аргентум аміакату долити 5-10 крапель 80%-ного розчину мурашиної кислоти. Вміст пробірки слабо нагріти. Спостерігати за зміною забарвлення реакційної суміші (утворення темно-сірого осаду). Написати рівняння реакцій. Дослід 9. Кислотні властивості вищих насичених кислот. В пробірці розчинити незначну кількість стеаринової або пальмітинової кислоти в диетиловому етері. В іншій пробірці змішати 2-3 крапель лугу з 1-2 краплями фенолфталеїну, який забарвиться в малиновий колір. До забарвленого розчину прилити краплями розчин даної кислоти. Спостерігати за зміною забарвлення. Написати рівняння реакції нейтралізації. Зробити висновок. Дослід 10. Сублімація бензойної (бензоатної) кислоти "зимовий сад". В хімічну склянку насипати кілька крупинок бензоатної кислоти і опустити в неї гілки ялинки. Склянку закрити склом і злегка нагріти. Спостерігати за гілочками, які вкриваються кристалами кислоти. Для чого можна використати дане явище? ЛітератураОсновна:
Додаткова:
ЗАНЯТТЯ №19 Тема:Монокарбонові кислоти. Актуальність теми:Карбонові кислоти – найбільш поширені в природі органічні сполуки. Вони були вперше виділені із рослинної сировини, де містяться як у вільному стані, так і вигляді сполук. Більшість з них являються біологічно – активними сполуками і використовуються як ліки, або в їх виробництві. Навчальні цілі:Теоретичне і практичне засвоєння будови ізомерії, номенклатури, властивостей та ідентифікації монокарбонових кислот. Малий практикум. Знати:
Вміти:
Самостійна позааудиторна робота 1.Вивчити теоретичний матеріал і вміти дати відповіді на контрольні питання теми. 2. Оформити три графи протоколу. 3. Здійснити синтез: СаСО3 → СН3–СООС2 Н5. Написати відповідні рівняння реакцій. 4. Яку масу ацетатної кислоти ω=80%, необхідно для приготування 0.5 дм3 оцту ω=9%? 5. Яку масу ацетатної кислоти можна одержати з 3 кг кальцій карбіду за реакцією Кучерова, якщо вміст домішок в карбіді рівний 4%?
Контрольні питання
Самостійна аудиторна робота
Теоретична частинаКарбоновими кислотами називаються похідні вуглеводнів, що містять в своєму складі одну або більше карбоксильних груп. Вони поділяються на аліфатичні, аліциклічні й ароматичні карбонові кислоти. Їх підрозділяють відповідно до числа карбоксильних груп на моно-, ди,-і полікарбонові. Серед аліфатичних розрізняють насичені і ненасичені кислоти. Назви кислот в основному дані за тривіальною номенклатурою. За замісниковою (ІЮПАК) назви карбонових кислот утворюють з назв вихідних вуглеводнів з тим самим числом атомів вуглецю, враховуючи і атом вуглецю карбоксильної групи, додаючи суфікс-ова та слово кислота. Ізомерія монокарбонових кислот структурна. Одержують монокарбонові кислоти: а) окисненням первинних спиртів і альдегідів; б) гідролізом гемінальних тригалогенопохідних вуглеводнів; в) гідролізом нітрилів; г) взаємодіє магнійорганічних сполук з СО2; д) окисненням і гідрокарбоксилуванням алканів. Реакційна здатність карбонових кислот визначається в основному наявністю в їх структурі карбоксильної групи. Виходячи з будови карбонових кислот, основні їх реакції можна умовно поділити на чотири типи: а) за участю зв’язку О- Н (кислотні властивості); б) реакції нуклеофільного заміщення за участю атома вуглецю карбонільної групи (взаємодія зі спиртами; взаємодія з галогенуючими реагентами (PCl3, PCl5, PBr3, SOCl2); взаємодія з аміаком і амінами). в) заміщення атомів водню при α- вуглецевому атомі (реакція Гелля-Фольгарда-Зелінського); г) окиснення та відновлення. До ненасичених карбонових кислот відносяться карбонові кислоти, які містять у вуглеводному радикалі кратний зв’язок. У номенклатурі ненасичених кислот широко використовують тривіальні назви. За замісниковою (ІЮПАК) назви ненасичених кислот утворюють аналогічно насиченим, використовуючи суфікс –ен (єн) для позначення подвійного зв’язку та суфікси –ин (ін) для позначення потрійного. Для добування ненасичених монокарбонових кислот можна використовувати багато методів як з методів синтезу насичених карбонових кислот. Крім того, використовують специфічні методи добування: а) гідрокарбоксилуванням алкінів (реакція Реппе); б) елімінування β-галоген- і β-гідроксикарбонових кислот. Реакційна здатність ненасичених монокарбонових кислот зумовлена наявністю у їх структурі карбоксильної групи, зокрема, вони утворюють солі, галогенангідриди, ангідриди, естери, аміди. По кратному зв’язку у вуглеводневому радикалі ненасичені кислоти виявляють ще властивості алкенів (алкінів). Ароматичні карбоновими (аренокарбоновими ) кислотами називають органічні кислоти, в яких карбоксильна група безпосередньо сполучена з ароматичним ядром. Ароматичні карбонові кислоти можна одержати тими самими способами, що й аліфатичні: а) окисненням алкіларенів; б) гідролізом тригалогенопохідних вуглеводнів; в) гідролізом нітрилів. Реакційна здатність аренмонокарбонових кислот зумовлена наявністю в їх структурі карбоксильної групи та бензольного ядра. По карбоксильні групі для них характерн6і реакції, властиві насиченим монокарбоновим кислотам (утворення солей, галогенангідридів, ангідридів, естерів та ін). За рахунок бензольного кільця аренмонокарбонові кислоти вступають у реакції електрофільного заміщення (нітрування, сульфування,галогенування), властиві ароматичним вуглеводням. Ідентифікацію проводять хімічними методами (утворення труднорозчинних солей з важкими металами, утворення естерів, виділення СО2, а для ненасичених з бромною водою або розчином KMnO4 ) і фізичними методами (УФ, ІЧ, ПМР-спектри). Практична роботаВластивості монокарбонових кислот. Дослід 1. Порівняння ступеня йонізації монокарбонових кислот. Кілька крапель або кристалів мурашиної, оцтової, трихлороцтової, монохлороцтової, бензойної і стеаринової кислот помістити у окремі пробірки, і прилити по 2 см3 води (якщо кислота не розчиняється, то нагріти). Після охолодження спостерігати за змінами в кожній пробірці. Вміст кожної пробірки випробувати універсальним індикатором. Результати спостережень та величини рН внести в дану таблицю. Осад нерозчинних кислот зберегти для другого досліду.
Дослід 2. Добування солей монокарбонових кислот. До нерозчинних у попередньому досліді кислот прилити розчину лугу. Що спостерігається? Зробити висновок. Написати рівняння реакції взаємодії даних кислот з лугом Дослід 3. Оксидація мурашиної кислоти. У пробірку помістити декілька крупинок натрій форміату , долити 3 краплі 2н розчину сульфатної кислоти і 2 краплі 0.1н розчину калій перманганату. Вміст пробірки закрити корком з Г-подібною трубкою, кінець якої опустити в розчин баритової або вапняної води. Приготовлену суміш нагріти. Що спостерігається? Написати рівняння реакції оксидації форміатної кислоти. Дослід 4. Доведення ненасиченості олеїнової або акрилової кислоти. В пробірку налити 1-5 крапель олеїнової або акрилової кислот і долити 3-4 крапель бромної води. Дослід повторити з розчином калій перманганату, нейтралізованого 2-3см3 розчину соди. Що спостерігається в обох випадках? Написати рівняння реакції з бромною водою та розчином калій перманганату. Дослід 5. Якісні реакції на карбонові кислоти. В окремі три пробірки помістити кілька крупинок натрій форміату, ацетату та бензоату, долити кілька крапель води і 1-2краплі розчину ферум (ІІІ) хлориду. Що спостерігається? Розчин ферум (ІІІ) ацетату нагріти (1-2 хвилин ) до утворення осаду у вигляді пластівців. Де змінилось забарвлення? Де використовується дана реакція? Написати рівняння реакції з ацетатною кислотою. Дослід 6. Утворення естерів. У пробірці змішати 2 см3 етанолу спирту і стільки ж ацетатної кислоти та долити 0,5 см3 конц. сульфатної кислоти. Помістити пробірку в гарячу воду (60-70˚С), і нагрівати не доводячи до кипіння. Охолодити пробірку і долити 2 см3 води. За запахом визначити естер. Дослід повторити з мурашиною (форміатною) кислотою. Написати рівняння реакцій утворених естерів. Дати їм назву. Дослід 7. Електропровідність та сила кислот. У склянку для визначення електропровідності налити розчину ацетатної кислоти. Опустити електроди приладу. Звернути увагу на яскравість загоряння лампочки. Проробити аналогічний дослід з розчином масляної та сульфатної кислот. Порівняти яскравість загоряння лампочки у всіх випадках. Прилад нарисувати в протокол. Зробити висновки. Кислоти розмістити в ряду зменшення їх сили. Дослід 8. Оксидація мурашиної (форматної) кислоти: ("реакція срібного дзеркала"). У пробірку налити 5-6 крапель аргентум нітрату і краплями приливати 5%-ний розчин аміаку до повного розчинення осаду. До утвореного аргентум аміакату долити 5-10 крапель 80%-ного розчину мурашиної кислоти. Вміст пробірки слабо нагріти. Спостерігати за зміною забарвлення реакційної суміші (утворення темно-сірого осаду). Написати рівняння реакцій. Дослід 9. Кислотні властивості вищих насичених кислот. В пробірці розчинити незначну кількість стеаринової або пальмітинової кислоти в диетиловому етері. В іншій пробірці змішати 2-3 крапель лугу з 1-2 краплями фенолфталеїну, який забарвиться в малиновий колір. До забарвленого розчину прилити краплями розчин даної кислоти. Спостерігати за зміною забарвлення. Написати рівняння реакції нейтралізації. Зробити висновок. Дослід 10. Сублімація бензойної (бензоатної) кислоти "зимовий сад". В хімічну склянку насипати кілька крупинок бензоатної кислоти і опустити в неї гілки ялинки. Склянку закрити склом і злегка нагріти. Спостерігати за гілочками, які вкриваються кристалами кислоти. Для чого можна використати дане явище? ЗАНЯТТЯ № 20 Тема:Дикарбонові кислоти. Актуальність теми:Дикарбонові кислоти, як і монокарбонові, являються біологічно-активними речовинами, які утворюють ряд похідних, використовуються в органічних синтезах, а також виробництві лікарських препаратів. Навчальні цілі:Теоретичне і практичне засвоєння будови та властивостей насичених, ненасичених і ароматичних дикарбонових кислот. Малий практикум. Знати:
Вміти:
Самостійна позааудиторна робота 1. Вивчити теоретичний матеріал і вміти дати відповіді на контрольні питання теми. 2. Оформити три графи протоколу. 3. Здійснити синтез: СО2 → НООС-СООН. Написати відповідні рівняння реакцій. 4. Здійснити перетворення: метан → метил хлорид → метанол → кальцієва сіль → форміатної кислоти → форміатна кислота → хлорангідрид форматної кислоти → амід форматної кислоти. 5. Обчислити рН 0.01н розчину оксалатної кислоти. 6.Написати формули ізомерів фталевої кислоти. 7.Написати формули похідних малонової кислоти. Дати назви. 8. Вставити структурні формули проміжних і кінцевих продуктів в дану схему: фталева кислота 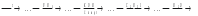 9.Дати порівняльну характеристику ацетатної і оксалотної кислот. Контрольні питання
Самостійна аудиторна робота
Теоретична частина Дикарбоновими кислотами називають похідні вуглеводнів, які містять у своєму складі дві карбоксильні групи. В номенклатурі дикарбонових кислот застосовують тривіальні назви. За замісниковою номенклатурою ІЮПАК назви дикарбонових кислот утворюють з назв відповідних вуглеводнів з додаванням префікса – ди-, суфікса – ова та слово кислота. Ізомерія дикарбонових кислот зумовлена різною структурою вуглецевого скелету. Одержують дикарбонові кислоти тими самими методами що й монокарбонові, використовуючи як вихідні речовини біфункціональні сполуки. За хімічними властивостями дикарбонові кислоти подібні до монокарбонових, але утворюють два ряди похідних (дисоціюють ступінчасто утворюють солі кислі і середні, естери повні і неповні, галогенангідриди та аміди). Крім того дикарбонові кислоти проявляють ряд специфічних властивостей: а) при нагріванні декарбоксилюються по одній карбоксильній групі і перетворюються на монокарбонові; б) починаючи з янтарної кислоти при нагріванні утворюють циклічні ангідриди; в) при нагріванні янтарної та глутарової кислот з аміаком утворюють циклічні іміди. Ненасичені дикарбонові кислоти містять в своєму складі дві карбоксильні групи та кратний вуглець-вуглецевий зв’язок. Представниками даних кислот є малеїнова та фумарова кислоти, які являються геометричними цис- і транс- ізомерами. За хімічними властивостями ці кислоти подібні до насичених мононокарбонових кислот та ненасичених вуглеводнів. Ароматичні дикарбонові кислоти містять дві карбоксильні групи безпосередньо сполучені з ароматичним ядром. Найважливішими представниками є фталева кислота та її ізомери. Їх одержують при окисненні ксилолів, багатоядерних сполук. Фталеві кислоти проявляють більшу кислотність ніж бензойна кислота. За хімічними властивостями вони не відрізняються від ароматичних монокарбонових. Ідентифікують дикарбонві кислоти за фізико – хімічними властивостями, а також рядом специфічних методів. Медичні препарати:ацетат калію і свинцю, бензоатна кислота, натрію бензоат, анестезин, новокаїн, “мурашиний спирт”, ізовалерянова кислота, натрію цетрат, фенібут та ін. Практична робота Властивості дикарбонових кислот аліфатичного ряду. Дослід 1. Розчинність оксалатної кислоти. У пробірку помістити декілька кристаликів кислоти і влити подвійний об’єм дистильованої води. Вміст пробірки добре розмішати. За допомогою універсального індикатора визначити за шкалою рН розчину кислоти. Зробити висновок. Написати рівняння ступінчастої дисоціації кислоти. Дослід 2. Одерження кальцієвої солі оксалатної кислоти та її розчиність в мінеральних кислотах. У пробірку прилити 3 см3 3%-ного розчину калій оксалату і такий же об׳єм см3 5%-ного розчину кальцій хлориду. Одержаний осад розділити на дві частини (пробірки) і в першу долити 3-5 крапель ацетатної, а в другу стільки ж хлоридної кислот. Що спостерігається в обох пробірках? Написати рівняння реакцій утворення відповідних солей та їх розчинність в мінеральній кислоті. Дослід 3. Добування кислих та середніх солей оксалатної кислоти. У пробірку прилити 2 см3 розчину оксалатної кислоти і краплями, перемішуючи паличкою, прилити розчин калій гідроксиду. Коли осад повністю розчиниться, додати такий же об’єм оксалатної кислоти. Що спостерігається? Написати всі відповідні рівняння реакцій. Дослід 4. Оксидація оксалатної кислоти. У пробірку налити 3 см3 5%-ного розчину калій перманганату , 1 см3 2н розчину сульфатної кислоти і 1 см3 розчину оксалатної кислоти. Швидко закрити пробірку корком з Г-подібною трубкою, кінець якої опустити в розчин баритової води і пробірку з реакційною сумішшю нагріти до початку реакції. Що спостерігається? Написати рівняння реакцій і урівняти його оксидно – відновним балансом. Дослід 5. Відновлення оксалатної кислоти. До щіпки металічного магнію, зволоженого краплею води, прилити порціями (по 1 см3) 5 см3 розчину оксалатної кислоти. Відновлення проходить з виділенням газу. Якого? Утворюється альдокислота, яку можна розпізнати за допомогою фуксинсульфітної кислоти. Написати рівняння реакції відновлення оксалатної кислоти. Дослід 6. Добування оксалатів важких металів. У дві пробірки прилити окремо по 5 крапель розчину амонію оксалату і відповідно до 1-ої пробірки прилити 5 крапель 10%-ного розчину плюмбум ацетату , а в другу – таку ж кількість 10%-ного розчину купрум (ІІ) сульфату. Осади розчинити в розчині хлоридної кислоти Що спостерігається у пробірках? Написати рівняння утворення відповідних оксалатів. Дослід 7. Порівняння сили насичених і ненасичених дикарбонових кислот. За допомогою приладу для вимірювання електропровідності порівняти силу дикарбонових кислот: янтарної, малеїнової, фумарової. Розмістити їх у порядку зменшення кислотних властивостей. Пояснити як впливає розміщення карбоксильних групи у цис- і транс-положенні на силу кислот. Написати рівняння дисоціації даних кислот. Дослід 8. Якісна реакція на малеїнову кислоту. До 5 крапель розчину малеїнової кислоти прилити 5 крапель бромної води. Що спостерігаються? Аналогічно повторити дослід з розчином калій перманганату. Спостерігати за зміною забарвлення у обох випадках. Написати рівняння реакцій даних кислоти з Br2 – водою i розчином KMnO4. Дослід 9. Ізомеризація малеїнової кислоти. У пробірку налити 2 см3 5%-ного розчину малеїнової кислоти і краплями прилити бромну воду. Одержану суміш опромінити кварцевою лампою або прямим сонячним світлом. Випадання кристалів фумарової кислоти свідчить про процес ізомеризації. Написати рівняння ізомеризації кислоти. Дослід 10. Ситуаційна задача. У 3-х окремих пробірках містяться розчини оксалатної, малеїнової і ацетатної кислот. За допомогою якісних реакцій визначити кожну кислоту. Написати відповідні рівняння реакцій. ЗАНЯТТЯ № 22 Тема:Функціональні похідні карбонових кислот. Актуальність теми:Карбонові кислоти утворюють похідні як по радикалу так і по функціональні групі. Це реакційноздатні сполуки, особливо ангідриди, галогенангідриди, які використовуються як ацилюючі засоби у виробництві різних органічних сполук та ліків. Навчальні цілі:Теоретичне і практичне засвоєння будови, властивостей естерів, жирів, восків, їх біологічним значенням та застосуванням. Знати:
Вміти:
Самостійна позааудиторна робота
СН4СН3-СООС2Н5 Вказати типи і механізми реакцій.
Контрольні питання
Самостійна аудиторна робота
Теоретична частинаДо функціональних похідних карбонових кислот відносяться ангідриди, галоген ангідриди, аміди, гідриди, нітрили, солі, бестери. Ізомерія даних кислот зумовлена ізомерією вуглецевого скелету. Назви функціональних похідних утворюють з назви відповідних кислот або анальних груп і назви замісників. За хімічними властивостями дані кислоти проявляють біфункціональні властивості по функціональній групі і по заміснику. Галогенангідриди являються активними електрофільними реагентами і легко вступають в реакції нуклеофільного заміщення. Внаслідок чого галогенангідриди є ацилуючими реагентами. Ацилування ароматичних вуглеводнів проводять за реакцією Фріделя-Крафтса. Ангідриди карбонових кислот можуть бути лінійні та циклічні. Лінійні, що містять з0алишки різних кислот називаються змішаними ангідридами. Ангідриди карбонових кислот як і галогенангідриди є досить активні електрофільні реагенти, але мають менш виражений електрофільний характер і легко реагують з різними нуклеофільними реагентами. Циклічні ангідриди реагують зі спиртами, аміаком і первинними амінами. Складні естери є електрофільними реагентами. Будучи електрофільними реагентами, естери вступають в реакції нуклеофільного заміщення (гідроліз, алкоголіз, гідразиноліз). Гідроліз проходить в кислому та лужному середовищі. Аміди карбонових кислот практично не вступають в реакції нуклеофільного заміщення і є слабкими основами. При цьому вони утворюють солі лише з сильними мінеральними кислотами, піддаються гідролізу, дегідратації, розщепленню і відновленню. Гідразиди карбонових кислот за хімічними властивостями подібні до амідів, виявляючи основні та нуклеофільні властивості (утворюють солі з мінеральними кислотами, вступають в реакцію ацилування, реагують з карбонільними сполуками, взаємодіють з азотистою кислотою). Нітрили відрізняються від похідних карбонових кислот відсутністю карбонільної групи і наявністю ціаногрупи. Нітрили вступають в реакцію нуклеофільного приєднання по α-вуглецевому атомі, конденсації, гідролізу, відновлення. Одержують функціональні похідні карбонових кислот діючи галогенідами фосфору, аміаком, спиртами, нагріванням амонійних солей, дегідратацією не заміщених амідів, розщепленням амідів. Ідентифікацію проводять за допомогою фізичних та хімічних методів. Медичні препарати: жири, твіни, спермацет, віск та ін. Практична робота |
