Методичка-Органічна хімія. Методичні вказівки для студентів до практичних занять. Заняття Тема Основи будови органічних сполук. Техніка безпеки. Ізомерія, номенклатура, класифікація органічних сполук
 Скачать 1.57 Mb. Скачать 1.57 Mb.
|
    Методичні вказівки для студентів до практичних занять. Методичні вказівки для студентів до практичних занять.ЗАНЯТТЯ №Тема: Основи будови органічних сполук. Техніка безпеки. Ізомерія, номенклатура, класифікація органічних сполук. Актуальність теми: Серед усіх хімій, які вивчаються на фармацевтичному факультеті, особливе місце займає органічна хімія. Понад 85% ліків мають органічне походження. Тому знання будови, властивостей, ізомерії, ідентифікації необхідні для вивчення спеціальних дисциплін, особливо фармацевтичної хімії-хімії ліків. Органічних речовин відомо близько 10 мільйонів, які мають різні назви. При вивченні органічних сполук, необхідно знати різні номенклатури, особливо правила міжнародної номенклатури (ІЮПАК). Навчальні цілі: Знати:
Вміти:
Самостійна позааудиторна робота
Контрольні питання
Самостійна аудиторна робота
Теоретична частина Значне місце серед фармацевтичних дисциплін займає органічна хімія, яка вважається основою для вивчення спеціальних предметів. Органічна хімія виникла на початку 19 ст. Вона вивчає вуглеводні та їх похідні. Причинами її відокремлення від інших хімій є : а) велика кількість органічних сполук; б) їх особливі властивості(горючість , нестійкість не проводять електричного струму, реакції відбуваються повільно, характерне явище ізомерії і ін.); в) велике практичне застосування. Основоположником органічної хімії є російський хімік О.М. Бутлеров, який створив теорію хімічної будови органічних речовин. Дана теорія не зазнала великих змін до сьогоднішнього часу, але лише розвивається в двох напрямках: а) просторової ізомерії; б) електронної структури будови атома. Розвиток органічної хімії в історичному аспекті включає чотири періоди розвитку: а) емпіричний (18 ст. початок і кінець); б) аналітичний (кінець 18ст. початок19ст.); в) структурний (друга половина 19ст. початок 20ст.); г) сучасний (початок 20ст. і до наших днів). Важливим періодом в розвитку органічної хімії є структурний, який характеризується бурхливим розвитком органічної хімії як самостійної науки. Важливого значення набуває органічний синтез, за допомогою якого одержано сотні не знайдених в природі речовин. З’являються нові галузі по виробництву синтетичних барвників, вибухових речовин, лікарських засобів. На основі сучасної органічної хімії розвивається хімія гетероциклічних, високомолекулярних сполук, алкалоїдів, вітамінів, гормонів, хімія елементоорганічних сполук. Органічні речовини відіграють важливу роль в життєдіяльності рослинних і тваринних організмів. Вони є основою прояву життя. При вивченні органічної хімії слід користуватися молекулярними формулами(брутто), які показують, які атоми і в якій кількості входять в склад молекули, також структурними (графічні), які відображають природу атомів, їх число послідовність зв’язування, а також тип хімічного зв’язку між ними. Для зручності запису частіше використовують скороченні структурні формули. Всі органічні сполуки ділять на дві групи: ациклічні і циклічні. До першої групи відносяться сполуки з відкритим (незамкнутим) ланцюгом. В залежності від будови скелету, сполуки можуть бути: насичені(наявність σ- зв’язків) ненасичені (σ і π зв’язки). Циклічні сполуки в свою чергу діляться на карбоциклічні (утворюють замкнутий цикл лише атомами Карбону) і гетероциклічні – крім атомів Карбону беруть участь інші атоми (гетероатоми). Серед карбоциклічних сполук слід виділити аліциклічні і ароматичні. За природою функціональних груп, органічні сполуки поділяють на окремі класи, які характеризуються певними функціональними групами. За кількістю функціональних груп сполуки поділяються на монофункціональні, поліфункціональні, гетерофункціональні. Сполуки одного класу об’єднуються в гомологічні ряди. Номенклатура (назва) існує тривіальна (історична, випадкова назва) і міжнародна номенклатура, яка включає замісникову і радикально-функціональну (ІЮПАК). При складані назв за правилом ІЮПАК спочатку визначають функціональні групи і вибирають старшу. Старша група позначається в суфіксі, а всі інші в префіксі. Нумерація атомів Карбону ведеться від старшої групи. Читаємо замісники в алфавітному порядку, вказуючи номер атома Карбону біля якого знаходяться замісники. Подвійний зв’язок в назві позначається суфіксом – ен потрійний - ін, одинарний - ан. Для органічних сполук характерна явище ізомерії (існування сполук з однаковим якісним і кількісним складом, але з різною будовою і властивостями). Розрізняють такі види ізомерії:
а) ізомерія ланцюга; б) положення зв’язку або функціональної групи; в) міжкласова.
а) геометрична (цис-транс форми); б) оптична (D і L ряду). Геометричні ізомери це - речовини, які мають одинаковий склад і послідовність зв’язування атомів в молекулах, але різне розташування замісників в просторі відносно площини подвійного зв’язку. Крім транс і цис позначення ізомерів останнім часом використовується E, Z-система, яка є більш загальною і використовується при будь-якому наборі замісників, враховуючи їх старшинство. Для характеристики оптичної активності вводять поняття асиметричність або хіральність молекул. Практична робота І. Правила роботи й техніка безпеки в лабораторії органічної хімії. До практичних занять у лабораторії органічної хімії студенти допускаються лише після докладного інструктажу з техніки безпеки (ТБ). Студенти, зобов'язані виконувати такі вимоги:
ІІ. ПЕРВИННІ ЗАСОБИ ВОГНЕГАСІННЯ У випадку виникнення пожежонебезпечної ситуації в лабораторії слід закрутити загальний газовий кран, вимкнути вентиляцію й рубильник силової мережі, негайно звернутися за допомогою до викладача чи лаборанта, вжити заходи для ліквідації пожежі. Під час пожежі необхідно швидко й організовано залишити лабораторію, вивести потерпілих і надати першу допомогу. Викликати за телефоном 01 пожежну охорону, за телефоном 03 карету швидкої допомоги, взяти участь в евакуації потерпілих і в боротьбі з вогнем різними підсобними засобами (вогнегасники, пісок, шерстяні ковдри, вода). Найпростіші засоби вогнегасіння: а) Повстяна або шерстяна ковдра, азбестове полотнище - застосовуються при гасінні невеликої за площею пожежі. Ковдрою обгортають людину у випадку займання одягу; б) Пісок - універсальний засіб гасіння пожежі; в) Вода - застосовується тільки для припинення горіння предметів, виготовлених з дерева, пластмас, змішуваних із водою рідин (етанол, метанол, пропанол, ацетон, ацетальдегід); Забороняється застосовувати воду для гасіння електроприладів та речовин, які реагують з водою (Nа, К, Са, кальцій карбід, хлорангідридів кислот). г) Вогнегасники бувають різних конструкцій, найбільш універсальним є вуглекислий вогнегасник. Пінний вогнегасник можна застосовувати тільки в тих випадках, для яких не рекомендується використання води. ІІІ. ПЕРША ДОПОМОГА ПРИ НЕЩАСНИХ ВИПАДКАХ У ХІМІЧНІЙ ЛАБОРАТОРІЇ Надання першої допомоги потерпілому до того, як прибуде лікар – обов'язок кожного. При цьому, перш за все, слід ліквідувати причину травми (вимкнути електромережу, погасити полум'я, видалити з рани осколки скла чи інших твердих тіл або хімічну речовину, яка викликала опік, промити рану чи очі, вивести потерпілого на повітря, тощо). Створити потерпілому умови для найзручнішого положення тіла, взяти аптечку першої допомоги і діяти за такими порадами: При порізах склом: видалити пінцетом скалки скла і промити рану 3%-им розчином гідроген пероксидом (Н2О2); змазати шкіру навколо порізу 5%-им розчином йоду; накласти стерильну пов'язку. При сильній кровотечі накласти джгут і точно зазначити час накладання. При термічних опіках: очистити місце опіку від обгорілого одягу, обробити обпечене місце етиловим спиртом або 5%-им розчином таніну в 40%-у розчині етилового спирту; змазати маззю від опіків; накласти стерильний тампон. При опіках кислотою: ділянки обпеченої шкіри чи ока добре промити проточною водою, обробити 2%-им розчином натрій гідрокарбонату . При опіках лугом: промити обпечену ділянку великою кількістю води, обробити місце опіку 1%-им розчином оцтової кислоти чи оцту. При опіках очей після промивання великою кількістю води промити 2%-им розчином (Н3ВО3) борної кислоти.. При опіках фенолом: розтерти уражену ділянку гліцерином до відновлення природного кольору шкіри, добре промити водою, накласти ватний або марлевий тампон, змочений гліцерином. При отруєнні газом або пароподібними речовинами: вивести чи винести потерпілого на свіже повітря; створити йому спокій, накрити теплою ковдрою або одягом. При ураженні електрострумом: вимкнути силову електромережу; користуючись предметами з дерева чи пластмаси, звільнити потерпілого від дотикання до електропроводки; забезпечити цілковитий спокій і доступ свіжого повітря, якщо потерпілий не втратив свідомості; у випадку припинення дихання чи серцевої діяльності застосувати штучне дихання чи непрямий масаж серця. ІV. Ознайомлення з хімічним посудом і допоміжними пристроями. 1. Колби: круглодонні (одно-, дво-, три- і чотиригорлі), плоскодонні; конічні, (колби Ергенмейера), колба Кיєльдаля; гостродонна (грушовидна), колба Вюрца, колба Кляйзена, колба Фаворського, колба Бунзена. 2. Склянки: хімічні, склянки для зважування (бюкси). 3. Пробірки: циліндричні, конічні, зі шліфом, зі шліфом і боковою трубкою. 4. Чашки: циліндричні (кристалізатори), плоскодонні, круглодонні, чашки Петрі. 5. Лійки: конічні, з скляним фільтром, лійки з цвяшком, крапельні лійки, ділильні лійки. 6. Ексикатори: звичайні, вакуумні. 7. Холодильники: повітряні, холодильник Лібіха, кулькові, спіральні, дефлегматор. 8. Пристрої: перехідники, насадки, алонж, затвори. 9. Фарфоровий посуд: склянки, чашки, тиглі, ступки, лодочки, шпателі, ложки. 10. Пристрої для закріплення приладів: а) Штатив лабораторний з затискачем і кільцями, тримачі. б) Штатив і тримачі для пробірок. в) Конусні шліфи (керни й муфти). Практична робота Вправи по ізомерії і номенклатурі органічних речовин
ЛІТЕРАТУРА Основна:
Додаткова:
Методичні вказівки для студентів до практичних занять. ЗАНЯТТЯ № Тема: Хімічний зв’язок. Кислотно-основні властивості органічних сполук. Методи очистки і виділення органічних сполук. Актуальність теми: Атоми в молекулах органічних сполуках з’єднані між собою певним зв’язком. Природа зв’язку впливає на властивості сполук, їх фармакологічну дію. Вміти розпізнавати типи зв’язків, їх природу дає можливість визначати хімічні властивості сполук. Органічні речовини зустрічаються в природі не в чистому вигляді, а у вигляді різних сумішей. При синтезі органічних сполук для їх вивчення необхідно вміти їх виділити і очистити відомими фізичними та хімічними методами. Навчальні цілі: Знати:
Вміти:
Самостійна позааудиторна робота
10. Оформити протокол (перші три графи, згідно поданої схеми; в передмові). Контрольні питання
Самостійна аудиторна робота
Теоретична частина Реакційна здатність органічних сполук залежить від природи молекул, їх електронної структури, природи хімічного зв’язку. Найбільш поширеним типом хімічного зв'язку в органічних сполуках є ковалентний зв'язок, який виникає між атомами рівними або близькими за електронегативністю. Якщо електронегативність однакова і спільна електронна пара розташовується симетрично до центрів обох атомів, то такий зв'язок називається ковалентним неполярним. Якщо електронегативність різна і електронна пара зміщується в сторону більш електронегативного атома, то такий зв'язок називається ковалентним полярним. Число спільних електронних пар позначають: якщо одинарний простий зв'язок однією рискою, подвійний – двома, потрійний – трьома. Коли атоми різко відрізняються своєю електронегативністю то між ними виникає йонний зв'язок (зв'язок за рахунок електростатичного притягання між протилежно зарядженими йонами). Сполуки з даним зв'язком добре розчиняється в полярних розчинниках , дисоціюють, проводять електричний струм мають високі температури плавлення тощо. Різновидністю ковалентного полярного зв'язку є донорно-акцепторний зв'язок, який виникає за рахунок двох електронів, які надає атом (донор) і приймає атом, що має вільну орбіталь (акцептор). Різновидністю даного зв'язку є семиполярний. Він утворюється між атомом, що має вільну пару електронів (донором) і електронейтральною частиною, що містить секстет електронів (акцептор). Ці два атоми зв'язані двояко як ковалентним так і йонним зв'язками. Досить поширеним в органічних сполуках водневий зв'язок, який утворюється за рахунок атома Гідрогену і сильно електронегативного атома (О, F, Cl, N). Водневий зв'язок розрізняють внутрішньомолекулярний і міжмолекулярний. Він сильно впливає на хімічні та фізичні властивості речовин, конфігурацію молекул, швидкість реакцій, біохімчні процеси в організмі. Кислотність та основність органічних сполук пояснюють дві теорії: протонна Бренстеда і електронна Льюїса. За Бренстедом кислоти це речовини, які віддають протон, а основи навпаки приймають його. Мірою сили кислот є константа кислотності, а основ константа основності. Сила кислот залежить від електронегативності атома і його поляризованості. На кислотність впливають замісники, які введені в радикал. Електронодонорні знижують кислотність, а електроноакцепторні підвищують. Сильніший вплив проявляють замісники, які ближче знаходяться до даних атомів. Органічні основи поділяються на амонієві, оксонієві і сульфонієві. Сила основ залежить від тих факторів, що і кислот. За теорією Льюєса будь-яка частинка, яка віддає пару електронів на утворення ковалентного зв'язку називається кислотою, а яка приймає основою. Основа є донором, кислота-акцептором. Кислоти Льюїса поділяються на жорсткі і м'які. Такий же поділ мають і основи. Перш ніж розпочати вивчення будови органічної сполуки необхідно її виділити з реакційної суміші або природних джерел в чистому вигляді. Для виділення і очистки використовують такі основні методи: а) перекристалізації; б) перегонки; в) екстракції; г) хроматографії та інші відомі методи. Трудність очищення полягає в тому, що органічні речовини нестійкі до нагрівання, легко звітрюються, тому підбір методу очищення потребує великої уваги і вміння. Для очищення суміші рідин в лабораторних умовах часто використовують метод перегонки. Якщо складові суміші різко відрізняються температурами кипіння то застосовують звичайну перегонку, яку проводять в перегінному апараті. Апарат складається з колби Вюрца, холодильника Лібіха , алонжа і приймачів. Окремі фракції збирають в приймачі слідкуючи за сталою температурою кипіння. Якщо близькі температури кипіння то використовують фракційну перегонку, а коли дуже леткі то перегонку з водяною парою. Метод сублімації (возгонки) використовують для речовин, які при нагріванні, минаючи рідкий стан переходять в пароподібний (нафталін, саліцилова, бензойна кислоти і ін.). Метод екстрагування застосовують , коли складові частинки суміші розчиняються в різних розчинниках, які не змішуються між собою (вода-ефір, вода-бензол і ін.). Екстрагування в лабораторії проводять в ділильних лійках , відокремлюючи окремі фракції, а потім розчинник випаровують або відганяють. Останнім часом в лабораторну практику широко впроваджений метод хроматографії, особливо паперова. Суть даного методу описана в даній лабораторній роботі. Після одержання речовин в хімічночистому вигляді, встановлюють їх будову. Практична робота Очищення та виділення органічних речовин. Дослід 1. Метод возгонки (сублімації). На дно хімічного стакану насипати забрудненої бензойної або саліцилової кислоти і помістити в нього кілька сухих гілочок або соломинок. Стакан накрити зверху колбою, заповненою до половини холодною водою. Нагрівати вміст стакану на слабкому вогні, не доводячи до плавлення. Що спостерігається? Яка форма кристалів? Зарисувати їх в протоколах. Які речовини можна очищати даним методом?  Прилад для сублімації. Дослід 2. Метод перегонки. В колбу Вюрца (до половини) налити забрудненого етанолу і вкинути 2-3 скляних капіляри. Колбу закрити корком з термометром, ртутний стовпчик якого повинен знаходитися на 0,5 см нижче рівня відвідної трубки колби. Колбу з'єднати з водяним холодильником і підставити приймач для конденсату. Підключивши воду до холодильника, нагрівати колбу на водяній бані. За термометром визначити температуру кипіння спирту, який відганяється від різних домішок. Перегонку проводити до різкої зміни температури на 5-100С. Чому температура залишається сталою? Для чого в колбі скляні капіляри? Коли не можна використовувати даний метод очистки?  Прилад для перегонки. Дослід 3. Метод перекристалізації. У пробірку внести 0,5 г забрудненої саліцилової або бензойної кислоти і долити 5-6 см3 води. Суміш нагріти до повного розчинення. Гарячий концентрований розчин відфільтрувати через складчастий фільтр. Фільтрат розділити на дві пробірки. Одну пробірку швидко охолодити під струменем холодної води. Другу залишити для повільного охолодження і кристалізації. Одержані кристали відфільтрувати і здати лаборанту. На чому оснований метод кристалізації? Яка різниця у формі кристалів в обох пробірках? Дослід 4. Метод паперової хроматографії. На стрічку фільтрувального паперу, просоченого розчинником хлороформ – ацетон (90: 10) на відстані 2 см від нижнього краю, олівцем провести лінію старту через 10 см провести лінію фінішу. На лінію старту через рівні інтервали (1-1,5 см) нанести по 2 краплі стандартного і досліджуваного хлороформних розчинів саліцилової кислоти, амідопірину і антипірину. Папір висушити на повітрі і помістити в хімічний стакан місткістю 100 см3, в якому міститься 12% - розчин гліцерину. Стрічку паперу закріпити в верхній частині стакану так, щоб край паперу з нанесеними на неї краплями розчинів був занурений в рухомий розчинник приблизно на 0,8 – 1 см. Стакан накрити скляною пластинкою. При досягненні фронту лінії фінішу (час утворення хроматограми близько 15 хвилин) пластинку вийняти із стакану підсушити і обробити з розпилювача 3-5% розчином ферум (ІІІ) хлоридом. Спостерігати появу плям: фіолетовий колір – саліцилова кислота, бурого – амідопірин, рожевого – антипірин. Які переваги даного методу над іншими? Які ще види хроматографії відомі? Дослід 5. Метод екстрагування. У пробірку помістити 0,3 г натрій бензоату і долити 5 см3 води. Добре перемішати до повного розчинення кристалів. Після цього долити конц. НСІ. Що спостерігається? Охолодити пробірку і долити до неї 5 мл ефіру, щільно закрити, добре стряхнути і вміст пробірки перелити у ділильну лійку. Після відстоювання і розділення шарів відкрити нижній кран ділильної лійки і корок, яким закрита лійка та обережно, не розливаючи, розділити суміш на окремі фракції в окремі посудини. Коли використовують даний метод? На чому оснований метод екстрагування? Яке значення він має у фармацевтичному аналізі? 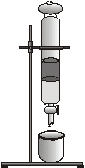 Ділильна лійка (метод екстрагування) |
