Методичка-Органічна хімія. Методичні вказівки для студентів до практичних занять. Заняття Тема Основи будови органічних сполук. Техніка безпеки. Ізомерія, номенклатура, класифікація органічних сполук
 Скачать 1.57 Mb. Скачать 1.57 Mb.
|
ЛІТЕРАТУРАОсновна:
Додаткова:
Методичні вказівки для студентів до практичних занять. ЗАНЯТТЯ № Тема: Фізичні та хімічні методи дослідження органічних сполук, їх ідентифікація. Актуальність теми: Дослідити органічну речовину можна як фізичними так і хімічними методами. Ідентифікацію їх проводять за допомогою якісних реакцій (хімічними методами) та визначають фізичні константи, які можна звірити за хімічним довідником та УДФ. Навчальні цілі: Теоретичне і практичне засвоєння фізичних та хімічних методів ідентифікації органічних сполук. Знати:
Вміти:
Самостійна позааудиторна робота
Контрольні питання
Самостійна аудиторна робота
Теоретична частина На підставі молекулярної маси і даних елементного аналізу встановлюють молекулярну формулу речовини. Далі визначають структуру вуглецевого скелету природу і положення функціональних груп, а також встановлюють певні фрагменти молекули і розташування атомів в просторі. Для цього використовують хімічні і фізичні методи. Хімічні методи основані на використанні якісних реакцій, що дозволяє визначити структуру вуглецевого скелету молекули, виявити функціональні групи, кратні зв'язки і т. д. Іноді з мето ідентифікації проводять розщеплення вуглецевого скелету молекули, або одержують різні похідні, які визначають шляхом порівняння з відомими речовинами. В останні роки поряд з хімічними методами важливе значення для дослідження будови органічних сполук набувають фізичні методи дослідження. Завдяки фізичним методам часто одержують таку інформацію про будову, яку не дають хімічні методи. Так за допомогою фізичних методів можна визначити відстані і кути між атомами у молекулі, їх взаємне розташування в просторі, внутрішньо-молекулярні і між молекулярні взаємодії. Перевага фізичних методів над хімічними полягає ще в тому, що в процесі аналізу досліджувана речовина не змінюється і не витрачається у великій кількості, що дозволяє використовувати їх для вивчення будови нестійких і мало стійких речовин та при наявності невеликої кількості речовин. До фізичних методів дослідження відноситься: спектральні-іфрачервона (ІЧ-) спектроскопія, спектроскопія комбінаційного розсіювання (КР), ультрафіолетова (УФ-) спектроскопія і спектроскопія у видимій області спектру, спектроскопія ядерного магнітного резонансу (ЯМР), мас-спектрометрія. До дифракційних методів дослідження будови відноситься – рентгенографія, електронографія, нейтронографія. Для вивчення структури найчастіше використовують комплекс фізичних методів. Електрона спектроскопія вивчає спектри вбирання в ультрафіолетовому (ультрафіолетова спектроскопія) і видимому (спектроскопія видимої області) діапазонах електромагнітного випромінювання. Інфрачервона спектроскопія заснована на властивості органічних речовин вбирати випромінювання інфрачервоного діапазону електромагнітного спектру. Спектроскопія ядерного магнітного резонансу заснована на властивості ядер деяких атомів, перебуваючи у зовнішньому магнітному полі, вбирати випромінювання у діапазоні радіочастот. Мас- спектроскопія заснована на іонізації молекул досліджуваної речовини і реєстрації спектру мас утворених йонів. Дифракційні методи дослідження засновані на вивченні розподілу інтенсивності розсіяного речовиною випромінювання. Практична робота Фізичні та хімічні методи дослідження (ідентифікації) органічних речовин Дослід 1. Визначення температури плавлення.  Н2SO4 (конц) Прилад для визначення температури плавлення. Для визначення температури плавлення, досліджуваною речовиною наповнити (0,5 см. висотою) капіляр, один кінець якого запаяний. Потім капіляр із речовиною прикріпити до кінця термометра, так, щоб стовпчик речовини містився на рівні кульки термометра. Прилад нагріти на газовому пальнику або спиртівці і зазначити температуру плавлення. Після визначення приблизної температури, прискорити нагрівання. Коли речовина повністю розплавиться, відмітити температуру кінця плавлення. Різниця початку і кінця температури плавлення буде точною температурою . Дослід 2. Визначення температури кипіння. В широкий капіляр налити кілька крапель досліджуваної рідкої речовини і прикріпити його до кінця термометра гумовим кільцем. Нагріти. Коли бульбашки будуть швидко виділятися, це означає, що рідина закипіла. Нагрівання припинити, дати остигнути і зазначити температуру при якій пухирці перестали виділятися. Ця температура і є температурою кипіння досліджуваної рідини. Дослід 3. Відношення органічної речовини до прожарювання. На кінчик шпателя нанести 0,1 г досліджуваної речовини і внести його в бокову частину полум'я пальника. Уважно спостерігати за змінами: а) характером плавлення (чи розкладається, горить повільно, дуже швидко, зі спалахом); б) коліром полум'я (світле свідчить, що речовина кисневмісна, жовто-кіптяве – ароматична, сильно ненасичена сполука з високим вмістом Карбону); в) запах (різкий, приємний, неприємний). Дослід 4. Визначення розчинності органічних речовин Перевірити розчинність досліджуваних речовин послідовно у: воді, 5%-ному розчині натрій гідроксиді, натрій гідрокарбонаті, хлоридній кислоті, концентрованій сульфатній кислоті, етанолі, бензолі, петролейному етері та ацетатній кислоті. Розчинення проводити при звичайних умовах, а коли речовина не розчиняється, нагріти її до кипіння. Якщо речовина погано розчиняється в розчинах лугу, натрій гідрокарбонаті і хлоридній кислоті, то нерозчинний залишок відфільтрувати. Якщо фільтрат мутніє, то це свідчить про кислотно-основні властивості речовини; кислі – коли розчинником був розчин лугу або соди, основні – розчин кислоти. Визначити рН розчину за допомогою індикатора або приладу рН-метра. Дослід 5. Функціональний аналіз органічних сполук. а) реакція на альдегіди "срібного дзеркала". В добре очищену і знежирену пробірку налити 3-5 крапель розчину аргентум нітрату і по краплях прилити розчину аміаку до зникнення осаду. По стінках пробірки прилити досліджуваного розчину. Вміст пробірки нагріти на киплячій водяній бані, уникаючи струшування.  Якщо розчин буріє і на стінках пробірки виділяється чистий аргентум; значить досліджувана речовина містить функціональну альдегідну групу Якщо розчин буріє і на стінках пробірки виділяється чистий аргентум; значить досліджувана речовина містить функціональну альдегідну групу( ). Написати рівняння оксидації альдегіду до відповідної кислоти. б) реакція "мідного дзеркала". До 5 крапель розчину купрум (ІІ) сульфату прилити 5 крапель розчину натрій гідроксиду, а потім до одержаного осаду прилити 5-7 крапель розчину досліджуваної речовини. Вміст пробірки нагріти як в попередньому досліді. Якщо забарвлення змінюється від голубого до жовтого, а в кінці морквяно червоного то досліджувана речовина є альдегідом. Написати рівняння реакції послідовного відновлення альдегідом: Cu(OH)2 → CuOH→ Cu2O/ Дана реакція використовується в біохімічних дослідженнях для виявлення надлишку глюкози в сечі. Дослід 6. Якісна реакція на фенольний гідроксид. а) До 3-5 крапель досліджуваного розчину прилити 1-2 краплі розчину ферум (ІІІ) хлориду . Якщо появиться фіолетове забарвлення значить речовина є фенолом. б) Проробити аналогічну реакцію з розчином саліцилової кислоти, а потім долити в обидві пробірки етанолу. Чи змінилось забарвлення у водному і спиртовому розчинах? Зробити висновок. Дослід 7. Ознайомлення з будовою та принципом дії поляриметра Для роботи з поляриметром необхідно спочатку встановити нульову його точку. Для цього слід повертати важелем аналізатора і домогтися рівномірного освітлення поля зору в окулярі: 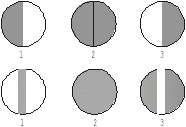 Поле зору поляриметра 1,3 - поляризоване світло не проходить через аналізатор; 2 - поляризоване світло проходить через аналізатор. Для визначення нульової точки і дослідження оптичної активності речовини, роблять 4-5 відліків, а потім обчислюють середнє значення. Нульову точку встановлюють за дистильованою водою, яку наливають в трубку поляриметра по верхньому меніску. На меніск води ставлять скельце, щоб не утворилося пухирців повітря, добиваючись чіткого зображення поля зору поляриметра. Якщо аналізатор повертати вправо (за годинниковою стрілкою), то ставлять знак "+", якщо вліво – знак "-". Тоді речовини відповідно називають право-, або лівообертаючими. Для визначення кута обертання оптично-активної речовини аналізатор промивають досліджуваним розчином 2-3 рази, наливають свіжоприготовлений розчин і проводять визначення аналогічно, як і з дистильованою водою, за шкалою визначають величину кута. Питоме обертання визначають за формулою: 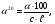 де - знайдений кут обертання; с – маса оптично активної речовини в грамах на 100 мл розчину; 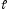 - товщина шару розчину. - товщина шару розчину.Дослідження повторити два три рази. Величину кута визначити як середнє арифметичне. Одержаний результат звірити з табличними даними за хімічним довідником. Дане дослідження широко використовується в аптечній справі для визначення концентрації рідких лікарських форм. |
