Операции,
направленные на отведение асцитической жидкости
Большинство из предложенных вмешательств, направленных на отведение асцитической жидкости в предбрюшинную, забрюшшшую и в подкожную клетчатку, имеют исторический интерес. Достаточно полно их описали Г. Г. Караванов и М. П. Павловский (1966).
Довольно широкое практическое применение получила операция Каль-ба (1916). Латеральнее восходящей и нисходящей толстой кишки, в области треугольников Пти иссекают участки брюшины и мышц величиной с пятикопеечную монету. Сосуды лигируют. Лапаротомный разрез зашивают. Асцитическая жидкость всасывается подкожной клетчаткой туловища.
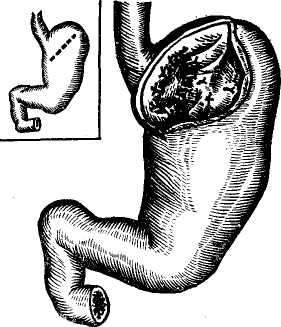
Рис. 118. Гастротомия с прошиванием вен кардиалъного отдела желудка и абдоминальной части пищевода (по М. Д. Пациоре).
В. А. Оппель модифицировал операцию Кальба. Он иссекал слева париетальную брюшину, поперечную и подвздошную фасции вверх до почки и вниз — до подвздошной кости, а щель в мышцах треугольников Пти расширял пальцем. Для образования большей поверхности и всасывания асцитической жидкости автор обнажал околопочечную и околопузырную клетчатку.
Функция «окон», «фитилей», «шпулек» довольно непродолжительна. Экспериментальные данные А. И. Клопцова (1953) показали, что прекращение всасывания жидкости при таких операциях происходит через 3—4 недели. Г. Г. Караванов и М. П. Павловский отмечают, что всасывание жидкости после операций типа Кальба можно проследить в течение 6 месяцев. Поэтому, по нашему мнению, лучший эффект достигается при комбинации подобных операций с операциями, разгружающими портальную систему или разобщающими ее от подверженных кровотечению мест гастроэзо-фагической венозной системы.
Отведение асцитической жидкости непосредственно в сосудистое русло предложил Routte (1907). Для этого большую подкожную вену бедра выделяют на протяжении 10—15 см
и пересекают, дистальныи конец ее заворачивают кверху и вшивают в отверстие брюшины над пупартовой связкой. Однако, как показали последующие наблюдения, вена вскоре облитерируется и отток асцити-ческой жидкости в сосудистое русло прекращается.
Недостаточно эффективным и небезопасным оказались также операции отведения асцитической жидкости в мочевые пути. После операции Розенштейна, 1914 (клапанное сообщение брюшной полости с мочевы-мы путями) и операции Я. 3. Пикус, 1957 (прямое соустье почечной лоханки с брюшной полостью) после нефрэктомии, как правило, развивались перитониты. Такие же осложнения наблюдались и при операции илеоэнтэктомии (Neuman с соавт., 1957). При этой операции в брюшную полость вводят сегмент кишки таким образом, чтобы слизистая оболочка могла абсорбировать ас-цитическую жидкость. Из 10 больных летальность составляла 50%.
В последнее время детально изучают возможность портальной декомпрессии путем увеличения лим-фооттока. Учитывая, что давление в портальной и лимфатической системе взаимозависимо, Degni, Ballero (1971) и другие считают улучшение лимфооттока из грудного лимфатического протока действенным средством декомпрессии портальной системы. Оперативное вмешательство оказывается эффективным при наличии препятствия лимфооттоку, которое встречается преимущественно у места впадения грудного лимфатического протока. Принципы хирургической коррекции данной патологии состоят в создании адекватного соустья между венозной системой и грудным лимфатическим протоком. Анализ ближайших результатов лимфо-венозного анастомоза показал, что такое вмешательство способствует уменьшению асцита и временной остановке кровотечения из флебэктазий пищевода. Э. И. Галь-
перин и соавторы (1973) успешно применили наружное дренирование грудного лимфатического протока для борьбы с печеночной недостаточностью.
Таким образом лучшим методом декомпрессии портальной системы несомненно являются портокавальные ангиоанастомозы, снижающие портальное давление сразу же после их выполнения в среднем на 9,7+5,8 мм рт. ст. (Leger с соавт., 1970). Полнота портальной декомпрессии находится в прямой зависимости от величины анастомозируемых сосудов и градиента давления между ними. При прямых портокавальных анастомозах происходит сброс всей или значительной части портальной крови в систему нижней полой вены и в меньшей степени при ме-зентерикокавальных и спленореналь-ных анастомозах.
Клинический эффект зависит от степени декопрессии. Так, по данным Palmer (1966), спадение варикоз-но расширенных вен пищевода после наложения портокавальных анастомозов происходит у 73% больных, а после спленоренальных — у 22%. Рецидивы кровотечений (по сводной статистике Hoffman с соавт., 1971) после портокавальных анастомозов наблюдались у 10% больных из 1412 оперированных, после мезенте-рикокавальных — у 17,6% из 131 оперированных, после спленоренальных — у 25,8% больных из 744 оперированных.
Образование портокавальных сосудистых анастомозов приводит к значительной перестройке портальной гемоциркуляции, особенно при внутрипеченочном блоке, что имеет важное значение. Уменьшение портального печеночного кровотока или полное выключение его, усугубляя гипоксию печени, отрицательным образом сказывается на ее функции. Нарушение функции печени наряду со сбросом портальной крови в ка-вальную систему является определяющим моментом в развитии эн-
цефалопатии. Отсюда понятна и большая частота этого осложнения после портокавальных анастомозов (16,7% из 1026 оперированных и прослеженных больных), чем после спле-норенальных (11,2% из 357 оперированных), и отсутствие энцефалопатии при хорошем исходном функциональном состоянии печени при допеченочном блоке (Hoffman с соавт., 1971). Linton с соавторами (1961) энцефалопатию отметил у 68% больных после прямого портокавального анастомоза, тогда как после сплено-ренального — только у 7% больных.
Анализ причин послеоперационной летальности после сосудистых анастомозов с достаточной убедительностью иллюстрирует, что наиболее частой причиной таких исходов является печеночная недостаточность, причем и здесь прослеживается зависимость от исходного состояния печени (Lord с соавт., 1945).
Изучение результатов при различных видах сосудистых анастомозов показало большую безопасность спленоренальных соустий по сравнению с портокавальными (М. Д. Па-циора, 1971). Об этом свидетельствуют и наши данные. Из 14 больных, которым были наложены прямые пор-токавальные анастомозы, умерло 5, а из 53 больных со спленоренальными анастомозами — 8. Следует отметить, что у всех умерших (8 больных) спленоренальный анастомоз был выполнен по типу «конец в бок».
Основную причину плохих результатов после спленоренальных анастомозов по типу «конец в бок» мы видим в удалении селезенки. При портальных кризах, которые являются одним из пусковых механизмов в возникновении кровотечений из флеб-эктазий пищевода и желудка (П. А. Иванов, 1967), селезенка, депонируя часть крови, играет роль буфера, ограничивая, в известной степени, повышение портального давления. С удалением селезенки устраняется этот важный компенсаторный механизм, к тому же, разрушаются
уже создавшиеся анастомозы между портальной и кавальной системами. Поэтому мы считаем физиологически более обоснованным выполнять спленоренальный анастомоз по типу «бок в бок». Так на 22 операции сплено-ренального анастомоза «бок в бок» не было ни одного летального исхода. Поэтому из сосудистых анастомозов мы отдаем предпочтение сплено-ренальному анастомозу по типу «бок в бок» и лишь при декомпенсирован-ном портальном блоке, сочетающемся с узкой или тромбированной селезеночной веной, и других причинах, исключающих наложение спле-норенального анастомоза, когда функция печени нарушена незначительно, показан прямой портока-вальный анастомоз.
Учитывая хроническое состояние гипоксии печени при циррозе и ухудшении кровообращения в ней после сосудистых портокавальных анастомозов, патогенетически обоснованным является сочетание портокавальных анастомозов с артериали-зацией печени (М. Н. Ханин, 1966; М. Д. Пациора, 1971; Shilling и Fisher, 1952, и др.). В то же время экспериментальные и клинические данные свидетельствуют, что артери-ализация печени при циррозе не предупреждает развития печеночной недостаточности, а повышение давления в портальной системе после артерио-портальных анастомозов вызывает тяжелые повреждения в си-нусоидных областях и в гепатоцитах (Benichoux, 1971). В связи с этим применение артерио-портальных соустий при прямых портокавальных анастомозах возможно, по нашему мнению, исключительно по строго ограниченным показаниям, а именно — при циррозе печени с высоким портальным давлением (декомпенси-рованном блоке) с частыми кровотечениями из вен пищевода и желудка, когда имеется узкая селезеночная вена или ее тромбоз, исключающие наложение спленоренального. анастомоза при условии плохой
функции печени. Наиболее обоснованной в таких случаях является операция прямого портокавального анастомоза — конец дистального отрезка воротной вены в бок нижней полой вены со сплено-умбиликаль-ным артериальным анастомозом. Мы выполнили эту операцию у 2 больных, 1 больная умерла на 3-и сутки после операции от печеночной недостаточности (на вскрытии выявлен тромбоз артерио-венозного анастомоза), у 2-й больной — результат хороший (срок наблюдения 3 года).
Операции создания сосудистых анастомозов при портальной гипер-тензии могут быть выполнены лишь у части больных. У одних такого вида вмешательства не выполнимы по техническим причинам, у других — ввиду нарушения общего состояния и особенно функции печени, у третьих они не показаны.
У 69 из 148 больных циррозом печени с портальной гипертензией, подвергшихся операции и находившихся под нашим наблюдением, явилось возможным выполнить сосудистые портокавальные анастомозы.
Менее радикальные в смысле снижения портального давления операции создания органных анастомозов. Хотя декомпрессорный эффект таких операций минимальный и достигается, по-видимому, в основном за счет улучшения лимфооттока из спланхнической зоны (М. Д. Паци-ора, 1971). Имеющийся опыт показывает, что органные анастомозы имеют свои строго обоснованные показания. Положительным фактором в создании органных анастомозов является их небольшая травматичность, в связи с чем они выполнимы при значительном нарушении функции печени. Выполнение органных анастомозов мы считаем оправданным: при невозможности создания сосудистых анастомозов по техническим причинам (кавернозная трансформация портальной вены, тромбоз или малый диаметр анастомозируемых сосудов и др.); при отсутствии доста-
точных показаний к наложению сосудистых анастомозов (низкое портальное давление, отсутствие флеб-эктазий пищевода и желудка, течение заболеваний без кровотечений и др.); при серьезных противопоказаниях к их выполнению (тяжелые нарушения функции печени, перемежающийся асцит). Из методов создания органных анастомозов мы предпочитаем операцию В. А. Оппеля в модификации А. А. Шалимова.
Состоит она в иссечении боковых отделов париетальной брюшины шириной 12—18 см от диафрагмы до таза, широком двухстороннем вскрытии забрюшинного пространства с обнажением нижней полой вены и ее ветвей и подведением с одной стороны сальника к крупным венозным сосудам забрюшинного пространства справа, а с другой — укладкой нисходящей и сигмовидной кишки в обнаженное забрю-шинное пространство слева.
Учитывая небольшие декомпрес-сорные возможности органных анастомозов и отсутствие эффекта непосредственно после их выполнения, необходимо сочетать такие вмешательства с операциями, направленными на уменьшение притока в портальное русло, прибегая чаще всего к перевязке селезеночной артерии. Временного снижения портального давления после перевязки селезеночной артерии, по-видимому, достаточно для сформирования органных анастомозов. Кроме того, после перевязки селезеночной артерии увеличивается дебит крови в печеночной артерии, что имеет важное значение при циррозах печени. Помимо этого к образованию органных анастомозов и перевязке селезеночной артерии мы прибегаем при операциях на желудке и пищеводе при варикозном расширении вен и кровотечении из них.
При решении вопроса о сплен-эктомии мы стоим на позициях тех авторов (Ф. Г. Углов, 1971; М. Д. Па-циора, 1971, и др.), которые считают возможным удаление селезенки при циррозе печени по строго ограниченным показаниям — начальные
стадии цирроза печени с выраженными явлениями гиперспленизма, с геморрагическим синдромом при отсутствии варикозного расширения вен пищевода и желудка, причем и в этих случаях выполнение спленэк-томии должно сочетаться с органо-анастомозами. Прямым показанием к спленэктомии является локальная портальная гипертензия при тромбозе селезеночной вены.
Удаление лишь одной селезенки при портальной гипертензии, как показал наш опыт, не должно проводиться, это у некоторых больных ведет к усилению гипертензии со всеми последствиями.
В борьбе с кровотечением из ва
рикозно расширенных вен пищевода и желудка на почве портальной гипертензии как более обоснованными являются методы, направленные на стойкое снижение портального давления, это может быть достигнуто созданием сосудистых анастомозов. Но довольно часто кровотечение возникает в активной фазе, у больных с выраженными нарушениями функции печени. К тому же и кровопотеря способствует развитию
печеночной недостаточности. Все это создает большой риск развития печеночной недостаточности с переходом в кому при наложении сосудистых анастомозов. В таких случаях наиболее оправданными являются вмешательства, направленные на разобщение портальной системы с венозной гастроэзофагеальной сетью сосудов, которые наиболее часто и дают кровотечения. Прекращение доступа портальной крови в вены пищевода и желудка ведет к остановке кровотечепия. Однако понижения портального давления при таких видах вмешательств не происходит, наоборот, в результате прекращения сброса по венам пищевода создаются условия для его повышения, в связи с чем угроза рецидива кровотечений остается. Учитывая это, мы ограничиваем показания к " трансторакальным методикам случаями, когда трансабдоминальное вмешательство связано с определенными трудностями. Мы отдаем предпочтение трансабдоминальным методам разобщения портальной системы от участков гастроэзофагеальной венозной сети в сочетании с операциями, умень-
Таблица 21
Характер оперативных вмешательств у больных циррозом печени с портальной гашертензией и непосредственные результаты
|
Количество опе-
|
Умерли в после-
|
Вид операции
|
рированных
|
операционном
|
|
больных
|
периоде
|
Прямой портокавальный анастомоз
|
12
|
4
|
Прямой портокавальпый анастомоз в сочетании с арте-
|
|
|
риализацией печени
|
2
|
1
|
Мезентерикокавальный анастомоз
|
2
|
1
|
Спленоренальныи анастомоз «конец в бок»
|
29
|
6
|
Спленоренальныи анастомоз — «конец в бок» -J- резекция
|
|
|
II—III сегмента печени
|
2
|
2
|
Спленоренальныи анастомоз «бок в бок»
|
22
|
—
|
Органные анастомозы
|
23
|
2
|
Спленэктомия в сочетании с органными анастомозами
|
16
|
3
|
Операция Оппеля—Шалимова
|
11
|
—
|
Операция Рюотта
|
2
|
1
|
Спленэктомия
|
15
|
2
|
Пересечение и сшивание абдоминального отдела пище-
|
|
|
вода
|
3
|
—
|
Эверсия слизистой оболочки отрезка восходящей кишки
|
|
|
в брюшную полость
|
1
|
1
|
Операция Таннера
|
4
|
1
|
Прочие операции
|
4
|
2
|
Всего
|
148
|
26
|
Отдаленные результаты оперативного лечения
Вид оперативного
|
Всего опе-
|
Умерли в послеопе-
|
|
Количество больных
|
Умерли
|
|
вмешательства
|
рировано
|
рационном периоде
|
Выписано
|
с изученными отдаленными
|
в отдаленном периоде
|
|
|
|
|
|
результатами
|
|
|
Портокавальные анасто-
|
|
|
|
|
|
|
мозы
|
14
|
5
|
9
|
7
|
2
|
|
Спленоренальные анасто-
|
|
|
|
|
|
|
мозы «бок в бок»
|
22
|
—
|
22
|
19
|
3
|
|
Спленоренальные анасто-
|
|
|
|
|
|
|
мозы «конец в бок» и ме-
|
|
|
|
|
|
|
зентерикокавалышй
|
|
|
|
|
|
|
анастомоз
|
33
|
9
|
24
|
21
|
4
|
|
Оргаиоанастомозы и
|
|
|
|
|
|
|
спленэктомии
|
54
|
7
|
47
|
33
|
7
|
|
Операция Оппеля—Ша-
|
|
|
|
|
|
|
лимова
|
11
|
|
11
|
11
|
—
|
|
Другие
|
14
|
5
|
9
|
8
|
1
|
|
Итого
|
148
|
26
|
126
|
99
|
17
|
|
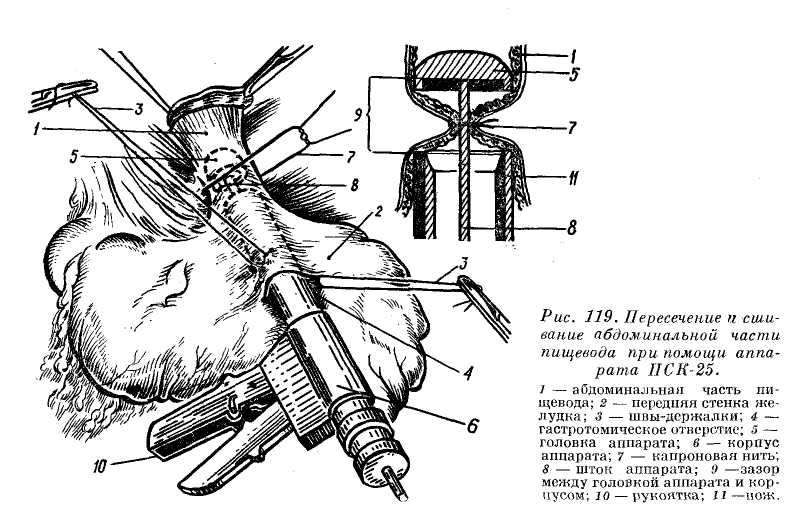
шающими приток крови в портальную систему, и созданием органоана-стомозов. Для этого в Киевском институте клинической и экспериментальной хирургии разработана (А. А. Шалимов, В. Н. Короткий, С. А. Шалимов) операция пересечения и сшивания абдоминальной части пищевода в сочетании с перевязкой селезеночной артерии и созданием органоанастомоза (рис. 119).
Методика. Срединная лапаротомия; выделение абдоминальной части пищевода; с освобождением дна желудка и окружающей пищевод клетчатки с венозной сетью; гастротомия (рис. 119,4), через гастрото-мический разрез в пищевод вводят аппарат ПКС-25; ниже головки (рис. 119,5) на штоке аппарата (рис. 119,8) капроновой нитью (рис. 119,7) перевязывают абдоминальную часть пищевода, затем производят пересечение и сшивание пищевода. Накладывают дополнительный ряд швов над линией анастомоза и производят ушивание гастротомического разреза. Перевязывают селезеночную артерию и создают органо-анастомоз по типу операции Оппеля-Ша-лимова.
По данной методике оперировано 3 больных с варикозным расшире-
|
 Скачать 11.68 Mb.
Скачать 11.68 Mb.

