Хирургия печени и желчных путей. Нежизнеспособности ее у больного или для борьбы с тяжелой печеночной недостаточностью
 Скачать 11.68 Mb. Скачать 11.68 Mb.
|
|
больных циррозом печени нием вен пищевода при портальной гипертензии на почве цирроза печени. Ближайшие результаты были хорошими. При расширенных венах желудка они могут быть прошиты и перевязаны через гастротомический разрез, как это делается по методикам М. Д. Пациоры. Асциты при портальной гипертензии, где наряду с нарушениями белковообразовательной функции печени, водно-солевого обмена, расстройствами лимфообращения, эндокринными и другими факторами, требуют своего подхода к решению задачи. Из значительного количества предложенных методик оперативных вмешательств, направленных на декомпрессию портальной системы, когда сосудистые анастомозы не выполнимы ввиду нарушения общего состояния и функции печени, при пере^-межающихся и прогрессирующих формах асцита мы применяли вышеописанную операцию Оппеля—Шалимова. По данной методике оперировано 11 больных с хорошими результатами. Асцит исчез, кровотечение из Таблица 22 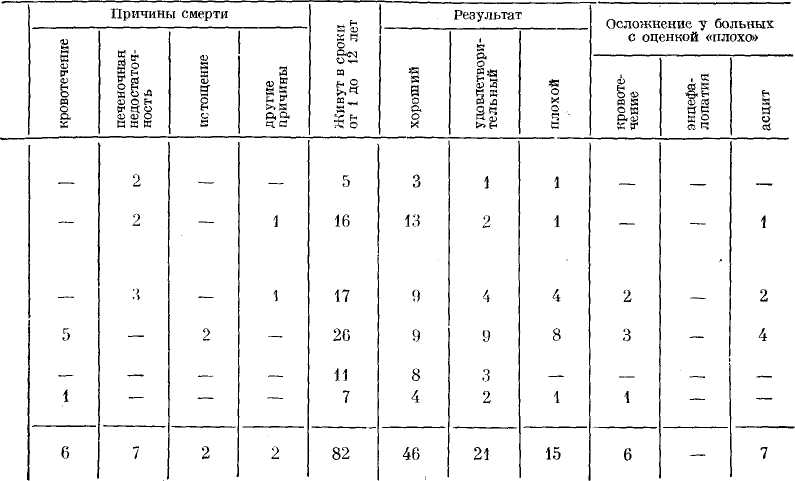 вен пищевода в течение полуторагодичного наблюдения не определялось. У 1 больного операцию сочетали со спленэктомией и у 1 — с перемещением селезенки в плевральную полость. Характер оперативных вмешательств и непосредственные результаты представлены в табл. 21. Основной причиной летальных исходов в послеоперационном периоде явилась печеночная недостаточность. Из 126 выписанных больных отдаленные результаты в сроки от 1 года до 12 лет прослежены у 99 больных (табл. 22). Хорошее и удовлетворительное состояние отмечено у 67 больных (67,6%), плохое — у 15 (15,1%), умерло в отдаленном периоде — 17 больных (17,2%). Кровотечение как причина смерти отмечено у 6 больных (6,2%); печеночная недостаточность—у 7 (7,1%); истощение — у 2 больных (2,1%). У 2 больных причина смерти не связана с циррозом печени (травма, аппенди-кулярный перитонит). В группе больных с оценкой от- даленных результатов «плохие» из 15 (15,1%) кровотечения однократные и многократные отмечены у 6 больных (6,1%), асцит — у 7 (7,1%), истощение — у 2 (2,1%) больных. Кровотечения в отдаленном периоде отмечены у больных, у которых эффективной декомпрессии портальной системы оперативным вмешательством достичь не удалось (операция органо-анастомоза и спленэктомии). У 2 (2,9%) из 69 больных с сосудистыми анастомозами, перенесших операцию спленоренального анастомоза по типу «конец в бок», отмечено кровотечение в отдаленном периоде. Выполнена операция Оппеля—Шалимова 11 больным с устойчивым асцитом. Отдаленные результаты у них прослежены в сроки до 2 лет. Рецидива асцита не наблюдали. Таким образом, не отказ от какой-либо операции, строго обоснованные показания к ней могут способствовать улучшению результатов лечения портальной гипертензии на почве цирроза печени. Глава десятая Т  РАНСПЛАНТАЦИЯ ПЕЧЕНИ РАНСПЛАНТАЦИЯ ПЕЧЕНИНесмотря на высокий уровень развития современной медицины, нет еще достаточно эффективных методов борьбы с целым рядом заболеваний печени, таких как острая печеночная недосточность, врожденная атрезия внутрипеченочных желчных протоков, постгепатитный или алкогольный цирроз, острая атрофия, большие первичные опухоли, особенно располагающиеся в области ворот печени или развилки печеночных протоков. Во всех этих случаях необходима постоянная или хотя бы временная замена пораженной паренхимы на ткань, способную выполнить функции, присущие здоровой печени. Все это обусловливает интерес к проведенным исследованиям по пересадке печени в эксперименте и клинике. Пересадка органов вообще и в частности печени является новой отраслью восстановительной хирургии и открывает широкую возможность в лечении ряда несовместимых с жизнью поражений органов человеческого организма. Пересадка печени является той важной проблемой, которая позволяет радикальным путем решить лечение ряда заболеваний у людей, обреченных па явную смерть, и естественно, что нужда в подобных вмешательствах огромна. Решение этой проблемы позволит возвратить или хотя бы продлить жизнь сотням людей. Так, в 1964 г. в Великобритании среди 990 умерших больных с поражением печени 500 нуждались в пересадке им здоровой печени (Gamier, 1970). 95% больных, состоящих в списке кандидатов на пересадку печени, умирают, не дождавшись подходящего донора (Starzl, 1964). Однако проблема пересадки печени остается нерешенной и до настоящего времени. Операции пересадки сопровождаются высокой летальностью, существует еще ряд нерешенных проблем, коренным образом тормозящих этот важный вид хирургической помощи. И все же несмотря на высокую послеоперационную летальность проблеме пересадки печени должно быть уделено исключительное внимание. Решение указанной проблемы в настоящее время идет по двум основным путям: временное подключение в кровообращение больного другой печени и полная трансплантация печени. Однако прежде чем приступить к изложению проблем временной и постоянной подмены или замены печени мы позволим себе остановиться на некоторых вопросах лечения печеночной недостаточности консервативными методами. Лечение преко-матозных и коматозных состояний, являющихся печальным финалом печеночной недостаточности, является одной из сложнейших задач современной медицины. В настоящее время применяют для этой цели 3 метода: лечение гемодиализом, обменное по- реливание крови и временное вспомогательное подключение в кровооб-ращение больного другой печени, находящейся в организме здорового человека. Замещение большей части и всего объема крови больного дает в подавляющем большинстве лишь временное улучшение. Так, обменное переливание даже 5 л крови, по данным Jonas, Clain и соавторов (1967), у 4 больных с некрозом печеночной ткани при вирусном гепатите и у 2 при острой печеночной недостаточности после применения галотана лишь у 3 больных дало кратковременное улучшение состояния, а в состоянии печеночной комы такое обменное переливание вообще не приносит улучшения и больные погибают. В 1967 г. Swift, Ghent и другие сообщили о лечении печеночной недостаточности методом временного вспомогательного подключения в кровообращение больного печени здорового человека без изъятия последней из организма. Для этой цели используют пупочную вену больного и донора, через которую катетер под контролем рентгенэкрана устанавливается в воротах печени. Через катетер при помощи роликового насоса забирают кровь у больного, она проходит через донора и снова возвращается в бедренную вену больного. Swift и Ghent отметили, что из 22 больных, известных им из литературы и леченных методом перекрестного кровообращения, выжило всего 4 человека. В качестве донора Fortner и Beatty в 1969 г. предложили использовать обезьяну-бабуина. Используют для этой цели и шимпанзе I (0) группы крови. Однако этот метод в конечном счете мало чем отличается от обменного переливания и дает у большинства больных лишь кратковременное улучшение. В том же 1967 г. появилось сообщение Paliard, Motin и соавторов об успешном излечении больного с тяжелым паренхиматозным гепатитом в состоянии глубокой комы гипербарической оксигенотерапией, которую авторы применили перед началом переливания крови. После первого сеанса (1 час, давление 2,7 атм) к больному вернулось сознание. Проведен 21 сеанс, ежедневно. Через 3 дня отмечено полное восстановления сознания. Выздоровление наступило на 26-е сутки. О подобном лечении, как отмечают Paliard, Motin и соавторы, уже было сообщено в виде доклада в 1966 г. Goulon и Rapin о 3 случаях выздоровления из 6 (5-вирусный гепатит и 1-инток-сикация трекатором). Paliard, Motin и соавторы объясняют быстрый лечебный эффект у своего больного одновременным воздействием на 2 элемента печеночной комы — мозговые поражения и поражения паренхимы печени. На уровне мозга гипербарическая оксигено-терапия позволяет бороться с клеточной аноксией, а на уровне печени ведет к улучшению метаболизма пораженных клеток и ускоряет клеточную регенерацию. Как средство борьбы с печеночной недостаточностью в ее острой форме в последние годы все чаще наряду с методикой перекрестного кровообращения начинают использовать изолированную печень, что позволяет оказывать помощь не только времен-но нуждающимся в замене больного органа при обратимых процессах, но и постоянно нуждающимся больным, при органических поражениях или врожденных пороках. Для всех этих методов необходимо получить и сохранить на более или менее длительный период времени изолированную печень. ВРЕМЕННОЕ ПОДКЛЮЧЕНИЕ ГОМО-ИЛИ ГЕТЕРОЛОГИЧЕСКОЙ ПЕЧЕНИ В методе используют экстракорпоральный шунт. Цель метода — временная разгрузка больной пече-  ни и очищение организма от вредных продуктов обмена. В основу положена возможность изолированного органа нести на протяжении нескольких часов полную функциональную нагрузку при соблюдении нор-мотермических условий и адекватной перфузии оксигенированной кровью (Ruffо, Rossotto, Motto, 1967, и др.). ни и очищение организма от вредных продуктов обмена. В основу положена возможность изолированного органа нести на протяжении нескольких часов полную функциональную нагрузку при соблюдении нор-мотермических условий и адекватной перфузии оксигенированной кровью (Ruffо, Rossotto, Motto, 1967, и др.).Впервые в эксперименте на собаках с фистулой Экка экстракорпоральную перфузию печени применил в 1958 г. Otto. В клинике этот метод для лечения больных с печеночной комой использовал Eise-man в 1965 г. и в 1967 г. Н. Н. Савицкий и Б. А. Петров. По данным Г. М. Соловьева (1972), этот метод в клиниках различных стран был применен за период с 1965 по 1972 г. у 123 больных, 15 из которых выздоровели. Использовали печень животных: телят, свиней, приматов (бабуина, шимпанзе) (Н. Н. Савицкий, 1967; М. Д. Паци-ора и соавт., 1969; Б. В. Петровский, В. В. Шумаков, В. С. Крылов, 1970; М. О. Стернин, 1971; Liew, Raftuc-ci, 1965; Monges, 1969; Abouna, 1970; Battersby, 1971, и др.) и человека (Abouna,' 1970). Для клинического применения чаще всего используют печень свиньи, хотя, по данным Abouna (1971), для длительной перфузии пригодна больше печень бабуина. Свинья должна иметь вес не менее 40 кг и пройти ветеринарный контроль (Б. В. Петровский и соавт., 1972). Сложность проблемы экстракорпоральной перфузии печени состоит в том, что используемая изолированная печень может в определенных условиях функционировать лишь ограниченное время, которого в большинстве случаев не хватает для восстановления функции больной печени. Очень наглядным в этом плане является случай, описанный Abouna (1970). Больному с тяжелой пече-ночно-почечной недостаточностью на почве хронического гепатита наряду с 20-ю обменными переливаниями произведено 16 сеансов экстракорпоральной перфузии гетеро- и гомологической печени, жизнь больного удалось продлить на 2,5 месяца. Наблюдение является с одной стороны ярким примером несостоятельности экстракорпоральной перфузии при хронических формах недостаточности, когда замена функции больного органа требуется на длительное время, и с другой стороны подтверждает возможность использовать указанный метод лишь при острых состояниях недостаточности, когда поражение еще не захватило всей паренхимы или находится в стадии обратимости. Такие больные должны попадать в руки хирурга еще до наступления прекоматозного состояния, только с первыми признаками угрозы развития печеночной недостаточности, чего, к сожалению, еще до настоящего времени не наблюдается. Необходимо создать центры борьбы с печепочной недостаточностью, специально оборудованные, вооруженные всеми возможными способами борьбы с этим грозным осложнением, включая полную пересадку органа. Печень является органом крайне чувствительным к ишемии, гибель ее наступает через 15—20 минут после прекращения кровообращения, поэтому получение жизнеспособной печени от человека является крайне сложным. В связи с этим в экстракорпоральной перфузии используется большинством исследователей ге-терологическая печень, что создает ряд дополнительных трудностей. Если при использовании гомологической печени необходима групповая совместимость крови, то гетеро-логическую печень необходимо, во-первых, освободить от эритроцитов хозяина, а во-вторых, принять меры, направленные на предотвращение несовместимости. При взятии печени необходимо максимально сократить срок ишемии, освободить печень от эритроцитов, принять меры против несовместимости. Удовлетворение первого требования осуществляется точным и быстрым выполнением операции изъятия печени, начиная от наркоза и кончая восстановлением кровообращения изолированного органа, постоянной перфузией растворов и гипотермией на протяжении всей операции. Удовлетворение второго требования осуществляется по ходу операции. Третьим требованием обычно пренебрегают, считая, что ввиду кратковременности перфузии реакция несовместимости не успевает развиться (М. О. Стернин 1969; М. С. Моргулис, 1972, и др.). Несмотря на то, что Battersby (1971) в экспериментальных перфузиях, Norman (1957, 1970, 1971), Б. В. Петровский (1972) в клинике обнаруживали в крови реципиентов специфические для донора протеины и антитела с высоким титром, этот вопрос всеми исследователями отнесен на второй план, в связи, по-видимому, с отсутствием убедительных доводов в его значимости. И действительно, изолированная печень прекращает нормально функционировать значительно раньше, чем могут развиться иммунологические реакции. Однако исключить действие тканевой несовместимости как на организм реципиента, так и на изолированную печень полностью нельзя, возможно секрет такого эффекта от экстракорпоральной перфузии и ранняя гибель изолированной печени имеет к этому прямое отношение. Забор печени животного и подготовка ее к перфузии. После преме-дикации под наркозом (внутривенно вводят гексенал — 18—20 мг 5% раствора на кг веса) и путем трахеотомии производят интубацию, затем добавляют листенон 40—50 мг, операция проходит с ручным дыханием на режиме гипервентиляции. В процессе экстирпации печени животное получает внутривенно 4% раствор соды (200—400 мл), 5% раствор глюкозы (300—400 мл) и физиологи- ческий раствор (200—300 мл — Б. В. Петровский и соавт., 1972). М. С. Маргулис и соавторы (1972) считают более рациональным для лучшей сохранности печени применять наркоз закисью азота с премедикацией препаратами нейролептоанальгезии, а также поддержание во время операции стабильной гемодинамики, оптимального насыщения крови кислородом, нормального кислотно-ще-лочиого равновесия в артерии, воротной вене и печеночных венах, а также переливание крови и гепариниза-цию животного. Mezzetti (1970) для изъятия печени убивал животное электротоком, производил эвисцерацию внутренних органов, погружал их в ванну с физиологическим раствором, изолировал идущие к печени сосуды и желчный проток, а затем начинал перфузию печени. Метод прост, но вряд ли уменьшает время ишемии по сравнению с изъятием печени под наркозом. Доступ к печени осуществляют широкой лапаротомией и продольной стернотомией. Сразу же после лапаротомии путем введения катетеров в селезеночную и брыжеечную вену начинают перфузию 5—10 л холодного (+ 4°) раствора Ринге-ра с добавлением гепарина, гидрокортизона, глюкозы, низкомолекулярного декстрана и антибиотиков. Marchal (1970) перфузировал печень собаки физиологическим раствором, содержащим 15% перекиси водорода, что является оригинальным и, по его мнению, способствует активизации и более длительному удержанию ионов кислорода в цитоплазме и митохондриях печеночных клеток, что позволяет печени сохранить свои функции в течение 2 часов. Для более надежной и глубокой гипотермии Starzl (1964) производил охлаждение животного до 30° еще до операции. Печень без излишней травмы отделяют от диафрагмы, выделяют все сосудистые образования, связывающие ее с организмом. После введения первых 200—300 мл перфузионного раствора нижнюю полую вену выше печени пережимают, а ниже печени в вену вставляют катетер для оттока перфузионного раствора. После перфузии 18— 20 л раствора Рингера под давлением 40—60 см вод. ст. и температуре 4—8° (Б. В. Петровский и соавт., 1972) печень извлекают из организма и переносят в специальный контейнер. При этом портальная вена и печеночная артерия остаются ка-нюлированными для продолжения перфузии, конец нижней полой вены выше печени лигируют, а нижний ее конец используют для оттока пер-фузионной жидкости, остальные сосуды лигируют. Отток желчи остается свободным. Подготовленная таким образом печень животного, по мнению Starzl (1964), способна переносить полную ишемию в течение 90—100 минут и впоследствии хорошо функционировать. Гипотермическое состояние печени необходимо для оптимального ее сохранения в процессе отмывания от эритроцитов донора, однако этот период должен быть сокращен до минимума, так как гипотермическое состояние хотя и предотвращает ише-мические осложнения, но не остается безразличным для паренхимы печени. Следует всегда стремиться к возможно быстрейшему восстановлению нормальной температуры печени путем экстракорпорального кровообращения в замкнутой системе. Сразу же после извлечения печени начинают отмывать ее от эритроцитов донора. Для этой цели используют охлажденный раствор Рингера в смеси с иизкомолекулярным дек-страном, новокаином, гепарином и гидрокортизоном. Новокаин вводят в смесь для предотвращения спазма сосудов внутри печени и этим сокращается время отмывания. Подобный раствор использует Ю. М. Лопухин (1971): Рингера—Локка — 900 мл, 0,5% раствор новокаина —100 мл, гепарина — 5000 ед., пеницилли- на—250000 ЕД, стрептомицина — 250 000 ЕД при температуре 3,5—4°. Некоторые используют раствор с температурой 37,5°. М. С. Маргулис с соавторами (1972) рекомендует раствор комнатной температуры, отмечая, что безопасный период гипоксии печени при таком способе равняется 45—60 минут. Отмывание эритроцитов производят через воротную вену и печеночную артерию с помощью сифона самотеком под давлением 40—45 мм рт. ст. Отток жидкости происходит через нижнюю полую вену. Средняя скорость перфузии 100—200 мл/мин. Контролируют степень отмывки по исчезновению в промывной жидкости эритроцитов. После помещения изолированной печени в контейнер прежде чем подключить ее к организму больного продолжают перфузию по замкнутой системе с использованием малогабаритного аппарата искусственного кровообращения или роликового насоса типа Сарна. Задача состоит в создании стабильного кровообращения в изолированной печени путем заполнения ее 800—1000 мл свежегепари-низованной крови донора, разбавленной до гематокрита 30% и доведенной до рН равного 7,4; поднятии температуры печени с помощью теплообменника до 37—38°; исследовании исходного уровня ее функции (М. О. Стернин, 1971). Обычно эти задачи выполняют в течение 10—30 минут. Адекватность перфузии контролируется по уровню кровотока через изолированную печень (до 1 мл на 1 г веса в 1 минуту при давлении па входе в воротную вену 180—200 мм вод. ст.); артерио-венозной разницей по кислороду (20—30%), внешнему виду органа (отсутствие отечности, цианоза, набухание). Постоянство температуры печени на уровне 37—38° в контейнере поддерживается автоматически. Функциональная способность изолированной печени определяется по величине выделения желчи 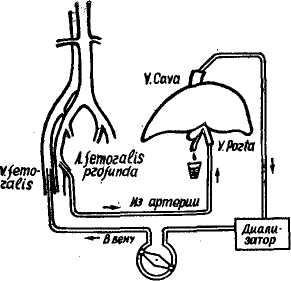 Рис. 120. Схема экстракорпоральной перфузии: артерия реципиента — вена изолированной печени — нижняя полая вена — вена реципиента (по Б. В. Петровскому). (2—3 мл /час); степени очистки перфу-зата от экзогенного аммиака; степени исчезновения бромсульфалеипа и бенгальской розы (М. С. Маргулис с соавт., 1972). Для более быстрого освобождения печени от остатков метаболитов ишемического происхождения некоторые авторы рекомендуют первые 400—500 мл перфузата слить. После восстановления функции и стабилизации кровообращения систему, заполненную донорской кровью, подключают к больному. |
