Хирургия печени и желчных путей. Нежизнеспособности ее у больного или для борьбы с тяжелой печеночной недостаточностью
 Скачать 11.68 Mb. Скачать 11.68 Mb.
|
|
а б Рис. 115. Мезентерикокавальный анастомоз: а) «конец в конец», б) «конец в бок»: vci — v. cava inferior: vp — v. portae: vras — v. mesente-rica superior: vmi — v. mesenterica inferior; vl—v. lienalis (no Littmann). Lord с соавторами (1971) модифицировал мезентерикокавальный шунт путем интерпозиции тефлонового протеза между нижней полой и мезен-териальной венами, располагая его в туннеле между двенадцатиперстной кишкой и поджелудочной железой. Draponas (1972), выполняя мезентерикокавальный шунт дакроновым протезом, считает опасным располагать трансплантат в туннеле между двенадцатиперстной кишкой и поджелудочной железой в связи с угрозой панкреатита. Автор производит тун-нелирование непосредственно через правую часть брыжейки поперечно-ободочной кишки. Для предотвращения сдавления двенадцатиперстной кишки последнюю сдвигают влево путем ее мобилизации. Baind с соавторами (1971) рекомендует анастомозировать левую почечную вену с верхней мезентери-альной по типу «конец в бок». Спленореналъные анастомозы. Соустье между селезеночной и .печеночной венами может быть выполнено в трех вариантах: «конец в конец» (Wipple, 1945; Blakemore, 1945), «конец в бок» (Linton с соавт.) и «бок в бок» (Blakemore, 1947; Cooley, 1963). Методика. Выполнение операции возможно из левостороннего торако-абдоми-нального доступа по IX межреберью слева с пересечением косых мышц живота, абдоминального — параллельно левому  Рис. 116. Спленореналъный анастомоз. 1) По типу «конец п бок». 2) По типу «бок в бок»: а — без пересечения селезеночной вены, G—с пересечением селезеночной вены (по Littrnann и М. Д. Пациоре). реберному краю. Мы предпочитаем выполнение данной операции, вскрывая брюшную полость клюшкообразным разрезом влево. Для этого разрезом от мечевидного отростка по средней линии, не доходя на 1/3расстояния до пупка и поворачивая влево с пересечением прямой мышцы живота, нижним углом доходим до уровня пупка по наружной поверхности прямой мышцы живота, вскрывая брюшную полость. Спленореналь-ный анастомоз начинают с перевязки селезеночной артерии для уменьшения крово-потери при выделении селезенки. Производят спленэктомию с максимальным щаже-нием и предварительным выделением селезеночной вены, которую пережимают у самых ворот. Далее по методике Wipple (1945) и Blakemore (1945) удаляют левую почку и селезеночную вену анастомозиру-ют с почечной веной «конец в конец». Отрицательным моментом этой операции является необходимость удаления левой почки. Избежать ее удаления позволяет предложе- ние Baird с соавторами (1971). Они рекомендуют пересекать почечную вену между генитальной и надпочечниковой. Центральную культю левой почечной вены анастомо-зируют с селезеночной по типу «конец в конец», а периферическую перевязывают. Функция левой почки при этом не нарушается. Спленоренальный анастомоз по типу «конец в бок» также начинают с удаления селезенки и выделения селезеночной вены. Далее медиальное от ворот левой почки рассекают задний листок париетальной брюшины, тупо выделяют почечную вену на протяжении 3—5 см. Затем окончательно выделяют селезеночную вену и накладывают анастомоз — конец селезеночной вены в бок почечной, при этом в последней сохраняется кровоток, благодаря частичному боковому сжатию сосуда (рис. 116). При выполнении спленоренального анастомоза «бок в бок» селезеночную вену выделяют на задненижней поверхности поджелудочной железы, поднимая последнюю снизу и несколько вверх. После выделения печеночной вены боковые стенки сосудов отжимают зажимами с сохранением в них кровотока, сближают, рассекают и накладывают анастомоз по обычной методике. Диаметр соустья при спленореналь-ных анастомозах должен быть не менее 1 си, в противном случае будет угроза его тромбирования. У ряда больных использование почечной вены для сосудистого соустья оказывается практически невозможным (рассыпной тип) или нежелательным (единственная функционирующая почка). В такой ситуации возможно анастомозировать селезеночную вену непосредственно с нижней полой — спленопортальный анастомоз (Asada, Schumaker, 1958). Омфало-кавальный и омфало-ре-налъный анастомозы. В случаях портальной гипертензии, когда коллатеральный кровоток направляется через пупочную вену, последняя расширяется и может быть использована для сосудистого соустья. При этом пупочную вену анастомозируют с нижней полой по типу «конец в бок» — омфало-кавальный анастомоз (Leger, Premont, 1962) или с почечной веной (Leger, Denton, 1969) по типу «конец в конец» — омфало-ренальный анастомоз. Помимо указанных операций для создания портокавальных анасто- мозов разработан ряд методик, которые не нашли широкого применения из-за технических трудностей при их выполнении, но в основном из-за недостаточного эффекта декомпрессии портальной системы. Это анастомоз между v. colica sin. с v. lienalis по типу «конец в бок», лиеносафе-нальный и мезентерикосафенальный анастомозы, при которых дисталь-ный конец большой подкожной вены, проведенной в подкожном туннеле левой половины передней брюшной стенки, соединяется с селезеночной или нижней брыжеечной венами (Г. Г. Караванов, М. П. Павловский, 1955); сперматиколиеналь-ный термино-латеральный анастомоз — проксимальный отрезок пересеченной семенной вены соединяется в бок селезеночной вены (И. И. Шафер, 1956, и др.). Зональная портальная декомпрессия. Учитывая, что чаще всего кровотечения при портальной гипер-тензии возникают из варикозно расширенных вен пищевода и желудка, Warren с соавторами (1967) предлагает производить декомпрессию только этой зоны. Методика операции заключается в перевязке коронарной вены желудка у места ее впадения в v. portae, выделении и пересечении селезеночной вены возможно ближе к месту ее впадения, после чего проксимальный конец ее перевязывают, а дистальный анастомозируют с левой почечной веной по типу «конец в бок». Таким образом, венозная система желудка изолируется от портальной системы и кровоток через селезенку направляется в систему нижней полой вены. Экстренная декомпрессия портальной системы. Больным с пище-водно-желудочными кровотечениями в тяжелом состоянии, у которых радикальная операция невыполнима в связи с их состоянием, а консервативная терапия оказывается неэффективной, показаны операции для временной декомпрессии портальной системы. Для этого Mс Quarrie с со- авторами (1970) предложил накладывать сафеноумбиликальный анастомоз. Методика. Продольным разрезом на бедре обнажают и выделяют большую подкожную вену, которую пересекают в ди-стальной части раны, проксимальный ее конец поворачивают вверх и проводят в подкожном туннеле в эпигастральную область, где через отдельный разрез анастомозируют с пупочной веной. White с соавторами (1968) и другие с этой же целью рекомендуют использовать экстракорпоральный шунт из пластической селикони-зированной трубки, которой соединяют пупочную вену с большой подкожной. После выведения больного из тяжелого состояния выполняют радикальную операцию по декомпрессии портальной системы. Все эти методики при циррозе печени имеют и отрицательный эффект — при снижении портального давления снижается портальный печеночный кровоток, что усугубляет явления печеночной недостаточности. Для улучшения кровообращения печени разработаны методы ее артериализа-ции, которые должны нивелировать уменьшение портального кровотока, возникающего при наложении сосудистых анастомозов. Так, Kimoto (1970) после выполнения порто-кавального анастомоза по типу «конец в бок» центральную культю портальной вены анастомозирует с селезеночной артерией. Maillard с соавторами (1970) дополняет такой порто-кавальный анастомоз шунтом между аортой и центральным концом v. portal, a Mat-zander, Consigio (1971) вводят трансплантат из подкожной вены между общей подвздошной или подвздошно-толстокишечной артериями и центральной культей портальной вены. Burlui с соавторами (1968) для артериализации печени использует пупочную вену, которую после разбу-жирования анастомозирует с селезеночной артерией. Fujishiro (1964) предложил a. lienalis имплантировать в паренхиму печени. Следует, однако, учитывать, что вопрос о целесообразности артериализации печени еще требует дальнейшей разработки, 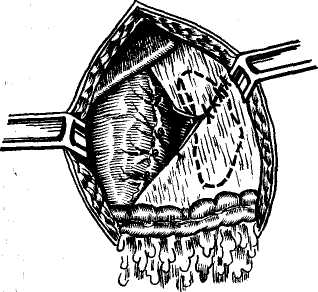 Рис. 117. Перемещение декапсулированной селезенки в забрюшинное пространство (по М. Д. Пациоре). так как повышенное давление в портальной системе ведет к повреждению печеночных клеток (Mallet — Guy, 1968), таким образом, эффективность ее при циррозе остается сомнительной (Hivet, 1968). Органные анастомозы. Идея усиления; коллатерального кровообращения для разгрузки портальной системы путем искусственного образования сращений между органами портальной и кавалыюй систем была высказана в 1887 г. Тальма и затем осуществлена многими хирургами, Было разработано значительное количество вмешательств подобного рода, но большинство из них не нашли широкого применения из-за небольшой эффективности, но отдельные; методики применяют широко: оменторенопексия, оментогепатодиа-фрагмрпексия, перемещение селезенки в плевральную полость или забрюшинное пространство. В 1907 г. С. G. Гирголав установил наличие анастомозов между сальником и почкой после ее декапсу-ляции, а в 1913 г. П. А. Герцен впервые выполнил оменторенопек-сию. Сущность метода оменторено-пексии заключается в следующем: после лапаротомии производят де-капсуляцию почки; ее окутывают сальником и фиксируют. Техника оментогепатодиафрагмопексии состо- ит в фиксации сальника к печени и диафрагме после предварительного нарушения эпителиального покрова этих органов с помощью металлической щетки, марлевого тампона или химических агентов. Применяется операция перемещения селезенки в плевральную полость (Nylander и Turnen, 1955), которая может быть выполнена как из трапсторакального доступа, так и путем лапаротомии. После этого при необходимости производят мобилизацию селезенки, рассекают в мышечной части левый купол диафрагмы и смещают селезенку в плевральную полость. Отверстие в диафрагме ушивают таким образом, чтобы не сдавить селезеночные сосуды. Плевральную полость дренируют. Для лучшего развития сращений капсула селезенки может быть обработана тальком, щеткой или тампоном. Имплантацию селезенки в брюшную стенку впервые осуществил Hol-inan (1933), но широкого распространения она не получила. Однако последние работы М. Д. Пациоры (1972) свидетельствуют об удовлетворительном эффекте такой операции. Методика. Лапаротомия, в боковом отделе позади селезенки рассекают париетальную брюшину; частичной отслойкой брюшины образуют карман, в который перемещают декапсулированную селезенку. Брюшину ушивают до ножки (рис. 117). Смещением селезенки в плевральную полость и в забрюшинное пространство достигают создания окольного кровотока. Такое перемещение можно сочетать с перевязкой селезеночной артерии, что дает непосредственный декомпрессионный эффект. Оригинальной по замыслу является операция сплено-гепатопластики, при ко- торой верхний полюс селезенки вводят в траншею, образованную в левой доле пе чени. При этом создается новое артериаль ное и веночное кровообращение за счет селезенки. Это артернализует печень под слабым давлением и отводит часть крови из норотпой вены (Benichoux, 1971). Спленэктомия. В настоящее время при портальной гипертензии селезенку удаляют лишь при ее фиброаде нии и синдроме гиперспленизма, сопровождающихся анемией, лейкопенией (ниже 4 000), тромбоцитопенией (ниже 100 000) и гиперплазией костного мозга при изолированном тромбозе селезеночной артерии. В остальных случаях удалять селезенку противопоказано. Ограничение притока крови в портальную систему. Для уменьшения притока крови и понижения портального давления предложены перевязки многих артерий и вен спланхнической зоны: перевязка селезеночной, желудочных, желудочно-сальниковых артерий, деваскуляризация карди-ального отдела желудка, нижнего отдела пищевода, перевязка вен под-диафрагмального пространства, направляющихся к пищеводу, венечной вены желудка и др. Выполняя данные вмешательства, можно добиться снижения давления в портальной системе. Однако эффект от таких операций в большинстве незначителен и не очень стоек. Не получила должного клинического подтверждения и перевязка печеночной артерии (Reinhoff, 1953, и др.).Предполагалось, что перевязкой ее будет достигнуто уменьшение наполнения артериальной кровью синусов, в результате чего улучшится портальный кровоток. Однако достигнуть полного отключения артериальной крови от печени, ввиду аномалий печеночных артерий, в большинстве случаев не удается. Выраженного гипотензивного действия на портальную систему после ее перевязки не отмечено (Sahnke с соавт., 1953). Высокая общая летальность после перевязки печеночной артерии — 40,5% (Г. Г. Караванов и М. П. Павловский, 1968) делает операцию чрезмерно рискованной. Вмешательства на расширенных венах пищевода и желудка Для непосредственного вмешательства на флебэктазиях пищевода и кардиального отдела желудка раз- работан ряд методик, значительная часть которых выполняется из трансторакального доступа. Применение его обусловлено выраженным спаечным процессом в брюшной полости, что при портальной гипертензии делает операцию травматичной и ведет к значительной кровопотере. В связи с этим вмешательства из торакального доступа являются целесообразными. В большинстве методик трансторакальный доступ к пищеводу осуществляют путем левосторонней торакотомии по 7—8-му межреберью. Трансторакальные методики. В 1949 г. Воегеmа предложил производить остановку кровотечения из расширенных вен пищевода путем их прошивания и перевязки отдельными узловатыми швами, для чего после выделения наддиафрагмальной части пищевода производили продольное вскрытие. В просвет вен между лигатурами для облитерации автор рекомендует вводить 66% раствор глюкозы. Целость пищевода восстанавливают трехрядным швом: слизистую оболочку— непрерывным кетгуто-вым, мышечную — двухрядным узловатым швом (шелк). Crile (1950) модифицировал операцию Воегета, предложив производить обшивание варикозных вен пищевода на протяжении непрерывным кетгутовым швом. Свой вариант обработки вен пищевода в операции выполнил Э. Клейнт (1962). Прошив вену непрерывной капроновой лигатурой (№ 2) снизу вверх, нужно возвратиться к исходному участку и связать концы нитей между собой, то есть одной нитью прошить ствол варикозно расширенной вены в 2 направлениях. Перевязкой расширенных вен пищевода по методу Воегета — Crile полного разрыва связи портальной и кавальной систем через вены пищевода не происходит, так как мелкие вены при этом не перевязывают, а в последующем, расширяясь, служат источником рецидивных крово- течений. Учитывая это, Tanner (1950) предложил полное поперечное пересечение пищевода в наддиафрагма-льной части с последующим послойным ушиванием его двухрядным швом. Nissen (1954), боясь недостаточности швов после вскрытия пищевода, прошивал варикозно расширенные вены без его вскрытия, обкалывая их снаружи. Исходя из этих соображений, Ra-pant (1956) рассекал циркулярно лишь мышечную оболочку. Последняя осторожно отслаивалась по всей окружности от подслизистого и слизистого слоев, без вскрытия слизистой оболочки. Флебэктазии обкалывают иглой, прошивают и накладывают швы на мышечную оболочку. М. Д. Пациора (1971) в отличии от операции Rapant производила га-стростомию с прошиванием вен кар-дии и вен области пищеводно-желу-дочного перехода со стороны слизистой оболочки желудка. Walker (I960) предложил свою модификацию операции Таннера. Ввиду того, что в мышечном слое флеб-эктазий практически не бывает, автор считает нецелесообразным пересекать мышечный слой пищевода, а производить его рассечение продольно. Подслизистый слой и слизистую оболочку рассекают циркулярно и после лигирования вен слизистую оболочку сшивают непрерывным швом, а на продольный разрез мышечной оболочки накладывают узловатые швы. Указанные операции, как и некоторые другие модификации (Ideruki с соавт., 1967; Wenzi, 1968, идр.), не смогли решить проблемы борьбы с кровотечениями, так как рецидивы геморрагий наблюдались при выполнении всех методик. Кроме того, всегда существует угроза эмпиемы при вскрытии пищевода трансторакальным доступом. Указанные методики не позволяют производить эффективные вмешательства при кровотечении из вен желудка. Послед- нее обстоятельство удачно исправляется в методиках М. Д. Пациоры (1971), Skinner (1969). Методика, предложенная Skinner (1969), заключается в следующем. После выделения пищевода подтягиванием за него в плевральную полость вытягивают дно желудка, деваскуляризируют его и производят поперечную гастростомию, на 5—7 см отступя от гастроэзофагального соединения. Через гастростомический разрез производят непрерывный шов вокруг гаст-роэзофагеального соединения. Операцию заканчивают реконструкцией кардии по Belsey (1967) с погружением желудка в брюшную полость. Чрезбрюшинные методы. Tanner (1950) предложил разобщить портальную и навальную системы пересечением желудка в поперечном направлении, при этом по линии пересечения разъединяют малый сальник и желудоч-но-селезеночную связку. Первоначально данную операцию Tanner производил из торако-абдоминального доступа, в последующем — из абдоминального. В различных модификациях эта операция получила довольно широкое применение (Б. А. Петров, Э. И. Гальперин, 1959; Н. Н. Напалков 1971; Patel с соавт., 1968; Nilson с соавт., 1970, и др.). В 1957 г. Wosschulto для борьбы с кровотечением из вен пищевода предложил его лигатурное пересечение из абдоминального доступа. Сущность операции заключается в следующем: через гастротомическое отверстие в кардию по дуоденальному зонду вводят трехстворчатое металлическое кольцо; по окружности рассекают мышечный и серозный слой кардии, слизистую оболочку с венами пережимают шелковой лигатурой вокруг кольца; мышечный слой сшивают над лигатурой, через 2 недели лигатура прорезается через слизистую оболочку в просвет желудка, кольцо распадается и выводится естественным путем. К этому времени место прохождения лигатуры рубцуется и рубцы разобщают вены. У 7 из 18 больных, оперированных этим методом, рецидива кровотечений не было. Б. А. Петров и Э. И. Гальперин (1963) предложили перевязывать вены желудка и пищевода через гастротомический разрез. При этом со стороны слизистой оболочки захватывают зажимами Люэра и перевязывают расширенные вены кар-дии и пищевода. Слизистую и под-слизистую оболочку задней стенки желудка прошивают кетгутом в поперечном направлении. Переднюю стенку желудка ушивают 2-рядным швом. В своей модификации эту операцию выполняет М. Д. Пациора с соавторами, 1967 (рис. 118). Неудовлетворенность получаемыми результатами побуждала искать все новые и новые пути для улучшения эффекта в борьбе с кровотечениями из расширенных вен пищевода и желудка. С этой целью были применены такие операции, как гастро-эктомия (Wangensteen, 1945), резекция нижней трети пищевода и кар-дии (Phemister, Humphreys, 1947), изоперистальтическая эзофагостомия по Ру (Barnes и Redo, 1957), интерпозиция изолированного сегмента тонкой кишки (Merendino и Dillard, 1955), интерпозиция сегмента толстой кишки (Коор и Roddy, 1958), экстирпозиция и замещение пищевода (Colin и Mathewson, 1957) и многие другие. |
