Хирургия печени и желчных путей. Нежизнеспособности ее у больного или для борьбы с тяжелой печеночной недостаточностью
 Скачать 11.68 Mb. Скачать 11.68 Mb.
|
|
Пищеводно-желудочные кровотечения. Варикозные расширения вен пищевода и желудка имеют в своей основе повышение портального давления. Этому способствует анатомическая связь портальной и каваль-ной систем через вены желудка и пищевода, непарную, полунепарную и щитовидную вену. Предрасполагающим фактором является магистральный тип строения вен пищевода и слабая окружающая их опора в виде рыхлого подслизистого слоя. Под воздействием высокого портального давления, передающегося на вены пищевода через венечную вену желудка, вены пищевода удлиняются, расширяются, приобретая извилистость и узловатость. Этому в известной степени способствует также недостаточность анастомозов вен пищевода с венами верхней полой вены, проходящими через мышечный слой пищевода. Наблюдения за больными с портальной гипертензией показали, что кровотечения из флебэктазий пищевода и желудка могут возникнуть при относительно невысоком портальном давлении — 250—300 мм вод. ст., и в то же время у ряда больных с портальным давлением, достигающим 500 и даже 600 мм вод. ст., кровотечений из расширенных вен не наблюдалось (М. Д. Пациора, 1961). В настоящее время установлено, что пусковыми моментами в возникновении кровотечений из расширенных вен пищевода и желудка являются: гипертонические кризы в портальной системе (П. А. Иванов, 1967), пептическое действие желудочного сока на измененную в результате трофических нарушений слизистую оболочку пищевода (М. Д. Пациора с соавт., 1971; Wagen knecht с соавт., 1953; Roseti, 1960, и др.), нарушения в свертывающей системе крови (Ю. М. Дедерер, Е. Я. Суховеева, 1963; О. В. Крутков- ская, 1964; А. Г. Караванов и М.. А. Уманский, 1966, и др.). Кровотечение из варикозно расширенных вен пищевода и желудка всегда является грозным осложнением портальной гипертензии. Летальность при первых кровотечениях колеблется от 20 (Lord, 1953) до 60—70% (Orloff, 1963; Conn, 1964). Как правило, кровотечения повторяются, становясь с каждым разом более массивными. Первый год после кровотечения выживают только 50% больных циррозом печени (Ludington, 1959). Кровотечения из пищевода и желудка чаще возникают у больных с допеченочным блоком. Обычно первое кровотечение у них не заканчивается летальным исходом (В. В. Гаврюшов, 1969, и др.) и даже при повторных кровотечениях, которые могут продолжаться в течение нескольких лет, летальность в этой группе больных относительно невелика. Так, из 26 детей с допе-чепочпым блоком (в наблюдении Аге-ari и Lynn, 1961) в результате повторных кровотечений умер только 1 больной спустя 6 лет после первого кровотечения. У больных с внутри-печеночным блоком пищеводно-желу-дочные кровотечения возникают значительно реже, но протекают более тяжело. В течение года после перенесенного кровотечения в этой группе больных летальность колеблется от 14, 5 до 80% и более (Ф. Г. Углов и Т. О. Коренина, 1964; В. В. Гаврюшов, 1969; Reynell, 1951; Walker, 1962; Foster с соавт., 1964, и др.). Диагностика кровотечений из варикозно расширенных вен пищевода и желудка основывается на профуз-ных кровотечениях в виде срыги-вания свежей неизмененной, непенящейся крови без рвотных движений. Но при затекании крови в желудок может наблюдаться рвота «кофейной гущей» и мелена. Острое кровотечение из расширенных вен пищевода обычно является первым проявлением портальной гипертензии у детей, но нередко и взрослые не по- дозревают о заболевании до появления 1-го кровотечения. Тем не менее, обследование таких больных позволяет выявить и другие признаки портальной гипертензии: расширение подкожных вен живота и грудной стенки, «сосудистые звездочки», спленомегалию, увеличение печени, желтуху и др. Данные исследования функционального состояния печени — бром-сульфолеиновая проба и другие имеют небольшое диагностическое значение, так как угнетение функций печени может быть обусловлено реакцией организма на кровопотерю. Ценным показателем для диагностики цирроза печени является про-тромбиновый индекс — снижение его до 50% нормы и менее наблюдается при цирротическом поражении печени, тогда как при язвенной болезни он обычно не меняется. Более достоверным показателем, свидетельствующим о выраженном коллатеральном кровообращении, является гипер-аммониемия. Рентгенологическое исследование на высоте кровотечения дает значительный процент ложно-отрицательных результатов (Knowles с соавт., 1952). Ценные данные, облегчающие дифференциальную диагностику кровотечений из варикозных вен пищевода, могут быть получены при спленоманометрии, при этом данная манипуляция выполнима и у тяжелых больных без риска кровотечения, используя иглу небольшого диаметра. Ranke, Rousselot, Moreno (1959) сообщили о положительных результатах спленометрии у 90% больных. Спленопортография для диагностики расширенных вен пищевода при кровотечении применяется ограниченно в связи с тяжелым состоянием больных данной категории. Важные данные могут быть получены при эзофагоскопии, но проведение ее на высоте кровотечения очень затруднено. В последнее время более широкое применение находят методы радиологической диагностики. И, на- конец, последним дифференциально-диагностическим приемом является балонная тампонада пищевода. Следует заметить, что установление портальной гипертензии у больного с кровотечением из верхнего отдела желудочно-кишечного тракта не исключает другой причины. Так, Merigen с соавторами (1960) среди больных циррозом печени отметил кровотечение из вен пищевода у 53% больных, у 22% причиной кровотечения был гастрит, у 14% — язва двенадцатиперстной кишки, у 6% — язва желудка, и у 5% больных источник кровотечения не был обнаружен. Асцит. Портальная гипертензия нередко сопровождается кровотечением при асците и спленомегалии. В клиническом отношении различают 3 варианта асцита (Н. Напалков, С. А. Апаков, 1971): 1) транзиторный — под воздействием терапии состояние больного улучшается и уменьшается асцит; 2) прогрессирующий — терапия не эффективна или дает лишь временный эффект; 3) дистрофический асцит — конечная стадия заболевания. Прогноз асцита неблагоприятный. Продолжительность жизни с момента обнаружения его 1—3 года (В. А. Журавлев, 1964). Спленомегалия при портальной гипертензии развивается в результате застоя крови. Внутриселезеноч-ное давление не отличается существенным образом от давления в воротной вене (в норме 70—120 мм вод. ст.) и колебания его в портальной системе быстро передаются на селезенку. При портальной гипертензии селезенка, депонируя часть крови, увеличивается в размерах. В дальнейшем капсула ее уплотняется, нередко развиваются явления пери-спленита, при микроскопическом исследовании — фиброз по ходу сосудов (фиброадения), расширение венозных синусов и другие изменения. Увеличиваясь в размерах и депонируя часть крови при портальной гипертензии, селезенка до некоторой степени играет буферную роль, смягчая быстрые подъемы портального-давления, являющиеся одним из пусковых механизмов в развитии кровотечений из варикозно расширенных вен. Вот почему после спленэктомии при неустраненном блоке кровотечения из варикозно расширенных вен пищевода и желудка учащаются. Понижение давления в портальной системе (кровотечение идругие факторы) влечет за собой уменьшение размеров селезенки и лишь при длительной портальной гипертензии и выраженном ее фиброзе она теряет способность к сокращению. Увеличение селезенки сопровождается анемией, лейкопенией, тром-боцитопенией, гиперплазией костного мозга с нарушением процессов созревания (синдром гиперспленизма). Определенной зависимости между размерами селезенки и степенью гиперспленизма не наблюдается (Ф. Г. Углов и Т. О. Корякина, 1964). Критериями гиперспленизма являются снижение числа лейкоцитов ниже 4000 и тромбоцитов ниже 100 000 в 1 мм3. Механизм развития гиперспленизма сложен и связан с литичес-кой функцией селезенки, аутоиммунными процессами, тормозящим действием на лейкопоэз и другими факторами. Однако, если эти явления при внепеченочном блоке обусловлены отрицательным действием селезенки, то при внутрипеченочной форме портальной гипертензии подобные изменения в крови могут быть следствием цирроза печени, что подтверждается рецидивированием их в отдаленные сроки после спленэктомии при нормальных показателях миелограм-мы (М. И. Лыткин, 1971). КОНСЕРВАТИВНОЕ ЛЕЧЕНИЕ КРОВОТЕЧЕНИЙ ИЗ ВЕН ПИЩЕВОДА И ЖЕЛУДКА Консервативная терапия больных с кровотечением из варикозных вен пищевода и желудка включает слож- ный комплекс мероприятий, направленных на восполнение кровопотери, остановку кровотечения и на борьбу с печеночной недостаточностью, угроза развития которой на фоне кровотечения чрезвычайно велика. По данным Baker с соавторами (1959), Garcean с соавторами (1963), примерно одинаковое число больных погибает от печеночной недостаточности, развившейся после кровотечения, и от неостановленного кровотечения. Данные литературы (Greenway и Stark, 1971) свидетельствуют о том, что при кровопотере общий печеночный кровоток уменьшается пропорционально уменьшению сердечного выброса, причем в большей степени за счет уменьшения портального кровотока. Понижение насыщения кислородом крови в венозной системе печени нарушает печеночный метаболизм, так как гипоксия ведет к выделению витамина К и глюкозы из печени. На фоне неполноценной в функциональном отношении печени (например, при ее цир-ротическом поражении) это является одним из важных факторов в развитии печеночной недостаточности даже при остановленном кровотечении. Продолжительная гиповолемичес-кая гипотензия может привести к необратимым изменениям. Поэтому применение гемотрансфу-зий (свежая кровь!) не только с ге-мостатической целью, но и для полного восполнения кровопотери и стабилизации артериального давления мы считаем оправданным у больных циррозом печени. Для предупреждения печеночной недостаточности рекомендуют внутривенные вливания 5—10% раствора глюкозы, аскорбиновой кислоты, витаминов группы В. Важное значение имеет дезинтоксикационная терапия, включающая 10% раствор глютаминовой кислоты, неокомпен-сан, реополиглюкин и другие. Для подавления кишечной флоры назначают антибиотики, кишеч- ник очищают от крови с помощью клизм. Учитывая нарушения в свертывающей системе крови, в арсенал ге-мостатической терапии необходимо включать витамин К (викасол), фибриноген, хлористый кальций, е — аминокапроновую кислоту, параами-нометилбензойную кислоту и другие гемостатические препататы. В ряде случаев хороший гемостатический эффект мы наблюдали, применяя смесь е-аминокапроновой кислоты (10 г сухого вещества) с тромбином (200 мг). Оба вещества, как рекомендуют М. А. Уманский и соавторы (1971), растворяются в 100 мл воды и принимаются per os по 1 столовой ложке каждые 15 минут в течение первых 2 часов, а затем на протяжении суток через 2 часа по столовой ложке. Снижение портального давления достигается применением питуитрина. По данным М. Д. Пациоры с соавторами (1971), введение его снижает давление в среднем на 100—140 мм вод. ст. (на 20—35% от исходного). Доза его 20 ед., растворенных в 250 мл 5% глюкозы, повторную дозу при необходимости вводят через 24 часа. Суживая сосуды спланхни-ческой зоны, питуитрин снижает портальную гипертензию, и тем самым уменьшает геморрагию из варикоз-но расширенных вен. Однако следует помнить и о снижении в тех же пропорциях печеночного кровотока и возможном усилении печеночной недостаточности (Raschke и Paquet, 1971). Во время кровотечения и в течение 1—2 дней после его остановки для предупреждения рецидива прием пищи и жидкостей категорически запрещается. При неэффективности гемостати-ческой терапии и наличии противопоказаний к экстренному хирургическому вмешательству для остановки кровотечения из вен пищевода может быть применена тампонада пищеводным зондом с пневмо- баллонами. Зонд Sengataken — Bla-kemore состоит из трехпросветной трубки с 2 баллонами, 2 канала трубки служат для раздувания баллонов, 3-й — для эвакуации содержимого из желудка и таким образом контроля за кровотечением, а также для кормления больного (рис. 111). Методика применения зонда. После анастезии носоглотки зонд, смазанный вазелином, через носовой ход вводят в пищевод до отметки, указывающей, что нижний баллон находится в желудке. Желудочный баллон раздувают воздухом (около 200 см3) и несколько подтягивают. Это обеспечивает правильную установку пищеводного баллона и сдавливает стенку желудка вокруг кардии, пережимая таким образом расположенные здесь вены, которые также могут быть источником кровотечения. Отдельными порциями по 10—15 см3 с интервалом в 3—5 минут раздувают пищеводный баллон до объема 80—150 см3. Затем аспирируют содержимое из желудка, отмывают его «до чистой воды» и в дальнейшем по характеру содержимого судят об эффекте тампонады. После остановки кровотечения через зонд дробными порциями начинают кормить больного. Через каждые 5—6 часов воздух из пищеводного баллона выпускают и контролируют содержимое желудка: если кровь не поступает — кровотечение остановлено. Зонд извлекают через 24—72 часа, опорожнив баллоны. На время нахождения зонда в пищеводе больным назначают промедол или пантопон, пипольфен, димедрол и обычных дозах. При использовании пищеводного зонда возможны осложнения: изъязвление слизистой оболочки пищевода, образование пролежней, аспирацион-ная пневмония. Во избежание осложнений, применение зонда более 2—3 суток не рекомендуют, но при рецидиве кровотечения допустимы повторные применения. Профилактикой аспираци- 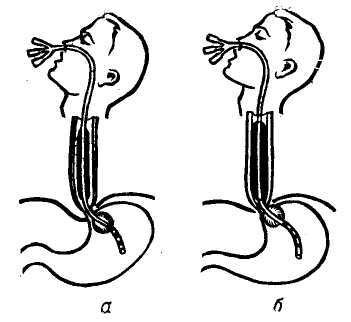 Рис. 111. Тампонада с помощью зонда Блекмора варикозно-расширенны.т вен пищевода. Через зонд раздунаетсн сначала баллон в желудке (а), я затем и пищеводе (С, no Littmann). онной пневмонии является частое удаление секрета из глотки. Эффективность применения зонда, по данным различных авторов, колеблется в пределах 83,6% (Hermann, Fraul, 1971). Число осложнений, по их данным,— 9,2%, из них с летальным исходом — у 3,7% больных. М. Д. Пациора с соавторами (1971) применением пищеводного зонда достигла остановки кровотечения у 37 из 50 больных. К отрицательным моментам этого метода относятся необходимость назначения седативных средств, плохо разрушаемых пораженной печенью, опасность асфиксии при антиперистальтике и опасность изъязвления в местах тампонады (Esser, Giit-gemann, 1969; Raschke, Paquet, 1971). К. А. Петров с сотрудниками (1965—19(57), Salmon с сотрудниками (1960) и другие для остановки кровотечения из варикозно' расширенных вен пищевода и желудка применяют местную желудочно-пище-водную гипотермию, которую осуществляют с помощью двуиросвет-ного зонда, введенного в желудок. Через зонд пропускают охлажденную до 5—10° жидкость со скоростью 600 мл/мин. Снижение температуры до 14° уменьшает перистальтику пи- щевода и желудка. Для охлаждения применяют жидкость в составе: на 1 л дистиллированной воды 50,0 Глюкозы, 5,0 хлористого аммония. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ПОРТАЛЬНОЙ ГИПЕРТЕНЗИИ И ЕЕ ОСЛОЖНЕНИЙ В настоящее время методы оперативного лечения при синдроме ги-пертензии направлены на выполнение следующих основных задач. I. Декомпрессия портальной системы. П. Разобщение портальной системы от наиболее слабых — «кровоточащих» мест гастроэзофагеальной венозной сети на различных уровнях. III. Борьба с асцитом. Методы декомпрессии портальной системы Наиболее эффективное снижение давления в портальной системе может быть достигнуто лишь созданием порто-кавальных анастомозов, когда вся или часть портальной крови направляется в систему нижней полой вены, минуя печень. Условием для наложения сосудистых анастомозов является повышение давления в портальной системе выше 250 мм вод. ст. с градиентом давления между портальной и кавальной системами не менее 10 мм рт. ст. Порто-кавалъные анастомозы. К ним относятся: получившие наибольшее распространение прямые порто-кавалыше мезентерико-кавальные и спленорепальные анастомозы по типу «бок в бок», «конец в бок», «два конца в бок» и «конец в конец». Идея создания порто-кавалыюго соустья, разработка методики и выполнение его в условиях эксперимента принадлежит Н. В. Экку, который в 1877 г. выполнил операцию порто-кавального анастомоза по типу «бок в бок» на собаке. Применение метода в клинической практике на науч- ной основе стало возможным благодаря работам Wipple (1945), Blake-more, Lord (1945). Методика. Положение больного на спине с приподнятым правым боком на 30° от стола. Для вмешательства применяют торако-абдомина-льный доступ или абдоминальный. При торако-абдоминальном доступе разрез проводят справа по VIII или IX межреберью от средней подмышечной линии и продолжают на брюшную стенку справа сверху налево вниз до средней линии. Разрез начинают с абдоминальной части и после ревизии продолжают на грудь, при этом избегают вскрытия плевральной полости. Затем рассекают диафрагму. Достаточный доступ можно обеспечить менее травматичным путем — выполнением поперечного разреза в эпигастральной области и подреберье или типа Рио-Бранко. Мы пользуемся клюшкооб-разным разрезом вправо, продолжая его несколько книзу. После разделения васкуляризованных сращений производят мобилизацию двенадцатиперстной кишки по Кохеру для лучшего доступа к нижней полой вене. Рассекают париетальный листок брюшины над нижней полой веной и выделяют ее от нижнего края печени на 6—10 см, при этом освобождается только передняя ее поверхность. Обнажение воротной вены может быть достигнуто путем рассечения над ней заднего брюшного листка печеночно-двепадцатиперст-ной связки с последующим выделением вены от бифуркации до нервного пучка или спереди раздвиганием общего желчного протока и печеночной артерии в сторону, а также через малый сальник (Valdoni, 1961) путем рассечения печеночно-подже-лудочной и печепочно-привратнико-вой связок. Выделив портальную и нижнюю полую вены, приступают к созданию анастомоза (рис. 112). Создание соустья по типу «бок в бок» начинают с отжатия боковых 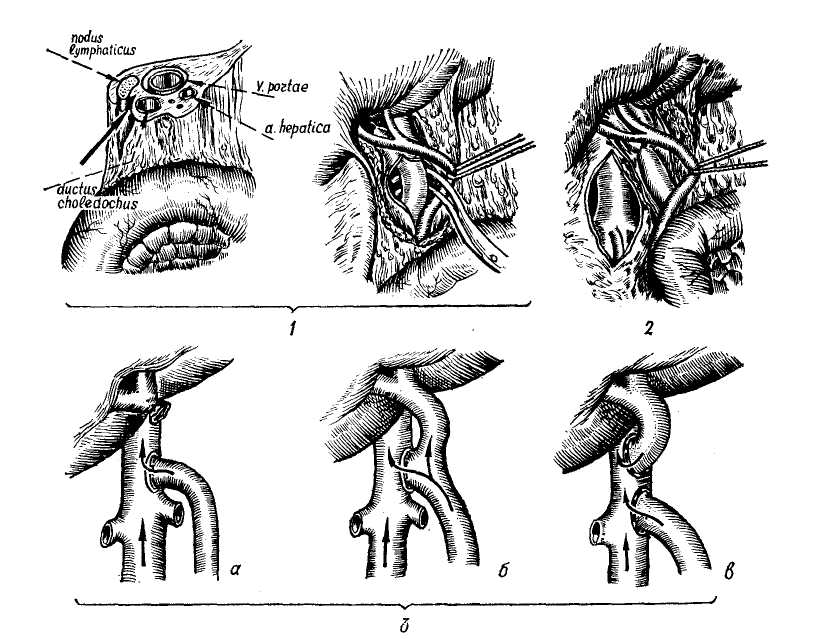 Рис. 112. Портокаеальный анастомоз: 1) Выделение воротной вены. 2) Обнажение передней поверхности нижней полой вены. ,?) Различные варианты портокавального анастомоза: а) «конец в бок», б) «бок в бок». «) «два конца в бок» (по Lilttnann). 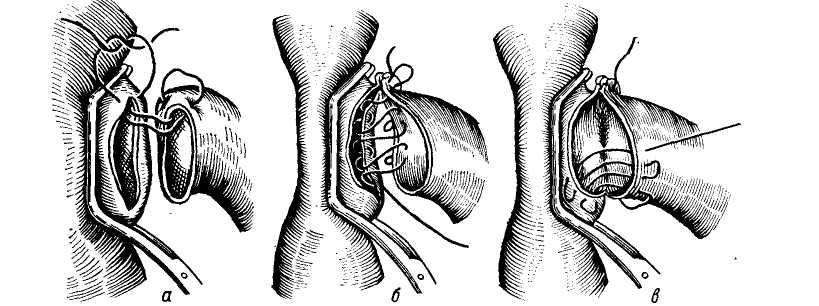 Рис. 113. Портокавалъный анастомоз. Сосудистый шов no Blalock: а) матрацный узловатый шов в верхнем углу; б) матрацный непрерывный вворачивающий шов на задней стенке анастомоза; в) тот же шов на передней стенке.(по Uttmann). стенок сосудов зажимами, не прерывая полностью кровотока в них. Зажимы сближают, в отжатом участке полой вены иссекают овальное окно длиной до 2 см, шириной 0,3—0,5 см. а в отжатом участке воротной вены иссекают узкую полоску шириной 1—2 см и накладывают выворачивающийся непрерывный матрацный шов по Blalock (рис. ИЗ) или циркуляр- 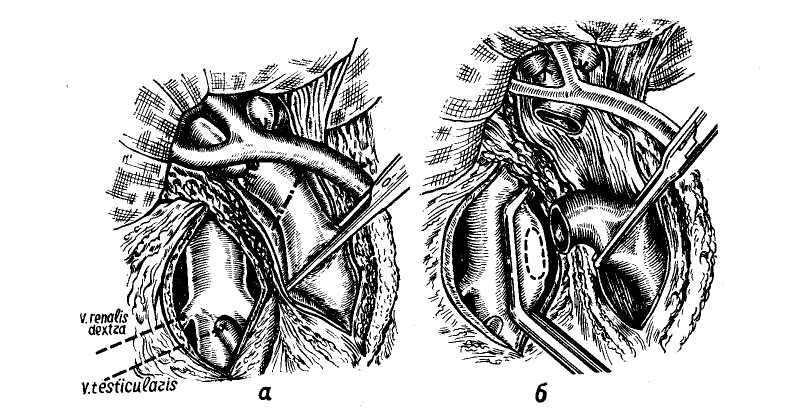 Рис. 114. Портокаеалъный анастомоз по типу «конец в бок»: а) перевязка обеих ветвей воротной вены, пережатие основного ствола ее и пересечение; б) наложение на стенку нижней полой вены зажима и вырезание овального отверстия (по Littmann). ный непрерывный шов атравматичес-кой иглой. Зажимы снимают. Однако сблизить боковые поверхности и наложить анастомоз бывает довольно сложно, поэтому большинство хирургов предпочитают наложение анастомоза «конец в бок». При выполнении анастомоза по типу «конец в бок» дистальпый конец выделенной воротной вены пережимают мягким зажимом, проксимальный — у бифуркации перевязывают и вену пересекают (рис. 114,а). Переднюю стенку нижней полой вены отжимают, в ней вырезают овальное отверстие и между культей воротной вепы и отверстием в стенке полой вены формируют анастомоз (рис. 114,6). Создание анастомоза по типу «два конца в бок» отличается тем, что воротную вену пересекают между 2 зажимами и оба конца ее последовательно, по отдельности соединяют с нижней полой веной. Анастомоз печеночного конца портальной вены выполняют первым (см. рис. 112,в). Порто-кавальные анастомозы по типу «конец в бок» и «два конца в бок» по сравнению с соединением по типу «бок в бок» менее подвержены тромбированию. Анастомоз по типу «конец в бок» показан при выраженном ретроградном токе крови из печени, а при отсутствии последнего целесообразно выполнять анастомоз по типу «два конца в бок», так как при этом сохраняется частичный кровоток через портальную систему печени. Левый порто-ренальный анастомоз. Этот вариант порто-кавального анастомоза разработан Ezlik, Bar-rilai, Shramek (1964). Выполним из срединной или поперечной лапаро-томии. После выделения портальной и нижней полой вен с впадающими в последнюю почечными сосудами и удаления левой почки v. renalis sin. анастомозируют с v. portae пo типу «конец в бок». Данный вариант позволяет создать сосудистое соустье между портальной и .нижней полой венами в случае, когда непосредственное их сближение затруднено. Однако необходимость удаления почки ограничивает его применение. Аналогична методика и при правом порто-ренальном анастомозе (Blakemore, 1951), когда с портальной веной анастомозируется правая почечная вена. Мезентерикокавалъные анастомозы. Первым в выполнении мезенте-рикокавального анастомоза был Н. А. Богораз, выполнивший успешную операцию по разработанной им методике в 1912 г. Методика. Для выполнения мезенте-рнкокавалышх анастомозов может быть применена срединная или верхнесрединная трансректальная лапаротомия. Поперечно-ободочную кишку приподнимают вверх, брюшинный покров ее брыжейки рассекают у корня поперечно. Находят мезенте-риальные артерию и вену, пересекающие спереди нижнюю горизонтальную часть двенадцатиперстной кишки, вену, расположенную справа от артерии, выделяют на протяжении 4—6 см. Мобилизовав горизонтальную часть двенадцатиперстной кишки в краниальном направлении, обнаруживают и выделяют (на протяжении 4—5 см) нижнюю полую вену, бифуркацию и приступают к созданию одного из мезентерико-кавальных анастомозов. Н. А. Богораз пересекал верхнюю брыжеечную вену ниже впадения v. colica dex., v. ileocolica, ряда мелких вен и анастомозировал дисталь-ный конец верхней брыжеечной вены с нижней полой между бифуркацией ее и яичниковой веной по типу «конец в бок». В. В. Крестовский (1926) в отличие от Н. А. Богораза (1912) пересекал верхнюю брыжеечную вену в корне брыжейки, направляя всю кровь этого бассейна в нижнюю полую вену. Marion и Clatworthg (1964) видоизменили метод, предложив пересекать нижнюю полую вену над бифуркацией и анастомозировать центральный ее конец в бок верхней мезенте-риальной вены (рис. 115). Для предупреждения сдавления места анастомоза горизонтальной частью двенадцатиперстной кишки Mai Hard с соавторами (1971) предложил накладывать анастомоз между нижней полой и верхней мезенте-риальной веной в верхней ее части по типу «бок в бок», пересекая для этого горизонтальную часть двенадцатиперстной кишки с последующим ее ушиванием. С этой же целью 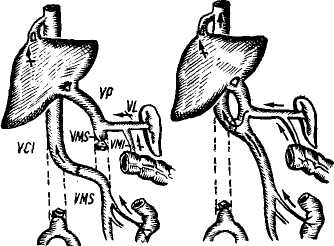 |
