Хирургия печени и желчных путей. Нежизнеспособности ее у больного или для борьбы с тяжелой печеночной недостаточностью
 Скачать 11.68 Mb. Скачать 11.68 Mb.
|
|
Проблема донора, подготовка трансплантанта и консервирование печени. Проблема получения жизнеспособного трансплантата печени для пересадки человеку является очень важной и трудной. Получить печень у донора-добровольца или родственника, как при пересадке почки, исключается. Получить печень можно лишь у трупа. Проведение реанимационных мероприятий, установление смерти будущего донора комиссией врачей и затем лишь — не ранее получаса после смерти («Правила судебно-медицинского вскрытия трупа», СССР, 1928) допустимы мероприятия по сохранению внутренних органов и их экстирпации. Требуется максимальное сокращение периода «тепловой ишемии», в связи с чем перфузия гипотермической жидкости, рациональная техника гепатэктомии, охлаждение трупа — мероприятия, которые должны быть строго регламентированы и изучены. Starzl (1969) вполне справедливо ставит зависимость исходов трансплантации от длительности и осо- бенностей смерти донора. Он отметил, что у 7 из 9 больных причина гибели после пересадки заключалась в длительности агонии и неэффективности кровообращения в печени донора в терминальном периоде. Fortner и соавт. (1970) изъятие печени у донора производили до периода остановки сердца. Для изъятия печени с целью трансплантации используют трупы, погибших в данном лечебном учреждении во время операции, например, на открытом сердце, а также умерших от повреждений, не совместимых с жизнью (Н. В. Коростовцев, 1966; И. Д. Корнатовский, 1968; William, 1970; Lie, 1971, и др.). После констатации смерти в бедренную вену и артерию вводят полиэтиленовые катетеры и налаживают экстракорпоральную перфузию жидкости, состоящей из 5% раствора декстрозы с добавлением пенициллина и гепарина из расчета 1,5 мг на 1 кг веса донора при температуре жидкости 15° (рис. 122). Доступ к печени производят двусторонним подреберным разрезом и сразу же начинают перфузию через катетер и верхнюю брыжеечную вену гепаринизированного раствора Гартмана при температуре 4°. В это же время канюлируют нижнюю полую вену ниже почечных вон для предотвращения повышения венозного давления; собранная таким образом кровь впоследствии может быть перелита реципиенту. Грудную аорту после рассечения диафрагмы справа от позвоночника пережимают зажимом, таким образом перфу-зируют только поддиафрагмальную часть тела. Для предотвращения аутолиза внутрипеченочных желчных ходов делают разрез на дне желчного пузыря и желчь удаляют, разрез впоследствии используют для наложения холецистоэнтероанастомоза. В дальнейшем производят выделение элементов печеночно-двенадца-типерстной связки, нижней и полой вены и мобилизацию печени. Сразу же над двенадцатиперстной кишкой пересекают общий желчный проток, воротную вену и печеночную артерию берут на держалки. Следует помнить, что у 15% больных имеется добавочная печеночная артерия, которая проходит позади воротной вены и отходит от верхней брыжеечной артерии. Все окружающие печень ткани, включая и малый сальник, пересекают. Г. Е. Островерхое и соавторы (1969) указывают на необходимость особо тщательной перевязки окружающих тканей после их рассечения для предупреждения лимфорреи. Пересекают связки печени. Перевязывают и пересекают надпо-чечниковые вены, после чего нижняя полая вена оказывается выделенной от диафрагмы до почечных вен. Освобождают надпочечный отрезок нижней полой вены и намечают место ее отсечения вблизи правого предсердия. На этом этапе особо важное значение имеет выделение и перевязка правой, левой и задней диафрагмаль-ных вен. Неперевязка этих вен ведет после трансплантации к тяжелому кровотечению и опасности воздушной эмболии. После выделения всех образований прекращают экстракорпоральную перфузию, канюлиру-ют воротную вену как можно дальше от печени и продолжают уже через нее перфузию охлажденным до 15° раствором Рингера. Удаление печени производят в тот момент, когда полностью подготовлены кровеносные сосуды реципиента. Для уменьшения периода аноксии печени операции на доноре и реципиенте идут одновременно, соблюдая соответствующую последовательность пересечения сосудов: верхнебрыжеечной, воротной вен, аорты, нижней полой вены. В среднем изъятие печени проводили через 1 час 30 минут после остановки сердца у донора. Иссечение печени обычно занимает 50—60 минут. После изъятия ее помещают в стерильный пластмассовый сосуд, содержащий охлажденный физиологический раствор. Перфузия продолжается охлажденным раствором, содержащим плазму, бикарбонат натрия и декстрозу. Температуру печени снижают до 27° и убедившись, что в устье чревной артерии нет сгустков, приступают к трансплантации. Сохранение печени, то есть ее консервация на данном этапе развития медицинской науки невозможна. Имеющиеся средства и методы позволяют сохранить печень 2—3 дня, но она уже не может удовлетворить клинициста (Starzl, 1970). Нужно искать новые средства консервации печени, позволяющие долгосрочное хранение заранее паспортизированных по лейкоцитарным антигенам органов. Ортотопическая трансплантация представляет наибольший интерес, поскольку она является истинной заменой больного органа на здоровый и, по всей вероятности, займет в будущем ведущее место. Основные принципы пересадки были вначале разработаны в эксперименте на собаках (Moore, Starzl), операцию проводили одновременно на доноре и реципиенте двумя бригадами хирургов. В экспериментах были изучены возможные осложнения во время пересадки и их предупреждение, в экспериментах для увеличения срока жизни гомотранс-плантата изучали и вопросы иммуно-депрессивной терапии. В результате было достигнуто приживление пересаженной печени от 50 до 324 дней (Starzl, 1964—1969; Micaeloff, 1965; Rassat, 1965; Haraano, 1972, и др.) (рис. 123). Принципы ортотопической пересадки печени были затем перенесены в клинику. Ортотопической пересадке печени подлежат больные с врожденной атрезией желчных путей, раком печени и распространенным раковым поражением наружных желчных про- 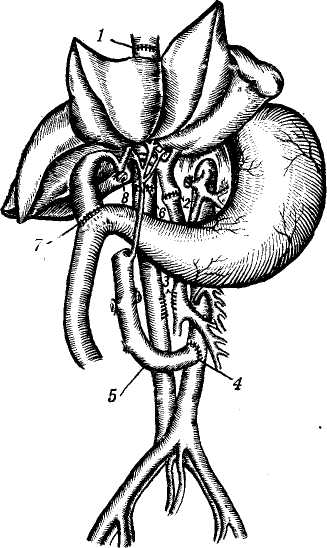 Рис. 123. Ортотопическая трансплантация печени (по Starzl). 1 — проксимальный анастомоз нижней попой вены; 2 — портальный анастомоз; 3— разъединенный порто-кавальный анастомоз; 4, — аортальный анастомоз; 5 -— аорта донора; 7— холецистодуо-деностомия; 8 — общий желчный проток (перевязан). токов, постгепатитным и алкогольным циррозом (Calne, 1969; Starzl, 1969; Williams, 1969, 1970; Fortrep, 1970, и др.). В большинстве клиник ортото-пическую пересадку печени выполняют по методике Starzl, которая считается в настоящее время универсальной (Jouson, 1970). Ортотопическая пересадка состоит из следующих этапов: подготовка реципиента, вскрытие брюшной полости, мобилизации печени и сосудов, создания сосудистых разгрузочных шунтов, удаление печени реципиента, собственно пересадка, создание оттока желчи, ушивание раны. Подготовка реципиента должна быть тщательной и увеличивающей резервные возможности организма, в расчете на то, что ему придется пе- ренести операцию, в некоторых случаях длящуюся до 12 часов. Для изучения особенностей кровоснабжения печени необходимо произвести селективную ангиографию (For-tner, 1970; Williams, 1970). Для наркоза следует подбирать вещества, разрушение которых происходит не в печени (закись азота, галламин и др.). Вскрытие брюшной полости производят либо при помощи разреза справа от средней линии, либо срединным торакоабдоминальным разрезом. Мобилизация печени и сосудов предусматривает гепатэктомию у реципиента и отличается от таковой у донора более тщательными и осторожными манипуляциями. К концу этого этапа печень остается связанной с организмом хозяина только выделенными нижней полой веной (выше и ниже печени), воротной веной, печеночной артерией и общим желчным протоком. Создание сосудистых разгрузочных шунтов, для чего накладывают портокавальный анастомоз по типу «бок в бок» на протяжении 1 см для разгрузки воротной системы и наружный шунт полиэтиленовым катетером, соединяющий наружную бедренную вену с внутренней яремной веной (верхняя полая вена), для разгрузки венозной системы нижней части тела. Шунты необходимо на период удаления печени реципиента для предотвращения отека кишечника и развития резких гемодинамичес-ких расстройств (Calne, 1969). Starzl (1969), напротив, не рекомендует наложение шунтов, считая, что последние приводят к излишней травматизации сосудов и увеличивают риск тромбообразования. Удаление печени реципиента выполняют после пересечения нижней полой вены (выше и ниже печени), воротной вены, печеночной артерии и общего желчного протока. Сосуды пересекают между зажимами и печень удаляют. К этому времени долж- на быть готова к пересадке печень донора. Пересадка печени заключается в помещении органа донора на место бывшей печени реципиента (рис. 124). Соединение сосудов начинают с анастомоза «конец в конец» нижней полой вены вначале выше печени, затем ниже. Анастомоз начинается с ушивания задней стенки просвета сосуда непрерывным краевым швом. Снимают зажимы с нижней полой вены и удаляют наружный шунт. Анастомозируя «конец в конец» печеночную артерию, затем воротную вену, полностью восстанавливают кровоток в пересаженной печени. Снимают порто-кавальный анастомоз, зашивают стенки вен. Восстановление желчетока осуществляют путем создания холецисто-еюноанастомоза, либо сшивают общий желчный проток по типу конец в конец двухрядным швом с введением через отдельный разрез Т-образного дренажа таким образом, чтобы одно колено его проходило через место анастомоза (рис. 124, 3). После этого сшивают связочный аппарат печени и ее тщательно фиксируют к задней брюшной стенке, боковой и т. д. Пересаженная печень должна быть расположена и фиксирована так, чтобы не были перекручены анастомозы и не было затруднения оттоку желчи. Ушивание брюшной стенки осуществляют путем послойных швов и дренирования поддиафрагмального пространства через отдельный разрез. Осложнения. Наиболее частыми осложнениями, приводящими больных к гибели, являются различные нарушения свертываемости крови и вторичная инфекция. Myrreg — Lyon (1970) ставит на первое место инфекцию и указывает на то, что, кроме флоры желудочно-кишечного тракта, ее источником являются имеющиеся у больного до пересадки инфекционные очаги. Активизация инфекции происходит в связи с применением им- 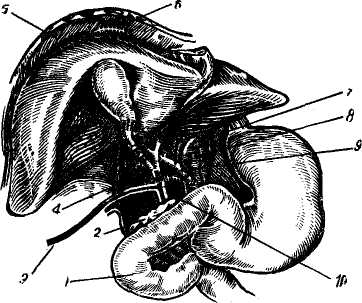 Рис. 124. Ортотопическая пересадка печени у человека (по Starzl). 1 — двенадцатиперстная кишка; 2 — поджелудочная железа; 3 — Т-образная трубка в общем желчном протоке; 4,6— нижняя полая вена; 5 — диафрагма; 7 — аорта; S— чревной ствол; 9 — печеночная артерия; 10 — воротная вена. мунодепрессоров. Среди возможных причин активизации инфекции некоторые авторы называют и реакцию отторжения, а также ишемические повреждения трансплантата. Williams (1970) отмечает, что наложение холецистохоледохоанасто-моза, при сохранении сфинктера Од-ди у реципиента, значительно уменьшает возможность развития восходящего холангита. Н. В. Коростовцева и А. И. Веденский (1966), анализируя данные литературы, пришли к выводу, что нарушение свертывающей системы крови наблюдается в виде фибриноли-за и гиперкоагуляции. По данным Mernshemer (1967), фибринолиз наблюдается несколько чаще, однако его можно купировать введением ЕАКК, фибриногена или переливанием свежей крови. Обычно фибринолиз является следствием удаления печени. Одной из причин, вызывающих развитие геморрагического диатеза, как полагают Abouna и соавторы (1971), может служить ишеми-ческое повреждение трансплантата. Проанализировав данные о состоянии свертывающей системы крови у 10 больных, проживших в клинике Starzl после пересадки печени свыше 1 месяца, Groth и соавторы (1969) выявили четкую зависимость функционального состояния этой системы от качества функционирования трансплантата. При плохой функции обнаружено снижение содержания II, V, IX и X факторов свертывания печеночного происхождения, содержание фибриногена также снижено, тогда как фактор VIII, не синтезируемый печенью, превышал норму. У этих больных нарастала тром-боцитопения, укорачивался период лизиса эуглобулина, и они погибли от профузных кровотечений. В это же время, у больных с удовлетворительной функцией трансплантата, после кратковременных нарушений система свертывания крови полностью нормализовалась к исходу 1-й недели после операции. Эти данные подтверждаются также исследованиями Tlute (1969) и Popov (1971). У больных, благополучно переживших ближайший послеоперационный период, то есть не погибших из-за каких-либо технических погрешностей или плохого качества трансплантата, примерно на 4—6-е сутки после операции начинают проявляться признаки отторжения трансплантата в виде кризов отторжения, острой или хронической формы реакции тканевой несовместимости. Располагающий наибольшим опытом и материалом по ортотопической пересадке печени в клинике Starzl (1969) подчеркивает, что признаки, характеризующие иммунологический конфликт в данном случае, чрезвычайно полиморфны. Наряду с этим, обращает на себя внимание тот факт, что при трансплантации печени остается совершенно неясным значение факторов совместимости, определяемых путем типирования лейкоцитарных антигенов, и влияния степени совместимости донора и реципиента на длительность существования трансплантата. Williams (1970) и Е. Ф. Чернушенко (1973) также приводят данные, подтверждающие это поло- жение. Porter (1969) описывает случай смерти больного на 10-й день после операции в результате острого отторжения трансплантированной печени, причем донор и реципиент отличались между собой по 2 главным антигенам Н-А2 и Н-А5. Starzl (1969) приводит данные, совпадающие с результатами экспериментальных исследований у собак и свиней, показывающих, что криз отторжения печени в клинике иногда проходит без всякого лечения, но у других больных требуется проведение интенсивной иммуноде-прессивной терапии, а 2 больным (на 68-й день и через год) потребовалась повторная гомотрансплантация печени, так как реакция отторжения не поддавалась коррекции. В этой же работе Starzl описал еще одно, весьма характерное для печени, проявление реакции отторжения — «септический инфаркт». Первым признаком этого осложнения, чаще всего поражающего левую долю печени, является лихорадка, затем в крови резко повышается уровень трансаминаз, а на скеннограммах выявляются большие зоны пустого пространства, вызванные набуханием и отеком трансплантата. Предрасполагающим фактором служит ротация печени при ее недостаточной фиксации. Больные, несмотря на предпринимаемые меры, погибают. Основными признаками начинающегося отторжения печени (7—8-й день) служит появление желтухи, повышение уровня сывороточных трансаминаз, билирубина, ано-рексия. Морфологически определя-ется центролобулярный холестаз, пятнистый некроз печеночных клеток, инфильтрация лимфоцитами и моноцитами (Andres, 1972). В отличие от проявленной реакции отторжения пересаженной почки, при которой прежде всего поражаются сосуды, реакция отторжения печени начинается с некроза пе-чепочпых клеток и инфильтрации паренхимы мононуклеарами (Andres, 1972). Применяемая в таких случаях терапия (АЛГ, преднизолон, азатио-пирин, имуран, метотрексат и др.) позволяет, как правило, купировать этот процесс. В более поздние сроки — через 2 месяца после пересадки — развиваются кризы отторжения или реакция переходит в хроническую стадию, характеризующуюся развитием соединительной ткани, портальным фиброзом, утолщением интимы вну-трипеченочных сосудов, холестазом и др. Применение вышеуказанных иммунодепрессивных препаратов позволяет купировать и значительно замедлить течение этого процесса, так что сама по себе реакция тканевой несовместимости крайне редко приводит больных к гибели (Calne, 1969; Chapuis, 1969; Porter, 1969; Williams, 1970; Tschong, 1970; Perm, 1970; Daloze, 1971, и др.). Высказано предположение, что со временем организм реципиента адаптируется к трансплантату печени, но механизм этой адаптации неизвестен (Otto, 1966). Необходимо отметить, что контролировать ход реакции отторжения пересаженной печени довольно сложно, так как желтуха, повышение билирубина, изменение активности ферментов и другие признаки могут наблюдаться и при патологических процессах в печени, не связанных с тканевой несовместимостью. В связи с этим заслуживает внимания предложение Eddeston и соавторов (1971) использовать для контроля тест миграции лейкоцитов in vitro. Авторы показали, что существует почти полная коррекция между миграцией лейкоцитов, активностью реакции отторжения и эффективностью иммунодепрессивной терапии. Авторы большинства работ отмечают, что у реципиентов, длительное время живущих после ортотопическоq трансплантации печени, ее функция, как правило, существенных изменений не претерпевает, хотя, по данным Starzl (1969), в поздние сроки после пересадки можно обнаружить изменения, характерные для цирроза. Как уже отмечалось, отторжение печени лишь в единичных случаях является причиной гибели реципиента. В основном, причиной гибели больных служит инфекция, проявления геморрагического диатеза и др. Так, Porter (1969), анализируя причины смерти 29 больных в клинике Starze за период с марта 1963 г. по май 1969 г., сообщает, что у 9 больных смерть наступила в первые 11 дней из-за различных технических осложнений, причем у 2 имели место массивные повреждения трансплантата из-за неадекватной перфузии, у 3 — окклюзия печеночной артерии, у остальных — тромбоз воротной вены и непроходимость желчных путей. У 9 больных наблюдали острую реакцию отторжения, от которой погиб 1 больной на 10-й день после операции. У остальных 8 — смерть наступила в сроки от 22 до 400 дней по разным причинам. Starzl (1969) отмечает, что во всех случаях, когда пересадку печени производили по поводу рака, наступал метастатический рецидив заболевания. В клинике Williams (Flut, 1969; Williams, 1969, 1970) умерло 7 из 17 больных в течение первых 6 дней, остальные жили в течение 10—11 месяцев. Таким образом, можно сказать, что ортотопическая гемотрансплан-тация печени имеет довольно большие перспективы, однако сама операция крайне сложна, ее исход зависит от очень многих причин, учесть которые сегодня удается далеко не всегда. Этим и объясняется большая смертность больных в ближайшем и раннем послеоперационном периоде. Гетеротопическая трансплантация печени показана только при доброкачественных поражениях печени типа цирроза. Сама операция менее сложна, чем ортотопическая пересадка, но, как оказалось, и менее перспективна.  Рис. 125. Схема гетеротопической трансплантации печени с подключением воротной вены в общий кровоток (по Fon Kalsrud): а — печеночная артерия донорской печени вшита в аорту; проксимальный отрезок нижней полой вены печени вшит в нижнюю полую вену реципиента; воротная вена реципиента вшита в нижнюю полую вену; б — воротная вена печени соединена с дистальным отрезком нижней полой вены; нижняя полая вена донора вшита в 'проксимальный отрезок нижней полой вены реципиента; в — печеночная артерия печени донора соединена с наружной подвздошной артерией, воротная вена донора соединена с нижней полой веной: 1 — порто-кавальный шунт, 2 — порто-кавальный анастомоз, 3 — наружная подвздошная артерия, 4 — печеночная артерия, 5 — холецистодуоденостомия, 6 — кава-кавальный анастомоз, 7 — нижняя полая вена, 8 — общий желчный проток. Трудности, которые встречаются при гетеротопической пересадке, заключаются в выборе места для трансплантата, поисках оптимального варианта его реваскуляризации, борьбе с тяжелым осложнением, получившим название «блок оттока» и др. Техника операции на реципиенте отличается от ортотопической пересадки тем, что нет необходимости в создании сосудистых шунтов, так как по ходу операции не производится перекрытия воротной вены. В настоящее время применяется 3 метода подсадки печени в зависимости от места имплантации: чаще всего на место селезенки или правой почки и в нижний этаж брюшной полости (Hagihara, Absolon, 1964). Техника подсадки печени была также предварительно отработана и изучена в эксперименте Parronetto и соавт., 1965; Leder и соавт., 1965, и др.). Срок жизни оперированных животных достигал 5—45 дней. На рис. 125, 126, 127 схематически показаны основные принципы гетеротопической подсадки печени. При имплантации на место селезенки воротную вену донорской печени соединяют с селезеночной веной реципиента, чревную артерию донора с участком аорты соединяют с общей подвздошной артерией. Над-печеночный конец нижней полой вены донора перевязывают, а нижний конец соединяют по типу «конец в бок» с нижней полой веной. При имплантации печени на место правой почки печеночную и почечные артерии соединяют по типу «конец в конец», воротную вену трансплантата соединяют с верхней брыжеечной веной по типу «конец в бок», нижнюю полую вену подключают как и в предыдущей операции. 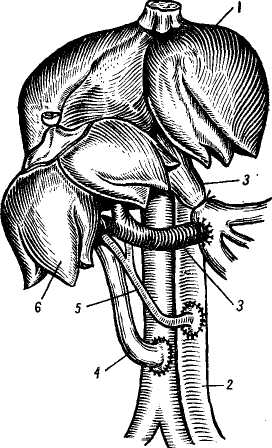 Рис. 126. Схема гетеротопической трансплантации печени (по Ю. М. Лопухину). 1 — печень реципиента; 2 — аорта; 3 — воротная вена; 4 — кава-кавальный анастомоз; 5 —анастомоз печеночной артерии с аортой; 6 — печень (трансплантат). 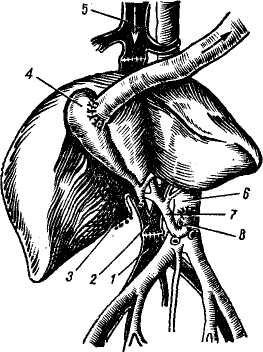 Рис. 127. Гетеротопическая трансплантация печени у человека. Схема подключения трансплантата в нижнем этаже брюшной полости (по И. Д. Кирпатовскому). 1, s— нижняя полая вена реципиента; 2 — воротная вена; 3 — нижняя полая вена донора: 4 — желчный пузырь; 6 — аорта; 7 — общая печеночная артерия; 8 — чревный ствол. При подсадке печени в нижний этаж брюшной полости чревную артерию трансплантата вшивают в бок брюшной аорты реципиента, нижнюю полую вену пересекают и дистальный ее конец соединяют с воротной веной, а проксимальный с надпеченочным концом нижней полой вены, проксимальный конец нижней полой вены трансплантата перевязывают. Желчеотток осуществляется во всех методах наложением холецисто-еюноанастомоза по Ру, а холедох трансплантата перевязывают. Уже через 2 недели пересаженная печень начинает сморщиваться (Ме-rusheimer, 1967) и процесс в дальнейшем прогрессирует. По данным Calue (1969) и Starzl (1969), длительность выживания после гетеротопической подсадки составляет от 3 недель до 34 дней. У большинства смерть наступила от серьезных легочных осложнений, связанных с введением в брюшную полость добавочного органа. Williams (1970), оценивая перспективы гетеротопической печени, пришел к выводу о полной бесперспективности этого метода. Возможно, что такое мнение слишком категорично, но не лишено смысла. Оценивая трансплантацию печени в целом, можно сказать, что высокая летальность у больных после пересадки связана, в первую очередь, с несовершенством техники трансплантации, так как смерть обычно наступает в первые дни, когда еще не успели развиться тяжелые осложнения, связанные с реакцией тканевой несовместимости. Это свидетельствует о еще незаконченном процессе экспериментального изучения трансплантации. Однако допустима трансплантация и в клинике, так как больные, подвергающиеся этой операции, обречены на гибель, но производиться вмешательства должны у строго ограниченного контингента больных. Глава одиннадцатая О  СОБЕННОСТИ ПРЕДОПЕРАЦИОННОЙ ПОДГОТОВКИ, СОБЕННОСТИ ПРЕДОПЕРАЦИОННОЙ ПОДГОТОВКИ,МЕТОДИКИ ОБЕЗБОЛИВАНИЯ И ПОСЛЕОПЕРАЦИОННОГО ВЕДЕНИЯ БОЛЬНЫХ С ХИРУРГИЧЕСКОЙ ПАТОЛОГИЕЙ ПЕЧЕНИ И ЖЕЛЧНЫХ ПРОТОКОВ НЕКОТОРЫЕ ОСОБЕННОСТИ ПРЕДОПЕРАЦИОННОЙ ПОДГОТОВКИ Подготовка больных с заболеваниями печени и желчевыводящих путей к операции включает комплекс лечебных и профилактических мероприятий, направленных на нормализацию функции печени, метаболизма, энергетического баланса организма, гемодинамики, снижение интоксикации. Важное место занимает полупостельный, постельный режим и диета, богатая белками и углеводами и бедная жирами. Желательно придерживаться суточной диеты Н. И. Лепорского (1951), которая содержит 3000—4000 калорий, а по составу: 20% белков, 74% углеводов и до 6% жиров. Hevllin (1957) считает, что этим больным необходимо ежедневно вводить перорально или внутривенно не менее 50 г глюкозы; Cattell (1959) — 100 г с соответствующим количеством инсулина. Нарушение энергетического обмена при заболеваниях гепатобили-арной системы до операции, повышенный расход энергии в послеоперационном периоде требует восстановления энергетического баланса. Восстановление запасов гликогена в печени повышает ее резистент-ность к гипоксии, ацидозу, травме, способствует восстановлению обезвреживающей функции. Вследствие интоксикации, нередко плохой проходимости двена- дцатиперстной кишки (особенно при рвоте), значительно нарушается водно-солевой баланс. Это требует устранения часто встречающейся общей клеточно-внеклеточной дегидратации, сопровождающейся одновременной потерей воды и электролитов, особенно К+ и Na+. Для этого мы вводили 5% раствор глюкозы до устранения жажды и олигурии. По нашим данным, инсулин следует вводить с глюкозой лишь при скрытом диабете и отклонении от нормы кривой с сахарной нагрузкой. В остальных случаях инсулин вызывает стимуляцию секреторной деятельности поджелудочной железы, что при закрытых протоках приводит к набуханию ее и усилению боли. При нормализации выведения натрия и хлора с мочой приступали к сочетанному введению изотонических растворов глюкозы и поваренной соли, постепенно повышая дозу последнего и компенсируя недостаток электролитов (подробная схема приводится при описании послеоперационного периода). При раке поджелудочной железы и большого соска у большинства больных наблюдается резкое истощение, гипопротеинемия, уменьшение уровня хлоридов. Поэтому показано введение плазмы, альбумина, белковых гидролизатов, жидкости в виде физиологического раствора и 10% раствора глюкозы. Кровь перед операцией мы вводили лишь по абсолютным показаниям при кро-вопотере или выраженной анемии. Переливание крови при гепатите и жировом перерождении печени может неблагоприятно отразиться на функции печени. При непоступлении в кишечник желчи, превращающей нерастворимые соединения витаминов в растворимые, у больных развивается гипо-и даже авитаминоз, для устранения которых необходимо вводить: витамин А в виде каротина (по 1 мл 10—-15 инъекций), витамин В1 (0,5— 5% растворы по 1 мл 10—15 инъекций), витамин С в виде аскорбиновой кислоты (5% раствор по 1 мл 10—15 инъекций), витамин Д внутрь в виде витаминола, витамин В6 (1—5% раствор внутримышечно по 1 мл 1—2 раза в течение 10—30 дней), витамин В12 0,003—0,05% растворы внутримышечно 1 мл (30—500 мкг) 1 раз в день в течение 3—5 дней, витамин В15 50—100 мг. Для улучшения метаболической функции печени применяют липотропные вещества, кам-полон. При длительной желтухе, когда наступают тяжелые дегенеративные изменения в печени и жировое ее перерождение, исключительно большую роль в предоперационной подготовке играют метионин, холйн-хлорид, липокаин и камполон. Метионин относится к аминокислотам, способствует синтезу хо-лина и удалению из печени избытка жира, активирует действие витаминов, гормонов, ферментов; обезвреживает различные токсические вещества и этим значительно улучшает антитоксическую функцию печени. Метионин применяют внутрь по 0,5—1,5 г 3—4 раза в день за 1,5 часа до еды в течение 10—30 дней. Холин-хлорид служит источником метильных групп, необходимых для биохимических процессов в организме, обладает липотропным действием, уменьшая жировую инфильтрацию печени, стимулирует мускулатуру кишечника. Применяют внутрь 20% раствор холин-хлорида по 5 мл 3—5 раз в день, а также внутривенно в виде 1% раствора на физиологическом растворе или 5% растворе глюкозы, который вводят медленно по 30—40 капель в 1 минуту, в количестве 200—300 мл (2—3 г холин-хлорида). Холин-хлорид назначают сроком от 7 до 30 дней. Липокаин оказывает влияние на фосфолипиды и выход их из печени в кровь, чем предупреждает и уменьшает жировую инфильтрацию печени, стимулирует действие липотроп-ных веществ — метионина и холина (холин-хлорида). Особенно благотворное действие липокаин оказывает при сахарном диабете, сопровождающем механическую желтуху. Применяют внутрь по 0,1—0,2 г (1—2 таблетки) 2—3 раза в день в течение 10—20 дней. Камполон представляет собой концентрированный водный экстракт печени. Действующим началом его является витамин В12 и другие вещества печеночной ткани, которые, участвуя в обмене веществ, в частности в синтезе лабильных метильных Групп и образования холина, метионина, креатина, нуклеиновых кислот, способствуют превращению токсических продуктов в нетоксические, чем улучшают обезвреживающую функцию печени при дегенеративном состоянии ее клеток. Применяют камполон в виде раствора внутримышечно по 2—4 мл ежедневно в течение 5—20 дней. Хороший эффект дает внутривенное введение очищенного гидролизата экстракта печени с цианокобалами-ном—сирепара. Для улучшения антитоксической функции печени назначают аминокислоты: глютаминовую, аргини-новую, цистеиновую, гистидиновую. Особенно большое распространение получила а-глютаминовая кислота, которая способствует обезвреживанию аммиака. Из аммиака и глютами-новой кислоты образуется безвредный для организма глютамин, усиливающий к тому же выделение аммиака через почки в виде аммонийных солей. Глютаминовая кислота участвует в белковом и углеводном обмене, стимулируя окислительные процессы, способствует синтезу аце-тилхолина, аденозинтрифосфорной кислоты и переносу ионов калия. Назначают глютаминовую кислоту как внутрь по 1 г 2—3 раза в день, так и внутривенно в виде 1% раствора по 10—20 мл, а больным в тяжелом состоянии — до 90—60 мл. При тяжелых заболеваниях печени и почек глюта-мииовая кислота противопоказана. При значительных дегенеративных изменениях и жировой инфильтрации печени, сопровождающихся резким снижением антитоксической функции, лучше вводить одновременно метионин, холин-хлорид, ли-покаин и камполон. Можно назначать творог (200 г в день) или овсяную кашу (продукты обладающие ли-потропным свойством). Большое значение при механической желтухе имеет нормализация содержания протромбина в крови. Как известно, он вырабатывается печенью при участии витамина К. В желудочно-кишечном тракте под действием желчи витамин К из нерастворимого соединения переходит в растворимое, усваиваемое кишечником. Если желчные кислоты в кишечник не поступают, то витамин К не всасывается. Сопутствующий холеста-зу гепатит и жировое перерождение печени приводят к тому, что даже незначительная всасываемая часть витамина К не может принять участие в выработке печенью протромбина. Низкие показатели протромбино-вого индекса были у некоторых наших больных, но тщательная предоперационная подготовка привела к повышению содержания протромбина, холемического кровотечения в послеоперационном периоде не наблюдалось. Больным необходимо вводить внутримышечно викасол (1 % раствор по 1 мл 2 раза в день), метионин (0,5— 1,5 г 3—4 раза в день). Для улучшения обезвреживающей функции печени и остановки холемического кровотечения применяют также спленин — препарат, полученный из селезенки крупного рогатого скота. Он улучшает функцию печени при токсическом ее поражении, циррозе, а также раке поджелудочной железы. Спленин назначают в виде внутримышечных инъекций по 1—2 мл 1—2 раза в день в течение 10—12 дней. Так как больные этой группы, особенно с печеночной недостаточностью предрасположены к синдрому истощения надпочечников, желательно назначать стероидные гормоны (кортизон, гидрокортизон, пред-низон, преднизолон и др.). При отсутствии явных признаков надпо-чечниковой недостаточности и солевого дисбаланса, гормональную подготовку необходимо назначать за 24—32 часа до операции. Суточная доза кортизона 100—200 мг. За 24 часа до операции эту дозу можно повторить. Дисбаланс электролитов корригируется введением хлористого натрия и калия внутрь или парентерально. При нарушенной функции надпочечников кортизонотерапию назначают за 5—7 дней до операции. При этом необходимым условием является нормальная функция почек. Перечисленный выше комплекс основных лечебных мероприятий у больных с заболеванием печени и желчных протоков, естественно, не может предусмотреть все, тем не менее он должен быть максимально насыщен и кратковременен, ибо основной задачей все же является быстрейшее устранение патологии хирургическими методами. ОБЕЗБОЛИВАНИЕ Анестезиологическое пособие при хирургическом лечении заболеваний печени и желчевыводящих путей должно основываться на использовании медикаментозных средств, не обладающих гепатотоксическим действием и не нарушающих обменные процессы в организме, которые регулируются печенью. Профилактическая премедикация не должна включать препаратов фе-нотиазинового ряда (аминазин и др.), производных барбитуровой кислоты и морфия. По мнению Teller (19(58), Т. М. Дарбипяна (1969), идеальным средством для этой цели является таламонал, ибо он практически безвреден и быстро выводится из организма. Применяемая в нашей клинике премедикация осуществляется введением 1—2 мл таламонала, 0,4— 0,8 мг атропина и 50 мг кокарбокси-лазы на фоне предварительной подготовки малыми транквилизаторами (триоксазин, мепробамат) 0,2—0,4 мг на 60 кг веса больного (А. А. Шалимов, А. М. Пикенин, 1969). Накануне операции можно назначить транквилизаторы в той же дозировке, анальгетики и нейролептики. При отсутствии вышеуказанных препаратов возможна и такая премедикация: накануне операции — по 20 мг димедрола и промедола; утром за 30—60 минут до операции — 20 мг промедола и 0,5—0,8 мг атропина подкожно. Введение атропина обязательно. Современный поверхностный наркоз в сочетании с тотальной кура-ризацией, искусственной вентиляцией легких вносит в обычное течение физиологических процессов легко обратимые изменения. Кроме того, он позволяет применять широкий комплекс воздействий, направленных на нормализацию функций важнейших органов и систем больного. Снижение дезинтоксикационной функции печени при механической желтухе и других поражениях существенным образом изменяет действие большинства препаратов, применяемых во время наркоза и послеоперационном периоде; барбитура- тов, мышечных релаксантов, атропина, морфия, газообразных анестетиков, симпатомиметиков, антибиотиков и других веществ. Их действие удлиняется, а снижение их выведения из организма увеличивает суммарную токсичность. Особую осторожность при выборе анестетиков следует соблюдать у больных, предрасположенных к развитию печепочно-почечной недосточности. Они должны отвечать следующим требованиям: не иметь гепатотоксического действия, обеспечивать надежную блокаду нейро-вегетативных реакций и вызывать минимальные изменения центральной и гепато-портальной гемодинамики. Эти требования могут быть выполнены только в условиях многокомпонентного обезболивания. |
