Клиническая химия в диагностике и лечении. Обмен натрия и воды обмен калия лечение диуретиками гомеостаз ионов водорода
 Скачать 3.99 Mb. Скачать 3.99 Mb.
|
ОБМЕН УГЛЕВОДОВ И ЕГО ВЗАИМОСВЯЗИДля большинства регионов мира углеводы составляют главный источник энергии в потребляемых продуктах питания. При обычных обстоятельствах крахмал — преобладающий углевод пищи, доля дисахаридов значительна, моносахаридов — небольшая. ХИМИЯ Наиболее физиологически важные моносахариды гексозы представляют собой редуцирующие сахара и поэтому реагируют с таблетками «Клинитест», содержащими соединение меди, изменяющее окраску при восстановлении. К числу гексоз относятся глюкоза, фруктоза, галактоза. Распространенными дисахаридами являются сахароза (фруктоза+глюкоза), лактоза (галактоза + глюкоза), мальтоза (глюкоза + глюкоза). Лактоза и мальтоза (но не сахароза) — редуцирующие сахара. К природным полисахаридам, молекулы которых состоят из длиннь1х углеводородных цепей, построенных из остатков глюкозы, относятся: 1) крахмал, содержащийся в растениях и представляющий собой смесь амилозы (нитевидные цепи) и амилопектина (разветвленные цепи); и 2) гликоген, встречающийся в тканях животных и представляющий собой полисахарид с сильно разветвленными углеводородными цепями в молекуле. ФИЗИОЛОГИЯ Значение внеклеточного уровня глюкозы При гипогликемии в наибольшей степени повреждаются клетки головного мозга. Они получают энергию в результате аэробного метаболизма глюкозы и не способны: 1) накапливать глюкозу в значительных количествах; 2) синтезировать глюкозу; 3) метаболизировать другие субстраты, кроме глюкозы и кетопов. Обычно последние удовлетворяют энергетические потребности головного мозга в незначительной степени, поскольку в норме содержание кетонов в плазме крови очень низкое; 4) извлекать в достаточных для их нужд количествах глюкозу из внеклеточной жидкости, где она содержится в низкой концентрации; инсулин не способствует поступлению глюкозы из внеклеточной жидкости в клетки головного мозга. Ясно, таким образом, что головной мозг во многом зависит от внеклеточной концентрации глюкозы как источника энергии, и что при гипогликемии высока вероятность нарушения функций мозга. Гипергликемия, особенно быстро развивающаяся, также может вызывать дисфункцию мозга, воздействуя на внеклеточную осмоляльность. У здорового человека концентрация глюкозы в плазме крови (внеклеточная) обычно остается в пределах от 4,5 до 11 ммоль/л, несмотря на периодические нагрузки глюкозой, поступающей в организм из желудочнокишечного тракта. Поддержание концентрации глюкозы в плазме крови на уровне, не превышающем приблизительно 11 ммоль/л, сводит к минимуму возможность выведения этого источника энергии из организма. В почечных канальцах реабсорбируется почти вся глюкоза из клубочкового фильтрата до достижения указанной концентрации (почечный порог), так что в норме моча почти не содержит глюкозы, даже после приема пищи, богатой углеводами. Задерживаемая организмом глюкозы может сохраняться в виде резерва до возникновения потребности в ней. Поддержание постоянства внеклеточной концентрации глюкозы Концентрация глюкозы в плазме зависит от равновесия между поступлением глюкозы во внеклеточную жидкость и выходом из нее. Поскольку в норме лишь небольшая доля глюкозы выводится из организма в неизмененном виде, сохранение постоянства концентрации в плазме в относительно узком диапазоне от 4,5 до 11 ммоль /л при значительных вариациях поступления из желудочнокишечного тракта по всей вероятности определяется процессами обмена с клетками. Если мы сумеем понять механизмы взаимодействия между тканями, лежащие в основе регуляции этих процессов, мы сможем также объяснить нарушения метаболизма углеводов при патологических состояниях (в том числе при накоплении избытка кетоновых тел и молочнокислом ацидозе) . Печень — наиболее важный непарный орган, обеспечивающий непрерывное снабжение энергией другие ткани, в том числе головной мозг, при самых разнообразных условиях. Она играет также важную роль в регуляции содержания глюкозы в плазме после приема пищи. По многим причинам печень хорошо приспособлена для осуществления этих функций. Кровь воротной вены, оттекающая от стенки кишечника, где происходят процессы всасывания, поступает прежде всего в печень. Клетки печени играют ключевую роль при осуществлении буферных эффектов в отношении гипергликемии после приема богатой углеводами пищи (рис. 25). Клетка печени обладает свойством осуществлять биосинтез гликогена в условиях временного избытка глюкозы. Скорость синтеза гликогена (гликогенез) из глюкозо6фосфата (Г6Ф) может быть повышена под влиянием инсулина (см. рис. 25), который секретируют [3клетки поджелудочной железы в ответ на повышение содержания глюкозы в кровяном русле. В условиях временного избытка глюкозы печень способна частично превращать ее в жирные кислоты, которые в конечном счете образуют тканевые резервы в виде триглицеридов жировой клетчатки (см. рис. 25). 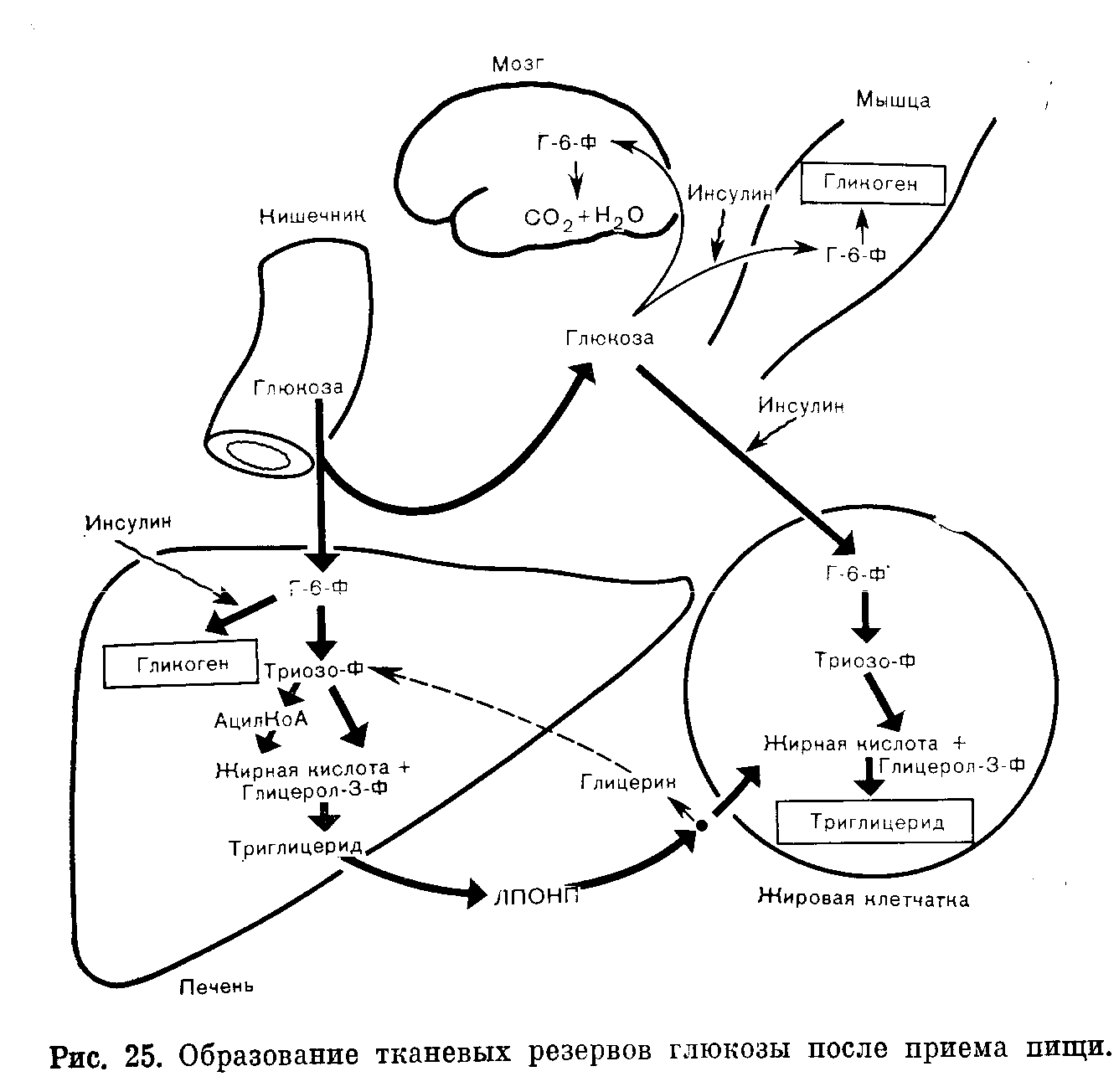 Поступление глюкозы в клетки печени (и головного мозга) зависит от внеклеточной концентрации глюкозы. Инсулин не оказывает непосредственного воздействия на этот процесс. Превращение глюкозы в Г6Ф (первый этап метаболизма глюкозы во всех клетках) в печени катализирует фермент глюкокиназа, имеющий низкое сродство к глюкозе по сравнению с гексокиназой, обнаруживаемой в большинстве тканей. Активность глюкокиназы индуцирует инсулин, секретируемый в ответ на повышение концентрации глюкозы в циркулирующей крови. По этим причинам в клетки печени поступает пропорционально меньше глюкозы во время голодания, когда уровни глюкозы в крови воротной вены низкие, чем после приема пищи, богатой углеводами. Указанные факторы способствуют в условиях голодания поддержанию постоянства уровня поступления глюкозы в такие легко ранимые объекты как ткани головного мозга. При аэробных условиях в печени возможен синтез глюкозы путем глюконеогенеза с использованием продуцируемых в других тканях глицерина, лактата или углеводородных цепей, образующихся при дезаминировании большинства аминокислот (главным образом, аланина). В печени имеется фермент (глюкозо6фосфатаза), который, катализируя гидролиз Г6Ф, продуцируемого при расходе гликогена (гликогенолиз) или при глюконеогенезе, способствует высвобождению глюкозы и поддержанию постоянства ее внеклеточной концентрации в условиях голодания. Гликогенолиз в печени стимулируется гормоном глюкагоном, который секретируют аклетки поджелудочной железы. Во время голодания в печени возможно превращение высвобождаемых из жировой клетчатки жирных кислот в кетоновые тела, которые могут быть использованы другими тканямп (в том числе и головного мозга) в качестве источника энергии в условиях ограниченного поступления глюкозы. Это сочетание свойств уникально для печени. Единственной другой тканью, в которой возможен глюконеогенез и превращение Г6Ф в глюкозу, является корковый слой почек. Способность почек к глюконеогенезу, по-видимому, важна преимущественно в связи с гомеостазом ионов водорода. Другие ткани в большей или меньшей степени могут накапливать гликоген, но они не содержат глюкозо6фосфатазу и способны использовать гликоген лишь локально; в поддержании постоянства уровня глюкозы в плазме крови этот гликоген никакой роли не играет. Как мы уже видели, печень изменяет потенциальный гыпергликемический эффект богатой углеводами пищи, извлекая из притекающей крови воротной вены относительно больше глюкозы, чем в условиях голодания. Однако некоторая доля глюкозы проходит неизмененной через печень, и повышение концентрации глюкозы в циркулирующей крови стимулирует секрецию (3клетками поджелудочной железы инсулина, который затем может стимулировать гликогенез в печени и мышцах. Еще более важно то обстоятельство, что поступление глюкозы в жировую клетчатку и в клетки мышц (в противоположность ее поступлению в печень и головной мозг) стимулируется инсулином, и содержание глюкозы в плазме быстро снижается до величин, близких к наблюдаемым в условиях голодания. Эти явления не происходят при относительной или абсолютной недостаточности инсулина (сахарный диабет). Превращение внутриклеточной глюкозы в Г6Ф в клетках жировой ткани или мышц катализирует фермент гексокиназа, который, имея более высокое сродство к глюкозе, чем глюкокиназа печени, обеспечивает в указанных клетках участие в реакциях обмена веществ глюкозы при более низких концентрациях, чем в печени. За счет возникающего после приема пищи избытка глюкозы как в мышцах, так и жировой клетчатке создаются тканевые резервы углеводов, но механизм образования этих резервов и их функции в двух указанных типах клеток совершенно различны. Многие нарушения метаболизма углеводов можно объяснить на основе изучения взаимозависимости реакций обмена углеводов в каждой из этих двух тканей и печени. Кетоацидоз Жировая клетчатка и печень Наиболее важным долгосрочным резервом энергии в организме являются триглицериды жировой клетчатки. Резко повышенное использование этих запасов жира сопровождается накоплением кетоновых тел (кетоацидоз). Жировая клетчатка, взаимодействуя с печенью, превращает избыток глюкозы в триглицериды, создавая тканевые энергетические резервы преимущественно в виде триглицеридов, а не гликогена. Входящие в состав триглицеридов жирные кислоты образуются из глюкозы, поступающей в печень, а глицериновый компонент триглицеридов — из глюкозы, поступающей в клетки жировой ткани. В печени при синтезе триглицеридов глицерол3фосфат образуется из триозофосфата, а жирные кислоты — из ацетилКоА. Эти триглицериды транспортируются в составе ЛПОНП в жировую клетчатку, где они подвергаются гидролизу, катализируемому липопротеидлипазой. Высвобождаемые жирные кислоты (печеночного происхождения) конденсируются с глиперол3фосфатом, образующимся из глюкозы, которая поступает в жировую клетчатку под влиянием инсулина, и накапливающиеся триглицериды составляют тканевой резерв. В виде триглицеридов в резервной форме можно хранить значительно больше энергии, чем в виде гликогена. В условиях голодания, когда экзогенная глюкоза отсутствует, эндогенные триглицериды жировой клетчатки претерпевают обратное превращение путем липолиза в свободные жирные кислоты (СЖК) и глицерин (рис. 26). Эти соединения транспортируются в печень, где глицерин включается в реакции глюконеогенеза на стадии образования триозофосфатов. Синтезируемая при этом глюкоза может поступать в кровоток в то время, когда концентрация глюкозы в плазме имела бы тенденцию к снижению, если бы процесс глюкоцеогеыеза не функционировал. Большинство тканей, за исключением головного мозга, используют СЖК в качестве источника энергии после превращения в ацетилКоА. Кроме того, в печени возможно также образование ацетоуксусной кислоты путем ферментативного превращения двух молей ацетилКоА. Ацетоуксусная кислота может быть восстановлена до роксимасляной кислоты или декарбоксилирована с образованием ацетона. Эти кетоновые тела могут быть использованы в качестве источника энергии головным мозгом и другими тканями в периоды относительной недостаточности поступления глюкозы. Кетоацидоз, таким образом, развивается, когда главным источником энергии являются тканевые резервы жиров. Кетоны могут накапливаться л условиях голодания ялц при рвотах (i> результате снижения всасывания компонентов пищевых продуктов из желудочнокишечного тракта). Умеренный кетоацидоз может развиться после голодания в течение всего 12 ч (это явление не следует ошибочно интерпретировать как диабетический кетоацидоз). После кратковременных периодов голодания признаки ацидоза обычно обнаружить не удается. Но после более длительных периодов продуцирование ионов водорода превышает компенсаторные возможности гомеостатических механизмов, и концентрация биокарбонатов в плазме снижается. В течение многих недель постоянство концентрации глюкозы в плазме поддерживается компенсаторными механизмами печени, но при длительном голодании (как, например, при нейрогенной анорексии) или в раннем детстве может развиться гипогликемия, сопровождающаяся кетоацидозом. Головной мозг может в меньшей степени пострадать при гипогликемии, сопровождающейся кетоацидозом, чем при той же степени гипогликемии, обусловленной действием инсулина. В первом случае ткань мозга адаптируется к метаболизированию кетоновых тел, тогда как во втором случае при низком содержании кетонов, мозг оказывается лишенным единственного (за исключением глюкозы) источника энергии. Диабетический кетоацидоз — более тяжелое патологическое состояние. Наличие гипергликемии отличает его от кетоацпдоза при голодании, но механизм увеличения содержания кетонов при обоих состояниях идентичен. При кетоацидозе в условиях голодания количество поступающей глюкозы в клетки жировой ткани недостаточно для обеспечения соответствующих норме уровней гликолиза и липогенеза. При недостаточности инсулина дефицит глюкозы внутри клеток обусловлен нарушением поступления в них глюкозы, внеклеточная концентрация которой высока (но не может рассматриваться как показатель высокого внутриклеточного уровня глюкозы). Явление кетоацидоза указывает на то, что липолиз осуществляется на преобладающем пути метаболизма. После приема пищи глюкоза поступает в мышцы под влиянием инсулина и откладывается в виде гликогена как тканевой резерв. Поскольку глюкозо6фосфатаза отсутствует, этот гликоген не может быть превращен в глюкозу и пригоден лишь для использования в самих мышцах. Количественно тканевые резерBbi гликогена скелетных мышц уступают только таковым печени. Мышечное сокращение (рис. 27). При функционировании мышц адреналин стимулирует гликогенолиз. Образующийся при этом Г-6-Ф быстро утилизируется в процессе гликолиза и нри окислении в цикле трикарбоновых кислот, поставляя необходимую энергию. В этих условиях высокая скорость гликолиза может не соответствовать поступлению кислорода п продукты гликолиза могут накапливаться быстрее, чем осуществляется их непосредственное окисление при аэробных условиях. Суммарное уравнение реакции анаэробного гликолиза: Глюкоза—>2 Лактат--+2Н+ Током крови лактат переносится в печень, где он может быть использован в процессах глюконеогенеза, поставляющих дополни тельные количества глюкозы для функционирования мышц (цикл Кори). 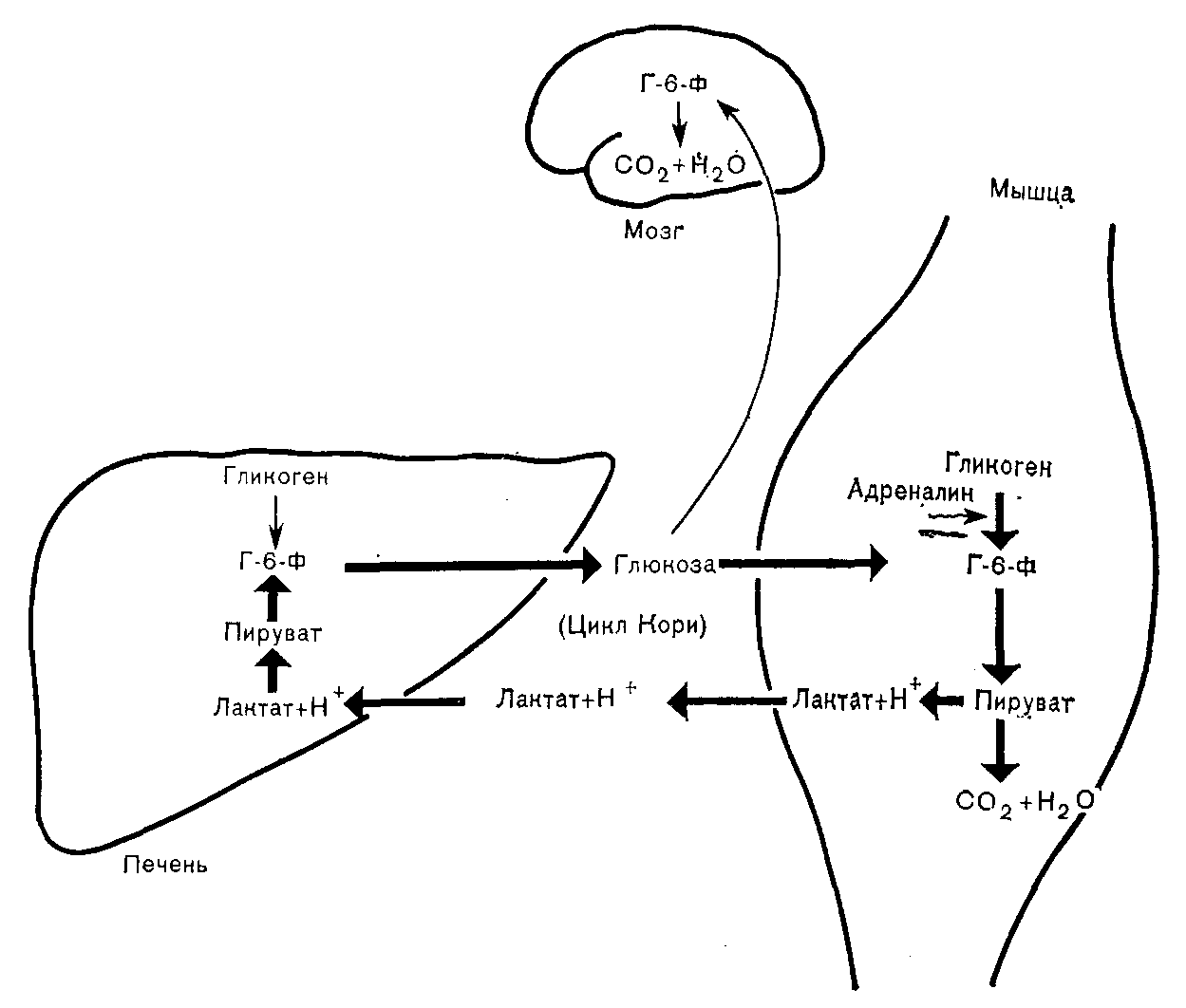 Рис. 27. Метаболизм углеводов при мышечном сокращении. В процессе глюконеогенеза Н4" также подвергается повторной утилизации. При аэробных условиях потребление печенью лактата значительно превышает его продукцию. Такое физиологическое накопление молочной кислоты во время мышечного сокращения представляет собой обратимое явление. Молочная кислота быстро исчезает в состоянии покоя, когда снижение скорости глпколиза дает возможность аэробным процессам нормализоваться. Патологический лактатацидоз Молочная кислдта, образующаяся при анаэробном гликолнзе. может быть окислена до СОг и воды в ЦТК или превращена обратно в глюкозу путем глюконеогенеза в печени. Как ЦТК, так п глюкопсогсасз требуют наличия кпслорода. Единственным мс таболическим процессом, не требующим кислорода, является анаэробный гликолиз. Патологическое накопление лактата может быть обусловлено повышенной его продукцией пли сниженной утилизацией. Продукция может быть повышена при нарастании скорости анаэробного гликолиза. Утилизация может быть снижена при нарушении функционирования ЦТК или глюконеогенеза. Клинические синдромы, связанные с лактатацидозом, обычно вовлекают несколько этих факторов. Тканевая гипоксия, обусловленная плохим кровоснабжением тканей в условиях синдрома шока, — наиболее обычная и важнейшая причина лактатацидоза (рис. 28). В этих условиях тканевая гипоксия повышает содержание лактата в плазме потому, что: 1) ЦТК не функционирует в анаэробных условиях и окисление пирувата, а также лактата до СОз и воды нарушено; 2) глюконеогенез из лактата в печени и почках не может происходить в анаэробных условиях; 3) анаэробный гликолиз стимулирован, поскольку пониженный уровень АТФ не может быть нормализован за счет ЦТК, как это происходит при аэробных условиях. Сочетание нарушенного глюконеогепеза и стимулированного анаэробного гликолиза лишает печень особенностей органа, потребляющего лактат и Н"1', придавая ей свойства органа, генерирующего большие количества молочной кислоты. При тяжелой гипоксии (как, например, после остановки сердца) отмечают очень тяжелый ацидоз. При истощении объема жидкости в организме этот гипоксический синдром может также осложнять диабетический кетоацидоз. Ниже указаны некоторые другие причины лактатацидоза. Во всех случаях отмечают нарушение соответствия между образованием и утилизацией пирувата. Метформин или фенформин, лекарственные средства, применяемые для лечения диабета, могут вызвать тяжелый лактатацидоз. Они ингибируют как ЦТК, так и глюконеогенез. В настоящее время эти препараты используют редко из-за опасности раз вития лактатацидоза; применение фенформина в некоторых странах запрещено. 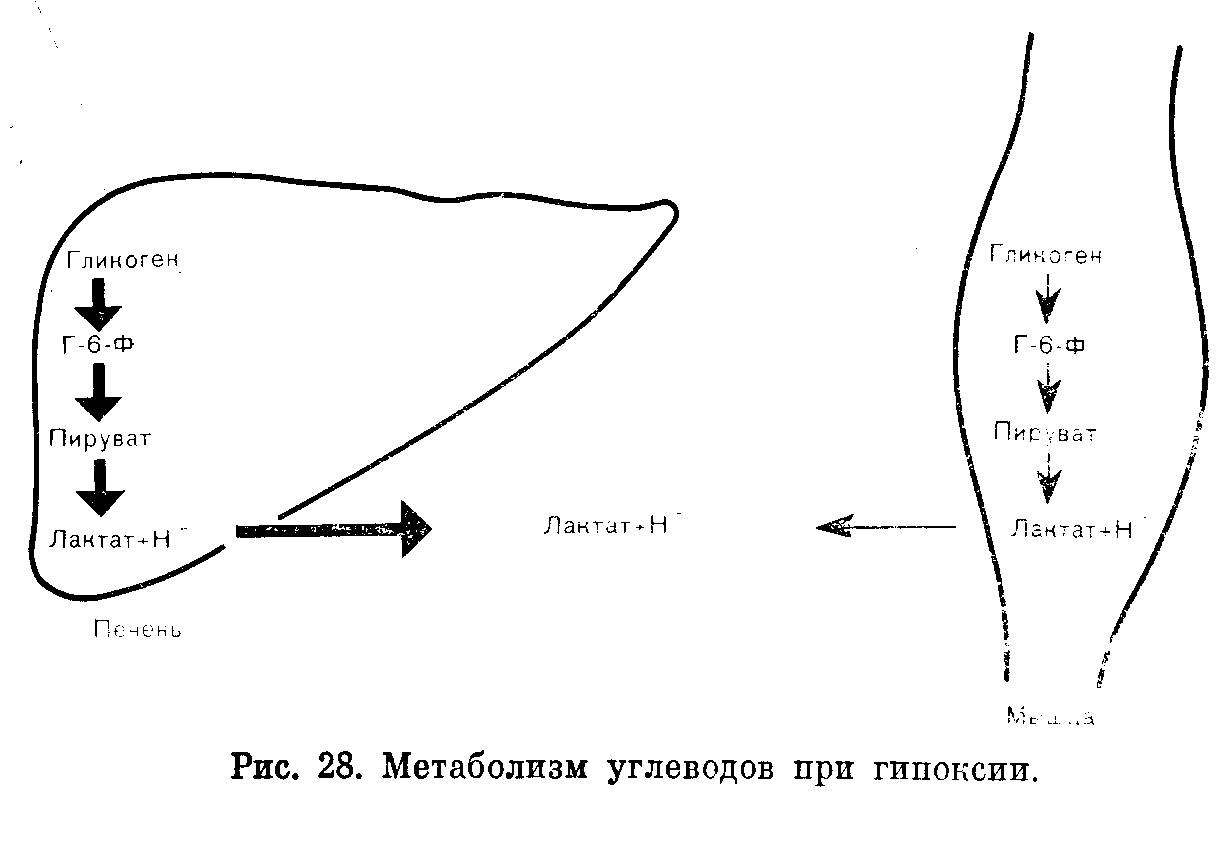 Тяжелые заболевания (как, например, лейкозы) могут сопровождаться лактатацидозом. В развитии такого ацидоза могут участвовать различные факторы, в частности, плохое кровоснабжение тканей и стимуляция анаэробного гликолиза в тканях злокачественных новообразований. Внутривенное вливание фруктозы может вызвать лактат ацидоз. В отличие от глюкозы фруктоза, когда ее концентрация в плазме низкая, поступает в клетки печени, где превращается в глюкозу. Скорость анаэробного гликолпза может превзойти потенциальную мощность ЦТК в печени даже в условиях слабой гипоксии. По этой причине в настоящее время фруктозу редко используют в качестве источника энергии при парентеральном питании. При недостаточности глюкозо6фосфатазы (болезнь Гирке) скорость гликолиза возрастает, если Г6Ф не может быть превращен в глюкозу в печени п почках. Лечение лактатацидоза направлено па устранение pro причины и на ацидоз как таковой. Определения уровней лактата в крови редко бывают необходимыми, поскольку опасным является именно ацидоз; лактат сам по себе безвреден. Гормоны, участвующие в гомеостазе глюкозы Некоторые важные эффекты этих гормонов уже были описаны. Обобщающие сведения об пх действии представлены в табл. 17. 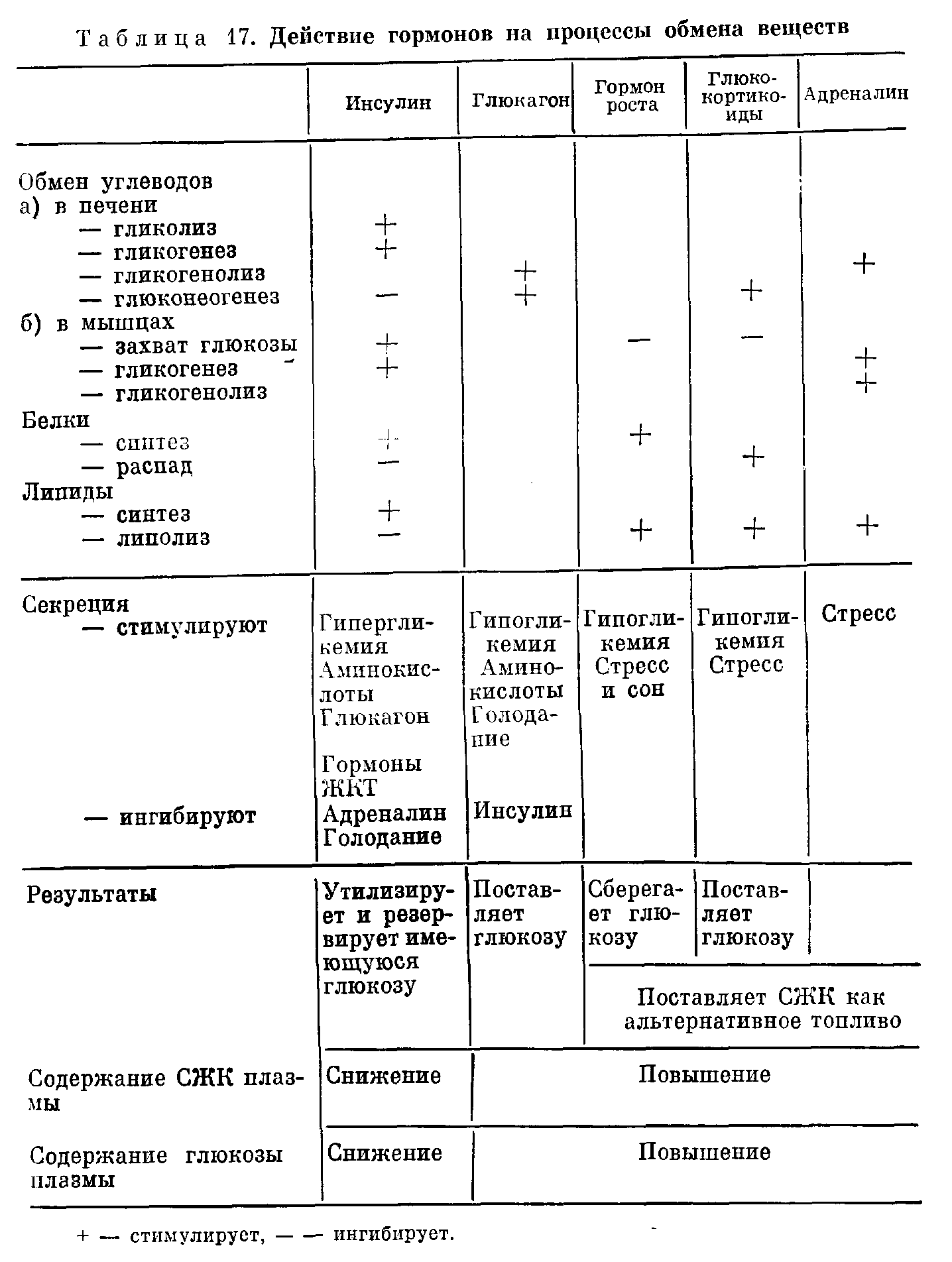 |
