патфиз шпоры экзамен. Ответы к экзамену по патологической физиологии doc
 Скачать 2.43 Mb. Скачать 2.43 Mb.
|
|
80.Значение наследственности, возраста, пола, особенностей питания, вредных привычек в возникновении и развитии опухолей. 1. Возраст: чем старше организм, тем более вероятность развития опухоли. 2. Пол: мужчины - рак желудка, легкого; женщины - рак молочной железы, матки. 3. Питание: объем пищи - избыток питания повышает риск заболеть характер пищи - недостаток витаминов, белка; избыток жира - рак прямой кишки; копченые, консервированные - рак пищевода. индолы в капсуле; кумарины в других овощах - противоопухолевые факторы в овощах и фруктах. Роль наследственности в развитии опухолей: Большая наследственная предрасположенность: Ретинобластома сетчатки саркома сосудистой оболочки глаза пигментная ксеродерма нейрофиброматоз полипоз толстого кишечнике Вредные привычки и рак: 1. Курение: в 20 раз чаще рак легкого; рак языка, глотки, пищевода, кишечника, 30 - 40% опухолей связаны с курением. 2. Алкоголь. 3. Загар - увеличение рака кожи у мужчин на 20%, у женщин - на 50% за последние годы. 4. Жевание бетеля. 81.Основные биологические особенности опухолей. Метастазирование опухолей механизмы, стадии. Понятие об опухолевой прогрессии. Биологические особенности злокачественных новообразований: 1. Относительная автономность и нерегулируемость роста (рост не подчиняется регуляторным механизмам). - отсутствуют лимит клеточного деления Хейблига - ослаблены межклеточные контакты - понижены механизмы контактного торможения - расстройство рецепторной поверхности клеток - нарушены синтез и чувствительность к кейлонам (вырабатываются зрелыми клетками и подавляют размножение опухолевых клеток). - нарушена работа аденилатциклазы системы 2. Упрощение структурно-химической организации клеток (анаплазия): - морфологическая анаплазия - биохимическая - энергетическая - функциональная - иммунологическая а) морфологическая тканевая - соотношение стромы и паренхимы нарушены клеточная - разные размеры, форма клеток, миграция ядрышка, нарушение структуры поверхности клеток. б) биохимическая анаплазия: набор изоферментов уменьшен активность ферментов снижена изоферментное упрощение (монотонизация) в) энергетическая анаплазия энергия за счет гликолиза как анаэробного, так и аэробного Превалируют синтетические процессы - снижение белка за счет продуктов разрушения клеток. Нарушение соотношения гистонов и негистоновых белков. Много ферментов синтеза РНК на денатурированной матрице ДНК. г) функциональная анаплазия Функция либо понижена, либо повышена. Гипо- ли гипертиреоз - пример. д) иммунологическая анаплазия: органоспецифические антигены межорганные антигены 1. Антигенное упрощение - резко уменьшено количество органоспецифических антигенов (нем. Вейлер). 2. Антигенная дивергенция - синтез. В опухолевых клетках гетерогенных антигенов (другого органа; Вейлер и Оленов). 3. Антигенная реверсия - синтез в опухолевых клетках эмбриональных антигенов (Абеленов и Татаринов - в гепатоме найден a-феропротеин; эмбриональный преальбумин в гепатоме мыши). 3. Наследуемость изменений - раковая клетка при размножении дает себе подобные. 4. Способность к метастазированию - образование вдали от первичного опухолевого узла вторичного опухолевого зачатка. Этапы метастазирования: 1. Отрыв опухолевых клеток от тканей опухоли 2. Транспортировка клеток по кровеносному или лимфатическому руслу, Лишь 9-11? переходит в 3 стадию. 3. Фиксация клетки к стенке сосуда. Если вызвать повреждение стенки сосуда, то фиксируется 85-90% клеток (атеросклеротическое; дистрофическое поражение стенки сосуда). Дремлющие клетки не проявляют своей активности до воздействия определенных агентов. 4. Пролиферация при действии факторов: гормональные нарушения нейродистрофические изменения хирургические вмешательства 5. Способность к инвазивному и деструктивному росту. 6. Прогрессия опухоли (Фулис) - способность опухоли в процессе ее эволюции менять биологические свойства. Опухоль становится все более и более злокачественной.(повыш. изменчивось генотипа опух. кл., постоянно изменяется генотип опух.кл., возрастание степени приспособл.кл.опухоли, повыш. резистентности кл.опухоли) 7. Системное действие опухоли на организм. Эпидемиология опухолей: Самая высокая заболеваемость раком: среди мужчин - Австрия среди женщин - Чили СССР - самая высокая заболеваемость раком в республиках Прибалтики; самая низкая - Ср. Азия. 82. Виды и основные проявления атипизма опухолевых клеток. Упрощение структурно-химической организации клеток (анаплазия): - морфологическая анаплазия - биохимическая - энергетическая - функциональная - иммунологическая а) морфологическая тканевая - соотношение стромы и паренхимы нарушены клеточная - разные размеры, форма клеток, миграция ядрышка, нарушение структуры поверхности клеток. б) биохимическая анаплазия: набор изоферментов уменьшен активность ферментов снижена изоферментное упрощение (монотонизация) в) энергетическая анаплазия энергия за счет гликолиза как анаэробного, так и аэробного Превалируют синтетические процессы - снижение белка за счет продуктов разрушения клеток. Нарушение соотношения гистонов и негистоновых белков. Много ферментов синтеза РНК на денатурированной матрице ДНК. г) функциональная анаплазия Функция либо понижена, либо повышена. Гипо- ли гипертиреоз - пример. д) иммунологическая анаплазия: органоспецифические антигены межорганные антигены 1. Антигенное упрощение - резко уменьшено количество органоспецифических антигенов (нем. Вейлер). 2. Антигенная дивергенция - синтез. В опухолевых клетках гетерогенных антигенов (другого органа; Вейлер и Оленов). 3. Антигенная реверсия - синтез в опухолевых клетках эмбриональных антигенов (Абеленов и Татаринов - в гепатоме найден a-феропротеин; эмбриональный преальбумин в гепатоме мыши). 3. Наследуемость изменений - раковая клетка при размножении дает себе подобные. 4. Способность к метастазированию - образование вдали от первичного опухолевого узла вторичного опухолевого зачатка. 83. Патогенез опухолей. Современные представления о молекулярно-генетических механизмах неопластической трансформации. Современная трактовка концепции онкогена. Роль мутаций, вирусов и эпигеномных нарушений в механизмах превращения протоонкогена в онкоген. Молекулярно-генетические механизмы опухолевой трансформации клетки Современная концепция канцерогенеза получила название концепции онкогена. Основополагающие положения ее были сформулированы еще в 1981-1985 гг. Этому предшествовали сложные поиски ведущего патогенетического звена в механизме опухолевой трансформации клетки. Все исследователи второй половины 20-го столетия считали, что данный процесс осуществляется на молекулярно-генетическом уровне, но суть его трактовали по-разному. Мутационная концепция канцерогенеза Нормальная клетка превращается в опухолевую в результате структурных изменений в генетическом материале, т.е. мутаций. В этом заключается суть мутационной концепции. Различают три ее варианта. Первый вариант концепции (Т. Bovery, 1914) касается хромосомных аббераций и геномных мутаций, затрагивающих значительную часть генома. Второй вариант (Н.Н. Петров, К.Н. Bayer, 1924) учитывает еще и точечные или генные мутации. Третий вариант касается возможности участия в канцерогенезе мутации регуляторных генов. О возможной роли мутационных механизмов в канцерогенезе свидетельствуют следующие факты: Мутагенность подавляющей части (90 %) известных канцерогенов и канцерогенность большинства (у 85-87 % исследованных образцов) мутагенов. Обнаружение в клетках ряда опухолей человека и животных так называемых маркерных хромосом (например, филадельфийской хромосомы примиелоцитарном лейкозе человека). Резкое увеличение заболеваемости лейкозом и опухолевой болезнью людей с различного рода генетическими дефектами (при болезни Дауна, синдромах Клайнфельтера, Шерешевского-Тернера и др). Эпигеномная концепция канцерогенеза Согласно этой концепции (Ю.М. Оленов, А.Ю. Броновицкий, B.C. Ша-пот), в основе превращения нормальной клетки в злокачественную лежат стойкие нарушения регуляции генной активности, а не изменения структуры генетического материала. Под влиянием химических и физических канцерогенов, а также онкогенных вирусов происходит сдвиг в строго специфичной для каждой ткани регуляции генной активности: дерепрессируются группы генов, которые в данной ткани должны быть зарепрессированы и (или) блокируются активные гены. В результате клетка в значительной мере утрачивает присущую ей специфику, становится нечувствительной или малочувствительной к регуляторным влияниям целостного организма, неуправляемой. С точки зрения эпигеномной концепции канцерогенеза можно объяснить ряд особенностей неоплазмы: изоферментное упрощение, антигенную реверсию, выработку некоторыми опухолями гормонов, не присущих клеткам гомологичной ткани и др. Вирусо-генетическая концепция канцерогенеза Данную концепцию предложил Л.А. Зильбер (1948). Она заключается в следующем. Опухолевая трансформация клетки происходит в результате привнесения в ее генетический материал новой генетической информации онкогенными вирусами. Главным свойством последних является их способность разрывать цепочку ДНК и объединяться с ее обрывками, т.е. с клеточным геномом. Проникнув в клетку, вирус, освободившись от белковой оболочки, под влиянием содержащихся в нем ферментов встраивает свою ДНК в генетический аппарат клетки. Привнесенная вирусом новая генетическая информация, меняя характер роста и «поведение» клетки, превращает ее в злокачественную. G. Temin (1963) открыл явление обратной транскрипций: списывание генетической информации возможно не только в одном направлении (ДНК-РНК-белок), но и в обратном (от РНК к ДНК). Обнаружение в РНК-содержащих вирусах фермента ревертазы, или обратной транскриптазы, обеспечивающего процесс обратной транскрипции, позволило понять механизм действия и РНК-вирусов. Они синтезируют ДНК-овую копию своей РНК, которая и встраивается затем в геном клетки. В процессе обратной транскрипции на концах ДНК-вой копии формируются одинаковые последовательности — большие терминальные повторы (LTR), играющие роль в трансформации нормальной клетки в опухолевую. Современная концепция онкогена Альтернативные точки зрения относительно природы неопластической трансформации в 70-е годы значительно сблизились, поскольку появились неопровержимые факты участия в канцерогенезе и мутационных, и эпигеномных, и вирусно-генетических механизмов, последовательно включающихся в процесс опухолевой трансформации. Стало аксиомой представление о многоэтапности процесса канцерогенеза, решающей предпосылкой которого является нерегулируемая экспрессия трансформирующего гена - онкогена, предсущест-вующего и геноме. Впервые онкогены были обнаружены с помощью трансфекции («переноса генов») в вирусах, вызывающих опухоли у животных. Затем с помощью данного метода было установлено, что в организме животных и человека содерпотенциальные онкогены – протоонкогены, экспрессия которых и обуславливает трансформацию нормальной клетки в опухолевую. Согласно современной концепции онкогена мишенью для изменений, обусловливающих начаяо опухолевого роста, являются протоонкогены, или потенциальные онкогены, существующие в геноме нормальных клеток и обеспечивающие yсловия для нормальной жизнедеятельности организма. В эмбриональный период они обеспечивают условия для интенсивного размножения клеток и нормального развития организма. В постэмбриональном периоде функциональная их активность в значительной степени снижается — большая часть их оказывается в репрессированном состоянии, а остальные обеспечивают лишь периодическое обновление клеток. Механизмы превращения протоонкогена в онкоген Превращение протоонкогена в активно действующий онкоген обеспечивается следующими механизмами. 1 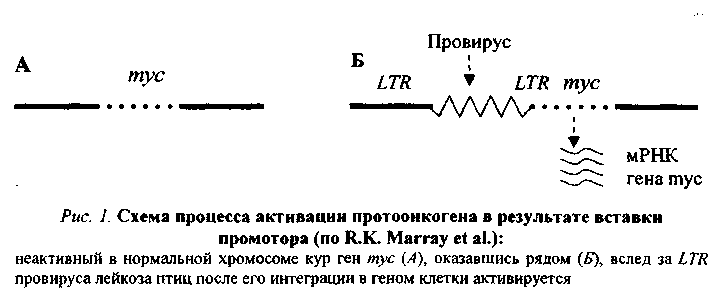 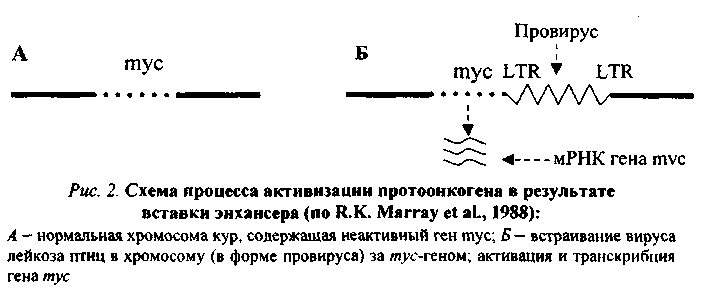 . Присоединение к протоонокгену промотора — участка ДНК, с которым связывается РНК-полимераза, инициирующая транскрипцию гена, в том числе и онкогена, располагающегося непосредственно за ним (рис.1). Такого рода участки (промоторы) содержатся в больших терминальных повторах (LTR) ДНК-копий РНК-содержащих вирусов. Роль промотора могут выполнять и транспозирующие элементы генома — мобильные генетические элементы, способные перемещаться по геному и встраиваться в различные его участки. . Присоединение к протоонокгену промотора — участка ДНК, с которым связывается РНК-полимераза, инициирующая транскрипцию гена, в том числе и онкогена, располагающегося непосредственно за ним (рис.1). Такого рода участки (промоторы) содержатся в больших терминальных повторах (LTR) ДНК-копий РНК-содержащих вирусов. Роль промотора могут выполнять и транспозирующие элементы генома — мобильные генетические элементы, способные перемещаться по геному и встраиваться в различные его участки.2. Вставка в геном клетки энхансера (enchancer — усилитель) — участка ДНК, способного активизировать работу структурного гена, находящегося не только в непосредственной близости от него, но и на расстоянии многих тысяч пар нуклеотидов или даже встроенного в хромосому после него. Свойствами усилителя обладают подвижные гены, LTR ДНК-копий. В случае, проиллюстрированном рис. 2, LTR провируса не может работать как промотор (см. рис. 1, Б) и выступает в роли энхансера, в результате чего ген туе активизируется и транскрибируется. 3. Хромосомные абберации с явлениями транслокации, роль которых в механизмах опухолевой трансформации клетки можно проиллюстрировать следующим примером. П 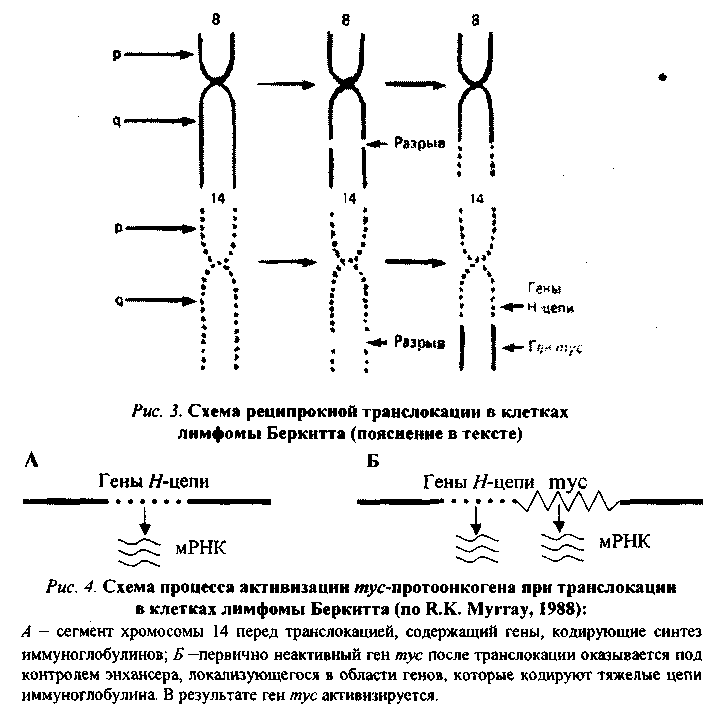 ри лимфоме Беркитта конец (q-плеча хромосомы 8, отделившись от нее, переходит к хромосоме 14: гомологичный фрагмент последней перемещается к хромосоме 8; а неактивный ген туе (протоонкоген), находившийся в том ее сегменте, который попадает на хромосому 14, встраивается вслед за активными генами, кодирующими тяжелые цепи молекул иммуноглобулинов, и активизируется (рис. 3, 4). Явления реципрокной транслокации между 9-й и 22-й хромосомами имеют место в 95 % случаев миелоцитарного лейкоза. Хромосома 22 с укороченным в результате такой транслокации одним плечом получила название Филадельфийской. ри лимфоме Беркитта конец (q-плеча хромосомы 8, отделившись от нее, переходит к хромосоме 14: гомологичный фрагмент последней перемещается к хромосоме 8; а неактивный ген туе (протоонкоген), находившийся в том ее сегменте, который попадает на хромосому 14, встраивается вслед за активными генами, кодирующими тяжелые цепи молекул иммуноглобулинов, и активизируется (рис. 3, 4). Явления реципрокной транслокации между 9-й и 22-й хромосомами имеют место в 95 % случаев миелоцитарного лейкоза. Хромосома 22 с укороченным в результате такой транслокации одним плечом получила название Филадельфийской.Точечные мутации протоонкогена, к примеру, C-H-raS, согласно имеющимся сведениям, отличается от нормального гена (C-H-raS) всего одной аминокислотой, но тем не менее обусловливает снижение гуанозинтрифосфатазной активности в клетке, что может вызвать рак мочевого пузыря у человека. Амплификация (умножение) прогоонкогенов, обладающих в норме небольшой следовой активностью, обусловливает увеличение их общей актив ности до уровня, достаточного для инициации опухолевой трансформации. Известно, что в икринке шпорцевой лягушки около 5 млн копий гена туc. После оплодотворения и дальнейшего деления яйцеклетки число их прогрессирующе уменьшается. В каждой клетке будущего головастика в эмбриональный период развития содержится не более 20—50 копий тус-гена, обеспечивающих быстрое деление клеток и рост эмбриона. В клетках же взрослой лягушки выявляются лишь единичные гены туc, в то время как в раковых клетках той же лягушки число их вновь достигает 20-50. 6. Трансдукция неактивных клеточных генов (протоонкогенов) в геном ретровируса и последующее их возвращение в клетку: считается, что онкоген опухолеродного вируса клеточного происхождения; при инфицировании животных или человека таким вирусом «похищенный» им ген попадает в иной участок генома, что и обеспечивает активизацию некогда «молчавшего» гена. 84.Виды и функции клеточных онкогенов, роль онкобелков в нарушении функции трансформированных клеток. Понятие об антионкогенах. Продукты деятельности онкогенов — онкобелки в следовых количествах синтезируются и в нормальных клетках, функционируя в них как регуляторы чувствительности их рецепторов к факторам роста или как синергисты последних. Многие онкобелки гомологичны или родственны ростовым факторам: тромбоцитарному (ТФР), эпидермальному (ЭФР), инсулинподобному и др. Находясь под контролем регуляторных механизмов целостного организма, фактор роста, действуя прерывисто, обеспечивает процессы регенерации. Выйдя из-под контроля, он «работает» перманентно, вызывая безудержную пролиферацию и подготавливая почву для процесса малигнизации (теория «самозатягивающейся петли»). Так, добавление ТФР в культуру нормальных клеток, имеющих соответствующие рецепторы, может вызывать обратимые фенотипи-ческие изменения, сходные с трансформацией: круглые клетки превращаются в веретенообразные, растут многослоем. Большая часть онкобелков принадлежит к протеинкиназам. Известно, что рецепторы факторов роста на своей внутренней, погруженной в цитоплазму стороне несут каталитическую часть протеин-киназы или гуанилат-циклазы. Механизмы действия онкогенов и их продуктов — онкобелков можно подразделить на три основные категории (рис. 5). Онкобелки могут имитировать действие факторов роста, оказывая влияние на синтезирующие их клетки по аутокринному пути (синдром «самозатягивающейся петли»; рис. 5, Б). Онкобелки могут модифицировать рецепторы факторов роста, имитируя ситуацию, характерную для взаимодействия рецептора с соответствующим фактором роста, без его действия (рис. 5, В). Продукты онкогенов могут действовать на ключевые внутриклеточные процессы, участвующие в контроле роста клеток без внешней их стимуляции. Так, продукт гена sre, являющийся тирозинпротеинкиназой, может воздействовать на митотическую активность клетки и тем самым влиять на фосфори лирование ключевых регуляторных белков. Аналогичный эффект возможен при действии продукта гена ras, стимулирующего (опосредованно) активность аденилатциклазы. М 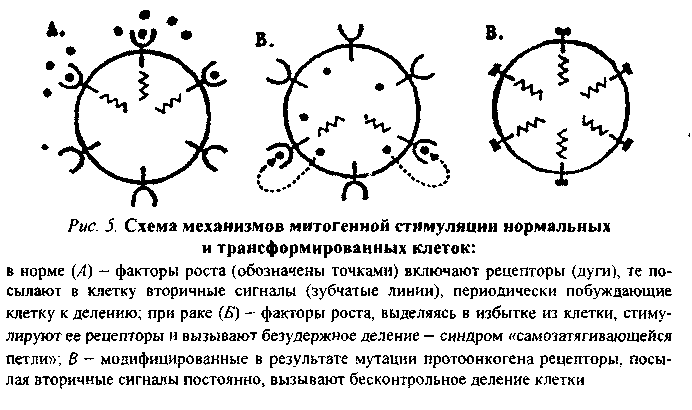 ногоэтапность процесса онкогенеза ногоэтапность процесса онкогенезаВ становлении неопластического фенотипа принимает участие не один онкоген а последовательно включающиеся в данный процесс несколько (по меньшей мере два) онкогена. Этот феномен лежит в основе еще одного явления характерного для канцерогенеза, — многоэтапное™, многоступенчатости процесса, причем два этапа решающие. На первом этапе происходит им-мортелизация популяции клеток, т.е. процесс, формирующий их способность беспредельно размножаться. В нем принимают участие ядерные онкогены, он-кобелки которых поступают в ядро. На втором этапе совершается процесс, меняющий характер роста клетки, определяющий ее агрессивность. К этому причастны в основном мембранные онкогены, онкобелки которых накапливаются в мембранах. Предполагается, что непрерывное деление клеток — функция ядра, а агрессивный (инфильтрирующий) их рост— функция мембран. А 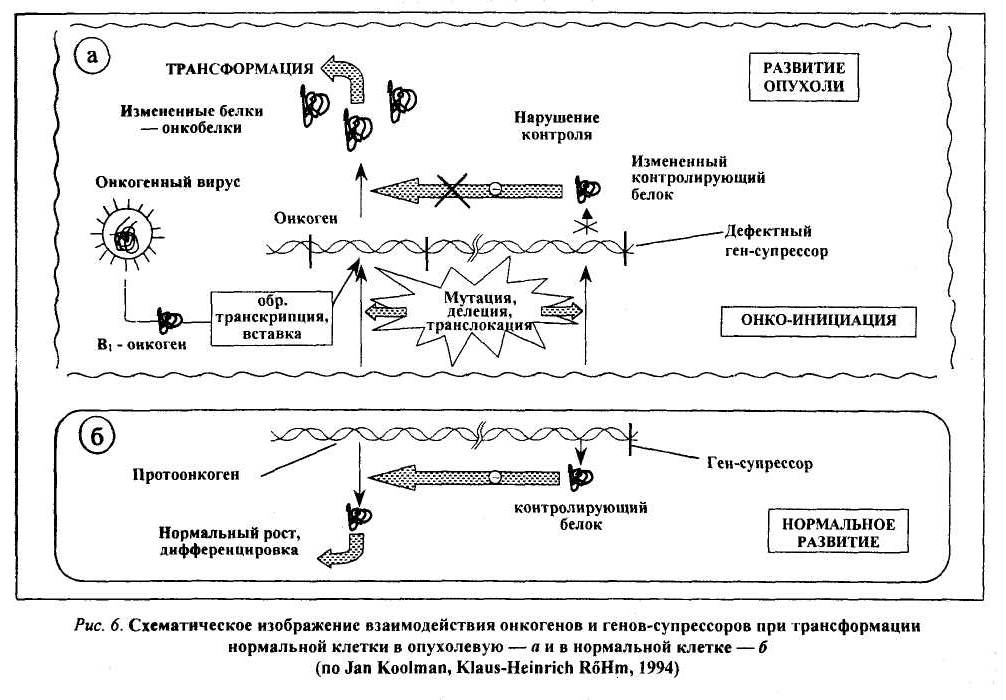 нтионкогены и их роль в онкогенезе нтионкогены и их роль в онкогенезеВ геноме клетки имеется и второй класс опухолеродных генов — гены-супрессоры (антионкогены). В отличие от онкогенов, они контролируют синтез не стимуляторов роста, а его ингибиторов (подавляют активность онкогена и соответственно — размножение клеток; стимулируют их дифференцировку). Нарушение баланса процессов синтеза стимуляторов и ингибиторов роста и лежит в основе трансформации клетки в опухолевую (рис. 6). Впервые ген-супрессор был обнаружен в 1985 году при исследовании ретинобластомы — злокачественной опухоли сетчатки глаза у детей. Выяснилось, что в клетках опухоли ген, локализующийся в нормальных клетках в длинном плече 13-й хромосомы, отсутствует или в результате мутации утратил функциональную активность. Кодируемый этим геном (РБ) белок (р 100) регулирует активность генов (в частности, онкогенов), вызывающих опухолевую трансформацию клеток сетчатки глаза. С помощью методов генной инженерии он был выделен и перенесен в безудержно размножающиеся клетки культуры ретинобластомы. Раковые клетки, получив отсутствующий ген, стали вырабатывать белок р100, который блокировал действие онкогена. В результате опухолевые клетки превратились в нормальные, жили положенный им срок, старели и погибали. В последующем было установлено, что РБ-ген отсутствует в 40 % случаях рака мочевого пузыря, почти во всех случаях рака легких, молочной железы, саркомы костей. При других формах злокачественных новообразований отсутствуют другие гены (возможно, супрессоры) различных хромосом. |
