практикум по биохимии. Практикум по биологической химии, изданный в 1986 году, подвергся существенной переработке, а также дополнен новыми лабораторными работами в разделах белки, липиды,
 Скачать 1.79 Mb. Скачать 1.79 Mb.
|
|
Ход определения. В одну пробирку помещают 1 мл раствора мочевины, во вторую – тиомочевины, в третью – ацетамида. В каждую пробирку добавляют примерно 100 мг соевой муки и 2 капли раствора фенолфталеина, тщательно перемешивают стеклянной палочкой и оставляют стоять при комнатной температуре. Следят за появлением розовой окраски содержимого в пробирках. Выделение аммиака обнаруживают также по запаху и с помощью влажной лакмусовой бумажки, которую подносят к отверстию пробирок. Сравнивают результаты выявления аммиака в трех пробах. Оформление работы. Данные оформить в виде таблицы, сделать вывод о специфичности уреазы и ее практическом значении.
Практическое значение работы. Ферменты с абсолютной субстратной специфичностью, к которым относится уреаза, катализируют превращение только одного вещества. Эти ферменты используют в клинической биохимии и фармации как аналитические реагенты для определения веществ, к которым они имеют абсолютную специфичность. Например, уреаза используется для определения мочевины в биологическом материале и лекарственных препаратах. Работа 26. Специфичность действия амилазы (α-1,4-глюкан-4-глюкангидролаза; КФ 3.2.1.1.) и сахаразы (β-D-фруктофуранозид-фруктогидролаза; КФ 3.1.1.26) Реактивы. Крахмал, 1%-ный раствор; сахароза, 2%-ный раствор; реактив Фелинга*. Оборудование. Штатив с пробирками; водяная баня; лабораторный термометр; глазные пипетки. Материал.
Метод основан на сравнительном изучении гидролиза α-амилазой и сахаразой разных субстратов, содержащих гликозидные связи: крахмала и сахарозы. Гидролиз крахмала и сахарозы оценивают пробой Фелинга на восстанавливающие сахара (мальтоза, глюкоза). Ферменты катализируют реакции по схеме: α-Амилаза Крахмал + nH2O Декстрины + Мальтоза Сахараза Сахароза + H2O Глюкоза + Фруктоза Ход определения. В одну пробирку вносят 10 капель раствора крахмала, в другую – такой же объем раствора сахарозы. Для выявления специфичности α-амилазы в обе пробы добавляют по 5 капель разбавленной слюны, перемешивают встряхиванием и ставят в водяную баню при 38˚С на 10 мин. Затем с жидкостью в обеих пробирках проделывают пробу с реактивом Фелинга (см. работу 19) и сравнивают окраску. Для выявления специфичности сахаразы в одну пробирку наливают 10 капель раствора крахмала, а в другую – сахарозы и прибавляют к ним по 5 капель экстракта сахаразы дрожжей. Пробы перемешивают встряхиванием и помещают в водяную баню при 38˚С на 10 мин, после чего с жидкостью обеих пробирок проделывают пробу с реактивом Фелинга. Сравнивают окраску. Оформление работы. Данные занести в таблицу, сделать вывод о специфичности изученных ферментов и обозначить, к какому типу специфичности они относятся.
Практическое значение работы. Ферменты с абсолютной и относительной групповой субстратной специфичностью, обладающие меньшей избирательностью действия на субстраты, участвуют, как правило, в гидролизе питательных веществ или превращении чужеродных соединений. В частности, α-амилаза и сахараза проявляют специфичность не к структуре субстрата в целом, а к типу гликозидных связей, находящихся в соответствующих углеводах. 5. Модификаторы активности ферментов Вещества, изменяющие активность ферментов (модификаторы), делятся на активаторы и ингибиторы. Они стимулируют или угнетают активность фермента, влияя на его активный или аллостерический центры. Модифицирующее влияние различных соединений на активность фермента устанавливают путем кинетических исследований. Работа 27. Активаторы и ингибиторы α-амилазы слюныРеактивы. Крахмал, 0,5%-ный раствор; хлорид натрия, 1%-ный раствор; сульфат меди (II), 1%-ный раствор; фенилтиомочевина. 0,02%-ный раствор; раствор иода в иодиде калия*. Оборудование. Штатив с пробирками; глазные пипетки; водяная баня с лабораторным термометром; часы. Материал. Слюна, полученная, как в работе 18, и разведенная водой в 10 раз. Метод основан на сравнении скорости гидролиза крахмала (продукт гидролиза крахмала обнаруживают пробой с иодом) под действием α-амилазы слюны до и после добавления фенилтиомочевины, ионов Cl‾ и Cu2+. Ход определения. Берут четыре пробирки и наливают по 10 капель: в первую – дистиллированной воды, во вторую – раствора хлорида натрия, в третью – раствора сульфата меди и в четвертую – раствора фенилтиомочевины, а затем по 20 капель раствора крахмала и по 1 капле разведенной слюны. Содержимое перемешивают встряхиванием, помещают пробирки в водяную баню при 38˚С и засекают время начала инкубации. Через каждые 1-2 мин из проб отбирают в другие пробирки по 1 капле жидкости и добавляют 1 каплю раствора иода в иодиде калия. Отмечают время появления красного окрашивания (стадия образования эритродекстринов) при проведении реакции с иодом в каждой из пробирок. Оформление работы. Результаты занести в таблицу, сделать вывод о действии изученных веществ и о предполагаемом типе ингибиторов.
Работа 28. Действие конкурентных ингибиторов на сукцинат-дегидрогеназу (сукцинат: акцептор оксидоредуктаза; КФ 1.3.99.1) мышечной ткани Реактивы. Малоновая кислота, 1%-ный раствор, нейтрализованный NaOH; сукцинат натрия, 1%-ный раствор; метиленовый синий, 1%-ный раствор; вазелиновое масло. Оборудование. Штатив с пробирками; пипетки вместимостью 1 мл; водяная баня; лабораторный термометр. Материал. Мышечная кашица, полученная после забоя животного. Метод основан на сравнительном определении активности сукцинатдегидрогеназы по обесцвечиванию в ходе реакции метиленовой сини (МС) как акцептора водорода в присутствии и в отсутствии малоновой кислоты. Сукцинатдегидрогеназа COOH COOH │ │ CH2 CH │ ФАД+ ФАД∙Н2 ║ CH2 HC │ │ COOH COOH сукцинат фумарат МС∙Н2 МС (бесцветная форма) (синее окрашивание) Образующийся ФАД∙Н2 восстанавливает метиленовую синь (МС∙Н2), в результате чего происходит обесцвечивание раствора. Сравнивая визуально уменьшение интенсивности синего окрашивания с пробами, содержащими разные количества малоновой кислоты (НООС – СН2 – СООН), делают вывод о типе действия ее на фермент. Ход определения. В три пробирки помещают по 3-4 г мышечной кашицы и добавляют в первую пробирку 0,8 мл воды, во вторую 0,2 мл раствора малоновой кислоты и 0,6 мл воды, а в третью – 0,8 мл раствора малоновой кислоты. Во все пробирки приливают по 1 мл раствора сукцината натрия, по 1 капле раствора метиленового синего и после перемешивания по 3-4 капли вазелинового масла. Пробирки ставят в водяную баню при 37˚С. Через 3-5 мин наблюдают обесцвечивание раствора. Оформление работы. Сравнить интенсивность голубого окрашивания в трех пробирках и сделать вывод о механизме действия малоновой кислоты на активность сукцинатдегидрогеназы. Практическое значение работы. Конкурентные ингибиторы различных ферментов широко применяются в биохимических исследованиях и в практической медицине как лекарственные препараты. В частности, малоновая кислота как конкурентный ингибитор сукцинатдегидрогеназы используется в экспериментах на животных для того, чтобы изучить изменения в обмене веществ в тканях при блокаде этого фермента, а также для исследования самого механизма конкурентного торможения. Работа 29. Неконкурентное ингибирование каталазы кровиРеактивы. Пероксид водорода, 3%-ный раствор; азид натрия, 1%-ный раствор. Оборудование. Штатив с пробирками; глазные пипетки. Материал. Цельная кровь, разведенная водой в 10 раз. Метод основан на визуальном сравнении интенсивности выделения пузырьков газа (кислорода) при разложении пероксида водорода с участием каталазы крови в отсутствии и в присутствии азида натрия NaN3. Ход определения. В две пробирки вносят по капле крови и добавляют в одну их них 2 капли воды, а в другую – такой же объем раствора азида натрия. Пробы встряхивают. Через 2 мин прибавляют в обе пробирки по 2 мл раствора пероксида водорода и сравнивают интенсивность выделения пузырьков газа. Оформление работы. По полученным данным сделать вывод о действии азида натрия на каталазу крови и указать на практическое значение работы. Практическое значение работы. Неконкурентными ингибиторами геминовых ферментов (цитохромы, цитохромоксидаза, каталаза и пероксидаза) являются азиды и цианиды, которые взаимодействуют с железом гема, входящего в активный центр, подавляя тем самым каталитическую активность этих ферментов. Благодаря этому азиды и цианиды являются сильными ядами. Учитывая, что они неконкурентные ингибиторы, снять их действие можно только теми веществами, которые связывают их и освобождают из активного центра фермента. 6. Количественное определение активности ферментов В клинико-биохимических лабораториях широко используется количественное определение активности ферментов для диагностики заболеваний, а также для контроля за проводимым лечением. В фармации оно необходимо для контроля качества ферментных препаратов, а в научных биохимических исследованиях – для наблюдения за процедурой очистки фермента. Об активности фермента судят по количеству превращенного субстрата или образовавшегося продукта реакции за определенный промежуток времени. Скорость ферментативной реакции графически описывается в виде гиперболы – кривая Михаэлиса-Ментен, поэтому для правильного измерения активности ферментов необходимо соблюдать ряд правил. Определение следует вести в стандартных условиях, т.е. при насыщающих концентрациях субстрата или субстратов, оптимуме рН среды и постоянной температуре, которые должны поддерживаться весь период наблюдения. При изучении сложных ферментов в среду добавляют необходимые кофакторы. Эти условия обеспечивают нулевой порядок реакции, при которой ее скорость лимитируется только концентрацией исследуемого фермента. Измерять активность фермента нужно не за любой отрезок времени, а только за начальный, когда скорость реакции протекает линейно, т.е. за единицу времени превращается одно и то же количество субстрата (это так называемая начальная скорость реакции). В зависимости от способа регистрации все методы определения ферментативной активности можно подразделить на два типа: метод отбора проб и непрерывного наблюдения. В первом случае перед инкубацией и через определенные отрезки времени в ходе реакции отбирают пробы раствора, осаждают белок и определяют в безбелковой жидкости содержание субстратов или продуктов реакции. По полученным данным строят кривую зависимости образования продуктов реакции от времени и рассчитывают активность фермента. Во втором случае наблюдение ведут непрерывно или автоматически регистрируют ход реакции, если субстрат (или продукт реакции) поглощает в определенной области спектра или флуоресцирует, что позволяет постоянно следить за изменением его концентрации в среде за выбранные промежутки времени. Метод непрерывной регистрации очень чувствителен, удобен и экономичен, так как для него требуются небольшие количества биологического материала или ферментного препарата. Он широко применяется при количественном измерении активности окислительных ферментов, для действия которых необходимы никотинамидные коферменты. Окисленные формы их (НАД+ и НАДФ+) не поглощают при 340 нм, а восстановленные (НАД∙Н2 и НАДФ∙Н2) имеют максимум абсорбции при этой длине волны. Поэтому скорость ферментативной реакции определяют по степени восстановления окисленных форм данных коферментов или по степени окисления восстановленных форм. Для выражения активности таких ферментов используют молярный коэффициент экстинкции восстановленных форм НАД и НАДФ, который при 340 нм равен 6,22∙106 см2/моль, или 6,22∙103л∙моль-1∙см-1. Это означает, что если в процессе реакции произошло изменение экстинкции на 6,22∙106, то это указывает на образование (или убыль) 1 моля восстановленного кофермента в расчете на 1 мл реакционной смеси. Если экстинкция изменяется на 6,22∙103 или на 6,22, то соответственно образуется (или расходуется) в ходе реакции 1 ммоль или 1 мкмоль восстановленных коферментов на 1 мл среды. Можно также наблюдать за скоростью ферментативной реакции по поглощению восстановленного НАД и НАДФ при 366 нм. Молярный коэффициент экстинкции в этом случае равен 3,3∙106 см2/моль. Концентрацию исследуемого фермента подбирают таким образом, чтобы обеспечить изменение экстинкции на 0,010-0,100 за 1 мин. Если этот показатель выше, то проба, содержащая фермент, разводится, если ниже, то берется больший объем изучаемого образца. Для непрерывного наблюдения за ходом реакции по светопоглощению восстановленных форм НАД (НАДФ) или других субстратов при определенной длине волны требуются спектрофотометры. Однако, современный фотоэлектроколориметр типа КФК-2 позволяет проводить измерения ферментативной активности, например, при 366 нм (расчет производится по экстинкции раствора НАД∙Н или НАДФ∙Н с известной концентрацией). При невозможности наблюдать за реакцией непрерывно активность фермента измеряют методом отбора проб, причем содержание субстратов и продуктов реакции определяют разными способами. Наиболее распространены колориметрические методы. Правила выражения активности ферментов в единицах СИ были изложены ранее (см. с.11). Температура, при которой проводится определение, указывается при выражении активности фермента. Работа 30. Количественное исследование активности препарата лактатдегидрогеназы по Корнбергу Реактивы. Фосфатный буфер, 0,1 М с рН 7,4*; пируват натрия, раствор 2∙10-2 М на 0,1 М фосфатном буфере с рН 7,4; НАД∙Н динатриевая соль, свежеприготовленный 6∙10-3 М раствор в дистиллированной воде. Оборудование. Пипетки вместимостью 0,1; 1 и 5 мл; стеклянная палочка; секундомер; СФ или ФЭК типа КФК-2. Материал. Разведенный продажный препарат фермента 0,2 мкг/мл. Кристаллический препарат в виде суспензии в 2,2 М растворе сульфата аммония, имеющий активность около 200 ФЕ/мг белка, разводят в 1000 раз 0,1 М фосфатным буфером с рН 7,4 перед опытом (1 ФЕ соответствует 1 мкмоль превращенного субстрата за 1 мин)1. Метод основан на непрерывном измерении скорости окисления НАД∙Н2, используемого на восстановление пирувата в реакции, катализируемой ЛДГ. По уменьшению экстинкции НАД∙Н2 при 340 нм рассчитывают количество превращенного субстрата за единицу времени. Лактатдегидрогеназа (ЛДГ) катализирует обратимое превращение пирувата в лактат: Н ЛДГ │ СН3―С―СООН + НАД·Н2 НАД+ + СН3―С―СООН ║ │ О ОН пируват лактат Равновесие реакции сдвинуто вправо, поэтому при изучении ЛДГ удобнее использовать в качестве субстрата пируват и НАД∙Н2 и по скорости окисления последнего рассчитать активность этого фермента. Ход определения. В кювету спектрофотометра последовательно вносят 2,4 мл фосфатного буфера, 0,2 мл раствора НАД∙Н2 и 0,1 мл образца фермента. Перемешивают стеклянной палочкой и ставят в кюветодержатель. Устанавливают шкалу отсчета экстинкции на 0,400 и ручкой «щель» выводят стрелку гальванометра (при открытой шторке) на нуль. В течение 1 мин проверяют отсутствие неферментативного окисления НАД∙Н2 (в этом случае экстинкция не падает). Добавляет в кювету 0,3 мл раствора пирувата натрия (запускают реакцию), быстро перемешивают, ручкой «щель» при открытой шторке возвращают стрелку гальванометра к нулевой отметке и включают секундомер. Снимают показания экстинкции (падение ее, начиная от отметки 0,400) через каждые 30 с в течение 2-3 мин. Если условия реакции подобраны верно, то за каждые 30 с наблюдается примерно одинаковое уменьшение экстинкции. Расчет. Удельную активность ЛДГ х (мкмоль∙мин-1∙мг-1) рассчитывают по формуле ∆Емин3,0∙1000 х = ——————— , 6,22∙0,02 где ∆Емин – изменение экстинкции в ходе реакции за 1 мин; 6,22 – коэффициент экстинкции 1 мкмоль НАД∙Н2 в 1 мл среды; 3,0 – объем инкубационной смеси, мл; 0,02 – количество белка в кювете, мкг; 1000 – коэффициент пересчета количества белка в миллиграммы. Оформление работы. Рассчитать удельную активность ферментного препарата, молекулярную активность ЛДГ (учитывая, что ее молекулярная масса 135000). Сделать вывод о качестве исследуемого препарата (сохранность исходной активности, %). Практическое значение работы. Принципы измерения активности лактатдегидрогеназы спектрофотометрическим методом непрерывного наблюдения используются при исследовании других ферментных препаратов, очищенных ферментов и в клинико-биохимических лабораториях при количественном определении активности ферментов в биологических жидкостях и биоптатах в норме и при патологии. Работа 31. Фотоколориметрический метод исследования активности лактатдегидрогеназы в сыворотке крови по Севелу и Товареку Реактивы. Лактат натрия, 0,45 М раствор или нейтрализованная гидроксидом натрия молочная кислота той же концентрации; пирофосфат натрия, 0,03 М раствор (Na4P2O7∙10H2O растворить в 50 мл воды, довести рН до 8,8 с помощью 1 М соляной кислоты и долить водой до 500 мл); НАД, свежеприготовленный раствор 3мг/мл; 2,4-динитрофенилгидразин, 0,2%-ный раствор в 1 М растворе соляной кислоты; гидроксид натрия, 0,4 М раствор; пируват натрия, раствор для построения калибровочного графика (содержит 11 мкг пирувата натрия или 8,8 мкг пировиноградной кислоты в 1 мл). Оборудование. Штатив с пробирками; пипетки вместимостью 0,1; 1 и 5 мл; ФЭК; водяная баня с лабораторным термометром. Материал. Сыворотка крови. Метод основан на определении скорости образования пирувата в ходе окисления лактата с участием лактатдегидрогеназы сыворотки крови: ЛДГ СН3―СН―СООН + НАД+ СН3―С―СООН + НАД·Н2 │ ║ ОН О лактат пируват 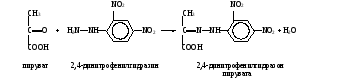 Пируват с 2,4-динитрофенилгидразином образует соответствующий гидразон, имеющий красно-бурое окрашивание в щелочной среде, интенсивность которого прямо пропорциональна содержанию кетокислоты: Пируват с 2,4-динитрофенилгидразином образует соответствующий гидразон, имеющий красно-бурое окрашивание в щелочной среде, интенсивность которого прямо пропорциональна содержанию кетокислоты:Ход определения. Сыворотку крови разводят в 3 раза дистиллированной водой. Вносят в пробирку 0,1 мл разведенной сыворотки, 0,3 мл раствора НАД+ и ставят на 5 мин в водяную баню при 37˚С (для прогревания смеси). Во вторую пробирку добавляют 0,8 мл раствора пирофосфата натрия и 0,2 мл раствора лактата натрия и нагревают на водяной бане при 37˚С. Выливают содержимое второй пробирки в первую, быстро перемешивают стеклянной палочкой, не вынимая пробирки из бани, и отмечают время начала инкубации. Через 25 мин реакцию останавливают, прибавляя 0,5 мл раствора 2,4-ДНФГ, и оставляют пробирку на 20 мин при комнатной температуре (для образования гидразона). К смеси приливают 5 мл раствора гидроксида натрия, содержимое перемешивают стеклянной палочкой и через 10 мин (после развития окраски) измеряют экстинкцию опытной пробы против контрольной на ФЭКе при длине волны 520-560 нм (светофильтр зеленый) в кювете с толщиной слоя 1 см. Контрольную пробу готовят как опытную, но разведенную сыворотку добавляют после инкубации. Расчет. Активность фермента рассчитывают по калибровочному графику, условия построения которого приведены в таблице.
По оси ординат откладывают значения экстинкции, а по оси абсцисс – соответствующие им единицы активности ЛДГ, выраженные в ммоль/(ч∙л). Оформление работы. Рассчитать активность фермента в исследуемой сыворотке крови, сделать вывод о возможном изменении активности и его причинах. Практическое значение работы. Определение активности лактатдегидрогеназы используется в клинико-биохимических лабораториях для диагностики и установления прогноза заболевания. В норме активность фермента составляет 0,8-4,0 ммоль/(ч∙л) и возрастает, как правило, у больных с повреждением миокарда, скелетных мышц, почек, а также при анемиях, опухолевых поражениях, остром гепатите и т.д. Работа 32. Определение активности щелочной фосфатазы в сыворотке крови по Боданскому Фосфатазы – ферменты, отщепляющие фосфат от различных субстратов. Среди них имеются энзимы с неодинаковой специфичностью по отношению к субстратам. Щелочная фосфатаза действует в щелочной среде (чем отличается от фосфатаз, осуществляющих катализ в нейтральной или кислой средах) и является малоспецифичной. Реактивы. β-Глицерофосфат, щелочной раствор на мединаловом буфере с рН 8,6*; трихлоруксусная кислота, 10%-ный раствор; реактив молибдата аммония*; аскорбиновая кислота, 1%-ный раствор на 0,1 М растворе соляной кислоты; дигидрофосфат калия (навеску 0,4394 г KH2PO4, предварительно высушенного в эксикаторе над серной кислотой, взвешивают на аналитических весах и растворяют в колбе вместимостью 100 мл; затем этот раствор разводят в 100 раз и используют для построения калибровочной кривой). Оборудование. Штатив с пробирками; центрифуга лабораторная с центрифужными весами; пипетки вместимостью 0,2; 1 и 5 мл; водяная баня с лабораторным термометром; ФЭК. Материал. Сыворотка крови. Метод основан на фотоколориметрическом определении неорганического фосфора, отщепляемого от β-глицерофосфата под действием фосфатазы сыворотки крови в щелочной среде: СН2ОН СН2ОН │ Фосфатаза │ НС―О―РО3Н2 + Н2О НС―ОН + Н3РО4 │ рН 8,6 │ СН2ОН СН2ОН β-глицерофосфат глицерин Неорганический фосфат определяют по образованию фосфомолибдата аммония с последующим восстановлением его в молибденовую синь аскорбиновой кислотой (см. работу 11). Ход определения. В две пробирки вносят по 1 мл раствора β-глицеро фосфата и помещают на 5 мин в водяную баню при 37˚С. Затем в опытную пробирку добавляют 0,2 мл сыворотки крови, перемешивают и отмечают время начала инкубации в водяной бане. Через 1 час приливают в обе пробирки по 1,8 мл раствора трихлоруксусной кислоты, а в контрольную – еще 0,2 мл сыворотки крови. Перемешивают пробы, оставляют стоять 5 мин для осаждения белка. Центрифугируют содержимое обеих проб в течение 5 мин при 3000 об/мин. Отбирают в чистые пробирки по 1,5 мл надосадочной жидкости (для определения в ней неорганического фосфата Фн) и приливают по 1 мл реактива молибдата аммония и по 1 мл раствора аскорбиновой кислоты. Через 10 мин измеряют экстинкцию опытной и контрольной проб на ФЭКе, при длине волны 630-690 нм (красный светофильтр) в кювете с толщиной слоя 0,5 см против раствора реактивов (1,5 мл раствора трихлоруксусной кислоты и 1,5 мл дистиллированной воды). Расчет. Активность фермента рассчитывают по калибровочному графику, условия построения которого приведены в таблице.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
