практикум по биохимии. Практикум по биологической химии, изданный в 1986 году, подвергся существенной переработке, а также дополнен новыми лабораторными работами в разделах белки, липиды,
 Скачать 1.79 Mb. Скачать 1.79 Mb.
|
Работа 100. Выявление дыхательной активности микросомДыхание микросом – процесс окисления веществ кислородом с образованием воды – можно изучать или по скорости потребления кислорода, или по использованию восстановленного НАДФ, или НАД, участвующих в этих реакциях. Реактивы. Хлорид калия, 1,15%-ный раствор; трис-буфер, 0,1 М раствор с рН 7,4*; хлорид кальция, 0,04 М раствор; НАДФ·Н, 1,0 мМ раствор, свежеприготовленный; НАД·Н, 1,0 мМ раствор, свежеприготовленный. Оборудование. Пипетки вместимостью 0,1; 1; 5; 10 мл; штатив с пробирками; стеклянные палочки; чашки Петри; мерный цилиндр вместимостью 25 мл; фильтровальная бумага; шприц с иглой; гомогенизатор с пестиком из тефлона; аптечные весы с разновесами; моторчик для гомогенизации; флуороскоп; центрифуга ЦЛР. Материал. Печень (свежая) забитого животного. а. Выделение микросомальной фракции из печени крысы. Метод основан на разной скорости осаждения субклеточных частиц печени при центрифугировании в зависимости от их размера и плотности. Для уменьшения фактора осаждения микросом добавляется хлорид кальция, вызывающий их преципитацию. Ход определения. После забоя животного печень отмывают от крови раствором хлорида калия из шприца, обсушивают ее фильтровальной бумагой и помещают в чашку Петри, стоящую на льду. 3 г ткани печени измельчают ножницами и переносят в стакан гомогенизатора, куда предварительно наливают 9 мл охлажденного раствора хлорида калия. Стакан помещают в лед и размельчают ткань с помощью тефлонового пестика при 1000 об/мин, делая 15-20 движений стаканом вверх-вниз. Гомогенат разливают в две центрифужные гильзы и центрифугируют на ЦЛР при 10000g в течение 20 мин при 0-4˚С. Надосадочную жидкость сливают в другие центрифужные гильзы, прибавляют к ней раствор хлорида кальция в соотношении 1:5 по объему. Перемешивают и вновь центрифугируют при 3000g в течение 15 мин при 0-4˚С. Надосадочную жидкость сливают. К осадку, содержащему обогащенную фракцию микросом, добавляют 3 мл раствора трис-буфера и с помощью пипетки, втягивая и выдувая жидкость, получают взвесь микросом. б. Обнаружение дыхательной активности микросом печени флуориметрическим методом. Метод основан на наблюдении за скоростью падения флуоресценции НАДФ·Н или НАД·Н в процессе их окисления препаратами микросом. Ход определения. В две пробирки наливают по 2,8 мл трис-буфера. Затем в одну из них добавляют 0,1 мл полученной взвеси микросом, а в другую – 0,1 мл дистиллированной воды (контрольная проба). Ставят обе пробирки в штатив предварительно включенного флуороскопа, вносят в них по 0,1 мл раствора НАДФ·Н или НАД·Н и быстро перемешивают стеклянной палочкой. Наблюдают за изменением флуоресценции в обеих пробах. Оформление работы. По изменению флуоресценции указать на наличие дыхательной функции микросом. Практическое значение работы. Выделение микросом используется в научных исследованиях для изучения их функций, в том числе дыхательной, при различных физиологических состояниях и при патологии, а также для исследования действия лекарств и ядов. Работа 101. Исследование окислительного N-деметилирования в микросомах печени по Нашу Реактивы. Гидроксид натрия, 3%-ный раствор; биуретовый реактив*; трис-буфер, 0,1 М раствор с рН 7,4*; НАДФ·Н, 1 мМ раствор, свежеприготовленный; хлорид магния, 2,5 мкМ раствор; амидопирин, 80 мМ раствор; сульфат цинка, 25%-ный раствор; гидроксид бария, насыщенный раствор; реактив Наша*. Оборудование. Штатив с пробирками; пипетки вместимостью 0,1; 1; 2 и 5 мл; спектрофотометр. Материал. Взвесь микросом печени, полученная в работе 85, а. 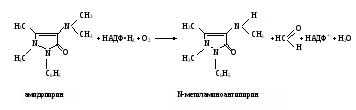 Метод основан на измерении содержания в среде формальдегида, образующегося при окислительном N-деметилировании амидопирина в микросомах: Метод основан на измерении содержания в среде формальдегида, образующегося при окислительном N-деметилировании амидопирина в микросомах:Формальдегид дает с реактивом Наша комплекс желтого цвета. Ход определения. Проверяют содержание белка в микросомальной фракции, для чего помещают в пробирку 0,05 мл взвеси микросом, добавляют 3,95 мл раствора гидроксида натрия и 0,2 мл биуретового реактива. Смесь перемешивают и через 30 мин измеряют экстинкцию опытной пробы против контрольной (4 мл раствора NaOH и 0,2 мл биуретового реактива) на СФ при 330 нм в кювете с толщиной слоя 1 см. Экстинкции 0,30-0,60 примерно соответствует содержание белка 2-4 мг в 0,1 мл взвеси микросом. Если экстинкция выше, то необходимо взвесь микросом разбавить трис-буфером так, чтобы получилась нужная концентрация белка. В опытную и контрольную пробирки вносят по 0,4 мл растворов трис-буфера и хлорида магния, по 0,2 мл НАДФ·Н и по 0,1 мл взвеси микросом. Перемешивают содержимое пробирок. 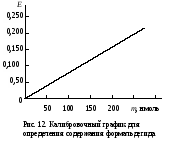 В опытную пробу добавляют 0,11 мл раствора амидопирина, а в контрольную – сначала по 0,25 мл растворов сульфата цинка и гидроксида бария, а затем 0,11 мл амидопирина. Содержимое перемешивают. В опытную пробу добавляют 0,11 мл раствора амидопирина, а в контрольную – сначала по 0,25 мл растворов сульфата цинка и гидроксида бария, а затем 0,11 мл амидопирина. Содержимое перемешивают.Помещают обе пробирки на 20 мин в водяную баню при 37˚С, периодически встряхивая пробы. По окончании инкубации реакцию в опытной пробе останавливают, добавив по 0,25 мл растворов сульфата цинка и гидроксида бария. Содержимое перемешивают. Центрифугируют обе пробы при 3000 об/мин в течение 10 мин. Отбирают по 1 мл надосадочной жидкости в две другие пробирки и приливают в них по 2 мл реактива Наша. Ставят пробы на 45 мин в водяную баню при 37˚С. Измеряют экстинкцию опытной пробы против контрольной на СФ при 412 нм в кювете с толщиной слоя 1 см. Расчет проводят по формуле: аV1,71·333 х = —————————— , 20·0,1·1000 где х – скорость N-деметилирования амидопирина, мкмоль/(мин·кг печени); а – количество формальдегида, найденное по калибровочному графику (рис.12), нмоль; V – объем взвеси микросом в трис-буфере, мл; 1,71 – объем инкубационной смеси, мл; 0,1 – объем взвеси микросом, взятый на исследование, мл; 20 – время инкубации, мин; 333 – коэффициент пересчета на 1 кг ткани печени; 1000 – коэффициент пересчета нмоль в мкмоль. Оформление работы. Рассчитать скорость микросомального окисления амидопирина. В выводе указать на значение этого процесса. Практическое значение работы. Исследование окисления ксенобиотиков монооксигеназной цепью микросом дает возможность оценить функцию этого процесса в норме и патологии, а также изучить особенности превращения различных соединений, токсичность и действие их продуктов на организм. Работа 102. Определение гидроксилазной активности микросом печени по Като и Жилете Реактивы. Трис-HCl буфер, 0,08 М раствор с рН 7,4*; хлорид магния, 0,16 М раствор; анилин перегнанный, 0,03 М раствор; трихлоруксусная кислота, 15%-ный раствор; карбонат натрия, 10%-ный раствор; фенол, 2%-ный раствор в 0,2 М растворе гидроксида натрия; НАДФ∙Н, 0,03 М раствор; биуретовый реактив*; гидроксид натрия, 3%-ный раствор; реактивы для выделения микросом, как в работе 86; 4-аминофенол, свежеприготовленный раствор для построения калибровочного графика. (5,45 мг/л). Оборудование. Штатив с пробирками; пипетки вместимостью 0,1; 0,2; 1 и 5 мл; водяная баня; лабораторная центрифуга с центрифужными весами; центрифуга рефрижераторная ЦЛР; ФЭК типа КФК-2 или спектрофотометр. Материал. Печень животного после забоя.  Метод основан на определении содержания 4-аминофенола, образующегося при гидроксилировании анилина в монооксигеназной цепи микросом и с участием цитохрома Р450: Метод основан на определении содержания 4-аминофенола, образующегося при гидроксилировании анилина в монооксигеназной цепи микросом и с участием цитохрома Р450: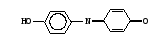 4-аминофенол при взаимодействии с фенолом и в присутствии карбоната натрия образует окрашенный индофенольный комплекс синего цвета: 4-аминофенол при взаимодействии с фенолом и в присутствии карбоната натрия образует окрашенный индофенольный комплекс синего цвета:Ход определения. Выделяют фракцию микросом печени, как указано в работе 100, затем определяют содержание белка в полученной микросомальной фракции; для этого отбирают 0,05 мл взвеси микросом в пробирку, добавляют 3,95 мл раствора гидроксида натрия и 0.2 мл биуретового реактива. Перемешивают содержимое стеклянной палочкой и через 30 мин измеряют экстинкцию этого раствора против контрольного (4 мл гидроксида натрия и 0,2 мл биуретового реактива) на ФЭКе и СФ при 330 нм в кювете с толщиной слоя 1 см. Рассчитывают концентрацию белка по калибровочному графику (содержание белка в 0,1 мл взвеси микросом должно составлять примерно 2-4 мг). Для изучения гидроксилирования анилина берут две чистые пробирки и готовят контрольную и опытную пробы. Последовательность внесения компонентов и их объем приведены в таблице.
| ||||||||||||||||||||||||||||||||
