практикум по биохимии. Практикум по биологической химии, изданный в 1986 году, подвергся существенной переработке, а также дополнен новыми лабораторными работами в разделах белки, липиды,
 Скачать 1.79 Mb. Скачать 1.79 Mb.
|
|
Из каждой пробы отбирают по 2 мл раствора в две пробирки (контрольную и опытную), которые обрабатывают как указано выше. По полученным данным строят калибровочный график. Расчет. При расчете рекомендуется проводить пересчет на 1 г креатинина, т.к. диурез за сутки может быть различным. Содержание АЛК в моче рассчитывают по формуле с использованием калибровочного графика: С·10 АЛК = ————— ,А·2где С – количество АЛК в пробе (мкмоль), найденное по калибровочному графику; А – содержание креатинина в пробе (г); 10 – коэффициент разведения мочи; 2 – объем фильтрата (мл). Коэффициент пересчета микрограмм АЛК в микромоли – 0,0076. Оформление работы. По полученным экстинкциям сделать расчет содержания дельта-аминолевулиновой кислоты и вывод о причине возможных изменений. Практическое значение работы. В норме содержание АЛК в моче 3,9-19 мкмоль/г креатинина (0,52-2,5 мг/г креатинина). Выделение аминолевулиновой кислоты с мочой увеличивается при патологических процессах, связанных с нарушением порфиринового обмена, а также при интоксикации свинцом, бензолом и другими токсическими веществами. Работа 76. Количественное определение содержания копропорфирина в моче по методу Соулсби в модификации Римингтона Реактивы. Уксусная кислота ледяная; эфир медицинский; соляная кислота 1,4 моль/л; йод, спиртовой раствор 0,039 моль/л; раствор йода в соляной кислоте (200 объемов соляной кислоты и 1 объем спиртового раствора йода). Оборудование. Штатив с пробирками; пипетки вместимостью 0,2; 2,0 и 5,0; делительные воронки, спектрофотометр. Материал. Свежевыделенная моча (срок хранения не более 3-х часов). Метод основан на способности йода переводить копропорфириноген в копропорфирин, который определяется спектрофотометрически по разнице оптической плотности при трех длинах волн. Ход определения. В делительную воронку вносят 2 мл мочи, 0,2 мл ледяной уксусной кислоты, 5 мл эфира и встряхивают в течение 1 минуты. После разделения фаз нижний водный слой отбрасывают. К эфирному слою, содержащему копропорфирин и копропорфириноген, добавляют 5 мл раствора йода в соляной кислоте для перевода копропорфириногена в копропорфирин, встряхивают в течение 1 минуты. После разделения фаз нижний слой переносят в пробирку, термостатируют при 37˚С, в течение 5 минут. Затем содержимое пробирки встряхивают и измеряют оптическую плотность раствора в кюветах с толщиной слоя 1 см при трех длинах волн: 380, 402 и 430 нм против 1,41 моль/л раствора соляной кислоты. Расчет проводят по формуле: [2·E402 – (E430 + E380)] ∙ 2,093·1,52 нмоль/г креатинина КП = ————————————————————————————————————— А где Е402, Е430, Е380 – оптическая плотность раствора при соответствующих длинах волн; А – содержание креатинина в пробе (г); 1,52 – коэффициент пересчета микрограмм КП в наномоль; 2,093 – коэффициент для расчета содержания КП, предложенный Римингтоном. Оформление работы. По полученным результатам сделать расчет содержания копропорфирина и сделать вывод о причине возможных изменений. Практическое значение работы. В норме содержание копропорфирина в моче 30,5-122 нмоль/г креатинина (20-80 мкг/г креатинина). Повышение содержания копропорфириа в моче наблюдается при наследственной копропорфирии, острой перемежающейся порфирии, эритропоэтической уропорфирии, а также при циррозе, гепатите, свинцовой интоксикации. РЕГУЛЯТОРЫ ОБМЕНА ВЕЩЕСТВК регуляторам метаболизма можно отнести витамины, гормоны, гормоноподобные вещества и медиаторы. Свою функцию они осуществляют посредством модификации активности ферментов или влияния на их количество в клетках. Поэтому при исследовании данной группы биологических соединений применяют как методы качественного и количественного анализа этих веществ и продуктов их обмена, так и оценку состояния системы регуляторов организма по их действию на соответствующие звенья метаболизма. 1. Исследование витаминов Работа 77. Качественные реакции на витаминыРеактивы. Хлороформ; серная кислота, конц.; сульфаниловая кислота, 1%-ный раствор; нитрит натрия, 5%-ный раствор, свежеприготовленный; карбонат натрия, 10%-ный раствор; азотная кислота, конц.; диэтилдитиокарбамат натрия, 2%-ный спиртовой раствор; гидроксид натрия, 4%-ный спиртовой раствор; гидросульфит натрия, порошок; хлорид железа (III), кристаллический; тиомочевина, кристаллическая. Оборудование. Штатив с пробирками; скальпель; весы аптечные с разновесами; беззольные фильтры; флуороскоп. Материал.
а. Проба Друммонда на ретинол (витамин А). Метод основан на способности концентрированной серной кислоты отнимать воду от ретинола с образованием окрашенных продуктов. Ход определения. В пробирку вносят 2 капли рыбьего жира, 5 капель хлороформа и 1-2 капли концентрированной серной кислоты. Появляется голубое окрашивание, переходящее в буро-красное. б. Обнаружение кальциферола (витамин Д). Метод основан на взаимодействии кальциферола с гидрохлоридом анилина с образованием окрашенных продуктов. Ход определения. В сухую пробирку помещают 10 капель анилинового реактива и прибавляют 5 капель рыбьего жира. Содержимое пробирки осторожно при постоянном перемешивании нагревают до кипения и кипятят в течение 30 с. В присутствии витамина Д желтая эмульсия приобретает вначале грязно-зеленое, а затем буро-красное или красное окрашивание. в. Качественная реакция на токоферол (витамин Е). Метод основан на образовании соединений хиноидной структуры, окрашивающихся в красный цвет, при действии сильных окислителей (концентрированной азотной кислоты) на токоферол. Ход определения. В сухую пробирку вносят 5 капель спиртового раствора токоферола и добавляют 10 капель концентрированной азотной кислоты. Встряхивают. Наблюдают за развитием красного окрашивания. г. Качественная реакция на нафтохинон (витамин К). Метод основан на взаимодействии диэтилдитиокарбамата с витамином К в щелочной среде с образованием комплекса голубого цвета. Ход определения. В пробирку вносят 4 капли спиртового раствора диэтилдитиокарбамата натрия и 4 капли раствора гидроксида натрия. Встряхивают и наблюдают за развитием окраски. д. Обнаружение тиамина (витамин В1). Метод основан на способности тиамина образовывать с диазофенилсульфоновой кислотой комплекс оранжево-красного цвета в щелочной среде. Ход определения. В пробирку вносят 5 капель раствора сульфаниловой кислоты и прибавляют 5 капель раствора нитрита натрия. К полученному диазореактиву добавляют на кончике скальпеля порошок тиамина и 5 капель раствора карбоната натрия. Встряхивают. Появляется оранжево-красное окрашивание. е. Обнаружение рибофлавина (витамин В2 и флавиновых коферментов. Метод основан на способности окисленных форм рибофлавина и флавиновых коферментов (ФМН и ФАД) давать в ультрафиолетовом свете желто-зеленую флуоресценцию, интенсивность которой зависит от их концентрации. Восстановленные формы флавинов не флуоресцируют. Ход определения. В одну пробирку вносят 10 капель раствора рибофлавина, в другую – рибофлавинмононуклеотида, в третью – флавината, приливают в каждую из них по 5 мл воды и перемешивают встряхиванием. Ставят пробирки в штатив флуороскопа и сравнивают интенсивность флуоресценции трех проб. Прибавляют в каждую пробирку на кончике скальпеля порошок гидросульфита натрия (восстановитель) и наблюдают за гашением флуоресценции. ж. Качественная реакция на рутин (витамин Р). Метод основан на взаимодействии рутина с хлоридом железа (III) с образованием комплексного соединения зеленого цвета. Ход определения. На аптечных весах берут навеску 100 мг чая, добавляют 15 мл дистиллированной воды и кипятят в течение 3 мин. Дают остыть, отбирают в пробирку 1 мл жидкости и добавляют несколько кристалликов хлорида железа (III). Перемешивают и разводят в 2-3 раза дистиллированной водой. Развивается зеленое окрашивание. з. Качественная реакция на цианкобаламин. Метод основан на способности кобальта, входящего в состав витамина В12, при высокой температуре взаимодействовать с тиомочевиной с образованием комплекса зеленого цвета. Ход определения. На беззольный фильтр наносят 2-3 капли 10%-ного раствора тиомочевины, высушивают на газовой горелке, после чего наносят 1-2 капли раствора витамина В12 и снова высушивают. Образуется зеленое кольцо. Оформление работы. Все результаты качественных реакций на витамины оформить в виде таблицы.
Практическое значение работы. Качественные реакции на витамины позволяют обнаружить их наличие в лекарственных препаратах и после экстракции в пищевых продуктах и лекарственных растениях. Принцип, положенный в основу качественных реакций на витамины, используется при разработке количественного определения их в различных природных объектах и лекарствах. Работа 78. Определение содержания тиамина и рибофлавина флуориметрическим методом в поливитаминных препаратах Реактивы. Соляная кислота, 0,1 М раствор; окислительная смесь*; Н-бутанол; этанол, 96%-ный; тиамин, стандартный раствор концентрации 10 мкг/мл; уксусная кислота, ледяная; перманганат калия, 4%-ный раствор; гидроксид водорода, 3%-ный раствор; гидросульфит натрия, порошок; рибофлавин, стандартный раствор концентрации 0,005 мг/мл. Оборудование. Штатив с пробирками; пенициллиновые флакончики с полиэтиленовыми пробками; пипетки вместимостью 1 и 5 мл; мерный цилиндр вместимостью 50 мл; ступка с пестиком; флуориметр ЭФ-3 или БИАН. Материал. Драже поливитаминов. а. Определение содержания тиамина. Метод основан на способности тиамина окисляться гексацианоферратом (III) калия в щелочной среде в тиохром, который после извлечения его из раствора бутиловым спиртом дает в ультрафиолетовом свете сине-голубую флуоресценцию: 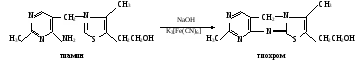 Ход определения. Драже поливитаминов разминают в ступке, добавляя 30 мл раствора соляной кислоты, и тщательно перемешивают. В один флакончик (контроль) вносят 5 мл соляной кислоты, во второй (опыт) – 1 мл водного экстракта драже витаминов и 4 мл дистиллированной воды, в третью (стандарт) – 5 мл раствора тиамина. Во все флакончики приливают по 1,5 мл окислительной смеси и осторожно встряхивают их до полного перемешивания. Затем добавляют в них по 5 мл бутанола, плотно закрывают пробками и интенсивно встряхивают 5 мин. После расслоения жидкости осторожно прибавляют по 0,5 мл этанола (для просветления бутанола). Осторожно сливают просветленный бутанольный слой в кювету флуориметра и измеряют интенсивность флуоресценции опытной и контрольной проб со стандартным раствором тиамина. Расчет проводят по формуле (Еоп – Ек)0,01·1·5,5 х = —————————— , Ест30 где х – содержание тиамина в драже, мг; Еоп – показания флуориметра для опытной пробы; Ек – показания флуориметра для контрольной пробы; Ест – показания флуориметра для стандартной пробы; 0,01 – концентрация тиамина в стандартном растворе, мг/мл; 30 – объем экстракта драже, мл; 1 – объем экстракта, взятого на исследование, мл; 5,5 – объем пробы, просветленной этанолом, мл. б. Определение содержания рибофлавина. Принцип метода см. работу 73, е. Ход определения. Драже поливитаминов разминают в ступке, добавляя 30 мл раствора соляной кислоты, и тщательно перемешивают. В одну пробирку вносят 7 мл дистиллированной воды, во вторую (опытную) – 2 мл экстракта драже и 5 мл дистиллированной воды, в третью (стандартная) – 1 мл стандартного раствора рибофлавина и 6 мл воды. Во все пробирки приливают по 10 капель ледяной уксусной кислоты и по 1,5 мл раствора перманганата калия (для окисления посторонних флуоресцирующих веществ). Содержимое пробирок встряхивают и добавляют по каплям (примерно 5 капель) гидроксид водорода при постоянном помешивании стеклянной палочкой до полного просветления жидкости. Растворы отстаивают 5 мин, до прекращения выделения пузырьков газа. Сливают жидкость в кюветы флуориметра и измеряют интенсивность флуоресценции всех проб. Расчет проводят по формуле (Еоп – Ек)2·0,005·7 х = —————————— , Ест30 где х – содержание рибофлавина в драже, мг; Еоп – показания флуориметра для опытной пробы; Ек – показания флуориметра для контрольной пробы; Ест – показания флуориметра для стандартной пробы; 30 – объем экстракта драже, мл; 2 – объем экстракта драже, взятого на исследование, мл; 0,005 – концентрация рибофлавина в стандартном растворе, мг/мл; 7 – объем флуориметрируемых проб, мл. Оформление работы. Рассчитать содержание исследуемых витаминов в драже и сделать вывод о возможности практического использования флуориметрического метода. Практическое значение работы. Флуориметрические методы определения тиамина и рибофлавина применяются для определения этих витаминов в пищевых продуктах, лекарственных растениях и готовых лекарственных препаратах, а также для изучения обеспеченности ими организма. Обеспеченность этими витаминами может быть определена по их уровню в крови и по экскреции с мочой. Низкое содержание витаминов в организме наблюдается при гиповитаминозах, болезнях печени, сердечно-сосудистых заболеваниях, заболеваниях желудочно-кишечного тракта и других патологических состояниях. Работа 79. Количественное определение аскорбиновой кислоты в лекарственных растениях Реактивы. Соляная кислота, 2%-ный раствор; 2,6-дихлорфенолиндофе нол, 0,001 М раствор. Оборудование. Пипетки вместимостью 5 и 10 мл; мерная колба вместимостью 100 мл; воронка; вата; аптечные весы с разновесами; микробюретка; скальпель; ступки с пестиком; стаканчики для титрования. Материал.
Метод основан на способности аскорбиновой кислоты к окислительно-восстановительным превращениям. В ходе окисления аскорбиновой кислоты происходит восстановление 2,6-дихлорфенолиндофенола с образованием его лейкоформы. На полное окисление аскорбиновой кислоты в растворе указывает появление розового окрашивания при небольшом избытке 2,6-дихлорфенолиндофенола в кислой среде: 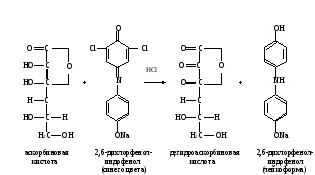 Ход определения. На аптечных весах берут навески лекарственного сырья: цветы бузины, лист крапивы, цветы тысячелистника, кора крушины, лист сенны, витаминный чай и плоды аронии черноплодной (или таблетки) по 0,5 г; шиповник, очищенный от семян, - 0,2 г. Исследуемый материал переносят в ступку, измельчают скальпелем и растирают в ступке с 5 мл раствора соляной кислоты. Вытяжку фильтруют через тонкий слой ваты в мерную колбу, вместимостью 100 мл. Извлечение витамина С из той же навески повторяют три раза с таким же объемом соляной кислоты, фильтруя каждый раз полученную вытяжку в ту же мерную колбу. Содержимое колбочки доводят до метки дистиллированной водой, перемешивают. Для определения отбирают 10 мл вытяжки в стаканчик и титруют содержимое раствором 2,6-дихлорфенолиндофенола, налитого в микробюретку, до появления розового окрашивания, не исчезающего в течение 30 с. Расчет проводят по формуле: 0,088V100·1000 х = —————————— , 10b где х – содержание аскорбиновой кислоты, мг/кг; 0,088 – масса аскорбиновой кислоты, соответствующая 1 мл 0,001 М раствора 2,6-дихлорфенолиндофенола, мг; 100 – разведение взятой пробы; 1000 – коэффициент пересчета на 1 кг сырья; 10 – объем жидкости, взятый для титрования, мл; V – объем 2,6-дихлорфенолиндофенола, пошедший на титрование, мл; b – навеска исследуемого материала, г. Оформление работы. Полученные данные оформить в виде таблицы и сделать вывод о значении исследованного растительного материала как источника аскорбиновой кислоты. Указать в выводе о целесообразности применения растительного сырья с целью профилактики С-витаминной недостаточности.
Практическое значение работы. Определение содержания аскорбиновой кислоты в пищевых продуктах и лекарственных растениях необходимо для составления правильного рациона, удовлетворяющего потребность организма в этом витамине. Богаты витамином С плоды шиповника, черной смородины, цитрусовых и т.д. Аскорбиновая кислота применяется для профилактики гиповитаминоза и простудных заболеваний, для лечения воспалительных процессов, атеросклероза. Она способствует усилению регенеративных процессов. Определение аскорбиновой кислоты в крови и моче используется для выявления состояния гиповитаминоза. Аскорбиновая кислота участвует в окислительно-восстановительных процессах при синтезе стероидных гормонов, обмене ароматических аминокислот, образовании соединительной ткани. 2. Исследования гормонов, медиаторов и их метаболитов В клинико-биохимических лабораториях и фармации используются методы качественного и количественного анализа для определения гормонов, включая и гормоноиды, и медиаторов в биологическом материале и лекарствах. В то же время отклонения в содержании гормонально-медиаторных соединений регистрируют по нарушению регулируемых ими звеньев в обмене веществ. Работа 80. Качественные реакции на белково-пептидные гормоны. Реактивы. Биуретовый реактив*; нингидрин, 0,5%-ный водный раствор; гидроксид натрия, 20%-ный раствор; ацетат свинца, 5%-ный раствор. Оборудование. Глазные пипетки; штатив с пробирками. Материал.
Принцип метода и ход определения см. работу 1, а, б, е. Берут шесть пробирок и вносят в три из них по 5 капель инсулина, а в три другие – по 5 капель окситоцина. Проделывают с ними биуретовую, нингидриновую реакции и реакцию Фоля, как описано в работе 1, а, б, е. Оформление работы. Данные занести в таблицу.
В выводах отметить присутствие соответствующих групп и аминокислот в исследуемых гормональных препаратах. Работа 81. Качественные реакции на гормоны – производные аминокислот Реактивы. Хлорид железа (III), 0,15 М раствор; сульфаниловая кислота, 1%-ный раствор; нитрит натрия, 5%-ный раствор; карбонат натрия, 10%-ный раствор; гексацианоферрат (III) калия K3[Fe(CN)6] 0,2%-ный раствор; гидроксид натрия, 5 М раствор; аскорбиновая кислота, кристаллическая; азотная кислота, конц.; иодат калия KIO3, 1%-ный раствор; хлороформ. Оборудование. Штатив с пробирками; глазные пипетки; стеклянные палочки; водяная баня; флуороскоп. Материал.
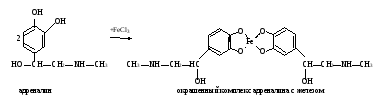 а. Реакция на адреналин с хлоридом железа (III). Метод основан на способности пирокатехиновой группировки адреналина образовывать с хлоридом железа (III) комплексное соединение изумрудно-зеленого цвета: а. Реакция на адреналин с хлоридом железа (III). Метод основан на способности пирокатехиновой группировки адреналина образовывать с хлоридом железа (III) комплексное соединение изумрудно-зеленого цвета:Ход определения. В пробирку приливают 10 капель раствора адреналина и добавляют 1 каплю раствора хлорида железа (III). Наблюдают появление характерного окрашивания. б. Реакция на адреналин с диазобензолсульфокислотой. Метод основан на способности адреналина образовывать с диазобензолсульфокислотой соединение красного цвета. Ход определения. Для получения диазобензолсульфокислоты в пробирку наливают по 3 капли раствора сульфаниловой кислоты и нитрита натрия, перемешивают встряхиванием. Затем в пробирку добавляют 5 капель раствора адреналина и 3 капли раствора карбоната натрия. Содержимое перемешивают встряхиванием и наблюдают за развитием характерной окраски. в. Обнаружение адреналина по образованию флуоресцирующего продукта его окисления – адренолютина. Метод основан на способности адреналина окисляться под действием K3[Fe(CN)6] в адренохром, из которого в щелочной среде образуется адренолютин, имеющий желто-зеленую флуоресценцию: 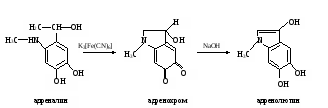 Ход определения. В две пробирки вносят по 1 капле исходного раствора адреналина и добавляют в одну из них 5, а во вторую 10 мл воды. Перемешивают стеклянной палочкой. В две другие пробирки отмеривают по 4 мл разведенных растворов адреналина, приливают по 0,3 мл раствора K3[Fe(CN)6] и оставляют стоять 5 мин (при этом адреналин окисляется в адренохром). В каждую пробирку прибавляют на кончике скальпеля кристаллической аскорбиновой кислоты и по 4 мл раствора гидроксида натрия. Содержимое перемешивают стеклянной палочкой (аскорбиновая кислота препятствует дальнейшему окислению адренохрома, а гидроксид натрия способствует превращению его в адренолютин). Пробирки помещают в штатив флуороскопа и сравнивают интенсивность характерной флуоресценции в пробах. г. Обнаружение иодтиронинов. Метод основан на отщеплении при кислотном гидролизе тиреоидных гормонов (иодтиронины) иодистоводородной кислоты Иодтиронины HIO3 (тироксин, HI + Продукты гидролиза трииодтиронин) нагревание при взаимодействии которой с иодатом калия выделяется свободный иод: 5HI + KIO3 + HNO3 → 3I2 + KNO3 + 3H2O В хлороформе иод имеет фиолетовую окраску. Ход определения. В пробирку помещают несколько кристаллов тиреоидина, добавляют 10 капель концентрированной азотной кислоты и нагревают 3-5 мин в кипящей водяной бане. Затем приливают 20 капель раствора иодата калия. Содержимое перемешивают и охлаждают. В пробирку добавляют 15 капель хлороформа. Встряхивают и отмечают характерную окраску хлороформа. Оформление работы. Данные занести в таблицу.
|
