Лаб. практикум. Практикум по биологической химии методические указания к проведению лабораторных работ по биологической химии для студентов второго курса
 Скачать 1.02 Mb. Скачать 1.02 Mb.
|
биохимия простых белковОсновную роль в структуре и процессах жизнедеятельности живых организмов играют белки, представляющие собой высокомолекулярные азотсодержащие биополимеры со специфическими структурами, состоящие из 20 природных аминокислот, соединенных между собой пептидными связями. Простые белки (протеины) состоят только из аминокислот и являются высокомолекулярными полимерными органическими соединениями – полипептидами. Лабораторная работа №1Качественные цветные реакции на функциональные группы белков и аминокислотПри взаимодействии белка с отдельными химическими веществами возникают окрашенные продукты реакции. Образование их обусловлено присутствием в молекуле белка той или иной аминокислоты, имеющей в своем составе определенную химическую группировку. Значение качественных цветных реакций на функциональные группы белков и аминокислот в том, что они дают возможность обнаружить присутствие белка в биологических жидкостях, растворах, лекарственных препаратах и идентифицировать индивидуальные аминокислоты. Эти реакции применяют как для качественного, так и для количественного определения белка и содержащихся в нем аминокислот.
Биуретовая реакция открывает пепетидную связь Её способны давать вещества, которые содержат не менее двух пептидных связей. Положительную биуретовую реакцию отдельные аминокислоты не дают, за исключением гистидина (His), серина (Ser), треонина (The) и аспарагина (Asn), с которыми биуретовая реакция получается при условии больших концентраций их в растворе. При добавлении сернокислой меди к сильнощелочному раствору белка или полипептида образуются соединения меди с пепетидной группировкой, окрашенные в красно-фиолетовый или сине-фиолетовый цвет в зависимости от длины полипептидной цепи. Раствор белка даёт сине-фиолетовое окрашивание, а продукты неполного гидролиза (пептоны) – розовое или красное окрашивание. Принцип метода. В сильно щелочной среде пептидные группы полипептидных цепей переходят в енольную форму, которая, взаимодействуя с ионами Cu2+ , образует окрашенный (фиолетового цвета) биуретовый комплекс. При этом енольная форма полипептида, образованная в сильнощелочной среде, дает отрицательный заряд, и ее кислород, взаимодействуя с медью, образует ковалентную связь, а медь, взаимодействуя с атомами азота, образует координационные связи. 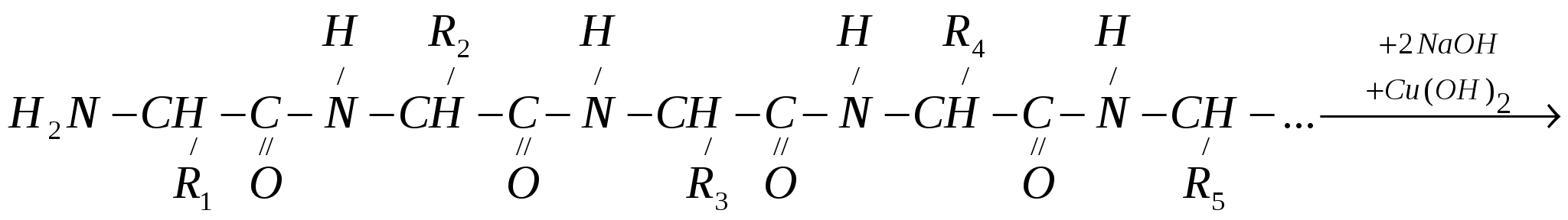 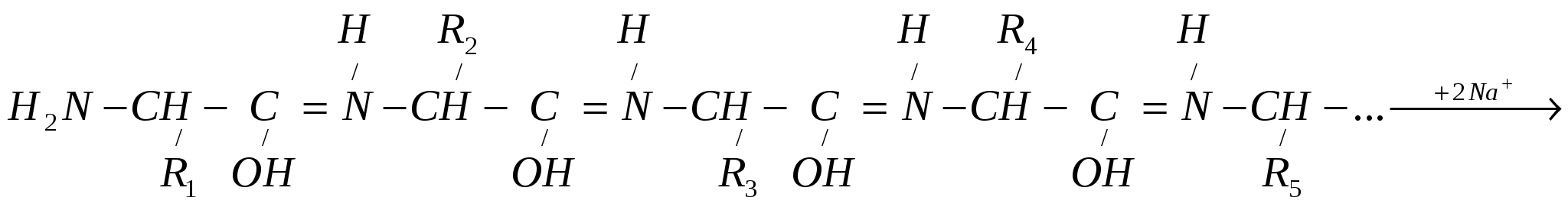 Енольная форма пептидной связи ( 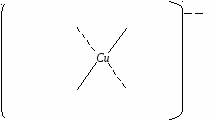 Комплекс фиолетового цвета Исследуемый материал и реактивы 1. Раствор яичного белка (1%). 2. Гидроксид натрия(10%). 3. Сернокислая медь (1%). Ход работы К 5 каплям раствора белка прибавляют 3 капли 10% раствора едкого натра и 1 каплю 1% раствора сернокислой меди и перемешивают. Содержимое пробирки приобретает сине-фиолетовый цвет. Нельзя добавлять избыток сернокислой меди, так как синий осадок гидрата окиси меди маскирует характерное фиолетовое окрашивание биуретового комплекса белка.
Нингидриновая реакция характерна для аминогрупп, находящихся в альфа-положении. Растворы белка, альфа-аминокислот и пептидов при нагревании с нингидрином дают синее или фиолетовое окрашивание. Принцип метода. В этой реакции альфа-аминокислоты и пептиды окисляются нингидрином и подвергаются окислительному дезаминированию и декарбоксилированию с образованием аммиака, альдегида и СО2. Нингидрин восстанавливается и связывается со второй молекулой нингидрина посредством молекулы аммиака, образуя продукты конденсации, окрашенные в синий, фиолетовый, красный, а в случае пролина – в желтый цвет. Нингидриновая реакция используется для количественного определения альфа-аминокислот в аминокислотных анализаторах, а также широко используется в хроматографическом анализе и для колориметрического количественного определения аминокислот. 1.  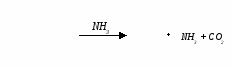 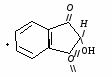 н  ингидрин аминокислота альдегид нингидрин ингидрин аминокислота альдегид нингидринокисленный восстановленный (гидриндантин (бесцветный)) 2. 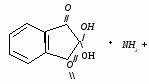 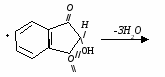 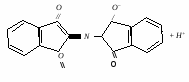 нингидрин нингидрин продукт конденсации окисленный восстановленный пурпур Роумэна (сине-фиолетовый) Исследуемый материал и реактивы 1. Раствор яичного белка (1%). 2. Раствор нингидрина (0,5%). Ход работы В пробирку наливают 0,5 мл раствора яичного белка и прибавляют 5 капель 0,5% водного раствора нингидрина и нагревают на водяной бане до кипения. Появляется розово-фиолетовое или сине-фиолетовое окрашивание. С течением времени раствор синеет. Данная реакция не является специфичной, поскольку её дают некоторые амины и амиды кислот.
Ксантопротеиновая реакция открывает наличие в белках циклических аминокислот – фенилаланина (Phe), тирозина (Tyr), триптофана (Trp), а также свободные перечисленные кислоты. Белки, в которых циклические аминокислоты отсутствуют, не дают ксантопротенновой реакции. Принцип метода. Реакция обусловлена нитрованием бензольного кольца циклических аминокислот с образованием нитросоединений желтого цвета. При взаимодействии азотной кислоты с тирозином реакция нитрования протекает по следующему уравнению: 1. 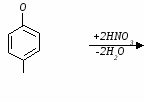 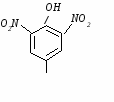 тирозин (Tyr) динитротирозин при подщелачивании возникает хиноидная структура, окрашенная в оранжевый цвет: 2. 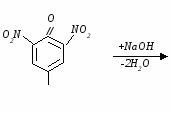 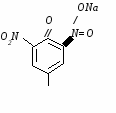 динитротирозин натриевая соль динитротирозина хиноидная форма хиноидной структуры (насыщенный желтый) (оранжевый) Исследуемый материал и реактивы 1. Раствор яичного белка (1%). 2. Азотная кислотаконцентрированная. 3. Гидроскид натрия(10%). Ход работы В пробирку вносят 0,5 мл раствора яичного белка. Добавляют 0,5 мл концентрированной азотной кислоты и осторожно нагревают. Вначале появляется осадок свернувшегося белка (под влиянием кислоты), который при нагревании окрашивается в желтый цвет. После охлаждения в пробирку наливают по каплям 10% раствор едкого натра до появления оранжевого окрашивания вследствие образования натриевой соли динитротирозина.
Реакция Фоля указывает на присутствие в белке аминокислот цистеина (Cys) и цистина, содержащих слабосвязанную серу. Метионин (Met), хотя и является содержащей серу аминокислотой, этой реакции не дает, поскольку сера в нем связана прочно. Принцип метода. Реакция состоит в том, что при кипячении белка с реактивом Фоля (плюмбит натрия в избытке NаОН) под действием щелочи цистеин или цистин легко отщепляет серу в виде сернистого натрия, который с плюмбитом дает черный или бурый осадок сернистого свинца. Интенсивность окраски зависит от количества в белке аминокислот цистеина и цистина, содержащих слабосвязанную серу и от количества белка в растворе. Реакция протекает по следующим уровням: 1. 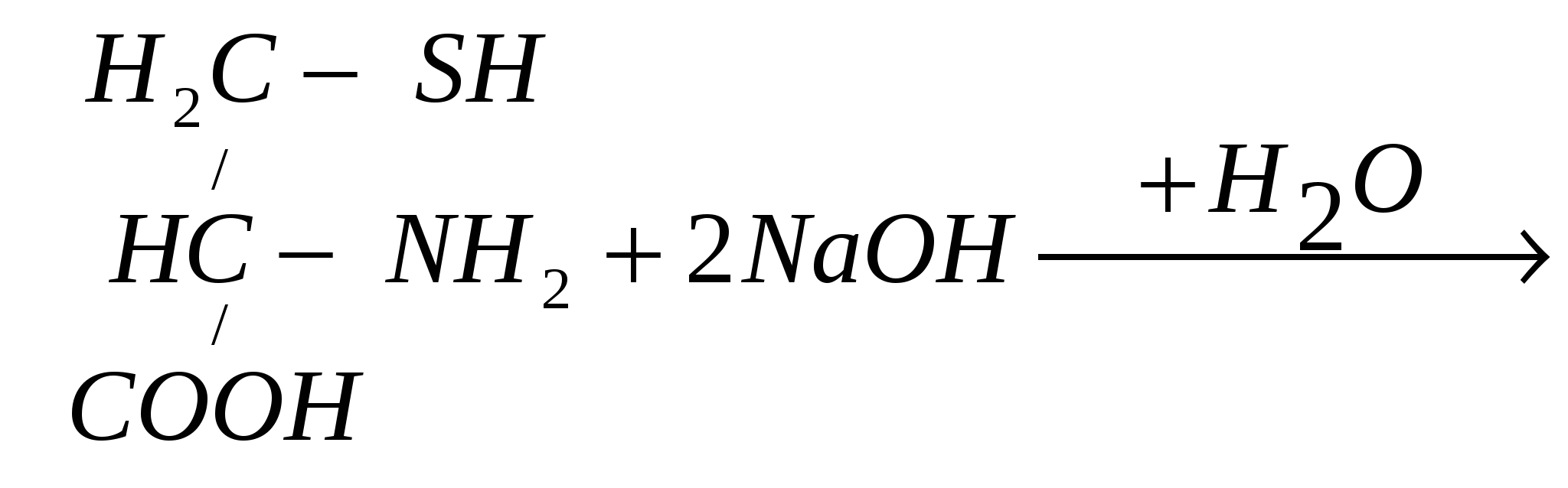 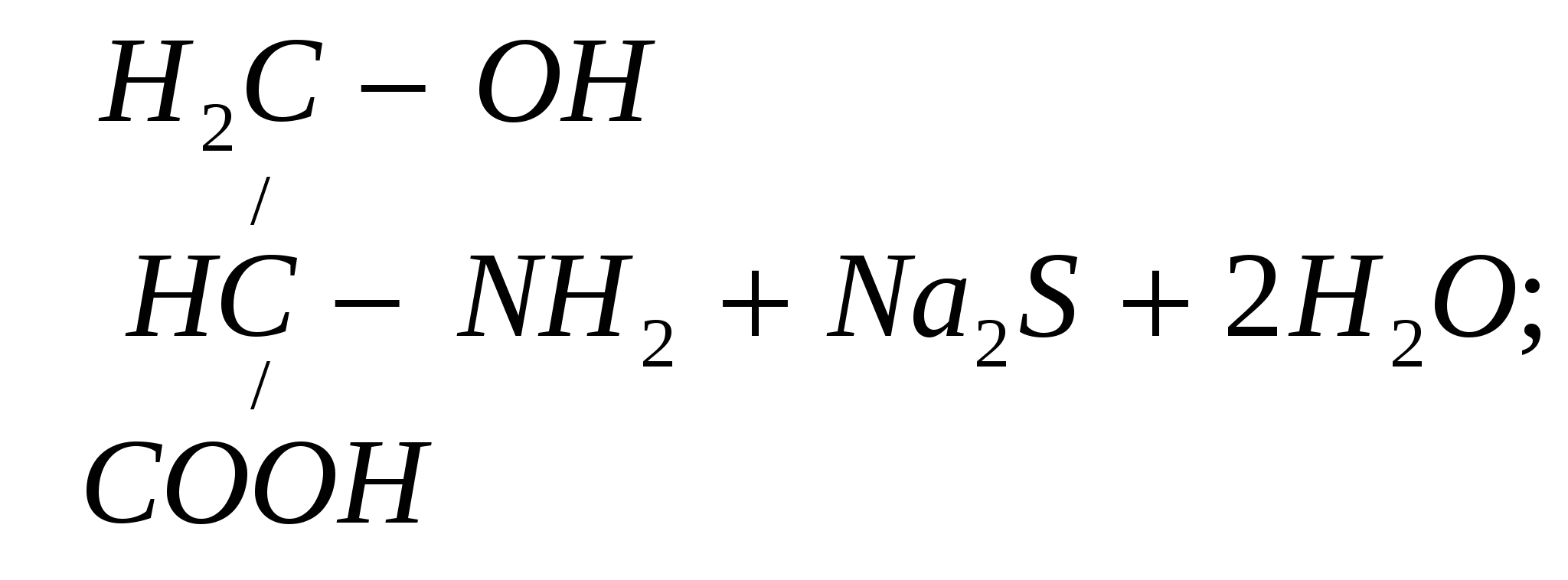 2. 2. цистеин серин осадок черного цвета Исследуемый материал и реактивы 1. Раствор яичного белка (1%). 2. Реактив Фоля. Ход работы В пробирку вносят 0,5 мл яичного белка и прибавляют 5 капель реактива Фоля. Кипятят и дают постоять 1-2 минуты. При стоянии появляется бурый или черный осадок черного цвета сернистого свинца.
Реакция Адамкевича открывает в белках аминокислоту триптофан (Trp). Принцип метода. При добавлении к раствору белка незначительных количеств глиоксиловой кислоты и при подслаивании концентрированной серной кислоты получаем красно-фиолетовое кольцо на границе раздела жидкостей, обусловленное способностью триптофана в кислой среде взаимодействовать с альдегидной группой глиоксиловой кислоты, давая окрашенные продукты конденсации. В качестве источника глиоксиловой кислоты можно использовать ледяную уксусную, в которой глиоксиловая всегда присутствует в небольшом, но вполне достаточном для этих целей количестве. 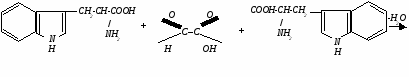 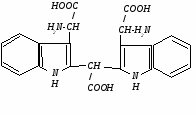 триптофан глиоксиловая кислота триптофан продукт конденсации (красно-фиолетовое кольцо) Исследуемый материал и реактивы 1. Раствор яичного белка (1%). 2. Уксусная кислота ледяная. 3. Серная кислота концентрированная. Ход работы В пробирку наливают 1 мл раствора белка и 1 мл уксусной кислоты. Осторожно (!) по стенке подслаивают 1 мл концентрированной серной кислоты, Наблюдают появление красно-фиолетового кольца. Записывают химизм реакции.
Реакция Сакагучи открывает в белках аминокислоту аргинин (Arg). Принцип метода. Аминокислота аргинин и полипептиды, содержащие ее в присутствии щелочи окисляются гипобромитом или гипохлоридом натрия и в присутствии α-нафтола образуют продукт конденсации красного цвета (гуанидиновая группировка). Реакция не является строго специфичной для аргинина. Ее дают и другие монозамещенные гуанидина (метилгуанидин, гликоциамин, агматин и др.), но они отсутствуют в молекуле белка и не мешают определению в белке аргинина. 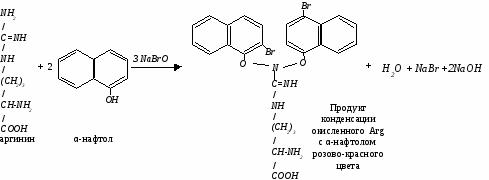 Исследуемый материал и реактивы 1. Раствор яичного белка (1%). 2. Гидроскид натрия(10%). 3. Раствор α-нафтола в спирте (0,1%). 4. Раствор гипобромита. Ход работы Вносят в пробирку 0,5 мл раствора яичного белка, добавляют 0,5 мл 10% раствора едкого натра, 5 капель 0,1% раствора α-нафтола в спирте и 1-5 капель раствора гипобромита. Появляется розово-красное окрашивание, обусловленное образованием продукта конденсации окисленного аргинина с α-нафтолом. Указания к оформлению лабораторной работы В тетради для лабораторных работ отметьте цель занятия. Полученные результаты всех цветных реакций необходимо записать в виде таблицы. Химизм каждой цветной реакции записать отдельно.
Сделайте выводы о специфичности цветных реакций на белки и аминокислоты. Контрольные вопросы
|
