Методичка ФЧЖ. Практикум по физиологии человека барнаул 2008 удк 612591. 1 Ббк 28. 903я735 л 125 Лабораторный практику по физиологии человека. Учеб пособие В. Д. Киселев, И. Н. Томилова, Н. В. Плешкова. Барнаул Издво АлтГУ, 2008. 210с
 Скачать 4.96 Mb. Скачать 4.96 Mb.
|
ОФОРМЛЕНИЕ ОТЧЕТОВ ПО ПРАКТИЧЕСКИМ РАБОТАМНакопление знаний в любой области происходит путем активного общения ученых, которое состоит в публикации результатов экспериментов в научных журналах и выступлениях на конференциях, съездах и симпозиумах. Поэтому в задачу практикума входит не только знакомство с основами экспериментальной работы, но и обучение студентов правилам изложения результатов научной работы в виде письменных отчетов и устных сообщений. Письменный отчет предлагается строить по тем же правилам, которые обычно предъявляют к публикации экспериментальных материалов научные журналы. Отчет по практическим работам включает основные разделы, которые присутствуют в научной статье, — «Введение», «Методика», «Результаты работы», «Обсуждение», «Выводы». Теоретическая часть. В ней содержится небольшое количество базовой информации по изучаемой проблеме и формулируются цели эксперимента. Дается определение основных исследуемых физиологических явлений и понятий, можно описать ожидаемые результаты экспериментов. Включайте в эту часть отчета только ту информацию, которая имеет отношение к данной работе! Оборудование и материалы. Сюда входит краткое описание объекта исследования, материалов, приборов, оборудования, веществ и реактивов, используемых в эксперименте. Не забудьте указать дозы и концентрации применяемых препаратов. Результаты работы (оформление отчета). Этот раздел может быть оформлен отдельно или вместе со следующим разделом — «Обсуждение результатов». Полученные в эксперименте результаты могут быть представлены в виде оригинальных записей на ленте самописца, кардиографа, спирографа или электроэнцефалографа. Необходимо указать скорость движения ленты, параметры наносимых раздражений с точной фиксацией момента нанесения и прекращения действия стимула (в подписях к иллюстрациям даются соответствующие пояснения). Если регистрация производилась с экрана осциллографа, по шкале манометра и т.п., то результаты эксперимента удобнее представить в виде таблицы. В таблицу вносятся полученные значения исследуемых параметров и единицы их измерения. Если возможно, то для выявления основных закономерностей изучаемых явлений по полученным данным строят графики. Они должны быть аккуратными и понятными. Не надо строить каждый график на листе формата А4, но и уменьшать его до размеров почтовой марки также не стоит. Графики должны иметь заголовок (подпись), обозначения параметров по осям с единицами измерения, номер и разъяснения применяемых в нем обозначений (легенда); в них вносят все экспериментальные точки и рассчитанные параметры. Обсуждение результатов. Это самый важный раздел отчета, выявляющий глубину понимания изучаемой проблемы и умение применить теоретические знания при объяснении результатов, полученных в реальном эксперименте. Обсудите Ваши результаты с точки зрения современных представлений науки. Попытайтесь представить механизмы, лежащие в основе наблюдаемых явлений. Объясните, какое значение обнаруженный способ регуляции имеет в работе целого организма. В случае расхождения полученных результатов с теоретически ожидаемыми, попробуйте выявить возможные причины этих расхождений. Высказывая предположения, не забывайте об ограничениях, которые имеют любая методика и техника измерений. Выводы. В них кратко, по пунктам перечисляются основные результаты и закономерности, обнаруженные в эксперименте. Например: «При увеличении амплитуды стимула от ... мВ до ... наблюдается возрастание амплитуды мышечного ответа. Дальнейшее усиление стимула не приводит к изменению мышечного ответа». (Не надо еще раз объяснять механизмы наблюдаемых явлений - они уже изложены в разделе «Обсуждение».) I. ФИЗИОЛОГИЯ КРОВИ Лабораторная работа № 1. ВЗЯТИЕ КРОВИ Исследование крови начинают с одномоментного получения образцов крови для всех производимых исследований. Цель работы. Получение образцов крови для определения группы, скорости оседания эритроцитов (СОЭ) количества эритроцитов, лейкоцитов, гемоглобина. Оборудование и материалы. Скарификатор, ватные шарики, 5 % цитрат натрия, спирт, капилляр, аппарат Панченкова, часовое стекло, 3 пробирки. Ход работы. Приготовить часовое стекло и 3 пробирки. На часовое стекло нанести 1-2 капли 5 % цитрата натрия, в пробирку № 1 добавляют цитрат натрия, набранный до метки «Р» капилляра аппарата Панченкова, в пробирку № 2 приливают 4 мл 3,5 % NaCl, в пробирку № 3 — 0,38 мл 3 % раствора уксусной кислоты подкрашенной метиленовой синью. Прокол производят одноразовыми иглами-скарификаторами, представляющими собой стальную пластинку с лезвием и ограничителем глубины прокола. Кровь берут из IV пальца левой руки. Брать кровь у себя не следует. Дающий кровь, садится боком к столу и кладет руку на стол ладонью вверх. Палец дезинфицируют. Перед проколом кожа должна быть сухой. Сдавливают мякоть концевой фаланги с боков, и быстрым резким движением скарификатора прокалывает кожу сбоку в мякоть первой фаланги на глубину 2,5-3 мм. Кровь должна поступать свободно, так как при сильном надавливании к ней примешивается тканевая жидкость, снижающая точность исследования. Первую каплю стирают сухой ватой. Затем в капилляр аппарата Панченкова дважды набирают кровь до метки «К» и выпускают обе порции на часовое стекло, перемешивают, и в дальнейшем эту цитратную кровь используют для определения группы крови, количества эритроцитов и лейкоцитов. Снова дважды набирают кровь в капилляр до метки «К» и обе порции выпускают в пробирку № 1 (для определения СОЭ). Лабораторная работа № 2. ОПРЕДЕЛЕНИЕ СКОРОСТИ ОСЕДАНИЯ ЭРИТРОЦИТОВ (СОЭ) ПО ПАНЧЕНКОВУ Теоретическая часть. Кровь, предохраненная от свертывания, при стоянии разделяется на слои форменных элементов и слои плазмы. Оседание эритроцитов — свойство эритроцитов осаждаться на дне сосуда при сохранении крови в несвертывающем состоянии. Это происходит потому, что удельная плотность эритроцитов выше, чем плазмы: 1,096 и 1,027 соответственно. Эта реакция характеризует некоторые физико-химические свойства крови. Механизм оседания эритроцитов чрезвычайно сложен, зависит от многих факторов, к которым относят количество эритроцитов, их морфологические особенности, величину заряда, способность к агломеризации, количественные и качественные изменения белков плазмы, вязкость крови, кислотно-основное состояние, содержание желчных кислот и желчных пигментов, соотношение холестерина и лецитина. Определение СОЭ имеет важное диагностическое, прогностическое значение и служит важным показателем эффективности проводимой терапии. В нормальном состоянии СОЭ за первый час у здоровых мужчин составляет 1-10 мм, у женщин — 2-15 мм. СОЭ выражается в миллиметрах высоты столба плазмы, появившейся над слоем осевших эритроцитов за 1 единицу времени (обычно за 1 ч). На величину СОЭ влияет физиологическое состояние организма. Оседание значительно ускоряется во время беременности (до 45 мм), при большинстве острых воспалительных процессов. Низкие значения характерны для новорожденных. Усиленная мышечная тренировка замедляет эту реакцию. О  пределение СОЭ производится в аппарате Панченкова (рис. 1). Аппарат состоит из штатива, на котором закреплены в вертикальном положении капилляры, разделенные на миллиметры от 0 до 100. На высоте деления 0 стоит отметка К (кровь), на высоте 50 мм - метка Р (реактив). пределение СОЭ производится в аппарате Панченкова (рис. 1). Аппарат состоит из штатива, на котором закреплены в вертикальном положении капилляры, разделенные на миллиметры от 0 до 100. На высоте деления 0 стоит отметка К (кровь), на высоте 50 мм - метка Р (реактив).Цель работы. Определение скорости оседания эритроцитов в исследуемой крови. Оборудование и материалы. Аппарат Панченкова, 5 % раствор лимоннокислого натрия, часовое стекло, скарификатор, спирт, вата. Ход работы. Цитратную кровь из пробирки № 1 набирают в капилляр до метки «К» и помещают в штатив на 1 час. СОЭ нельзя вычислить, измеряя количество плазмы, образовавшееся за 30 мин, и умножая полученное значение на 2, так как процесс оседания протекает неравномерно. Оформление отчета. По высоте столбика плазмы в капилляре определите СОЭ (мм/час). Вывод. Сравните СОЭ исследуемой крови с нормой. Лабораторная работа № 3. ОПРЕДЕЛЕНИЕ КОЛИЧЕСТВА ЭРИТРОЦИТОВ Теоретическая часть. Эритроцит — наиболее многочисленный безъядерный форменный элемент крови, содержащий гемоглобин. Количество эритроцитов в крови — один из наиболее важных показателей системы крови. В норме число эритроцитов у женщин 3,9-4,7·1012 у мужчин 4–5·1012 в 1 л крови. Снижение количества эритроцитов в крови является одним из критериев анемии. Повышение количества эритроцитов в крови — эритроцитоз (более 6,0 · 1012/л у мужчин и более 5,0 · 1012/л у женщин). Подсчет форменных элементов крови производят в счетных камерах. Существует много различных счетных камер, но все они построены по одному принципу. Наиболее частое применение имеет камера Горяева, на которой поперек основной пластинки проходят три возвышающиеся полоски, отделенные друг от друга желобками, а средняя полоска поперечным желобком разделена еще пополам (рис. 2). На каждой ее половинке выгравирована счетная сетка (рис. 3). Счетная сетка камеры Горяева состоит из 225 больших квадратов, 25 из которых разделены на малые, по 16 квадратов в каждом. Боковые полоски выше средней на 0,1 мм. При накладывании покровного стекла оно опирается на выступающие боковые полоски, а расстояние от сеток до покровного стекла (т. е. глубина камеры) равно 0,1 мм. Для того чтобы это расстояние точно соответствовало расчетному, покровное стекло должно быть крепко прижато к подлежащей полоске. Это достигается его притиранием. Хорошо вымытое и вытертое стекло подвигают взад и вперед скользящим движением, прижимая его к камере, пока над боковыми полосками не станут видны кольца «Ньютона» — радужные линии, овалы или кольца.  Р 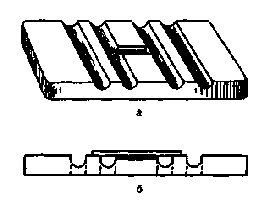 ис. 2. Камера Горяева. а) вид сверху; б) вид сбоку. Рис. 3. Счетная сетка камеры Горяева. Цель работы. Определение количества эритроцитов с помощью камеры Горяева. Оборудование и материалы. Микроскоп, камера Горяева, часовое стекло, пипетка на 5 мл, капилляр от гемометра Сали на 0,02 мл или автоматическая микропипетка, глазная пипетка или стеклянная палочка, 3,5% NaCl, кровь. Ход работы. Для подсчета эритроцитов в камере Горяева кровь разводят в 200 раз в гипертоническом растворе хлорида натрия, для чего в пробирку № 2 с 4 мл 3,5 % NaCl приливают 0,02 мл крови, с помощью капилляра от гемометра Сали или автоматической микропипетки. Взвесь тщательно перемешивают и затем заполняют счетную камеру. Для чего каплю разведенной крови либо глазной пипеткой, либо, после взбалтывания жидкости, стеклянной палочкой (кончиком ее с повисшей каплей) выпускают под покровное стекло, прикасаясь к щели между камерой и притертым покровным стеклом. Жидкость по капиллярам засасывается и заполняет пространство над сеткой. Подсчет производят спустя 1 мин (когда эритроциты осядут на дно камеры), пользуясь объективом ×8 и окуляром ×15. П  одсчет эритроцитов производят в 5 больших квадратах, разделенных на малые и расположенных по диагонали. Чтобы не сбиться со счета, придерживаются определенной последовательности счета (рис. 4): передвигаются из квадрата в квадрат по горизонтали, один ряд слева направо, следующий — справа налево, как показано на рисунке пунктиром со стрелкой. Считают, помимо находящихся внутри квадрата, все эритроциты, лежащие на двух линиях, например на левой и верхней, и пропускают все лежащие справа и снизу. К  оличество эритроцитов в 1 мм крови вычисляют следующим образом: сосчитанные эритроциты (А) в пяти больших квадратах делят на 80, так как в каждом большом квадрате 16 маленьких (5 · 16 =80), А/80. оличество эритроцитов в 1 мм крови вычисляют следующим образом: сосчитанные эритроциты (А) в пяти больших квадратах делят на 80, так как в каждом большом квадрате 16 маленьких (5 · 16 =80), А/80.Объем жидкости над одним маленьким квадратиком равен 1/4000 мм3. Следовательно, количество эритроцитов в 1 мм3 крови равно: П  олученное количество эритроцитов умножают на разведение, то есть на 200. Таким образом, формула для вычисления количества эритроцитов в 1 мкл следующая:  Число эритроцитов в 5 больших квадратах, пересчитывают на содержание их в 1 л. Оформление отчета. Произведите подсчет эритроцитов в исследуемой крови. Результаты занесите в таблицу, сравните полученное значение с нормой:
Вывод. Оцените содержание эритроцитов в исследуемой крови. Лабораторная работа № 4. ОПРЕДЕЛЕНИЕ ЧИСЛА ЛЕЙКОЦИТОВ Теоретическая часть. Основной функцией лейкоцитов является защита организма от чужеродных агентов. Благодаря их фагоцитарной активности, участию в клеточном и гуморальном иммунитете, обмене гистамина, гепарина реализуются антимикробные, антитоксические, антителообразующие и другие важнейшие компоненты иммунологических реакций. Нормальное содержание лейкоцитов 4000 - 9000 в 1 мкл, или 4,0 - 9,0 · 109 в 1 л крови. Увеличение количества лейкоцитов в периферической крови выше 10,0 · 109/л называют лейкоцитозом, уменьшение - ниже 4,0 · 109/л - лейкопенией. Цель работы. Определение числа лейкоцитов с помощью камеры Горяева. Оборудование и материалы. Микроскоп, камера Горяева, часовое стекло, пипетка на 1 мл, капилляр от гемометра Сали на 0,02 мл или автоматическая микропипетка, глазная пипетка или стеклянная палочка, 3 % раствор СН3СООН, подкрашенный метиленовой синью, кровь. Ход работы. В пробирку № 3 с 0,38 мл 3 % раствора СН3СООН, подкрашенного метиленовой синью приливают 0,02 мл крови с помощью капилляра от гемометра Сали или автоматической микропипетки. Разведение крови в данном случае в 20 раз. Заполнение счетной камеры производят, как описано выше для эритроцитов. Лейкоциты подсчитывают в 25 больших неразграфленных квадратах (рис. 3). Поскольку каждый большой квадрат состоит из 16 маленьких, подсчитанное количество лейкоцитов размещается в 400 маленьких квадратиках. Следовательно, итоговая формула для подсчета лейкоцитов в 1 мкл будет выглядеть следующим образом: где А – количество лейкоцитов в 25 больших квадратах. Оформление отчета. Произведите подсчет лейкоцитов в исследуемой крови. Результаты занесите в таблицу, сравните полученное значение с нормой:
Вывод. Дайте оценку содержания лейкоцитов в исследуемой крови. Лабораторная работа № 5. ОПРЕДЕЛЕНИЕ КОЛИЧЕСТВА ГЕМОГЛОБИНА В КРОВИ Теоретическая часть. Гемоглобин находится в эритроцитах и составляет 90 % их сухого остатка. Количество гемоглобина в 100 г крови называется абсолютным содержанием гемоглобина, в среднем оно составляет 14 г %: у женщин - 12-13 г %, у мужчин - 13-15 г %. В клинике обычно определяют относительное содержание гемоглобина в крови, выражающееся процентом гемоглобина данной крови по отношению к высшей норме -16,8 г %, принятом за 100 %. В норме относительное содержание гемоглобина составляет 70-90 %. Определение количества гемоглобина в крови производится косвенным калориметрическим методом в гемометре Сали. Гемометр Сали представляет собой черный штатив, заднюю стенку которого составляет матовое стекло (рис. 5). В штативе имеется три пробирки. Средняя пробирка градуирована в г % и служит для исследования крови, две крайних запаяны и содержат стандартный раствор солянокислого гематина. К гемометру приложена капиллярная пипетка с меткой 0,02 мл. С  тандартный раствор приготовлен следующим образом: к 0,2 мл 0,1 нормального раствора HCl добавляется 20 мм крови, содержащей 16,8 г % гемоглобина. Затем объем раствора добавлением дистиллированной воды доводится до 2 мл. Такое содержание гемоглобина считается высшим пределом нормы и принимается за 100 % относительно содержания по Сали. тандартный раствор приготовлен следующим образом: к 0,2 мл 0,1 нормального раствора HCl добавляется 20 мм крови, содержащей 16,8 г % гемоглобина. Затем объем раствора добавлением дистиллированной воды доводится до 2 мл. Такое содержание гемоглобина считается высшим пределом нормы и принимается за 100 % относительно содержания по Сали.Цель работы. Определение количества гемоглобина в крови с помощью гемометра Сали. Оборудование и материалы. Гемометр Сали, 0,1 нормальный раствор HCl, дистиллированная вода, капиллярная пипетка на 0,02 мл, глазная пипетка, стеклянная палочка, кровь. Ход работы. В среднюю пробирку наливают 0,1 нормальный раствор HCl до нижней кольцевой метки. К 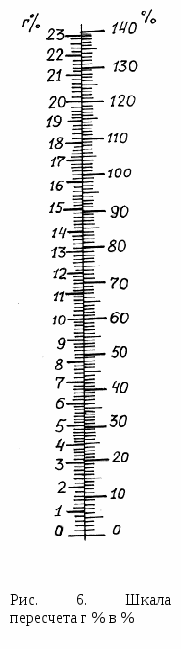 апиллярной пипеткой, приложенной к гемометру, берут 0,02 мл крови с часового стекла и, обтерев кончик пипетки ватой, выдувают кровь на дно пробирки так, чтобы верхний слой соляной кислоты оставался неокрашенным. Не вынимая пипетку, ополаскивают ее соляной кислотой из верхнего слоя. Содержимое пробирки перемешивают, ударяя по ее концу пальцем и оставляют стоять 3-5 мин (за это время гемоглобин превратится в солянокислый гематин и жидкость приобретает буро-коричневый цвет). Затем к раствору по каплям прибавляют дистиллированную воду (раствор при этом перемешивают стеклянной палочкой) до тех пор, пока цвет полученного раствора не совпадет с цветом стандарта. Цифра на уровне нижнего мениска полученного раствора, показывает содержание гемоглобина в исследуемой крови в г %. Зная величину, выраженную в г % с помощью шкалы для пересчета (рис. 6) вычисляем относительное содержание гемоглобина в исследуемой крови. апиллярной пипеткой, приложенной к гемометру, берут 0,02 мл крови с часового стекла и, обтерев кончик пипетки ватой, выдувают кровь на дно пробирки так, чтобы верхний слой соляной кислоты оставался неокрашенным. Не вынимая пипетку, ополаскивают ее соляной кислотой из верхнего слоя. Содержимое пробирки перемешивают, ударяя по ее концу пальцем и оставляют стоять 3-5 мин (за это время гемоглобин превратится в солянокислый гематин и жидкость приобретает буро-коричневый цвет). Затем к раствору по каплям прибавляют дистиллированную воду (раствор при этом перемешивают стеклянной палочкой) до тех пор, пока цвет полученного раствора не совпадет с цветом стандарта. Цифра на уровне нижнего мениска полученного раствора, показывает содержание гемоглобина в исследуемой крови в г %. Зная величину, выраженную в г % с помощью шкалы для пересчета (рис. 6) вычисляем относительное содержание гемоглобина в исследуемой крови.Оформление отчета. Сравните полученные результаты с нормой. Вывод. Оцените содержание гемоглобина в исследуемой крови. Лабораторная работа № 6. ВЫЧИСЛЕНИЕ ЦВЕТОВОГО ПОКАЗАТЕЛЯ Теоретическая часть. Зная число эритроцитов в крови и содержание в ней гемоглобина, можно высчитать, в какой мере им насыщен каждый эритроцит. Есть разные способы установления этой величины. Первый — вычисление цветового показателя (ЦП). Это условная величина, выводимая из соотношения гемоглобина и числа эритроцитов. В норме эта величина приближается к 1. Число меньшее единицы, указывает на недостаточное насыщение эритроцита гемоглобином; число, большее 1, встречается в тех случаях, когда эритроциты имеют объем больше нормального. Перенасыщения гемоглобином не бывает; нормальный эритроцит насыщен им до предела. В настоящее время в соответствии со стремлением выражать константы крови в абсолютных величинах вместо цветового показателя высчитывают весовое содержание гемоглобина в эритроцитах. В норме 1 эритроцит содержит 33 пг гемоглобина. Цель работы. Определение степени насыщения эритроцитов гемоглобином. Ход работы. Вычислите ЦП, разделив концентрацию гемоглобина, выраженную в г/л, на число из первых трех цифр количества эритроцитов в 1 мкл крови с последующим умножением полученного частного на 3: Определите весовое содержание гемоглобина в эритроците, разделив содержание гемоглобина в 1 л на число эритроцитов в том же объеме. Оформление отчета. Сравните полученные результаты с нормой. Вывод. Оцените насыщение эритроцитов гемоглобином в исследуемой крови. Лабораторная работа № 7. ИЗУЧЕНИЕ РАЗЛИЧНЫХ ВИДОВ ГЕМОЛИЗА Теоретическая часть. Процесс разрушения эритроцитов, при котором гемогобин выходит их них в плазму, называют гемолизом. Различают: физиологический гемолиз — постоянно протекающий в организме естественный процесс разрушения старых эритроцитов (около 200 млрд эритроцитов в сутки); патологический гемолиз — возникает в организме при действии экзо- и эндогенных повреждающих факторов и сопровождается усиленным разрушением нормальных эритроцитов. Кровь после гемолиза эритроцитов представляет собой прозрачную жидкость красного цвета («лаковая кровь»). Гемолиз может возникать под влиянием ряда факторов разной природы. Механический гемолиз — вследствие деформации эритроцитов, например при прохождении эритроцитов по узким капиллярам, при интенсивном встряхивании или перемешивании крови. Термический гемолиз — при действии высоких (более 50°С) или низких температур, например, при замораживании и размораживании крови. Химический гемолиз — при действии на мембраны эритроцитов химических веществ (например, при отравлении): нитратов и нитритов, анилиновых красителей, кислот (соляная, уксусная), эфира, бензина, этилового спирта и др. Биологический гемолиз — при действии токсинов змей, членистоногих, микроорганизмов и др., а также под влиянием антител-гемолизинов (иммунный гемолиз), например при переливании несовместимой крови. Осмотический гемолиз наступает при помещении эритроцитов в раствор с низким осмотическим давлением, в результате разницы осмотического давления раствор поступает внутрь эритроцита, он набухает и происходит разрыв мембраны. Эритроциты обладают определенной осмотической устойчивостью (резистентностью) по отношение к гипотоническим растворам NаС1. Резистентность эритроцитов одной и той же крови неодинакова. Молодые эритроциты значительно устойчивее старых. Поэтому различают максимальную и минимальную осмотическую резистентность эритроцитов. Минимальная резистентность определяется концентрацией NaС1, которая предшествует началу гемолиза наименее устойчивых эритроцитов (для эритроцитов крови человека 0,48 % NaС1). Максимальная резистентность - концентрация раствора NaС1, предшествующая полному гемолизу (0,32 % NаС1 ) Цель работы. Изучение влияния различных химических веществ на эритроциты. Определение осмотической резистентности эритроцитов исследуемой крови. Оборудование и материалы. 14 пробирок, пипетка на 2 мл, глазная пипетка, спиртовка, цитратная кровь (2-3 мл), нашатырный спирт, этиловый спирт, 1 % р-р уксусной кислоты, NaCl разной концентрации от 0,9 до 0,1 %. Задание № 1. Изучение влияния различных химических веществ на эритроциты (химический, осмотический и термический гемолиз) Ход работы. Установите пробирки в штатив, пронумеруйте. В первые четыре пробирки налейте по 2 мл 0,9 % NaCl, затем в первую добавьте 2 капли уксусной кислоты, во вторую – 2 капли нашатырного спирта, в третью - 2 капли этилового спирта. В пятую пробирку налейте 2 мл дистиллированной воды. Далее в каждую из пяти пробирок добавьте по 1-2 капли крови, перемешайте содержимое. Результат в пробирках №1, 2, 3 и 5 наблюдайте через 30 мин. Для наблюдения термического гемолиза пробирку №4 нагрейте на спиртовке. Оформление отчета. Данные наблюдения занесите в таблицу и проанализируйте механизмы наблюдаемого гемолиза:
Вывод. Перечислите основные факторы, приводящие к гемолизу эритроцитов. Задание № 2. Определение осмотической резистентности эритроцитов Ход работы. В пробирки с № 6 по № 14 наливаем по 2 мл NaCl различной концентрации (см. таблицу), после чего добавляем в каждую из них по 2 капли цитратной крови. Содержимое пробирок перемешиваем, результат наблюдаем через 40 мин. Если осадок эритроцитов достаточно большой, а слой жидкости слегка окрашен – произошел частичный гемолиз. Если же осадка нет, а жидкость прозрачна и интенсивно окрашена («лаковая кровь») – произошел полный гемолиз. Оформление отчета. Результаты опыта занесите в таблицу. Постройте кривую осмотической резистентности.
Степень гемолиза: «-» - отсутствует; «+» - частичный, выражен слабо; «++» - частичный, выражен хорошо; «+++» - полный.  Вывод. Сравните полученные результаты с нормой. Оцените степень осмотической резистентности исследуемой крови. Лабораторная работа № 8. ОПРЕДЕЛЕНИЕ ГРУПП КРОВИ Теоретическая часть. Группы крови отличаются друг от друга содержанием агглютиногенов и агглютининов. Агглютиногены — вещества, способные склеиваться; содержатся в эритроцитах. Агглютинины — склеивающие вещества, находятся в плазме. Имеются 2 вида основных агглютиногенов (А и В) и соответственно два вида агглютининов (α и β). Реакция агглютинации наступает лишь при контакте одноименных агглютиногенов и агглютининов, например: А и α или В и β. Агглютинацию нельзя смешивать с процессом свертывания крови — выпадением фибрина в виде нерастворимых нитей. Определение группы крови имеет практическое значение при переливании крови. Учитывают при этом лишь свойства эритроцитов донора и свойства плазмы реципиента, пренебрегая агглютинирующими свойствами плазмы донора, не имеющими практического значения, так как она вводится в малом количестве и, разводясь в крови реципиента, теряет свои агглютинирующие свойства. Если эритроциты крови донора содержат агглютиногены, одноименные к агглютининам плазмы реципиента, то при переливании такой крови произойдет агглютинация, приводящая к развитию гемолиза и явлений гемотрансфузионного шока. Кровь донора, не имеющая агглютиногенов, одноименных агглютининам реципиента, пригодна для переливания (табл. 1). Таблица 1 Определение совместимости крови разных групп
Примечание: знаком (+) обозначается реакция агглютинации; знаком (-) – отсутствие таковой. Группы крови определяют по свойствам эритроцитов, которые устанавливаются с помощью стандартных сывороток, содержащих известные агглютинины. Цель работы. Определение группы крови. Оборудование и материалы. Планшет, стеклянные палочки, стерильный скарификатор, вата, спирт, стандартные сыворотки I, II и III групп. Ход работы. Перед началом выполнения задания заполните приведенную ниже таблицу:
На планшет с лунками нанесите по 1 капле стандартных сывороток I, II и III группы (предварительно рекомендуется подписать, соответствующие лунки). Затем каплю крови с часового стекла (можно использовать донорскую кровь) при помощи стеклянной палочки перенесите в каплю сыворотки I группы и тщательно размешайте до тех пор, пока смесь не приобретет равномерно розовый цвет. Аналогичным образом (используя каждый раз новую палочку) перенесите каплю крови в стандартные сыворотки других групп. Реакция агглютинации наступает через 1-5 мин. При наличии агглютинации капля становится прозрачной, а эритроциты склеиваются в виде комочков. Группа крови устанавливается в зависимости от наличия агглютинации. Оформление отчета. Заполните таблицу, обозначая знаком «+» наличие агглютинации, знаком «-» - ее отсутствие:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
