Лабораторный-практикум-по-технологии-сахара. Практикум по технологии сахара утверждено научнометодическим советом итпм 28 декабря 2002 года
 Скачать 0.79 Mb. Скачать 0.79 Mb.
|
Приборы и материалы:- баллон с диоксидом углерода;- колба для сока вместимостью 250 см3 с обратным холодильником; - прибор Каппуса; - коническая колба вместимостью 250 – 300 см3; - мерный цилиндр вместимостью 10 см3; - бюретка со штативом и стеклянный стакан.Ход определенияСок I сатурации в количестве 100-200 см3 помещают в колбу вместимостью 250 см3 и сатурируют из баллона с диоксидом углерода до нейтральной реакции на фенолфталеин. Затем пересатурированный сок кипятят в течение 10 мин, с добавлением при кипячении 0,5 – 1,0 г (на глаз) порошка СаСО3, в колбе с обратным холодильником. При кипячении сока без обратного холодильника, сок доводят до первоначального объема добавлением воды. Затем содержимое колбы фильтруют и определяют щелочность фильтрата, которая и будет оптимальной. Определяют также содержание солей кальция в полученном фильтрате, так как оно показывает, какое количество солей кальция может остаться в соке после правильно проведенной II сатурации. Расчеты: выполняют как по прямому методу. Контрольные вопросы1. Что характеризует оптимальная щелочность сока II сатурации? 2. Назовите примерные величины оптимальной щелочности сока II сатурации? 3. Какие методы применяют для определения оптимальной щелочности сока II сатурации? 4. На каком принципе основан экспресс-метод определения оптимальной щелочности сока II сатурации? 5. Что такое минимальная щелочность? 1.6. Определение содержания солей кальция в соках сахарного производства Введение Понятие «соли кальция» в сахарном производстве довольно условное и не совсем соответствует действительности. Это обусловлено тем, что соли кальция не всегда и не во всех продуктах можно определить с достаточной точностью. Под солями кальция понимают не только растворенные в пробе соединения кальция, но и неионизированные комплексы кальция. Не следует идентифицировать концентрацию солей кальция с концентрацией ионов Са2+, поскольку во многих случаях диссоциация соли незначительна, а кальций может присутствовать также в комплексных анионах (аминокислоты, органические оксикислоты). Соединения кальция, находящиеся в твердых продуктах, в процессе растворения пробы частично переходят в раствор, а частично остаются во взвеси. В подобных случаях обычное определение охватывает общее содержание обеих групп соединений кальция. Поэтому при исследовании твердых продуктов, таких, как сахарная свекла, жом, сахар, было бы правильнее говорить о содержании кальция, а не солей кальция. Кроме того, условность понятия «соли кальция» связана с тем, что большинство методов их определения титрованием дает суммарное количество соединений кальция и магния. Цель работы. Изучить методы определения содержания солей кальция в продуктах. 1.6.1. Комплексометрическое определение кальция и магния обратным титрованием Введение Комплексный метод основан на способности комлексона III (натриевая соль этилендиаминтетрауксусной кислоты – ЭДТА или трилон Б) образовывать в щелочной среде с катионами Са2+ и Mg2+ растворимые в воде, но прочные внутрикомплексные соединения типа     2- 2-O   OC – CH2 H2C - COO OC – CH2 H2C - COO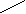 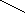 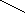 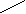  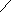 N - CH2 - CH2 - N Na2. N - CH2 - CH2 - N Na2.O  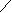 OC - CH2 H2C - COO OC - CH2 H2C - COO  C  a a   Вследствие образования этого комплекса ионы кальция выводятся из раствора, а вместо них появляются ионы водорода. Для их связывания необходимо поддерживать рН 8-10, применяя аммиачный буферный или боратный буферный растворы. В зависимости от стойкости комплекса один металл может вытеснять другой из менее стойкого комплекса, например, кальций вытесняет магний. Окончание комплексообразования устанавливают с помощью органических индикаторов. В качестве их могут быть использованы: эриохром черный, кислотный хром синий или кислотный хром темно-синий. Цвет индикаторов зависит от содержания в растворе ионов Са2+ и Mg2+ (табл.1). Таблица 1
Растворы индикаторов малоустойчивы и сохраняют свои свойства до 10 суток. Тип индикатора на точность метода не влияет. Обратное титрование применяют, если комплексообразование идет с некоторым запаздыванием или цветные комплексы разлагаются очень медленно, как, например, для случая цветных комплексов эриохрома черного с магнием. При анализе соков, содержащих незначительное количество кальциевых солей, навеску сока можно увеличить до 50 г. В некоторых продуктах из-за присутствия в них солей меди и железа не получается четкого перехода окраски индикатора. В этом случае, в данном методе, перед титрованием в колбу добавляют 1 мл 1,5-2,0% раствора сульфида натрия (Na2S). Цель анализа - уточнить технологический режим сокоочистительного отделения. Принцип метода анализа основан на добавлении к исследуемому раствору большого количества 1/28 н. раствора трилона Б для комплексообразования с последующим оттитровыванием его избытка 1/28 н. раствором сернокислого магния в присутствии индикатора хром темно-синий. Реактивы: - 1/28 н. раствор трилона Б; - 1/28 н. раствор MgSO4; - аммиачный буферный раствор (смесь равных объемов 20% NH4Cl и 20% NH4OH); - 1,5-2 %-ный раствор Na2S; - индикатор - хром темно-синий, или кислотный хром синий. Приборы и материалы: - технические весы; - коническая колба вместимостью 250-300 см3; - мерные цилиндры вместимостью 10 и 100 см3; - бюретка для титрования; - химический стакан. Ход определения 10 г сока II сатурации (5 г сиропа или 1 г мелассы) переводят в коническую колбу вместимостью 250-300 см3, добавляют 100 см3 дистиллированной воды, 5 см3 аммиачного буферного раствора, 10–15 см3 1/28 н. раствора трилона Б и 7-8 капель раствора эриохрома черного в качестве индикатора (индикатор обязательно добавляют последним). Избыток трилона Б оттитровывают 1/28 н. раствором сернокислого магния. Глухой опыт: определяют содержание кальция и магния в 100 см3 дистиллированной воды, подобно анализу в исследуемом продукте. Расчеты: Количество трилона Б, израсходованное при титровании 100 см3 дистиллированной воды, вычитают из общего количества трилона Б, израсходованного на титрование продукта. Суммарное содержание кальция и магния в % СаО к массе продукта, определяется по формуле где x - суммарное содержание кальция и магния, % СаО к массе продукта; aи a1 - количество 1/28 н. раствора трилона Б, добавленное соответственно к исследуемому раствору и дистиллированной воде в глухом опыте, см3; b и b1 - количество 1/28 н. раствора сернокислого магния соответственно пошедшее на титрование исследуемого раствора и дистиллированной воды в глухом опыте, см3; k - поправочный коэффициент к титру трилона Б; m – навеска исследуемого продукта, г. 1.6.2. Комплексометрическое определение кальция Введение Одним из направлений по усовершенствованию методов комплексометрического определения кальция является использование новых индикаторов. Так, например, известно применение с этой целью металлохромных индикаторов. К ним относятся мурексид (соль пурпуровой кислоты), кальцес (HSN) и кальцеин (флуорексон – сложный по составу краситель, производное флуоросцеина C20H12O5). В МГУПП разработан новый метод комплексометрического определения кальция с использованием в качестве индикатора кальконкарбоновой кислоты /2-окси-1-/2-окси-4-сульф-1-нафтилазо-3-нафтойная кислота/. Этот метод позволяет определить кальций в присутствии магния. В случае титрования раствором трилона Б окраска раствора меняется от винно-красной до зеленой. Переход окраски в точке эквивалентности при применении кальконкарбоновой кислоты является более резким и четким, чем при других индикаторах. Это позволяет получать более точные результаты, что также облегчает определение кальция в темноокрашенных продуктах сахарного производства (например, в мелассе). Цель анализа - определить содержание солей кальция в продуктах сахарного производства для оценки выбранного варианта схемы очистки и принятого технологического режима. Принцип метода анализа основан на использовании в качестве индикатора раствора кальконкарбоновой кислоты, являющейся специфическим индикатором на ионы Ca2+, с добавлением ионов Mg2+ в виде 1/28 н. раствора MgSO4, для более четкого перехода окраски в точке эквивалентности, и с последующим оттитровыванием 1/28 н. раствором трилона Б. Реактивы: - 1/28 н. раствор трилона Б; - 1/28 н. раствор MgSO4; - 0,1 н. раствор NaOH; - индикатор - кальконкарбоновая кислота (0,179 г индикатора растворяют в 50%-ном спирте в мерной колбе вместимостью 100 см3) Приборы и материалы: - технические весы; - коническая колба вместимостью 250-300 см3; - мерные цилиндры вместимостью 10 и 100 см3; - бюретка для титрования; - химический стакан. Ход определения 10 г сока II сатурации (5 г сиропа или 1 г мелассы) переводят в коническую колбу вместимостью 250-300 см3, добавляют 100 см3 дистиллированной воды, 8 см3 0,1 н. раствора NaOH, 2 см3 1/28 н. раствора MgSO4, 2,5 см3 индикатора кальконкарбоновой кислоты и титруют 1/28 н. раствором трилона Б. Глухой опыт: определяют содержание кальция в 100 см3 дистиллированной воды, как и в исследуемом продукте. Расчеты:
где a, b - количество 1/28 н. раствора трилона Б, пошедшее соответственно на титрование раствора исследуемого продукта и дистиллированной воды в глухом опыте, см3; k - поправочный коэффициент к титру трилона Б; m – навеска исследуемого продукта, г.
a = x – x’, где x – суммарное содержание кальция и магния в исследуемом продукте, в % СаО к массе продукта; x’ - содержание кальция в исследуемом продукте, в % СаО к массе продукта. Контрольные вопросы
2. Почему при комплексометрическом определении используют трилон Б? 3. Когда применяют метод обратного титрования? 4. Каким образом устанавливают окончание комплексообразования? 5. На каком принципе основан метод определения кальция и магния обратным титрованием? 6. На каком принципе основано комплексометрическое определение кальция? Лабораторная работа № 2 Определение общего содержания сернистой кислоты в продуктах сахарного производства ВведениеСульфитацией называют обработку сахарных растворов и воды диоксидом серы. В типовой технологической схеме предусмотрена сульфитация сока II сатурации, смеси сиропа с клеровкой и воды, подаваемой на диффузию. Проведение сульфитации с соблюдением оптимальных параметров позволяет улучшить технологию получения сахара-песка стандартного качества и снизить его потери с мелассой. В процессе сульфитации сока или смеси сиропа с клеровкой происходит восстановление красящих веществ и превращение их в бесцветные соединения. Видимый эффект обесцвечивания сахарных растворов составляет 15-30%, а истинный - 8-10%. Это объясняется индикаторными свойствами красящих веществ. Так, например, при снижении рН, обусловленном сульфитацией, происходит уменьшение интенсивности цвета, а при возврате к его исходному значению цветность раствора почти полностью восстанавливается. Кроме того, присутствие сернистой кислоты в соке во время его выпаривания снижает нарастание красящих веществ. Это условие выполняется лишь при определенном содержании в соке сернистой кислоты. Считается, что хороший эффект от этой технологической операции может быть достигнут, если в соке после сульфитации содержится 0,003-0,004% избыточного SO2. Цель анализа - определить качественные показатели сульфитированного сока и сиропа для оценки технологического режима сульфитации. Принцип метода анализа основан на определении SO2 титрованием 0,02 н. раствором йода в присутствии крахмала как индикатора. Реактивы: - 1 н. раствор NaOH; - серная кислота, разбавленная 1:3; - 0,5%-ный раствор крахмала; - 0,02 н. раствор йода. | ||||||||||||||
