|
|
Лабораторный-практикум-по-технологии-сахара. Практикум по технологии сахара утверждено научнометодическим советом итпм 28 декабря 2002 года
Приборы и материалы:
- пипетка с резиновой грушей или маленький цилиндр для серной кислоты;
- бюретка для титрования;
- коническая колба вместимостью 250 см3;
- химический стакан;
- пипетки: 1 см3 и 10 см3.
Ход определения
В коническую колбу вместимостью 250 см3 переводят 50 г фильтрованного сока или 25 г сиропа, приливают 20-25 см3 дистиллированной воды, 25 см3 1 н. раствора NaOH. Потом колбу закрывают пробкой, содержимое взбалтывают и оставляют стоять в течение 15 мин, затем вводят в колбу 10 см3 серной кислоты, разбавленной 1:3, 1 см3 0,5 %-ного раствора крахмала и титруют 0,02 н. раствором йода до появления синего окрашивания, неисчезающего при взбалтывании.
Расчеты:
Общее содержание сернистой кислоты в процентах SO2 определяют по формуле 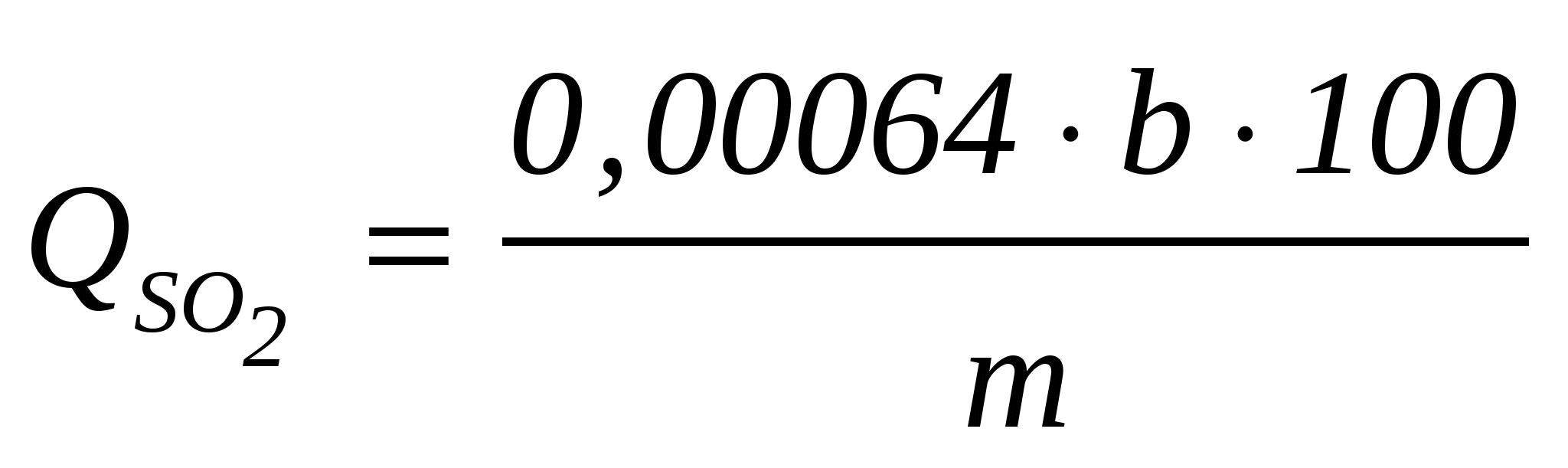 , ,
где Qso2- общее содержание сернистой кислоты в исследуемом продукте, % SO2;
b – количество 0,02 н. раствора йода, израсходованного на титрование, см3;
m – навеска исследуемого продукта, г.
Контрольные вопросы
Какой видимый и истинный эффект обесцвечивания сахарных растворов обеспечивает сульфитация?
На каком принципе основано обесцвечивание сахарных растворов при их сульфитации?
Что такое избыточное содержание в соке SO2?
С какой целью при определении содержания сернистой кислоты в исследуемый раствор добавляют крахмал?
Лабораторная работа № 3 Введение Под редуцирующими веществами понимают моносахариды, имеющие свободные альдегидные (СН3 – СОН) или кетонные (СН3 – СО – СН3) группы, способные легко окисляться в щелочной среде и восстанавливать (редуцировать) окись меди в закись (гемиоксид меди). В аналитической практике применяют оксид меди в виде щелочного раствора, который действует по схеме 2СuО = Сu2О + О, где, две молекулы оксида меди отдают один атом кислорода, превращаясь в закись меди Сu2О. То есть происходит восстановление меди с выделением красного осадка закиси меди. По количеству выпавшей в осадок редуцированной меди с помощью таблиц находят концентрацию моносахаридов в растворе. Именно по этому признаку все моносахариды относят к группе редуцирующих веществ, а метод их определения называют редуционным.
В свекле всегда содержится некоторое количество редуцирующих веществ. Обычно их содержание в свекле хорошего качества не превышает 0,07%, но в незрелой или порченой свекле, например, подмороженной, а затем оттаявшей количество редуцирующих веществ может превышать 0,5%.
В процессе переработки сахарной свеклы, особенно на стадии дефекации в сильно щелочной среде, моносахариды разлагаются с образованием темноокрашенных продуктов и ряда органических кислот, дающих с известью растворимые и нерастворимые кальциевые соли. Продукты распада редуцирующих веществ, вступая в реакцию с соединениями, содержащими аминогруппу (амиды, аминокислоты), образуют сильноокрашенные соединения (меланоидины), что обуславливает нарастание цветности соков и сиропов на выпарной установке.
Определение содержания редуцирующих веществ в сырье и продуктах сахарного производства осуществляют классическим методом с реактивом Мюллера. Этот метод является видоизмененным и улучшенным по сравнению с методом Офнера. Щелочность реактива Мюллера и концентрация сульфата меди выше, чем в реактиве Офнера, что улучшает условия определения редуцирующих веществ в продуктах с их высоким содержанием, например, в мелассе.
Применение для подкисления уксусной или винной кислот взамен соляной предотвращает посинение оттитрованной жидкости, что позволяет легко устанавливать момент завершения титрования.
Нагревание в этом методе выполняется при строгой постоянной температуре в кипящей водяной бане, что исключает один из главных источников ошибок анализа по методу Офнера. При этом условия анализа в классическом методе подобраны так, чтобы при достаточной скорости процесса окисление сахарозы было минимальным.
Цель анализа – оценить качество сырья и технологии его переработки по содержанию в продуктах редуцирующих веществ.
Принцип метода анализа основан на том, что в щелочной среде, создаваемой реактивом Мюллера, ионы Cu2+ окисляют моносахариды (редуцирующие вещества), восстанавливаясь до Cu+ и образуя в растворе закись меди (гемиоксид меди) Cu2O
C6H12O6 + Cu (OH)2 Cu2O + C6H12O7 +2H2O.
глюкоза глюконовая
кислота
Для определения количества образующейся закиси меди, соответствующей содержанию редуцирующих веществ, ее предварительно растворяют уксусной кислотой Сu2O + 2CH3COOH = 2CH3COOCu + H2O и оттитровывают раствором йода. При этом происходит окисление Cu+ до Cu2+
2CH3COOCu + I2 (CH3COO)2 Cu + CuI2.
Эта реакция обратима, но в присутствии избытка йода равновесие сдвинуто вправо. Избыток йода, не вошедшего в реакцию окисления меди, определяют титрованием гипосульфитом (тиосульфатом) натрия
I2 + 2Na2S2O3 = 2NaI + Na2S4O6.
1 см3 1/30 н. (0,0333 н.) раствора йода соответствует 0,001 г редуцирующих веществ.
Реактивы:
- 25%-ный нейтральный раствор уксуснокислого свинца (250 г в 1 дм3);
- 10%-ный раствор Na2CO3 (100 г Na2CO3 в 1 дм3 дистиллированной воды);
- медьсодержащий реактив (реактив Мюллера) содержит в 1 дм3 35 г CuSO4 H2O, 68 г Na2CO3 и 173 г сегнетовой соли;
- раствор йода 1/30 н.(0,0333 н.) (4,231 г I2 и 7 г KI на 1 дм3);
- раствор гипосульфита 1/30 н.(0,0333 н.) (8,3 г Na2S2O35H2O на 1 дм3);
- раствор 5 н. уксусной или винной кислоты (300 г ледяной уксусной или 375 г винной кислоты на 1 дм3).
Индикаторы:
- фенолфталеин (1%-ный раствор);
- 0,5%-ный раствор крахмала.
Приборы и материалы:
- технические весы;
- водяная баня;
- бюретка для титрования;
- пипетка: 50 см3.
3.1. Определение содержания редуцирующих веществ в свекле классическим методом
Ход определения
Навеску свекловичной кашки 51,23 г помещают в колбу вместимостью 200 см3, осветляют 8-10 см3 нейтрального раствора уксуснокислого свинца, доливают до метки и помещают в водяную баню на полчаса при температуре 75 ºС. После охлаждения и доведения до отметки фильтруют.
100 см3 фильтрата помещают в колбу вместимостью 200 см3 и, добавив 2-3 капли раствора фенолфталеина, удаляют избыток свинца 10%-ным раствором Na2CO3 (до появления светло-розовой окраски). Затем доливают до метки водой, хорошо взбалтывают и фильтруют. Из фильтрата отбирают 50 см3, соответствующих 6,5 г свеклы, помещают в коническую колбу на 300 см3, нейтрализуют разбавленной уксусной кислотой до обесцвечивания фенолфталеина, доводят его объем до 100 см3 дистиллированной водой, добавляют 10 см3 реактива Мюллера и помещают колбу на 10 мин в кипящую водяную баню. Размер водяной бани и ее нагрев должны быть подобраны так, чтобы кипение не прерывалось при помещении в нее колбы. При этом находящийся в колбе раствор должен быть на 2-3 см ниже уровня воды в бане. Колба не должна касаться дна бани и поэтому ее следует соответствующим образом закрепить или установить на специальную подставку. После кипячения раствор должен иметь голубую или зеленоватую окраску. В противном случае анализ считается испорченным, и его повторяют с меньшим количеством фильтрата (20, 10 см3 и т.д.).
Затем колбу охлаждают под струей холодной воды до комнатной температуры, не взбалтывая содержимого, и добавляют 5 см3 раствора уксусной или винной кислоты, 20 см3 0,0333 н. раствора йода (или более), так, чтобы он был в избытке, перемешивают вращательным движением колбы, закрывают пробкой и выдерживают 2 мин. Затем прибавляют 5 см3 раствора крахмала и оттитровывают избыток йода 0,0333 н. раствором гипосульфита.
Аналогичное титрование выполняют с 50 см3 фильтрата без предварительного нагревания – на холоду (глухой опыт).
Объем израсходованного гипосульфита вычитают из прибавленного йода и таким образом определяют количество йодного раствора, вступившего в реакцию. Из него вычитывают 0,2 см3 как поправку на восстановление, производимое 10 см3 реактива Мюллера, по 0,2 см3 на каждый грамм присутствующей в навеске сахарозы, и количество см3 йодного раствора, пошедшего на глухой опыт.
Поправку на восстановление, производимое 10 см3 реактива Мюллера, следует проверить после его изготовления один раз на глухом опыте, производимом точно так, как описано выше, но на чистой воде.
Содержание редуцирующих веществ определяют из расчета, что 1 см3 0,0333 н. йода соответствует 1 мг редуцирующих веществ.
Пример. На оттитровывание избытка йода израсходовано 12,4 см3 раствора гипосульфита. Расход йодного раствора, вступившего в реакцию, равен 20-12,4=7,6 см3. Количество сахарозы в 6,5 г свеклы при сахаристости свеклы 18,5 % составляет
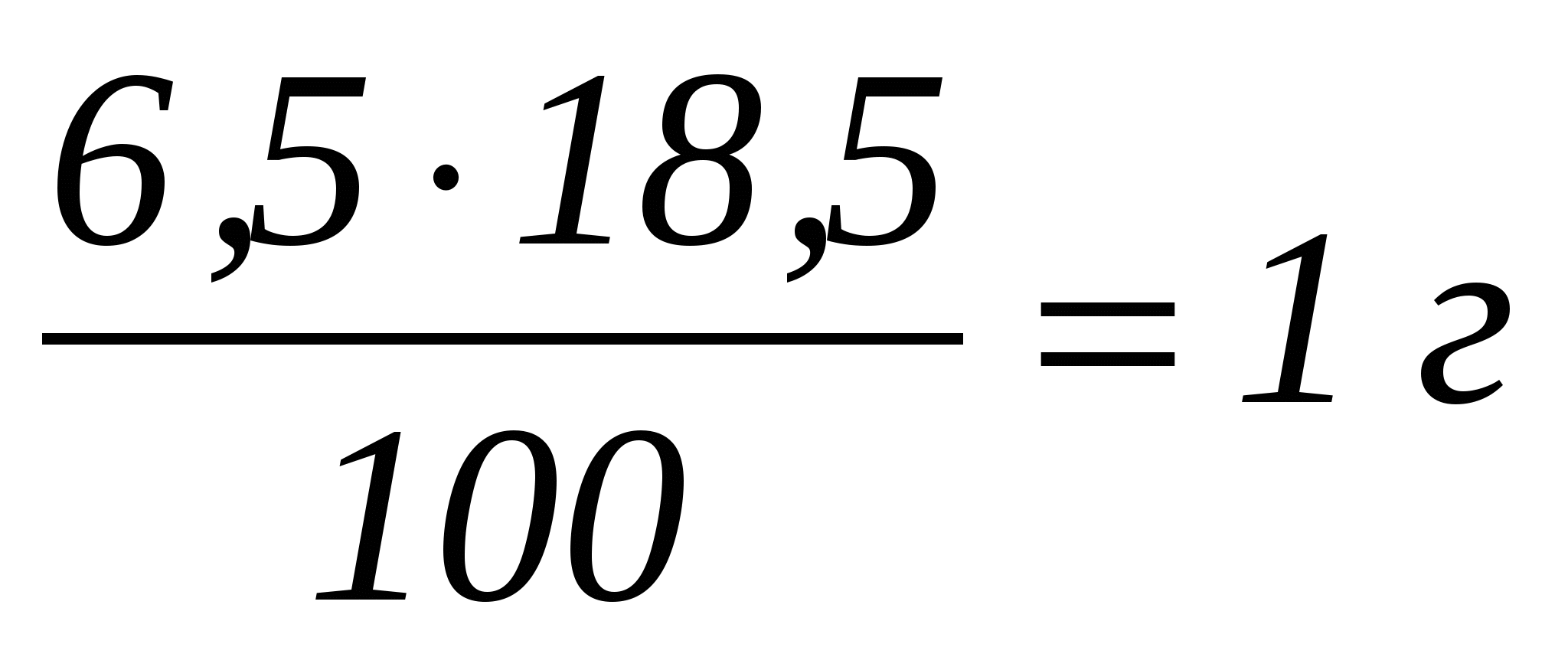 . .
Поправка на редуцирующую способность 10 см3 реактива Мюллера равна 0,2 см3 раствора йода и на глухой опыт – 0,2 см3.
Окончательный расход йодного раствора будет равен
7,6- 0,2 – 0,2 - 0,2 = 7,0 см3, что соответствует содержанию редуцирующих веществ (РВ) в количестве
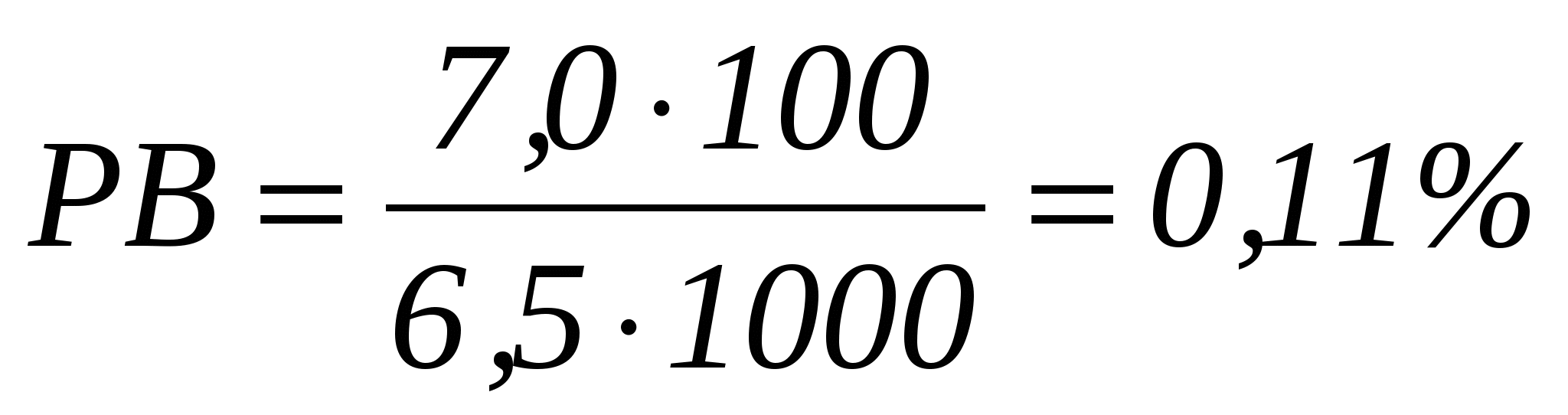 к массе свеклы. к массе свеклы.
3.2. Определение содержания редуцирующих веществ в диффузионном соке
Ход определения
Навеску массой 50 г диффузионного сока помещают в колбу вместимостью 250 см3, осветляют 6 см3 раствора нейтрального уксуснокислого свинца, доливают дистиллированной водой до метки, взбалтывают и фильтруют. Отбирают пипеткой 100 см3 фильтрата в колбу на 200 см3, удаляют из него избыток ионов свинца введением раствора соды (до слабо-розового окрашивания на фенолфталеин), доливают до метки, взбалтывают и фильтруют.
Из полученного таким образом фильтрата отбирают 50 см3, соответствующих 5 г сока, и переводят в коническую колбу.
Дальнейшие анализы проводят в соответствии с методикой определения редуцирующих веществ в свекле.
При большом содержании редуцирующих веществ берут меньше фильтрата, но его общий объем доводят дистиллированной водой также до 50 см3.
3.3. Определение содержания редуцирующих веществ в соке II сатурации и сиропе
Ход определения
|
|
|
 Скачать 0.79 Mb.
Скачать 0.79 Mb.