Лабораторный-практикум-по-технологии-сахара. Практикум по технологии сахара утверждено научнометодическим советом итпм 28 декабря 2002 года
 Скачать 0.79 Mb. Скачать 0.79 Mb.
|
Ход определения10г приготовленного для анализа анионита в ОН - форме переводят водой в стеклянную колонку диаметром 18 мм с тампоном из стеклянной ваты на дне, а избыток воды спускают через резиновую трубку с винтовым зажимом. После этого через слой анионита в течение 30 мин равномерно пропускают 400 см3 0,1 н. раствора HCl, поддерживая уровень раствора над слоем анионита равным 1 см. Затем его промывают двойным по объему анионита количеством воды. Фильтрат и промывные воды собирают в мерную колбу и доводят их объем до 500 см3. Отбирают из общего объема в стакан 50 см3 и титруют 0,1 н. раствором NaOH. Расчеты: 1. Для получения сравнимых результатов обменную емкость анионита выражают также, как и катионита через мг-экв/г сухого ионита. Поэтому, если 1 г абсолютно сухого анионита поглотит 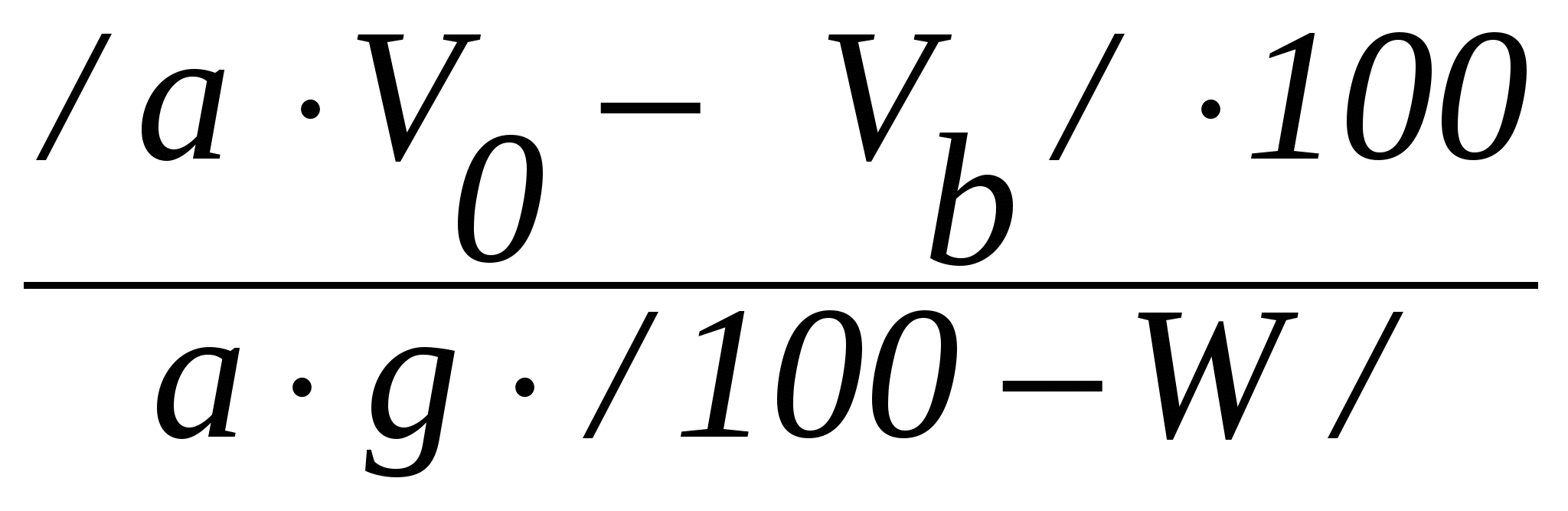 см3 0,1 н. раствора HCl, а 1 см3 этого раствора содержит 0,1 мг-экв/г, то полная обменная емкость анионита ЕА может быть рассчитана из формулы см3 0,1 н. раствора HCl, а 1 см3 этого раствора содержит 0,1 мг-экв/г, то полная обменная емкость анионита ЕА может быть рассчитана из формулы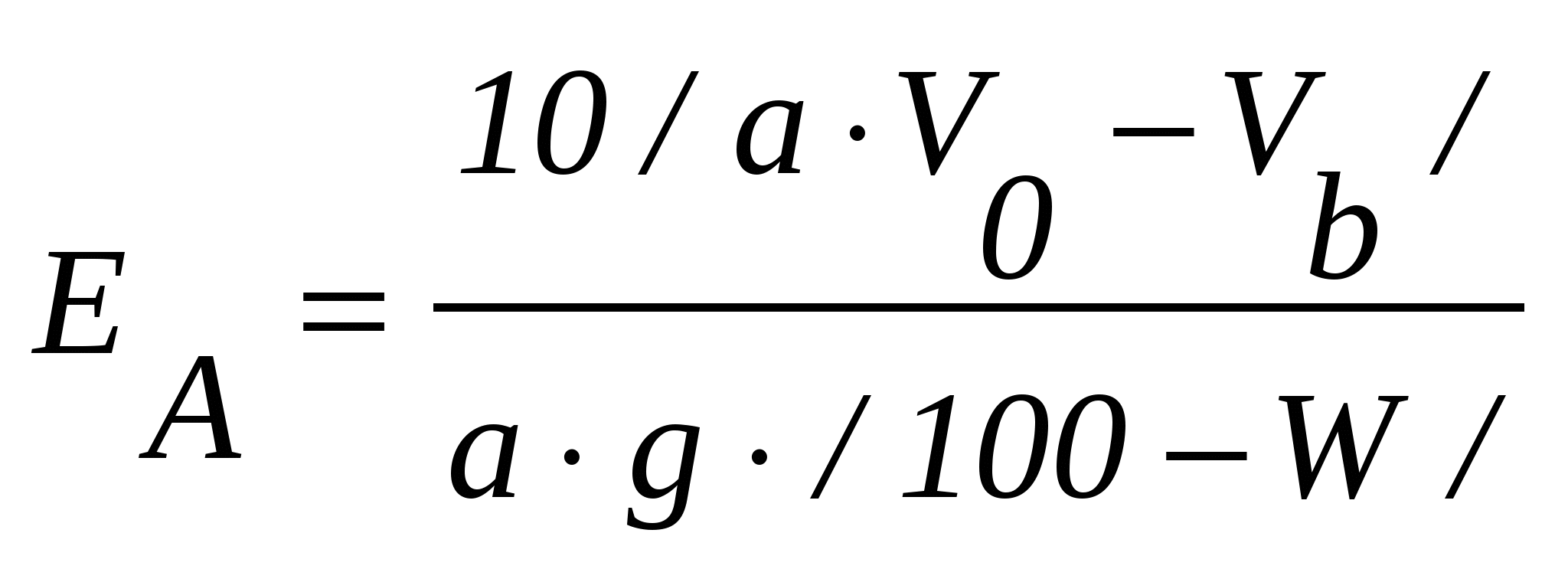 , ,где EА - полная обменная емкость анионита, мг-экв/г абсолютно сухого ионита; a - количество фильтрата, собранное для титрования, см3; VО – количество 0,1 н. раствора HCl, пропущенного через анионит, см3;Vb - общее количество фильтрата, см3; g - количество сухого анионита, взятого для определения его емкости, г; W – влажность анионита, %. Определяют методом высушивания в течение 3-х часов при 95-100˚С. 2. Емкость анионита может быть выражена и в процентах по HCl. В этом случае учитывают то, что 1 см3 0,1 н. раствора HCl содержит 0,0036 г HCl, расчет E 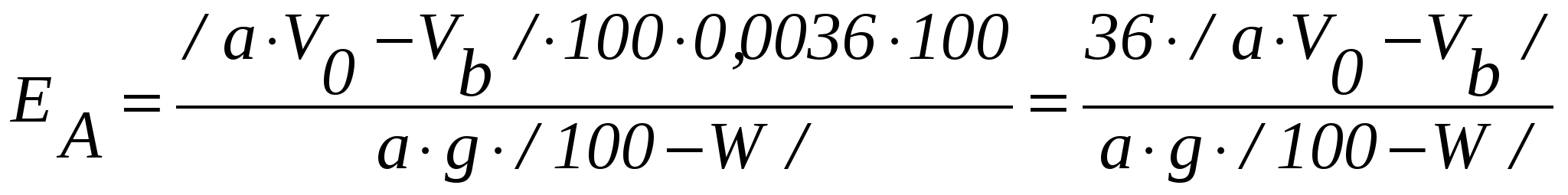 . .6.3. Регенерация ионообменных смол Введение Отработанные в рабочем цикле ионообменные смолы после их промывки водой подвергают регенерации (восстановлению). Катиониты восстанавливают слабыми растворами HCl и H K.Na + H KNa + HCl = KH + NaCl. Для восстановления анионитов применяются слабые растворы NaOH, KOH, NaCl и др. A.OH.Cl + Na В конце цикла регенерации кислотность регенерата из катионообменника или щелочность регенерата из анионообменника должны приближаться к кислотности и щелочности регенерационных растворов. Окончание регенерации устанавливают путем титрования. Цель анализа - восстановить обменную емкость ионитов. Принцип метода анализа основан на титровании регенерационных растворов из катионообменника 0,1 н. раствора NaOH, а из анионообменника - 0,1 н. раствором HCl. Реактивы: - 5%-ный раствор HCl; - 4%-ный раствор NaOH; - 0,1 н. раствор NaOH; - 0,1 н. раствор HCl. Приборы и материалы: - стеклянные колонки с катионообменной смолой и анионообменной смолой. Ход определенияПосле промывания смолы водой в колонках проводят регенерацию: катионита – 5%-ным раствором HCl, а анионита - 4%-ным раствором NaOH, пропуская их со скоростью 20 см3/мин. Окончание регенерации катионита устанавливают титрованием его регенерационных растворов 0,1 н. раствором NaOH , а анионообменника – 0,1 н. раствором HCl. После регенерации катионит отмывают водой до нейтральной или слабокислой реакции, а анионит – до нейтральной или слабощелочной реакции. Контрольные вопросы
Лабораторная работа № 7 Анализ сточных вод сахарного производства Введение В пищевой промышленности наибольшее количество воды потребляется сахарными заводами. Если для нужд свеклосахарного завода использовать только чистую воду из естественных водоемов, не возвращая части отработавшей воды в производство, то общий расход промышленной (свежей) воды составит 1200-1500% к массе свеклы. Сократить расход свежей воды до 150-250% к массе свеклы можно при условии использования на многих участках сахарного завода отработавшую воду по схеме оборотного водоснабжения. Артезианская вода расходуется только на промывание сахара-песка в центрифугах, для раскачки утфеля Ι кристаллизации и нужд заводской лаборатории. Сточные (отработавшие) воды сахарных заводов разнообразны по своему физико-химическому составу, степени загрязнения и способу требуемой очистки. По степени загрязнения их классифицируют на три категории. Каждую категорию подразделяют на две подгруппы: А и Б, из которых вода подгруппы А по качеству лучше подгруппы Б. Сточные воды сахарного производства содержат большое количество органических веществ, и их очистка в естественных условиях связана с определенными трудностями, требует значительных земляных площадей и может оказывать отрицательное влияние на окружающую среду. В последние годы разработан ряд способов биологической очистки и соответствующее оборудование для их реализации. Предлагаемые в настоящее время способы очистки в основном базируются на анаэробных и аэробных процессах разложения примесей сточных вод сахарных и крахмалопаточных заводов. Современная технология очистки сточных вод заключается в последовательном отделении содержащихся в них примесей механическим, анаэробным и аэробным способами. При этом анаэробный способ является новым процессом в технологии очистки сточных вод. Анаэробный процесс очистки требует для его проведения выдерживания температур в интервале 36-380С, что связано с дополнительным расходом тепла. Его отличие от широко распространенного аэробного способа состоит прежде всего в минимальном приросте биоосадка и превращении углеводсодержащих примесей в биогаз, основным компонентом которого является метан. Аэробный процесс С6Н12О6 + О2 ---- СО2 + Н2О + Биоосадок + Тепло (6360 кДж). Анаэробный процесс С6Н12О6 ---- СН4 + СО2 + Биоосадок + Тепло (0,38 кДж). Анаэробные способы подразделяют на четыре основные группы по типу используемых в процессах очистки реакторов: - с рециркуляцией биоосадка (активного ила): - со слоем анаэробного осадка и внутренним его осаждением; - с инертными наполнителями для биоосадка; - специальные. Сточные воды, подвергаемые анаэробной очистке, должны содержать как можно меньше механических примесей и веществ, ингибирующих метаногенный процесс. В них должна пройти гидролизно-кислотная фаза и кроме этого сточные воды должны иметь определенную величину рН и температуру в диапазоне 36-380С. Считается, что анаэробный способ очистки экономически выгоден для сточных вод с загрязнением более 1,2-2,0 г/дм3 БПК5 (биологическое потребление кислорода). Верхний предел загрязнения при этом не ограничен. Он может равняться и 100 г/дм3 ХПК (химическое потребление кислорода). Сточные воды I категории – это условно- чистые воды, которые по своему химическому составу мало отличаются от состава исходной промышленной (естественной) воды. К ним относят: А) Избыточную свежую воду из напорного резервуара, от охлаждения утфеля в утфелемешалках, от насосов и других установок с температурой ниже 30°С. Для возврата в производство эти воды не требуют очистки; Б) Барометрическую, аммиачную и другие с температурой выше 30°С. Для возврата этих вод требуется предварительное охлаждение и аэрация. К сточным водам II категории относят транспортерно-моечную воду из гидравлических транспортеров и свекломоек. Для повторного использования этих вод в производстве требуется их предварительная механическая очистка путем отстаивания в специальных отстойниках. К сточным водам III категории относят: жомопрессовую воду, ее отстой, лаверные воды, осадок транспортерно-моечной воды, жидкий фильтрационный осадок, хозяйственно-бытовые, фекальные и другие вредные воды. Для очистки вод III категории требуются биологические и комбинированные способы очистки в соответствующих отстойниках и на полях фильтрации. На действующих сахарных заводах за основу принимают следующие основные показатели баланса воды (% к массе свеклы): забор свежей воды из водоема – 164; количество оборотных вод I категории – 898; II категории –862; сточных вод III категории – 170 или 110 при условии отстаивания суспензии транспортерно-моечного осадка в вертикальных отстойниках-сгустителях Ш1-ПОС-3 и возврате декантата в контур рециркуляции вод II категории. Для вновь строящихся свеклосахарных заводов потребление свежей воды на производственные нужды не должно превышать 80% к массе свеклы, а количество сбрасываемых очищенных производственных сточных вод в природные водоемы – не более 75% к массе свеклы. При анализе качества промышленных и сточных вод определяют их температуру, цвет, запах, прозрачность, характеристику осадка, содержание взвешенных веществ, сухой остаток, рН, общую щелочность (кислотность), окисляемость, биохимическое потребление кислорода (БПК), химическое потребление кислорода (ХПК), концентрацию аммиака, нитратов, хлоридов и другие показатели. Цель работы - освоить методы контроля качества промышленной (свежей) и сточных вод. 7.1. Определение окисляемости Теоретические сведения Окисляемость воды характеризует степень ее загрязнения. Под окисляемостью понимают расход кислорода на окисление содержащихся в воде веществ (в основном органических), эквивалентных количеству расходуемого окислителя. В зависимости от применяемого окислителя различают перманганатную и бихроматную окисляемость. Выражают окисляемость в миллиграммах кислорода, затраченных на окисление органических веществ в литре воды. Бихроматный метод дает представление почти о полном содержании органических веществ (на 95 - 100%) в сточной воде, а перманганатный метод - о содержании в сточной воде легко окисляющихся органических веществ (например, гуминовых соединений).
ВведениеОпределение органических веществ в сточных водах по бихроматной окисляемости заключается в окислении их бихроматом калия в присутствии катализаторов AgSO4 или HgSO4. Для создания необходимой кислотности среды пользуются раствором бихромата калия, приготовленным на серной кислоте. Окисление проводят при кипячении пробы в течение 5 мин, что обеспечивает практически полное окисление органических веществ. Избыток непрореагировавшего бихромата калия оттитровывается раствором соли Мора{FeSO4 (NH4) 2 SO4 · 6H2O} в присутствии дифениламина, который при наличии в растворе окислителя (бихромата калия) находится в окисленной форме и окрашен в синий цвет. Раствор в начале титрования имеет буро-синюю окраску (смешанная окраска бихромата калия и окисленной формы дифениламина). Когда весь бихромат калия оттитрован, дифениламин становится бесцветным (восстановленная форма), а проба приобретает зеленый цвет, присущий солям Cr3+. В процессе титрования двухвалентное железо (Fe2+) окисляется в трехвалентное (Fe3+), а последнее, как окислитель, дает синюю окраску дифениламину, когда бихромат калия уже оттитрован. Цель анализа – провести оценку качества сточных вод по их окисляемости бихроматом калия. Принцип метода анализа основан на окислении органических веществ в сточных водах бихроматом калия. |
