Тец руководство. Руководство к практаческим занятиям по медицинской микробиологии, вирусологии и иммунологии под редакцией
 Скачать 2.14 Mb. Скачать 2.14 Mb.
|
|
Тема 16.1. ВОЗБУДИТЕЛИ ЧУМЫ, ТУЛЯРЕМИИ, БРУЦЕЛЛЕЗА, СИБИРСКОЙ ЯЗВЫ, ЛЕПТОСПИРОЗА И ДРУГИХ ЗООНОЗНЫХ ИНФЕКЦИЙ План Программа Биологические свойства возбудителей зооантропонозных инфекций, их патогенность, экология, особенность инфекций и эпидемиология вызываемых заболеваний. Микробиологическая диагностика чумы, туляремии, бруцеллеза, сибирской язвы, лептоспироза. Особенности лабораторной работы с возбудителями ООН. Диагностические, профилактические и лечебные препараты. Демонстрация Мазки из чистых культур: Bwcella abortus, Bacillus апthracis, Francisella tularensis (окраска по методу Грама). Yersinia pestis в гное из бубона (окраска метиленовым синим). Культура лептоспиры в темном поле. Рост B.anthracoides на питательной среде. Реакция агглютинации Райта для серодиагностики бруцеллеза. Реакция агглютинации для серодиагностики туляремии. Диагностические, профилактические и лечебные препараты. а Задание студентам Микроскопировать и зарисовать препараты возбудителей зоонозных инфекций. Учесть результаты реакции агглютинации Райта для серодиагностики бруцеллеза. Проанализировать результаты РИГА для серодиагностики бруцеллеза. Оценить результаты реакции агглютинации с парными сыворотками больного для серодиагностики туляремии. Оценить результаты реакции термокольцепреципитации по Асколи с исследуемым материалом (термоэкстракт из шкуры животного). Отметить результаты реакции агглютинации-лизисалептоспир для серодиагностики лептоспироза и сделать заключение. Ознакомиться с диагностическими, профилактическими и лечебными препаратами. а Методические указания • Микробиологическая диагностика чумы МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: гной из бубонов, пунктат лимфатических узлов, мокрота, промывные воды желудка, кровь, патолого-анатомический материал. МЕТОДЫ ДИАГНОСТИКИ: Бактериоскопическое исследование (схема 16.1.1). Из исследуемого материала готовят мазки, окрашивают по методу Грама и водным раствором метиленового синего. Y.pestis представляют собой грамотрицательные палочки овоидной формы (0,5x1,7 мкм). В мазках, окрашенных метиленовым синим, хорошо заметно биполярное распределение краски (рис. 16.1.1; на вклейке). Встречаются полиморфные клетки. Бактериологическое исследование. Исследуемый материал засевают на чашки с питательным агаром. Посевы инкубируют при 25—28 °С. Первичное изучение посевов производят через 10—12 ч. К этому сроку появляются колонии в виде батистового платочка, которые образованы вирулентными R-формами. Мало- и авирулентные бактерии формируют S-формы колоний. Идентификацию чистой культуры проводят по морфологии бактериальных клеток, характеру роста, антигенным и биохимическим свойствам, чувствительности к специфическому фагу и с помощью молекулярно-биологических методов. Иногда также используют биопробу. На бульоне Y.pestis образуют пленку со спускающимися нитями, напоминающими сталактиты; ферментируют многие сахара до кислоты, индола не образуют, желатин не разжижают. Y.pestis содержат групповой термостабильный соматический антиген и специфический термолабильный капсульный антиген, который обнаруживается только у вирулентных штаммов. В случае исследования материала, взятого у погибших грызунов, проводят дифференциальную диагностику с возбудителями псевдотуберкулеза (Yersinia pseudotuberculosis) на основании 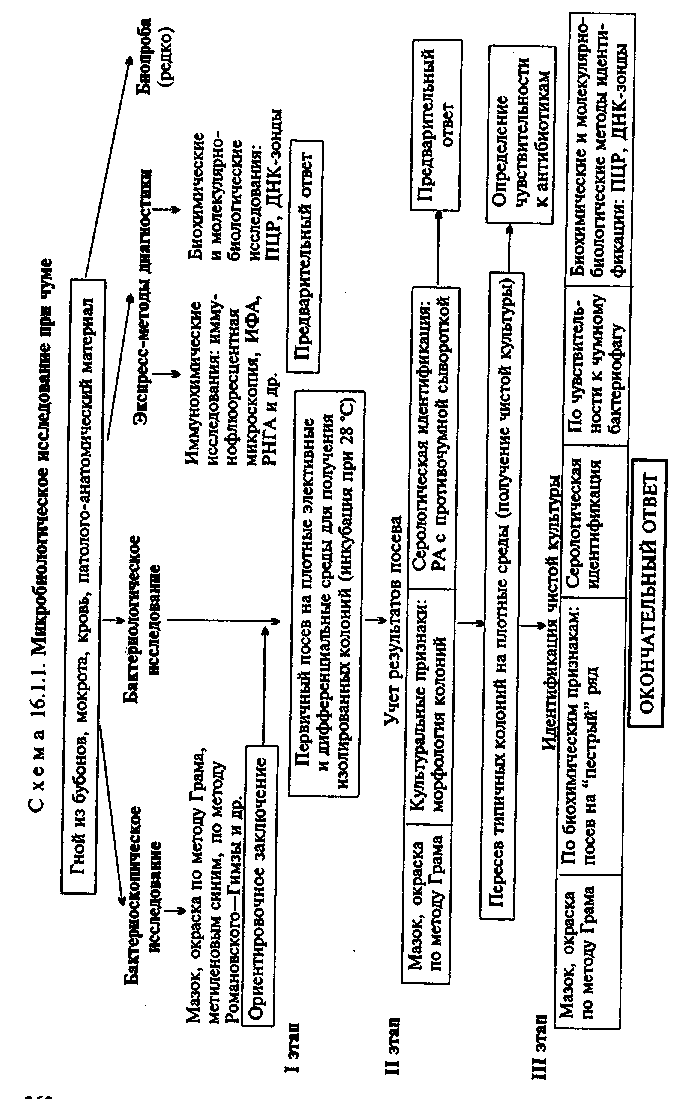 характера роста на специальных средах, биохимических свойств (ферментация рамнозы, адонита) и других признаков. Биопроба. Проводят для выделения чистой культуры из материала, загрязненного посторонней микрофлорой. Наиболее чувствительными лабораторными животными являются морские свинки. Материал вводят подкожно или внутрибрюшинно в том случае, если он не загрязнен другими бактериями. При контаминации посторонней микрофлорой материал втирают морской свинке в выбритый участок кожи в области живота. После гибели животных (на 3—7-й день в зависимости от способа введения материала) делают вскрытие, отмечают патологические изменения органов и проводят бактериологическое исследование по схеме 16.1.1. Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Иммунофлюоресцентный метод позволяет обнаружить присутствие антигенов возбудителя как в патологическом материале, так и в объектах окружающей среды (вода, почва), а также в пищевых продуктах и эктопаразитах. С этой целью используют люминесцентную ви-доспецифическую противочумную сыворотку, люминесцентные противокапсульную и противосоматическую сыворотки. РИГА применяют для обнаружения антигенов возбудителя чумы в исследуемом материале с помощью стандартной противочумной сыворотки, антитела которой нагружены на эритроциты. Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз. • Микробиологическая диагностика туляремии МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: гной из бубонов, пунктат лимфатических узлов, мокрота, кровь, патолого-ана-томический материал. МЕТОДЫ ДИАГНОСТИКИ: Бактериоскопическое исследование (схема 16.1.2). Из исследуемого материала готовят мазки, окрашивают по методу Грама и метиленовым синим. Для F.lularensis характерен выраженный полиморфизм. В чистой культуре они представляют собой очень мелкие (0,3—0,5 мкм) кокки (рис. 16.1.2; на вклейке). В мазках из органов преобладают палочковидные формы. Спор не образуют, грамотрицательны, иногда выражена биполярная окраска. В биоптатах тканей и мазках F.tularensis могут располагаться как вне, так и внутри клеток. Бактерии слабо окрашиваются по методу Грама и плохо выявляются в материале 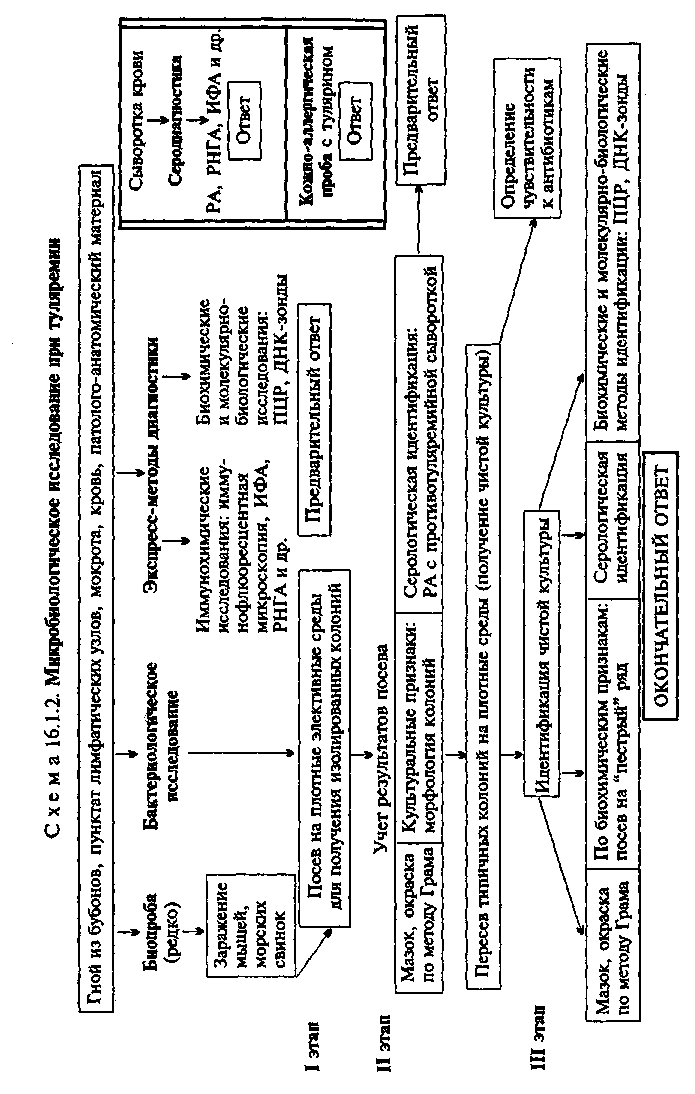 при обычных методах микроскопии. Для обнаружения используют преимущественно метод иммунофлюоресценции (см. ниже). Бактериологическое исследование. Применяют для выделения чистой культуры F.tularensis. Бактериологическую диагностику осуществляют в специальных лабораториях. Выделение возбудителя проводят на свернутой яично-желточной среде, глюкозоцистиновом кровяном агаре и других богатых питательных средах сложного состава. Для подавления роста сопутствующей микрофлоры в среды добавляют пенициллин. Вирулентные штаммы образуют S-формы колоний — мелкие, гладкие, беловатого цвета с голубоватым оттенком. Идентификацию чистой культуры проводят по морфологии бактериальных клеток, характеру роста, биохимическим, антигенным свойствам и с помощью молекулярно-биологических методов. Биохимические свойства F.tularensis выявляют на специальной плотной среде с ограниченным содержанием белка. Бактерии содержат оболочечный антиген, с которым связаны их вирулентные и иммуногенные свойства, и О-соматический антиген. По антигенным свойствам близки к бруцеллам. Биопроба. Наиболее чувствительными животными являются белые мыши и морские свинки, которые погибают при подкожном введении единичных бактерий. Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Метод ИФ позволяет обнаружить присутствие антигенов бактерий в патологическом материале. Используют люминесцентную противотуляремийную сыворотку. В положительном случае в препарате видны светящиеся микроорганизмы. Антигены возбудителя в материале от больного могут быть обнаружены с помощью ИФА. Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз. Серодиагностика. Ставят реакцию агглютинации с туляре-мийным диагностикумом. Относительно позднее появление антител-агглютининов в крови (на 2-й неделе болезни) затрудняет применение этой реакции для ранней диагностики, однако их длительное сохранение делает возможной ретроспективную диагностику. Диагностический титр реакции 1:100. Обязательно прослеживается нарастание титра агглютинации (в парных сыворотках). Более чувствительным методом серодиагностики туляремии является РНГА, которая бывает положительной в конце 1-й — начале 2-й недели заболевания. Титры антител в сыворотке в разгар заболевания достигают 1:1280— 1:2560 и выше. Используют также ИФА. Для ускоренной диагностики применяют кровяно-капельную реакцию: кровь из пальца больного наносят на обезжиренное предметное стекло, добавляют каплю дистиллированной воды (для лизиса эритроцитов), вносят каплю диагности-кума и смешивают стеклянной палочкой. При наличии в крови агглютининов в диагностическом титре (1:100 и выше) в капле немедленно наступает агглютинация диагностикума; при титрах ниже диагностических агглютинация происходит через 2—3 мин. Кожно-аллергическая проба. Для диагностики применяют внутрикожную и накожную пробы со специфическим аллергеном — тулярином. Пробы высокочувствительны и дают положительные результаты у больных начиная с 3—5-го дня болезни. Положительные результаты регистрируются также у переболевших и вакцинированных, поэтому оценка реакции должна проводиться с осторожностью. • Микробиологическая диагностика бруцеллеза МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь. МЕТОДЫ ДИАГНОСТИКИ: Бактериологическое исследование (схема 16.1.3). Для получения гемокультуры 5—10 мл крови, взятой из локтевой вены больного, засевают в два флакона с 50—100 мл печеночного бульона. Один из них (для выделения культуры B.melitensis) инкубируют в обычных аэробных условиях, другой (для выделения первичной культуры B.abortus) — в атмосфере с 10 % СО2. В первых генерациях бруцеллы растут очень медленно, поэтому посевы выдерживают в термостате не менее месяца. В то же время рост лабораторных культур наблюдается через 1—2 сут. На агаре бруцеллы образуют бесцветные с перламутровым блеском колонии, в бульоне — помутнение и слизистый бсадок. В мазках, окрашенных по методу Грама, обнаруживаются мелкие (от 0,3—0,5 до 1,5 мкм) грамотрицательные кок-ковидные или более удлиненные формы (рис. 16.1.3; на вклейке). Они неподвижны, спор не образуют. Для быстрой идентификации бруцелл ставят РА со специфическими агглютинирующими сыворотками на стекле и определяют чувствительность к специфическому фагу. Все виды бруцелл не ферментируют углеводы. Их дифференцируют по образованию ^S, чувствительности к СОз, способности окрашиваться анилиновыми красителями (основным фуксином и тионином) и другим признакам. Используют также молекуляр-но-биологические методы. Биопроба. Применяют для выделения чистой культуры из материала, загрязненного посторонней микрофлорой или содержащего небольшое количество бруцелл. Исследуемый материал вводят морским свинкам или белым мышам подкожно в паховую область. Мышей вскрывают через 20 дней после за- 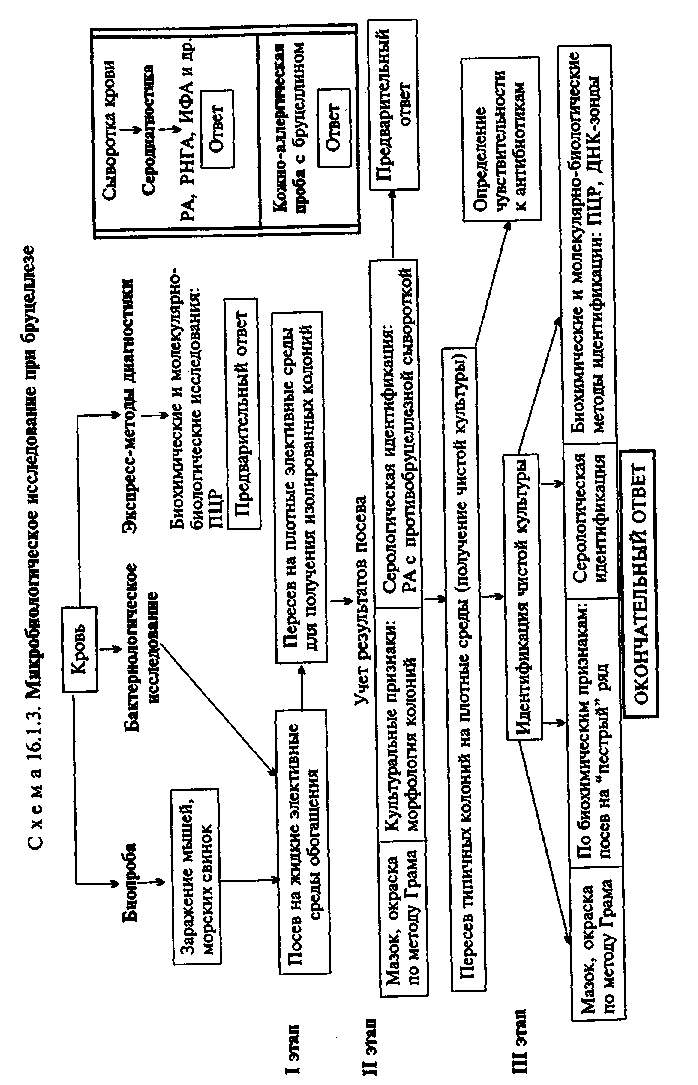
заболевания процент положительных серологических реакций (РА, РИГА и РСК) начинает снижаться и большее диагностическое значение приобретают кожно-аллергическая проба и реакция Кумбса, поэтому комплексный серо-аллергический метод является наиболее надежным в диагностике бруцеллеза. Кожно-аллергическая проба (реакция Бюрне). На ладонную поверхность предплечья внутрикожно вводят 0,1 мл бруцелли-на. При наличии ГЗТ уже через 6—8 ч могут появиться гиперемия кожи и болезненная отечность. Учет реакции производят через 24 ч (см. рис. 10.4.1). Реакция обладает высокой чувствительностью и появляется не только у больных и переболевших, но и у вакцинированных людей, в связи с чем ее диагностическая оценка должна производиться с осторожностью. • Микробиологическая диагностика сибирской язвы МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: экссудат из очага поражения (сибиреязвенного карбункула), мокрота, фекалии, кровь. МЕТОДЫ ДИАГНОСТИКИ: Бактериоскопическое исследование (схема 16.1.4). Изучение окрашенных по методу Грама мазков из патологического материала (экссудат, мокрота) позволяет обнаружить возбудителя, представляющего собой грамположительную крупную (1—2 х 6—10 мкм) неподвижную стрептобациллу. В организме больных и на белковой питательной среде микроорганизмы образуют капсулу (рис. 16.1.4; на вклейке), в неблагоприятных условиях (почве) — споры (см. рис. 2.2). Бактериологическое исследование. Исследуемый материал засевают на чашки с питательным и кровяным агаром, а также в пробирку с питательным бульоном. Посевы инкубируют при 37 °С в течение 18—20 ч. В бульоне культура B.anthracis растет в виде хлопьевидного осадка; на агаре вирулентные штаммы образуют колонии R-формы, имеющие под малым увеличением микроскопа вид львиной гривы или головы медузы. Авиру-лентные или слабовирулентные бактерии образуют S-формы колоний. Для идентификации возбудителя изучают биохимические свойства и ряд других признаков (гемолитическую активность, способность к образованию L-форм и др.). B.anthracis обладает сахаролитическими свойствами, медленно разжижает желатин (в виде елочки верхушкой вниз), лишен гемолитической активности. Под действием пенициллина образует сфероплас-ты, имеющие вид жемчужин. Это явление используется для дифференциации B.anthracis от непатогенных бацилл. Применяют также молекулярно-биологические методы идентификации. Биопроба. Исследуемый материал вводят подкожно белым мышам, морским свинкам или кроликам. Павших животных вскрывают, готовят мазки из крови и внутренних органов, делают посевы для выделения чистой культуры возбудителя. Капсульные формы B.anthracis в экссудате, полученном через 5—18 ч после заражения животного, можно обнаружить методом иммунофлюоресценции (см. ниже). Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Мазки из экссудата обрабатывают противокапсульной сибиреязвенной антисывороткой, а затем флюоресцирующей антикроличьей сывороткой, меченной родамином. В препаратах, содержащих капсульные бациллы, наблюдается желто-зеленое свечение возбудителя. Антигены B.anthracis (секретируемые белки — "протектив-ный антиген" и токсины) в исследуемом материале из очага инфекции могут быть обнаружены с помощью чувствительных серологических реакций (ИФА и др.). Реакцию термокольцепреципитации Асколи для исследования трупного материала ставят при необходимости диагностировать сибирскую язву у павших животных или у людей, умерших от неизвестной болезни, напоминающей висцеральную форму сибирской язвы, а также для определения зараженности сырья (кожа, мех, шерсть). Образцы исследуемого материала измельчают и кипятят в пробирке с изотоническим раствором хлорида натрия в течение 5—10 мин, после чего фильтруют до полной прозрачности. Преципитирующую сибиреязвенную сыворотку получают путем гипериммунизации лошадей убитой культурой B.anthracis. Испытуемый термоэкстракт осторожно наслаивают на поверхность сыворотки в преципитационной пробирке. В положительном случае через 1—2 мин в месте соприкосновения появляется белое кольцо преципитации, что свидетельствует о присутствии в материале антигенов возбудителя. Контрольный термоэкстракт готовят из того же материала, взятого от здорового животного (см. табл. 10.1.1). Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз. Кожно-аллергическая проба. Ставится на внутренней поверхности предплечья — внутрикожно вводят 0,1 мл антраксина. При положительной реакции через 24 ч появляются гиперемия и инфильтрат. Положительная реакция регистрируется у 90 % больных сибирской язвой, начиная со 2-й недели заболевания, и сохраняется у переболевших в течение всей жизни, в связи с чем ее диагностическая оценка должна производиться с осторожностью.  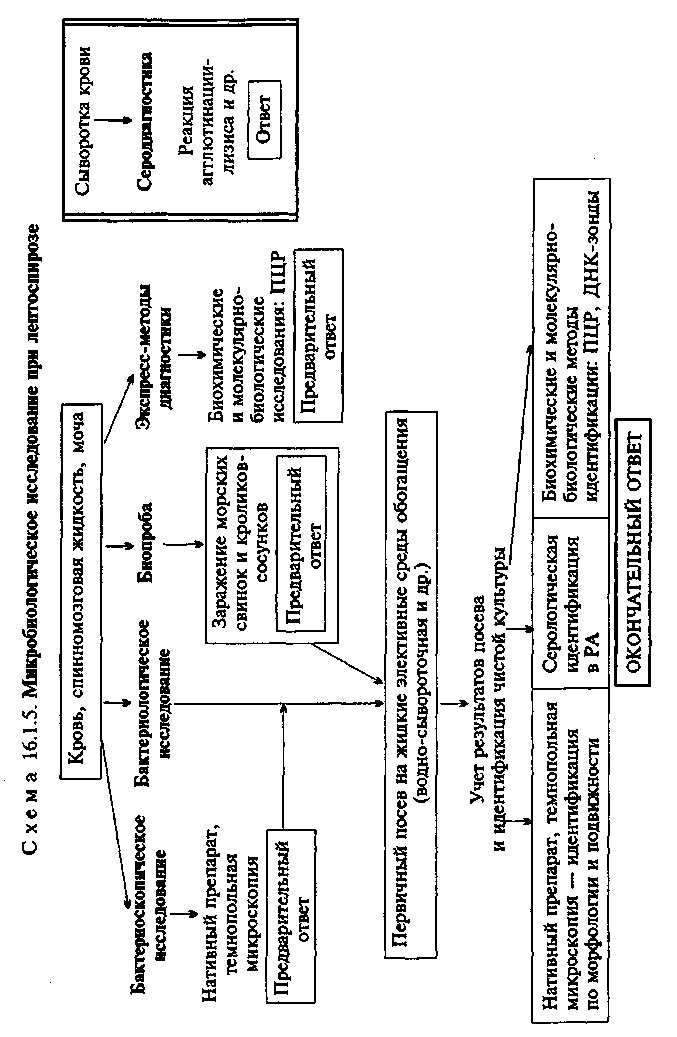 чение месяца. При заболевании или гибели животного готовят препараты из крови, мочи, материала, полученного после вскрытия, микроскопируют их в темном поле и делают посевы для выделения чистой культуры лептоспир. Экспресс-методы диагностики. Биохимические и моле-кулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз. Серодиагностика. Антитела в крови пациентов удается обнаружить с конца 1-й недели болезни. Для их выявления используют реакцию агглютинации-лизиса с живыми эталонными культурами лептоспир разных серогрупп и сероваров. Учет результатов реакции проводят методом термопольной микроскопии в препаратах "раздавленная" капля в темном поле. В положительном случае отмечают агглютинацию и лизис лептоспир. При этом в первых разведениях сыворотки наблюдаются полное растворение лептоспир, частичный лизис или зернистое набухание, в последующих разведениях — агглютинация лептоспир и появление агломератов в виде паучков. Диагностический титр реакции 1:100. Максимальный титр антител (1:1000— 1:10 000 и выше) наблюдается на 15—30-й день заболевания. Ввиду того что у части переболевших антитела в высоких титрах сохраняются в течение многих лет, диагностическое значение имеет нарастание титра антител в парных сыворотках. • Микробиологическая диагностика сапа МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: гной из язвенных поражений, абсцессов, отделяемое из носа. МЕТОДЫ ДИАГНОСТИКИ: Бактериоскопическое исследование. Из исследуемого материала готовят мазки и окрашивают по методу Грама. В мазках обнаруживаются мелкие (2—4 х 0,5—1 мкм) грамотрицатель-ные палочки. Метод имеет ориентировочное значение. Бактериологическое исследование. Burkholderia mallei культивируют на простых питательных средах. Они образуют мелкие гладкие колонии, имеющие кремовую окраску, которые появляются на 2—3-й день. Чистую культуру возбудителя идентифицируют по морфологии микробных клеток, подвижности (В.mallei неподвижны), тинкториальным, культуральным и биохимическим признакам. Экспресс-методы диагностики. Биохимические и моле-кулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз. Серодиагностика. Для обнаружения антител к возбудителю используют реакции агглютинации, РИГА, РСК. Кожно-аллергическая проба. Диагностическое значение имеет постановка кожно-аллергической пробы с маллеином (аллергеном, приготовленным из В.mallei). • Микробиологическая диагностика листериозов МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь, смывы из зева, спинномозговая жидкость, околоплодные воды, плацента. МЕТОДЫ ДИАГНОСТИКИ: Бактериоскопическое исследование. В мазках из исследуемого материала, окрашенных по методу Грама, обнаруживаются мелкие короткие (0,5—2x0,4—0,5 мкм) грамположительные палочки. Метод имеет ориентировочное значение. Бактериологическое исследование. Исследуемый материал засевают на богатые питательные среды (кровяной агар, сердечно-мозговой бульон и др.), применяют также селективные среды с высоким содержанием NaCl, антибиотиками (полимик-син, цефтазидим) и другими селектирующими агентами. Посевы инкубируют 5—7 дней при 35 "С. На кровяном агаре характерен р-гемолиз. Идентификацию осуществляют по морфологии микробных клеток, культуральным и биохимическим признакам. Для видовой и внутривидовой идентификации осуществляют серотипирование (по жгутиковому антигену и соматическому антигену клеточной стенки) и фаготипирование. Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Для быстрого обнаружения антигенов возбудителя в мазках из исследуемого материала используют метод прямой ИФ. Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз. Серодиагностика мало информативна и практически не применяется. • Микробиологическая диагностика инфекций, вызванных Streptobacillus moniliformis МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь, суставная жидкость. МЕТОДЫ ДИАГНОСТИКИ: Бактериоскопическое исследование. В мазках из суставной жидкости, окрашенных по методу Грама, можно обнаружить грамотрицательные палочки, располагающиеся в виде цепочек, образующих длинные неветвящиеся нити. Метод имеет ориентировочное значение. Бактериологическое исследование. Исследуемый материал засевают на богатые питательные среды с высоким содержанием (не менее 10 %) нативных добавок (кровь, сыворотка или ас-цитическая жидкость). Посевы инкубируют при 35 °С в атмосфере с повышенным содержанием СС^. Бактерии образуют мелкие гладкие блестящие колонии. Идентификацию осуществляют по морфологии и тинкториальным свойствам (грамотрицательные палочки располагаются в виде цепочек, образующих неветвящиеся нити длиной до 100—150 мкм), культураль-ным и биохимическим признакам. Важным методом идентификации является ГЖХ. Экспресс-методы диагностики. Биохимические и моле-кулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз. Серодиагностика. Для обнаружения антител к возбудителю используют реакцию агглютинации с парными сыворотками пациента. Диагностическим считается титр реакции 1:80 и нарастание титра антител не менее чем в 4 раза. • Микробиологическая диагностика инфекций, вызванных Spirillum minus МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь, экссудат из очага инфекции, пунктат лимфатических узлов. МЕТОДЫ ДИАГНОСТИКИ: Бактериоскопическое исследование. Является ведущим методом диагностики. Возбудителя в нативных препаратах из исследуемого материала обнаруживают с помощью темнопольной микроскопии. Бактерии 3—5 мкм длиной и 0,2—0,5 мкм толщиной, подвижны, имеют извитую форму (2—6 завитков). Бактериологическое исследование. Не проводится, поскольку Spirillum minus не удается культивировать in vitro. Экспресс-методы диагностики. Биохимические и моле-кулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз. Биопроба. Материал от больного вводят внутрибрюшинно морским свинкам. Через 7—10 дней перитонеальный экссудат и кровь зараженного животного исследуют методом темнопольной микроскопии. • Микробиологическая диагностика пастереллеза МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: отделяемое кожных язв, гной из абсцессов, кровь, спинномозговая жидкость. МЕТОДЫ ДИАГНОСТИКИ: Бактериоскопическое исследование. В препаратах из исследуемого материала, окрашенных по методу Грама, обнаруживают короткие (0,3—1,5 мкм длиной и 0,15—0,25 мкм толщиной) грамотрицательные палочки овоидной формы, которые могут окрашиваться биполярно. Бактериологическое исследование. Pasteurella multocida хорошо растут на простых питательных средах, через 24 ч образуют мелкие непигментированные колонии. На кровяном агаре гемолиз нехарактерен. Чистую культуру возбудителя идентифицируют по морфологии микробных клеток, тинкториальным, культуральным и биохимическим признакам. Экспресс-методы диагностики. Биохимические и моле-кулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз. Серодиагностика мало информативна и практически не применяется. • Микробиологическая диагностика инфекций, вызванных Erysipelothrix rhusiopathiae МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: биоптаты пораженных участков кожи, отечная жидкость, кровь при септической форме инфекции. МЕТОДЫ ДИАГНОСТИКИ: Бактериоскопическое исследование. В препаратах из исследуемого материала, окрашенных по методу Грама, обнаруживают мелкие (0,8—2,5 мкм длиной и 0,2—0,5 мкм толщиной) грам-положительные палочки, располагающиеся поодиночке, в виде коротких цепочек или образующих длинные неветвящиеся нити. Бактериологическое исследование. Исследуемый материал засевают на богатые питательные среды и инкубируют в течение 7 дней в атмосфере с повышенным содержанием СО2- Бактерии образуют колонии двух типов: мелкие гладкие и крупные шероховатые, на кровяном агаре дают а \ -гемолиз. Чистую культуру возбудителя идентифицируют по морфологии микробных клеток, тинкториальным, культуральным и биохимическим признакам, внутривидовое типирование (серотипирование) осуществляют по соматическому антигену клеточной стенки в РА с типоспецифическими антителами. Экспресс-методы диагностики. Биохимические и моле-кулярно-биологические исследования. Исследуемый материал используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз. Серодиагностика не применяется. • Микробиологическая диагностика инфекций, вызванных Bartonella hensella МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: биоптат из пораженного участка кожи, лимфатического узла или органа, кровь. МЕТОДЫ ДИАГНОСТИКИ: Бактериоскопическое исследование. В гистологических препаратах из очагов поражения, окрашенных по методу Грама, могут быть обнаружены мелкие грамотрицательные палочки, располагающиеся преимущественно внутриклеточно. Метод обладает чрезвычайно низкой чувствительностью в связи с малыми размерами возбудителя. Вероятность обнаружения бактерий повышается при использовании окраски серебрением, позволяющей выявлять объекты малых размеров. Метод имеет ориентировочное значение. Бактериологическое исследование. Бартонеллы выделяют из крови пациентов на богатых средах сложного состава (с добавлением сердечно-мозгового экстракта, крови и других факторов роста) или путем заражения клеточных культур (Vero и др.). Культивирование занимает несколько недель, поскольку бар-тонеллы являются прихотливыми медленно растущими бактериями. Для идентификации используют серологические (реакция ИФ) и молекулярно-биологические методы (ПЦР, метод ДНК-зондов). Бактериологическое исследование при болезни кошачьей царапины применяется сравнительно редко по причине трудоемкости. Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Антигены возбудителя в био-птатах из очагов поражения могут быть обнаружены методом ИФ. Молекулярно-биологические исследования. ДНК возбудителя в биоптатах из очагов поражения и крови может быть обнаружена с помощью метода ДНК-зондов и ПЦР. Серодиагностика недостаточно информативна, поскольку антитела часто присутствуют в крови здоровых лиц. Для обнаружения специфических IgM в крови больных применяют метод непрямой ИФ: клетки культуры Vero, зараженные тест-штаммом бартонелл, обрабатывают сывороткой крови пациента. Специфические IgM выявляют с помощью моноклональных антител (МКАТ) к человеческим IgM, меченных флюорохромом. В положительном случае наблюдается специфическое свечение бактерий в зараженных клетках. • Микробиологическая диагностика пситтакоза и Q-лихорадки. Изложена ранее (см. тему 14.1). • Диагностические, профилактические и лечебные препараты Бруцеллезный единый диагностикум. Взвесь убитых бруцелл, окрашенных метиленовым синим, применяется для серодиагностики бруцеллеза в реакции агглютинации Райта и Хеддель-сона. Туляремийный диагностикум. Взвесь убитых бактерий F.tu-larensis применяется для постановки реакции агглютинации при серодиагностике туляремии. Преципитирующая сибиреязвенная сыворотка. Получена из крови лошадей, гипериммунизированных культурой B.anthracis. Применяют для постановки реакции термопреципитации по Асколи. Чумной бактериофаг. Используется для идентификации Y.pestis. Сибиреязвенный бактериофаг. Применяют для идентификации B.anthracis. Бруцеллин. Фильтрат 3-недельных бульонных культур Б. те-litensis, B.abortus, B.suis, убитых нагреванием. Применяют для постановки кожно-аллергической пробы Бюрне. Тулярин. Взвесь F.tularensis (вакцинного штамма), убитых нагреванием, используется для постановки кожно-аллергической пробы. Антраксин. Белково-полисахаридно-нуклеиновый комплекс, извлеченный при гидролизе B.anthracis, применяется для постановки кожно-аллергической пробы. Чумная живая сухая вакцина. Высушенная живая культура Y.pestis вакцинного штамма EV используется для активной специфической профилактики чумы (создание активного иммунитета). Туляремийная живая сухая накожная вакцина. Высушенная живая культура вакцинного штамма F.tularensis применяется для активной специфической профилактики туляремии. Накожная сухая живая бруцеллезная профилактическая вакцина. Высушенная живая культура вакцинного штамма B.abortus применяется для активной специфической профилактики бруцеллеза (создание активного иммунитета). Бруцеллезная лечебная вакцина. Взвесь убитых нагреванием бруцелл используется с лечебной целью, способствует десенсибилизации организма. Сибиреязвенная живая вакцина СТИ. Названа в честь Сани-тарно-технического института, в котором была впервые получена. Представляет собой высушенную взвесь живых спор авирулентного бескапсульного штамма B.anthracis. Применяют для профилактики сибирской язвы. Противосибиреязвенный иммуноглобулин. Гамма-глобулино-вая фракция сыворотки крови лошади, гипериммунизированной живой сибиреязвенной вакциной и вирулентным штаммом B.anthracis, используется с профилактической и лечебной целью. Лептоспирозный антиген. Живая 7—10-дневная культура основных сероваров лептоспир. Применяется для серодиагностики лептоспирозов в реакции агглютинации-лизиса. Лептоспирозная вакцина. Содержит культуры основных сероваров лептоспир, убитых нагреванием и консервированных фенолом. Применяют для профилактики лептоспирозов в эндемичных очагах инфекции. Лептоспирозный иммуноглобулин. Применяют для лечения и профилактики лептоспирозов. Антибиотики: аминогликозиды, тетрациклины, хлорамфени-кол, пенициллины и цефалоспорины, фторхинолоны и др. Ф Brucella spp.\ тетрациклины, аминогликозиды. 4 Yersinia pestis: тетрациклины, аминогликозиды. 4 Yersinia pseudotuberculosis: ампициллин, цефалоспорины, аминогликозиды, тетрациклины, хлорамфеникол. 4 Francisella tularensis: аминогликозиды, тетрациклин, хлорамфеникол. 4 Pasteurella multocida: пенициллины, макролиды. 4- Bacillus anthracis: пенициллины, тетрациклины, цефалоспорины, аминогликозиды, хлорамфеникол, фторхинолоны. 4 Leptospira interrogans: тетрациклины, пенициллины, цефалоспорины, фторхинолоны. 4 Burkholderia mallei: аминогликозиды, тетрациклины, сульфаниламиды. 4 Listeria monocytogenes: пенициллины, аминогликозиды, сульфаниламиды с триметопримом. 4 Streptobacillus moniliformis: пенициллин. 4 Erysipelothrix rhysiopathiae: пенициллин. |
