Тец руководство. Руководство к практаческим занятиям по медицинской микробиологии, вирусологии и иммунологии под редакцией
 Скачать 2.14 Mb. Скачать 2.14 Mb.
|
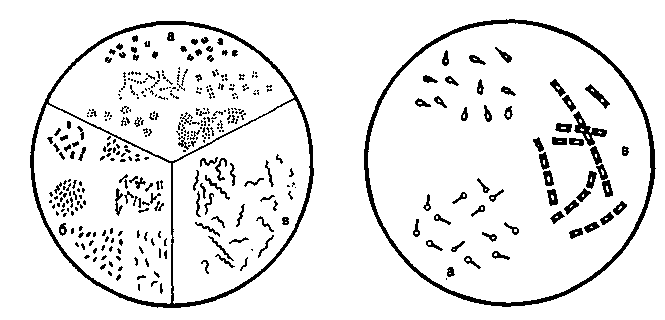
V2 завитка (вибрионы) или несколько (1-3) завитков (спириллы), и спиралевидными бактериями (спирохеты). Нитевидные и ветвистые формы характерны для актиномицетов.План Программа Правила работы и организация микробиологических (бактериологических, вирусологических, микологических) лабораторий. Основные приборы и оборудование микробиологической лаборатории. Микроскопы и микроскопическая техника. Правила работы с иммерсионным микроскопом (объективами). а Демонстрация Устройство и применение основных приборов и оборудования, используемого в микробиологических лабораториях: термостата, центрифуг, автоклава, сушильного шкафа, инструментария и посуды. Устройство биологического микроскопа. Различные методы микроскопии: темнопольная, фазово-контрастная, люминесцентная, электронная. Препараты микробов (дрожжей и бактерий) при различных методах микроскопии. Задание студентам 1. Микроскопировать и зарисовать препараты дрожже-подобных грибов рода Candida, используя различные виды микроскопии. Методические указания Правила работы в микробиологических лабораториях. Работу в микробиологической лаборатории медицинского учреждения проводят с возбудителями инфекционных заболеваний — патогенными микроорганизмами. Поэтому для предохранения от заражения персонал обязан строго соблюдать правила внутреннего распорядка. Все сотрудники должны работать в медицинских халатах, шапочках и сменной обуви. Вход в лабораторию без халата категорически воспрещен. В необходимых случаях работающие надевают на лицо маску из марли. Работа с особо опасными микробами регламентируется специальной инструкцией и проводится в режимных лабораториях. В лаборатории запрещается курить и принимать пищу. Рабочее место должно содержаться в образцовомпорядке. Личные вещи сотрудников следует хранить в специально отведенном месте. При случайном попадании инфицированного материала на стол, пол и другие поверхности это место необходимо тщательно обработать дезинфицирующим раствором. Хранение, наблюдение за культурами микробов и их уничтожение должны производиться согласно специальной инструкции. Культуры патогенных микробов регистрируют в специальном журнале. По окончании работы руки следует тщательно вымыть, а при необходимости обработать дезинфицирующим раствором. Микроскопы и методы микроскопии Для микробиологических исследований используют несколько типов микроскопов (биологический, люминесцент-  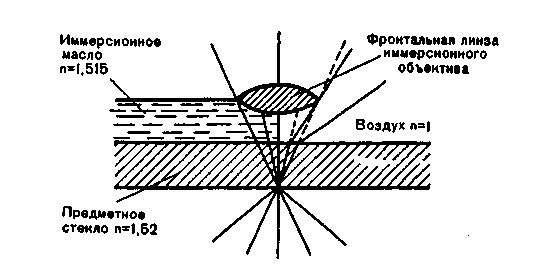 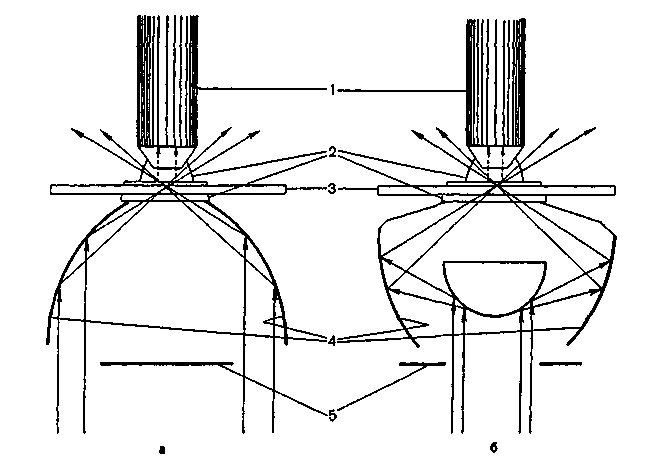 увеличения объектива на увеличение окуляра. Например, увеличение микроскопа с иммерсионным объективом 90 и окуляром 10 составляет: 90x10=900. Микроскопия в проходящем свете (светлопольная микроскопия). Используется для изучения окрашенных объектов в фиксированных препаратах. Темнопольная микроскопия. Применяется для прижизненного изучения микробов в нативных неокрашенных препаратах. Микроскопия в темном поле зрения основана на явлении дифракции света при боковом освещении частиц, взвешенных в жидкости (эффект Тиндаля). Эффект достигается с помощью параболоид- или кардиоид-конденсора, которые заменяют обычный конденсор в биологическом микроскопе (рис. 1.3). При этом способе освещения в объектив попадают только лучи, отраженные от поверхности объекта. В результате на темном фоне (неосвещенном поле зрения) видны ярко светящиеся частицы. Препарат в этом случае имеет вид, показанный на рис. 1.4, б (на вклейке). Фазово-контрастная микроскопия. Предназначена для изучения нативных препаратов. Фазово-контрастное приспособление дает возможность увидеть в микроскоп прозрачные объекты. Свет проходит через различные биологические структуры с разной скоростью, которая зависит от оптической плотности объекта. В результате возникает изменение фазы световой волны, не воспринимаемое глазом. Фазовое устройство, включающее особые конденсор и объектив, обеспечивает преобразование изменений фазы световой волны в видимые изменения амплитуды. Таким образом достигается усиление различия в оптической плотности объектов. Они приобретают высокую контрастность, которая может быть позитивной или негативной. Позитивным фазовым контрастом называют темное изображение объекта в светлом поле зрения, негативным — светлое изображение объекта на темном фоне (см. рис. 1.4; на вклейке). Для фазово-контрастной микроскопии используют обычный микроскоп и дополнительное фазово-контрастное устройство КФ-1 или КФ-4 (рис. 1.5), а также специальные осветители. Люминесцентная (или флюоресцентная) микроскопия. Основана на явлении фотолюминесценции. Люминесценция — свечение веществ, возникающее под воздействием внешнего излучения: светового, ультрафиолетового, ионизирующего и др. Фотолюминесценция — люминесценция объекта под влиянием света. Если освещать люминес-цирующий объект синим светом, то он испускает лучи красного, оранжевого, желтого или зеленого цвета. В результате возникает цветное изображение объекта. Длина волны излуча-  Наряду с приборами "просвечивающего" типа используют сканирующие электронные микроскопы, обеспечивающие рельефное изображение поверхности объекта. Разрешающая способность этих приборов значительно ниже, чем у электронных микроскопов "просвечивающего" типа. Правила работы с микроскопом. Работа с любым световым микроскопом включает установку правильного освещения поля зрения и препарата и его микроскопию различными объективами. Освещение может быть естественным (дневным) или искусственным, для чего используют специальные источники света — осветители разных марок. При микроскопии препаратов с иммерсионным объективом следует строго придерживаться определенного порядка: на приготовленный на предметном стекле и окрашенный мазок нанести каплю иммерсионного масла и поместить его на предметный столик, укрепив зажимами; повернуть револьвер до отметки иммерсионного объектива 90х или 100х; 3) осторожно опустить тубус микроскопа до погруженияобъектива в каплю масла; установить ориентировочный фокус при помощи макрометрического винта; провести окончательную фокусировку препарата микрометрическим винтом, вращая его в пределах только одного оборота. Нельзя допускать соприкосновения объектива с препаратом, так как это может повлечь поломку покровного стекла или фронтальной линзы объектива (свободное расстояние иммерсионного объектива 0,1-1 мм). По окончании работы микроскопа необходимо удалить масло с иммерсионного объектива и перевести револьвер на малый объектив 8х. Для темнопольной и фазово-контрастной микроскопии используют нативные препараты ("раздавленная" капля и др., см. тему 2.1); микроскопируют с объективом 40х или специальным иммерсионным объективом с ирис-диафрагмой, позволяющей регулировать численную апертуру от 1,25 до 0,85. Толщина предметных стекол не должна превышать 1-1,5 мм, покровных – 0,15-0,2 мм. Глава 2 МОРФОЛОГИЯ И УЛЬТРАСТРУКТУРА БАКТЕРИЙ Введение. Бактерии относятся к доминиону Bacteria. Они являются одноклеточными прокариотическими (доядерными) организмами. Бактериальная клетка обладает характерными особенностями строения (ультраструктуры) и существенно отличается от эукариотической. Бактерии имеют микроскопические размеры, большинство — в пределах разрешающей способности светооптической микроскопии (превышают 0,2 мкм), однако существуют и более мелкие формы. Форма клетки относится к числу важных таксономических признаков бактерии. По форме клеток бактерии подразделяют на шаровидные, палочковидные, нитевидные и извитые (рис. 2.1). Шаровидные бактерии — кокки (coccus — зерно) имеют правильную сферическую или эллипсоидную форму. Кокки могут образовывать характерные скопления, что обусловлено особенностями их деления и способностью дочерних клеток сохранять связь друг с другом после деления. Кокки могут располагаться беспорядочно (микрококки), парами (диплококки), в виде цепочек из 3 и более кокков (стрептококки), в виде пакетов, состоящих из 4 (тетракокки) и 8 (сарцины) кокков, и в виде скоплений, напоминающих виноградную гроздь (стафилококки). Диплококки и стрептококки образуются при делении в одной плоскости, если дочерние клетки могут не отходить друг от друга. Упорядоченное деление в 2 и 3 плоскостях приводит к образованию тетракокков и сардин. При делении в разных плоскостях образуются стафилококки. Палочковидные бактерии (бациллы) различаются по размерам, форме клеток и их концов, а также по расположению. Они могут быть тонкими, утолщенными на концах либо с обрубленными концами. Одни располагаются в виде одиночных клеток, другие парами — диплобактерии, третьи в виде цепочек — стрептобактерии. Извитые формы бактерий представлены изогнутыми палочками, имеющими V4 |
| Форма Разме- Окраска Наличие Кислого- Под-клеток ры по мето- устойчи- виж-ду Грама СПОР кап" зерен вость ность сул волю-тина |
Спорообразующие бактерии (окраска по методу Шеффера—Фултона).
Зерна волютина в клетках Corynebacterium diphtheriae (окраска по методу Нейссера).
Задание студентам
Микроскопировать и дифференцировать бактерии по морфологическим и тинкториальным свойствам в готовом препарате из смеси бактерий (окраска по методу
Грама). Зарисовать.
Самостоятельно приготовить мазки из смеси бактерий, окрасить по методу Грама, Микроскопировать и дифференцировать бактерии по морфологическим признакам и тинкториальным свойствам. Зарисовать.
Микроскопировать и зарисовать:
капсулы (окраска по методу Бурри—Гинса);
С.diphtheriae, содержащие зерна волютина (окраска по методу Нейссера);
кислотоустойчивые бактерии М. tuberculosis (окраска по методу Циля—Нильсена);
спорообразующие бактерии (окраска по методу Шеффера—Фултона).
4. Сделать заключение по результатам проведенных исследований.
Методические указания
Сложные методы окраски. Сложные методы окраски используют для выявления ультраструктурных компонентов бактериальных клеток, имеющих достаточно большие размеры (макрокапсулы, жгутики, цитоплазматические включения и т.д.), а также для дифференцировки (различения) бактерий в зависимости от химического состава и особенностей их тонкой организации (ультраструктуры).
Окраска по методу Грама
На фиксированный мазок нанести карболово-спиртовой раствор генцианового фиолетового через полоску фильтровальной бумаги. Через 1—2 мин ее снять, а краситель
слить.
Нанести раствор Люголя на 1-2 мин.
Обесцветить этиловым спиртом в течение 30-60 с до прекращения отхождения фиолетовых струек красителя.
Промыть водой.
Докрасить водным раствором фуксина в течение 1-2 мин, промыть водой, высушить и Микроскопировать.
Грамположительные бактерии окрашиваются в темно-фиолетовый цвет, грамотрицательные — в красный (рис. 2.2.1; на вклейке). В основе этого метода лежит избирательное обесцвечивание — удаление комплекса генцианового фиолетового с йодом под действием спирта. Результат окраски по методу Грама определяется особенностями строения и химического состава клеточной стенки бактерий и зависит от способности удерживать образовавшийся в процессе окраски комплекс генцианового фиолетового с йодом.
Фирмикутные бактерии окрашиваются грамположительно, поскольку имеют многослойный пептидогликан, связанный с тейхоевыми кислотами. Последние обусловливают прочную фиксацию красителя и резистентность к обесцвечиванию спиртом. Грациликутные бактерии окрашиваются грамотрица-тельно.
Окраска по методу Грама имеет важное дифференциально-диагностическое значение и широко используется в микробиологии. К грамположительным бактериям относятся стафилококки, стрептококки, коринебактерии дифтерии и др., к грамотрицательным — гонококки, менингококки, кишечная палочка и др. Некоторые виды бактерий (клостридии, гарднереллы) могут окрашиваться по методу Грама вариабельно в зависимости от возраста культуры, особенностей культивирования и других факторов, воздействующих на структуру клеточной стенки.
Основная ошибка, допускаемая при окраске по методу Грама, заключается в "переобесцвечивании" мазка этиловым спиртом. Грамположительные бактерии при этом могут утрачивать первоначальную окраску генциановым фиолетовым и приобретать красный цвет (характерный для грамотрицатель-ных бактерий) в результате последующей докраски мазка фуксином. Грамотрицательные бактерии в свою очередь могут сохранять сине-фиолетовый цвет генцианового фиолетового. Для правильной окраски следует строго соблюдать технику обесцвечивания.
Окраска кислотоустойчивых бактерий по методу Циля-Нильсена
На фиксированный мазок нанести карболовый раствор фуксина через полоску фильтровальной бумаги и подогреть 3-5 мин до появления паров.
Снять бумагу, промыть мазок водой.
Нанести 5 % раствор серной кислоты или 3 % раствор смеси спирта с хлористоводородной кислотой на 1-2 мин. для обесцвечивания.
Промыть водой.
Докрасить мазок водным раствором метиленового синего в течение 3-5 мин.
Промыть водой, высушить и микроскопировать.
В основе метода лежат протравливание (разрыхление) клеточной стенки бактерий для усиления поглощения красителя и избирательное обесцвечивание под действием кислоты. Кис-лотоустойчивость бактерий обусловлена особым строением их клеточной стенки с повышенным содержанием липидов: разветвленных жирных кислот (миколовых кислот), глико- и фос-фолипидов, восков. Клеточная стенка кислотоустойчивых бактерий имеет очень низкую проницаемость, поэтому они плохо воспринимают красители. Раствор карболовой кислоты разрыхляет клеточную стенку и тем самым повышает ее тинк-ториальные свойства, а высокая концентрация красителя и нагревание в процессе окраски усиливают реакцию взаимодействия красителя с бактериальными клетками, которые при этом окрашиваются в красный цвет. При обработке препарата серной кислотой некислотоустойчивые бактерии обесцвечиваются и в дальнейшем окрашиваются метиленовым синим в голубой цвет, а кислотоустойчивые бактерии остаются окрашенными фуксином в красный цвет (рис. 2.2.2; на вклейке).
Окраска спор по методу Ожешко
На нефиксированный мазок нанести 0,5 % раствор хлористоводородной кислоты и подогреть в течение 2-3 мин. на пламени.
Кислоту слить, препарат промыть водой, просушить и фиксировать над пламенем.
Окрасить по методу Циля-Нильсена.
Споры бактерий приобретают красный цвет, а вегетативные формы — синий (рис. 2.2.3; на вклейке). Споры бактерий имеют многослойную клеточную стенку сложного строения, практически непроницаемую для красителей, поэтому для повышения их тинкториальных свойств используют более жесткие условия протравливания, чем для окрашивания кислотоустойчивых бактерий.
Окраска спор по методу Шеффера-Фултона
На фиксированный мазок нанести 5 % раствор малахитового зеленого и 3-4 раза нагреть до появления паров.
Промыть водой.
Докрасить 0,5 % сафранином в течение 30 с.
4. Промыть водой, высушить и микроскопировать. Споры бактерий окрашиваются в зеленый цвет, вегетативные клетки — в красный.
Окраска зерен волютина по методу Нейссера
На фиксированный мазок нанести ацетат синьки Нейссера на 2-3 мин.
Добавить раствор Люголя на 10-30 с.
Промыть препарат водой.
Докрасить водным раствором везувина или хризоидина в течение 0,5-1 мин.
Промыть препарат водой, высушить и микроскопировать.
Зерна волютина представляют собой включения полифосфатов, имеющие в отличие от цитоплазмы щелочную реакцию, и поэтому избирательно воспринимают ацетат синьки, окрашиваясь в темно-синий цвет. Цитоплазма клетки, обладающая кислой реакцией, воспринимает щелочной краситель везувин и окрашивается в желтый цвет (рис. 2.2.4; на вклейке). Обнаружение макрокапсул по методу Бури-Гинса
Смешать каплю взвеси микробных клеток с каплей туши и при помощи стекла со шлифованым краем сделать мазок таким же образом, как мазок из крови, высушить и фиксировать.
На мазок нанести водный раствор фуксина на 1—2 мин.
Промыть водой, высушить на воздухе и микроскопировать.
Бактерии окрашиваются в красный цвет. Капсулы не окрашиваются анилиновыми красителями, остаются прозрачными и контрастно выделяются на черно-розовом фоне (рис. 2.2.5; на вклейке).