Тец руководство. Руководство к практаческим занятиям по медицинской микробиологии, вирусологии и иммунологии под редакцией
 Скачать 2.14 Mb. Скачать 2.14 Mb.
|
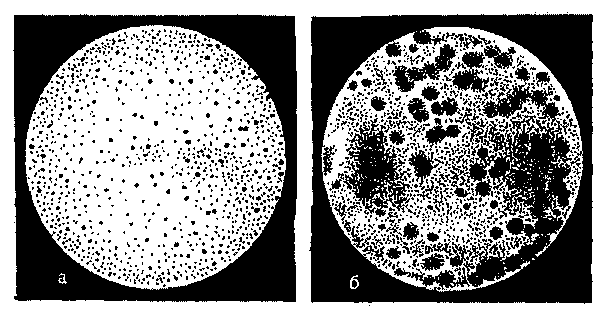
2, 10Введение. Вирион состоит из сердцевины (нуклеиновой кислоты в комплексе с сердцевинными белками) и оболочек. Размеры вирионов колеблются от 15—20 (0,015—0,002 мкм) до 300-500 нм (0,3-0,5 мкм). Существуют простые и сложные вирионы. Первые снабжены только капсидом. Форма просто устроенных вирусов определяется типом симметрии его капсида: изометрическим или спиральным. У вирусов с изометрическим типом симметрии капсида отдельные морфологические субъединицы капсида (капсомеры) уложены на осях симметрии многогранника, например икосаэдра (двадцатигранника). При этом вирион приобретает сферическую форму. У вирусов со спиральным типом симметрии капсомеры уложены по спирали вокруг нуклеиновой кислоты. При этом вирион приобретает палочковидную форму. Сложные вирионы имеют дополнительную внешнюю оболочку — суперкапсид, покрывающий капсид снаружи. Супер-капсид представляет собой модифицированную мембрану клетки хозяина [цитоплазматическую (ЦПМ), ядерную или др.], содержащую вирусные белки и гликопротеины. Форма сложных вирусов обычно близка к сферической, для них характерен плеоморфизм. Вирусы бактерий (бактериофаги) имеют сперматозоидную или нитевидную форму. Бактериофаги сперматозоидной формы состоят из головки, в которой содержится нуклеиновая кислота, и отростка. Капсид головки фагов построен по изометрическому типу симметрии, а отростка — по спиральному. У некоторых фагов отросток очень короткий или может отсутствовать. Морфологию вирусов изучают с помощью электронной микроскопии. Методы сканирующей электронной микроскопии позволяют исследовать форму и характер поверхности вирусной частицы. Для изучения ультраструктуры вирусов применяют методы просвечивающей электронной микроскопии. Тема 5.2. КУЛЬТИВИРОВАНИЕ ВИРУСОВ И ДРУГИХ ОБЛИГАТНЬГХ ВНУТРИКЛЕТОЧНЫХ ПАРАЗИТОВ (РИККЕТСИЙ, ХЛАМИДИЙ) Введение. Вирусы не имеют собственного метаболизма. Для репродукции они используют метаболические системы клетки-хозяина. Различают 3 типа взаимодействия вируса с клеткой. Продуктивная инфекция. При этой форме инфекции в клетке происходит репродукция вируса и образуется вирусное потомство — 104—10^ вирусных частиц, которые вы ходят из зараженной клетки во внешнюю среду. Интегративная инфекция. Геном вируса встраивается (интегрирует) в геном клетки-хозяина. Интегрированные вирусные геномы — провирусы — передаются потомству зараженной клетки при делении. РНК-содержащие вирусы также могут вызвать интегративную нфекцию путем обратной транскрипции с помощью РНК-зависимой ДНК-полимеразы (обратной транскриптазы). При этом в клеточный геном встраивается образующаяся ДНК-копия вирусной РНК. При определенных условиях интегративная форма вирусной инфекции может переходить в продуктивную. Абортивная инфекция. При проникновении в клетку дефектного вируса, не способного к самостоятельной репродукции, или при попадании полноценного вируса в непермис- сивную (не подходящую для его репродукции) клетку, или при неподходящих условиях внешней среды возникает абортивная форма инфекции. Взаимодействие с клеткой прерывается на одной из ранних стадий — вирус не репродуцируется и не передается потомству зараженной клетки. План Программа Методы культивирования вирусов, риккетсий, хламидий. Методы индикации вирусов. Бактериофаги: морфология и физиология, практическое применение. Демонстрация Питательные среды, растворы и лабораторная посуда для культур клеток. Культуры клеток: незараженные, зараженные вирусом простого герпеса и хламидиями. Отметить изменения в культурах клеток, зарисовать, сделать вывод. Задание студентам 1. Учесть результаты реакции гемагглютинации (РГА), поставленной для выявления гемагглютинирующего вируса в материале из куриного эмбриона, и определить титр вируса. Учесть результаты индикации вируса в культуре клеток по цветной пробе. Учесть результат титрования бактериофага по методу Грациа. Определить спектр литического действия бактериофага. Ознакомиться с методом фаготипирования бактериальных культур. Определить фаговары культур стафилококков, выделенных от больных. Ознакомиться с препаратами бактериофагов, классифицировать по назначению. а Методические указания Методы культивирования вирусов. Для культивирования вирусов используют культуры клеток, куриные эмбрионы и чувствительных лабораторных животных. Эти же методы применяют и для культивирования риккетсий и хламидий — облигатных внутриклеточных бактерий, которые не растут на искусственных питательных средах. Культуры клеток. Представляют собой соматические или эмбриональные клетки животных или человека, культивируемые в лабораторных условиях. Клеточные культуры различаются по источнику получения, способности к размножению in vitro и кариотипу. Их подразделяют на первичные (неперевиваемые), полуперевиваемые и перевиваемые. Первичные культуры клеток получают непосредственно из тканей многоклеточных организмов. Такие клетки обычно не способны к делению (неперевиваемые) и используются однократно. К полуперевиваемым культурам относятся диплоидные клетки различных тканей и органов, способные к ограниченному размножению in vitro. Они представляют собой клеточную систему, сохраняющую в процессе 20—50 пассажей (пересевов) — до года — диплоидный набор хромосом, типичный для соматических клеток используемой ткани. Диплоидные клетки при культивировании не претерпевают злокачественного перерождения и этим выгодно отличаются от опухолевых. Перевиваемые культуры клеток готовят из злокачественных линий клеток, обладающих способностью неограниченно размножаться in vitro в определенных условиях. К ним относятся, например, злокачественные клетки HeLa, первоначально выделенные из карциномы шейки матки, Нер-3 (из лимфоидной карциномы) и др. Для выращивания клеточных культур используют питательные среды сложного состава, включающие источники энергии, минеральные вещества, аминокислоты, витамины и другие факторы роста. Клетки чрезвычайно чувствительны к изменению рН среды. Для контроля рН в среды добавляют индикатор. Большинство клеточных культур растет в виде монослоя (пласта, состоящего из одного слоя клеток), прочно прикрепляясь к поверхности контейнера для культивирования — пробирки, пластикового планшета или матраса (флакон 4-гранной формы). Некоторые типы клеток способны расти также в суспензии. Приготовление первичной культуры клеток включает несколько последовательных этапов: измельчение ткани, разъединение клеток путем трипсинизации, отмывание полученной однородной суспензии изолированных клеток от трипсина с последующим суспендированием клеток в питательной среде, обеспечивающей их рост (например, в среде 199 с добавлением телячьей сыворотки крови). При оседании клетки довольно прочно прикрепляются к стенке пробирки или флакона, по которой распространяются в виде монослоя. После получения монослоя жизнеспособной культуры клеток ее заражают материалом, содержащим риккетсии, хламидии или вирусы. Упомянутые микробы проникают внутрь клеток, где и размножаются. В культурах клеток удается культивировать большинство вирусов, вызывающих заболевания человека. Внутриклеточные паразиты оказывают цитопатическое действие (ЦПД) на клетки, в которых происходит их репродукция. ЦПД может проявляться деструкцией (лизисом) зараженных клеток, изменением их морфологии (изменением размеров и формы самой клетки, клеточного ядра, появлением вакуолей или включений, представляющих собой внутриклеточные скопления вирусов, образованием синцития) и нарушением их функций. Куриные эмбрионы. Куриные эмбрионы по сравнению с культурами клеток значительно реже бывают контаминиро-ваны вирусами и микоплазмами, а также обладают сравнительно высокой жизнеспособностью и устойчивостью к различным воздействиям. Они пригодны для культивирования хламидии, риккетсии и некоторых вирусов, патогенных для человека. Для получения чистых культур риккетсии, хламидии и ряда вирусов в диагностических целях, а также для приготовления разнообразных препаратов (вакцины, диагностикумы) используют 8—12-дневные куриные эмбрионы. К недостаткам данного метода относятся невозможность обнаружения исследуемого микроорганизма без предварительного вскрытия эмбриона, а также наличие большого количества белков и других соединений, затрудняющих последующую очистку возбудителя при изготовлении различных препаратов. Для заражения куриных эмбрионов исследуемый материал вводят в аллантоисную и амниотическую полости, на хорион-аллантоисную оболочку или в желточный мешок куриного 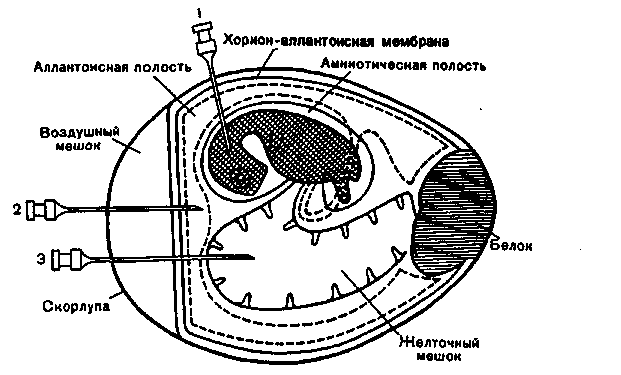 культивирования облигатных внутриклеточных паразитов в организме лабораторных животных перед другими состоит в возможности выделения тех вирусов, которые плохо репродуцируются в культуре клеток или эмбрионе. К его недостаткам относятся высокая вероятность контаминации организма подопытных животных посторонними вирусами и мико плазмами, а также необходимость последующего заражения культуры клеток для получения чистой культуры данного вируса, что увеличивает сроки исследования. Методы индикации вирусов. Для демонстрации присутствия вируса в клеточной культуре используют несколько методов. I. О размножении (репродукции) вирусов в культуре клеток судят по цитопатическому действию (ЦПД), которое может быть обнаружено микроскопически по морфологическим изменениям клеток. Часть таких клеток погибает и отслаивается от стенок пробирки. Вирусные частицы, освобождающиеся при разрушении одних клеток, инфицируют другие, которые через некоторое время также погибают. В результате вместо сплошного клеточного монослоя остаются лишь отдельные клеточные островки. Характер ЦПД, вызванного разными вирусами, неодинаков. При репродукции одних вирусов (парамиксовиру-сы, герпесвирусы) наблюдается слияние клеток с образованием синцития, других (энтеровирусы, реовирусы) — сморщивание и деструкция клеток, третьих (аденовирусы) — агрегация клеток (рис. 5.2.2) и т.д. ЦПД вирусов оценивают в динамике, просматривая культуру клеток под микроскопом в разные сроки после ее заражения вируссодержащим материалом. Некоторые вирусы (энтеровирусы, герпесвирусы) вызывают ЦПД в течение 1—2 сут, другие — в более поздние сроки (на 4—6-й день). Характер ЦПД используют как для обнаружения вирусов (индикации), так и ориентировочной идентификации, т.е. определения их видовой принадлежности. Некоторые вирусы можно обнаружить и идентифицировать по включениям, которые они образуют в ядре или цитоплазме зараженных клеток. Форма включений различна, а размеры колеблются от 0,25 до 25 мкм. Они представляют собой места скопления вирусных частиц и могут быть выявлены в препаратах, приготовленных из зараженной ткани и окрашенных по методу Романовского—Гимзы или флюорохромами. В последнем случае используют люминесцентную микроскопию. В клетках, пораженных риккетсиями, на 3—8-й день отмечается большое количество коккобациллярных форм, целиком заполняющих цитоплазму или ядро клеток, которые затем гибнут. Хламидии также рассматривают в окрашенных по методу Романовского—Гимзы препаратах клеток, в которых образуются цитоплазматические включения, представляющие собой внутриклеточные микроколонии этих бактерий.  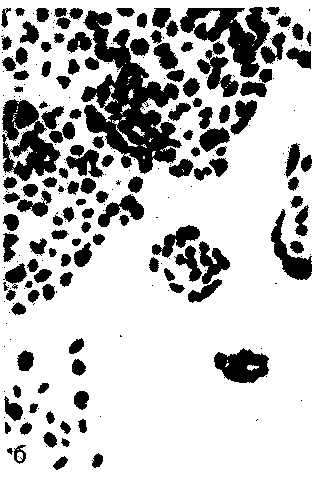 способность к метаболизму и погибают, поэтому окраска среды с течением времени не меняется. П. Реакцию гемадсорбции применяют для индикации гемаг-глютинирующих вирусов. Реакция основана на способности поверхности клеток, в которых репродуцируются такие вирусы, адсорбировать эритроциты. Для постановки реакции гемадсорбции в культуру клеток, зараженных вирусами, добавляют взвесь эритроцитов и после некоторого времени контакта клетки промывают изотоническим раствором хлорида натрия. На поверхности пораженных вирусами клеток остаются прилипшие эритроциты. III. Реакцию гемагглютинации (РГА) применяют для обнаружения гемагглютинирующих вирусов в культуральной жидкости зараженной культуры клеток либо хорионаллантоисной или амниотической жидкости куриного эмбриона. Гемагглюти-нацию — "склеивание" эритроцитов разных видов животных (кур, гусей, морских свинок) — вызывают вирусы, содержащие в оболочке гемагглютинин. Для постановки реакции гемагглютинации к исследуемому материалу добавляют взвесь эритроцитов. В присутствии вирусов происходит агглютинация эритроцитов. После вскрытия куриного эмбриона аллантоисную жидкость отсасывают и разливают по 0,5 мл в пробирки или лунки плексигласовой пластины (для контроля берут 0,5 мл такой же жидкости незараженного эмбриона). Затем добавляют по 0,2 мл 1 % суспензии отмытых куриных эритроцитов и выдерживают при комнатной температуре. Результаты реакции учитывают через 40 мин после оседания эритроцитов: (++++) — выраженная гемагглютинация — тонкая пленка склеившихся эритроцитов на дне пробирки, имеющая вид зонтика, (+++) — наличие просветов в пленке, (++) — наличие пленки с фестончатыми краями из склеившихся эритроцитов, (+) — хлопьевидный осадок эритроцитов, окруженный зоной комочков агглютинированных эритроцитов, (—) — резко очерченный осадок эритроцитов, неотличимый от контроля. Наличие гемагглютинации в опытных пробирках при ее отсутствии в контрольных указывает на содержание вируса в исследуемой жидкости. Для определения титра РГА ставят реакцию с разведениями вируссо-держащей жидкости 10 |
| Номер Число "стерильных" пятен фага, получен- Число исследуемой ных при посевах проб в разведениях фаговых час- пробы 1 1 тиц в 1 мл 105 106 КГ7 1 370 42 3 7,3х107 2 463 50 6 l.OxlO8 3 37 4 0 7,7хЮ6 |
жание постоянства состава генома, его воспроизведение при размножении и изменчивость, обеспечивающая приспособляемость, являются обязательными условиями сохранения вида. В основе поддержания постоянства генома лежит работа ферментов репликации и некоторых систем репарации ДНК. Изменения генетической информации являются результатом мутаций и рекомбинации. Мутации, различные по происхождению (спонтанные и индуцированные), приводят к изменениям ДНК, имеющейся в клетке. Рекомбинация позволяет также использовать и ДНК других клеток и вирусов, поступающую из окружающей среды.
Тема 6.1. МОДИФИКАЦИОННАЯ ИЗМЕНЧИВОСТЬ, МУТАЦИИ, РЕКОМБИНАЦИЯ И ПЕРЕНОС ГЕНОВ МЕЖДУ БАКТЕРИЯМИ
План
Программа
Способы сохранения генетической информации у микробов.
Модификационная изменчивость.
Мутационная изменчивость.
Рекомбинация ДНК.
Способы передачи генетической информации между бактериями — трансформация, трансдукция, конъюгация.
Фаговая конверсия.
Сохранение и изменение генетической информации в микробных популяциях.
Демонстрация
S- и R-формы колоний у E.coli.
Таблицы со схемами передачи генетической информации между бактериями в опытах трансформации,
трансдукции и конъюгации.
Задание студентам
Определить частоту образования рекомбинантов Leu+ в опыте конъюгации.
Определить частоту образования трансдуктантов (рекомбинантов) в опыте трансдукции фагом A, dgai
Определить частоту образования трансформантов (рекомбинантов) в опыте трансформации признака Strr (стрептомицинрезистентности) у Bacillus subtilis.
Методические указания
Постановка опыта трансформации (рис. 6.1; на вклейке). Реципиент — штамм Bacillus subtilis Str5 (сенная палочка, чувствительная к стрептомицину); донор — ДНК, выделенная из
штамма B.subtilis Strr (устойчивого к стрептомицину). Селективная среда для отбора рекомбинантов (трансформантов) — питательный агар, содержащий 100 ЕД/мл стрептомицина. К 1 мл бульонной культуры B.subtilis добавляют 1 мкг/мл ДНК донора. Смесь инкубируют при 37 "С в течение 30 мин. Затем в пробирку вносят смесь 0,1 мкг/мл раствора ДНКазы в 0,5 мл раствора хлорида магния для разрушения ДНК, не проникшей в бактериальные клетки реципиентного штамма, и выдерживают в течение 5 мин. Для определения количества образовавшихся стрептомицинустойчивых рекомбинантов (трансформантов) 0,1 мл неразведенной смеси высевают на селективную среду в чашку Петри. Для определения количества клеток реципиентной культуры в изотоническом растворе хлорида натрия готовят 10-кратные разведения до 105— 106 (для получения сосчитываемого количества колоний), высевают по 0,1 мл на питательный агар без стрептомицина, а для контроля — на агар со стрептомицином. На последней среде реципиентная культура не должна расти, поскольку она чувствительна к стрептомицину. Посев инкубируют при 37 °С. На следующий день учитывают результаты опыта и определяют частоту трансформации по отношению количества выросших рекомбинант-ных клеток к числу клеток реципиентного штамма.
Допустим, что при высеве 0,1 мл культуры реципиентного штамма в разведении 105 выросло 170 колоний, а при высеве 0,1 мл неразведенной смеси — 68 колоний рекомбинантного штамма. Поскольку каждая колония образовалась в результате размножений только одной бактериальной клеткой, то в 0,1 мл засеянной культуры реципиента содержится 170хЮ5 жизнеспособных клеток, а в 1 мл — 170хЮ6, или 1,7х108. В то же время в 0,1 мл смеси находится 68 рекомбинант-ных клеток, а в 1 мл — 680, или 6,8x10^. Таким образом, частота трансформации в данном опыте будет равна:
Постановка опыта специфической трансдукции (рис. 6.2; на вклейке). Реципиент — штамм E.coli lac, лишенный (3-галакто-зидазного оперона, контролирующего ферментацию лактозы. Трансдуцирующий фаг — фаг Я. dgal, в геноме которого часть генов замещена р-галактозидазным опероном E.coli. Он является дефектным, т.е. не способен вызывать продуктивную инфекцию, заканчивающуюся лизисом кишечной палочки, и обозначается буквой d (фаг dgal) с названием содержащегося в его геноме бактериального оперона gal. Селективная среда — среда Эндо, на которой лактозоотрицательные бактерии реципиентного штамма образуют бесцветные колонии, а лактозо-положительные колонии рекомбинантного штамма приобретают красный цвет с металлическим оттенком. К 1 мл 3-часовой бульонной культуры реципиентного штамма добавляют 1 мл трансдуцирующего фага dgal в концентрации 106—107 частиц в 1 мл. Смесь инкубируют при 37 °С в течение 60 мин, после чего готовят ряд 10-кратных разведений (в зависимости от предполагаемой концентрации бактерий) для получения сосчитываемого количества колоний. Из пробирки с разведением 106 делают высев по 0,1 мл культуры на 3 чашки Петри со средой Эндо и равномерно распределяют жидкость шпателем по поверхности среды. Посевы инкубируют в течение 1 сут, после чего отмечают результаты опыта и вычисляют частоту трансдукции по отношению количества клеток рекомбинантов (трансдуктантов), обнаруженных на всех чашках, к числу клеток реципиентного штамма.
Например, после посева 0,1 мл смешанной культуры в разведении 10"6 на 3 чашках со средой Эндо выросло соответственно 138, 170 и 160 бесцветных колоний реципиентного штамма, на первой и последней чашках — 5 и 1 колонии трансдуктантов красного цвета. Следовательно, частота трансдукции в этом случае будет равна:
(5+1) х 10xlO
(38+170+160) х 10х10б 468 '
Постановка опыта конъюгации с целью передачи фрагмента хромосомы, который содержит ген leu, контролирующий синтез лейцина (рис. 6.3; на вклейке). Донор — штамм E.coli K12 Hfr leu+ Str5; реципиент — штамм E.coli K12F leu+ StrR. .Hfr — обозначение состояния, для которого характерна высокая частота рекомбинации. Селективная среда для выделения рекомбинантов — минимальная глюкозосолевая среда: КН^РС^ — 6,5 г, MgSO4 - 0,1 г, (NH4)2S04 - 1 г, Ca(NO3)2 - 0,001 г, FeSO4 -0,0005 г, глюкозы — 2 г, стрептомицина — 200 ЕД/мл, дистиллированной воды — 1 л.
К 2 мл 3-часовой культуры реципиента добавляют 1 мл бульонной культуры донора. Посевы инкубируют при 37 °С в течение 30 мин. Затем смесь разводят до 102—103 и высевают по 0,1 мл на селективную агаровую среду в чашки Петри, на которой вырастут только колонии рекомбинантов. В качестве контроля на ту же среду высевают донорныи и реципиентныи штаммы, которые не будут расти на ней, так как первый штамм чувствителен к стрептомицину, а второй ауксотрофен по лейцину. Кроме того, культуру донорного штамма высевают на селективную среду без стрептомицина, а культуру реципиентного штамма — на полную среду (питательный агар) с антибиотиками для определения числа жизнеспособных клеток. Посевы инкубируют при 37 °С до следующего дня. После подсчета числа выросших колоний определяют частоту рекомбинаций по отношению количества рекомбинантных клеток к реципиентным. Например, после посева 0,1 мл смеси донорных и реципиентных культур в разведении 102 выросло 150 колоний рекомбинантов, а после посева 0,1 мл культуры реципиента из разведения 106 — 75 колоний. Таким образом, частота рекомбинации будет равна:
150 х 10 х 100 _ 1,5 х 10s _4
75х10хЮ6 7,5хЮ8 ' '
Глава 7 МЕТОДЫ СТЕРИЛИЗАЦИИ.
ОЦЕНКА ЭФФЕКТИВНОСТИ ДЕЙСТВИЯ АНТИСЕПТИКОВ И ДЕЗИНФЕКТАНТОВ. ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ БАКТЕРИЙ К АНТИМИКРОБНЫМ ПРЕПАРАТАМ
Введение. Уничтожение патогенных для человека микробов является одной из важнейших проблем в профилактике и лечении различных заболеваний. Для борьбы с микробами используют методы асептики, антисептики, дезинфекции и антимикробной терапии. Каждый метод имеет свои особые цели и условия применения.