Тец руководство. Руководство к практаческим занятиям по медицинской микробиологии, вирусологии и иммунологии под редакцией
 Скачать 2.14 Mb. Скачать 2.14 Mb.
|
|
Тема 10.2. МЕТОДЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ СПЕЦИФИЧЕСКИХ АНТИТЕЛ (СЕРОДИАГНОСТИКА) Количество специфических антител в сыворотке крови можно определить методами непосредственного выявления связывания со специфическим антигеном. Два наиболее современных метода серологических исследований: радиоиммунный и иммуноферментный. В любом случае нужен известный очищенный антиген, к которому прикрепляется метка: радионук-лидная или ферментная. Соответственно связывание меченого антигена с антителами учитывается радиометрическим или спек-трофотометрическим методом. Кроме методов непосредственного выявления связывания антител с антигеном, используют серологические исследования, основанные на изменении свойств антигена: реакции агглютинации, преципитации, иммунного лизиса, связывания комплемента, нейтрализации. План Программа Методы непосредственного выявления связывания антигена с антителами: радиоиммунный метод, иммуноферментный метод, иммунофлюоресцентный метод. Методы связывания антигена с антителами, проявляющегося изменением свойств антигена: реакция агглютинации, реакция преципитации, реакции иммунного лизиса, реакция связывания комплемента, реакции нейтрализации. Демонстрация 1. Диагностические препараты для выявления антител (диагностикумы). Задание студентам Протоколировать и оценить результаты развернутой реакции агглютинации, поставленной с целью определения титра специфических антител в исследуемой сыворотке. Протоколировать и оценить результаты РИГА, поставленной с целью серодиагностики. Протоколировать и оценить результаты реакции преципитации в геле, поставленной с целью серодиагностики. Протоколировать и оценить результаты титрования комплемента с целью расчета рабочей дозы комплемента. Протоколировать и оценить результаты реакции связывания комплемента (РСК), поставленной с целью серодиагностики. Протоколировать и оценить результаты реакции Кумбса, поставленной с целью определения титра неполных антител в исследуемой сыворотке. Протоколировать и оценить результаты иммуноферментного анализа с целью выявления специфических антител в исследуемых сыворотках. Протоколировать и оценить результаты реакции флоккуляции, поставленной с целью титрования антитоксической сыворотки. Протоколировать и оценить результаты антистрептолизиновой реакции, поставленной с целью серодиагностики ревматизма. 10. Протоколировать и оценить результаты РТГА, поставленной с целью серодиагностики вирусной инфекции. Сделать заключение по результатам каждой серологической реакции. Методические указания Для приготовления сыворотки взятую из вены кровь в количестве 3—4 мл помещают в термостат при 37 °С на 10—15 мин. После свертывания крови сгусток отслаивают от стенок пробирки стеклянной палочкой и выдерживают при 4 °С в течение часа для лучшей ретракции сгустка и более полного отделения сыворотки. Затем сыворотку осторожно отсасывают пипеткой. 1. Радиоиммунный метод. Количество специфических антител в исследуемом образце можно определить, используя вариант конкурентного связывания: по их способности ингибиро-вать связывание радиоактивно меченных антител со специфическим антигеном, фиксированным на твердой фазе. Но чаще используют метод выявления связавшихся с антигеном на твердой фазе специфических антител с помощью радиоактивно меченных антииммуноглобулиновых антител, специфичных к константной области молекулы иммуноглобулина. Проще всего получить антииммуноглобулиновую сыворотку путем иммунизации животных одного вида иммуноглобулинами животного другого вида. Такая антииммуноглобулиновая сыворотка будет связывать любые молекулы иммуноглобулинов соответствующего вида (мышей, кроликов или других видов). Такую меченную радионуклидами антииммуноглобулиновую сыворотку против иммуноглобулинов человека используют в РИА для выявления связывания немеченых человеческих антител на фиксированном антигене. Эта антииммуноглобулиновая сыворотка "распознает" антитела разной специфичности, связываясь с антигенными эпитопами в константной части молекул. Используя РИА или ИФА, можно определить не только количество антигенспецифических антител, но и принадлежность этих антител к тому или иному изотипу иммуноглобулинов. Для этого используют антииммуноглобулиновые антитела, специфичные для отдельных изотипов иммуноглобулинов. Получение таких антииммуноглобулиновых антител начинается с иммунизации животного очищенным препаратом одного из изотипов иммуноглобулинов. Из полученной иммунной сыворотки путем многократной абсорбции удаляют все антитела, перекрестно реагирующие с иммуноглобулинами других изотипов. Полученные антиизотипические антитела используют для определения количества антител каждого из изотипов в иммунной сыворотке, реагирующей с антигеном. Особая роль отводится антителам против IgE, которые позволяют определить количество иммуноглобулинов этого изотипа и специфических антител, относящихся к этому изотипу, при лабораторной диагностике аллергических реакций анафилактического типа и атонических заболеваний. Иммуноферментный анализ. Одним из наиболее чувствительных методов выявления антител считается ИФА, который не уступает по чувствительности РИА и в то же время отличается от него большей доступностью для обычных диагностических лабораторий. Специфический антиген адсорбируют на поверхности лунок в пластинах из полистирола (поливинилхлорида). Фиксированный на пластине антиген инкубируют с испытуемыми человеческими сыворотками. После отмывания от несвязавшихся белков связанные иммобилизованными антигенами иммуноглобулины выявляют с помощью антивидовой (античеловеческой) антииммуноглобулиновой сыворотки, меченной ферментом пероксидазой. После инкубации с субстратом (пероксидом водорода) и индикатором оценивают ферментативную активность по интенсивности окраски. Интенсивность окраски, пропорциональную количеству сорбированных на антигене антител, можно оценить визуально или с помощью спектрофотометра. В данной модификации удобна универсальность меченого реагента, который позволяет выявлять антитела к разным антигенам. Иммуноэлектрофорез. Для выявления антител, специфических по отношению к отдельным антигенным компонентам в составе сложной смеси, например к отдельным антигенам микроорганизмов, приходится прибегать к методам выделения белков из смеси. Одним из наиболее популярных методов выделения белков является электрофорез в полиакриламидном геле (PAGE) в присутствии додецилсульфата натрия (SDS), который получил сокращенное обозначение: SDS-PAGE. Белковые фракции распределяются в геле в соответствии с их размерами. После этого разделенные в электрофоретическом поле белки переносят на нитроцеллюлярную пластину, где они обрабатываются специфической антисывороткой. Положение белков, с которыми связываются специфические антитела, выявляется с помощью антииммуноглобулиновых антител, меченных ферментом или радионуклидом. Этот метод получил название Western blot и используется в качестве уточняющего при выявлении в сыворотке крови антител против вируса иммунодефицита человека. Для этого белки вируса разделяют с помощью SDS-PAGE, разделенные белки переносят на пластину нитроцеллюлозы и проводят инкубацию с испытуемой сывороткой. Антитела из сыворотки связываются с разными антигенными фракциями, что выявляется с помощью фер-ментно-меченой антииммуноглобулиновой сыворотки против иммуноглобулинов человека. 4. Иммунофлюоресцентный метод. Используется, например, в серодиагностике сифилиса. Мазок из взвеси T.pallidum на стекле обрабатывают исследуемой сывороткой, в которой подозревается присутствие специфических антител. Если в сыворотке имеются антитела против антигенов спирохеты, они связываются с микробом. Избыток антител удаляют отмыванием. Мазок дополнительно обрабатывают флюоресцирующей сывороткой против человеческих иммуноглобулинов. О выявлении специфических антител в исследуемой сыворотке будет свидетельствовать обнаружение светящихся спирохет при люминесцентной микроскопии мазка. Аналогичным методом выявляют антинуклеарные антитела (антитела против ДНК) в сыворотке крови при ряде аутоиммунных заболеваний, используя в качестве антигена ядерные клетки животного происхождения. 5. Реакция развернутой агглютинации. Сначала готовят основное разведение сыворотки, из которого делают серию разведений путем последовательного переноса 1 мл из предыдущей пробирки в следующую пробирку ряда. Из последней пробирки 1 мл разведенной сыворотки удаляют для сохранения одинакового объема. В контрольную пробирку (контроль анти гена) вносят 1 мл изотонического раствора хлорида натрия. В каждую пробирку с разведениями сыворотки и в контрольную пробирку вносят пастеровской пипеткой по 2 капли взвеси бактерий, содержащей 3 млрд микробных тел в 1 мл. Пробирки встряхивают и помещают в термостат при 37 °С на 2 ч, затем сутки выдерживают при комнатной температуре. Учет реакции развернутой агглютинации производят, оценивая последовательнл каждую пробирку, начиная с контрольных, при осторожном сшвании. В контрольных пробирках агглютинации не должыть. Интенсивность реакции агглютинации отмечают следу-ми знаками: "++++" — полная агглютинация (хлопья агг-F "1л|бтината в абсолютной прозрачной жидкости), "+++" — неполна Ля агглютинация Схлопья в слабоопалеспигпто] * агглютинация (хлопья в слабоопалесцирующей жидкости), jt (*f+" — частичная агглютинация (хлопья четко различимы, жидкость слегка мутная), "+" — слабая , сомнительная агглютинация (жидкость очень мутная, хлопья в ней плохо различимы), "—" — отсутствие агглютинации (жидкость равномерно мутная) (рис. 10.2.1). За титр сыворотки принимают последнее ее разведение, в 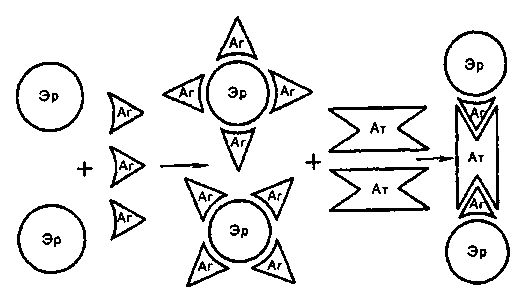 Как правило, в центральную лунку заливают стандартный раствор антигена, а в периферические — испытуемые сыворотки. В одну из периферических лунок вносят стандартную иммунную сыворотку соответствующей специфичности, а в другую — нормальную сыворотку для контроля. Антиген с сыворотками инкубируют во влажной камере при 37 "С в течение 24 ч, после чего учитывают количество и ширину полос преципитации между центральной лункой с раствором антигена и лунками с исследуемыми сыворотками. 8. Реакция лизиса. Реакция связывания комплемента. Для постановки реакции лизиса и РСК используют комплемент, который содержится в сыворотке крови морских свинок. Гемолитическая активность комплемента термолабильна и полностью утрачивается при прогревании сыворотки в течение 30 мин при 56 СС. При адсорбции комплемента на комплексе антиген—антитело его действие проявляется реакцией лизиса антигена, если антиген корпускулярный, или не сопровождается видимыми изменениями, если это мелкодисперсные или растворимые антигены. Для учета результатов РСК вводят вспомогательную (индикаторную) гемолитическую систему. Она состоит из взвеси эритроцитов барана в изотоническом растворе хлорида натрия и гемолитической сыворотки кролика, полученной путем его иммунизации упомянутыми эритроцитами. Положительная РСК характеризуется задержкой гемолиза вследствие адсорбции комплемента системой антиген—антитело (рис. 10.2.3). Отрицательная РСК характеризуется наличием гемолиза, поскольку свободный комплемент связывается с индикаторной системой антиген—антитело, т.е. эритроциты барана — гемолитическая сыворотка кролика. РСК обладает высокой чувствительностью и специфичностью, что позволяет использовать ее для серодиагностики многих заболеваний. Для постановки РСК требуется точное определение количественных соотношений всех ингредиентов, участвующих в реакции: исследуемой сыворотки, антигена, комплемента, гемолитической сыворотки кролика и эритроцитов барана. Поэтому постановке основного опыта предшествует титрование гемолитической сыворотки и выбор ее рабочего разведения, титрование других ингредиентов. Постановка РСК должна сопровождаться контролями для проверки отсутствия антикомплементарных ингредиентов в препаратах антигенов и в исследуемой сыворотке. Антикомплементарные свойства антигенов или сыворотки могут быть связаны с присутствием в их составе денатурированных или агрегированных иммуноглобулинов, гепарина, оксидантов, микробных контаминант. Эти компоненты могут либо связывать комплемент, либо связывать и удалять ионы кальция или магния, необходимые для комплементопосредованного гемолиза. 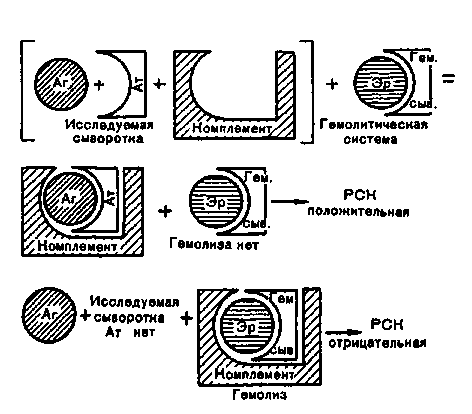
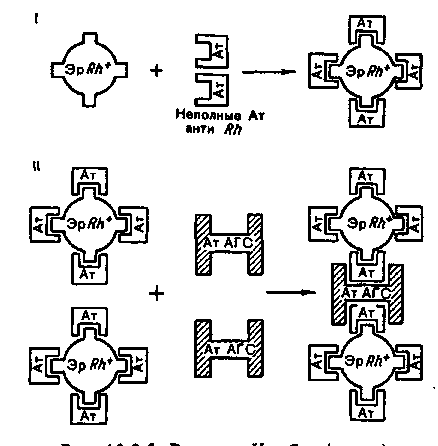
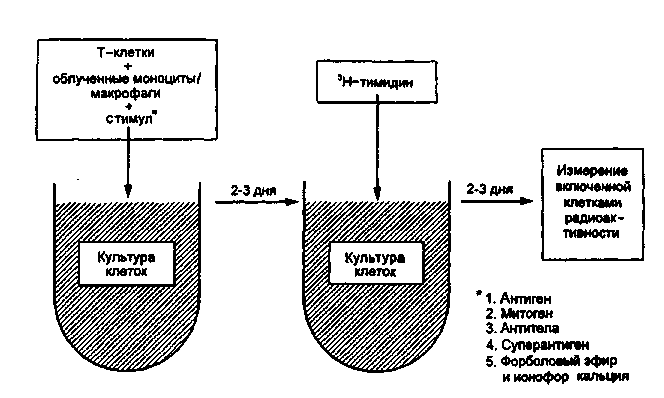
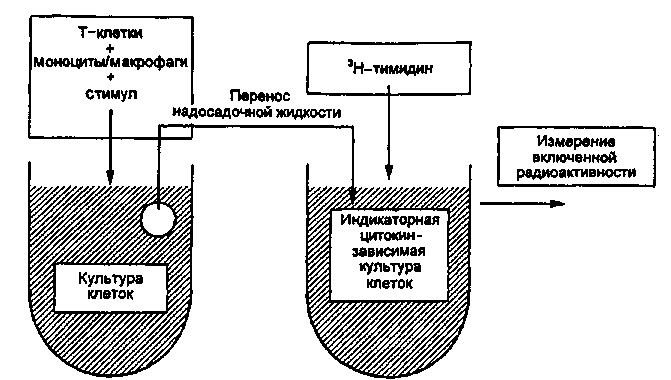
Тема 10.3. МЕТОДЫ ОЦЕНКИ ИММУННОГО СТАТУСА ОРГАНИЗМА ЧЕЛОВЕКА Иммунный статус человека складывается из комплекса неспецифических и специфических механизмов, обеспечивающих антибактериальную, противовирусную и противоопухолевую защиту организма. К механизмам неспецифической защиты против бактерий относятся фагоцитоз гранулоцитами и моноцитами/макрофагами и активация системы комплемента по альтернативному пути. Макрофаги не только захватывают и убивают бактерии, но при контакте с ними продуцируют и секретируют биологически активные молекулы — цитокины, запускающие неспецифический защитный процесс воспаления. Механизмы неспецифической противовирусной и противоопухолевой защиты: клетки — естественные киллеры и молекулы семейства интерферонов. Специфическую антибактериальную защиту против внеклеточно паразитирующих бактерий обеспечивают специфические антитела — иммуноглобулины путем усиления фагоцитоза (опсонизация) или активации системы комплемента по классическому пути иммунными комплексами. Специфическая защита от бактериальных токсинов является функцией специфических антитоксических антител — иммуноглобулинов, способных нейтрализовать экзотоксины бактерий. Специфическую защиту против внутриклеточ-но паразитирующих микроорганизмов берут на себя активированные Т-лимфоциты и макрофаги, продуцирующие цитокины: интерлейкины, гамма-интерферон, фактор некроза опухоли, обеспечивая при этом развитие в очаге инфекции реакции иммунного воспаления — гиперчувствительности замедленного типа (ГЗТ). Специфическую противовирусную защиту обеспечивают активированные цитотоксические лимфоциты (CTL), способные распознать инфицированную клетку и убить ее при непосредственном контакте. В специфической противовирусной защите велика роль специфических антител иммуноглобулинов, которые могут нейтрализовать внеклеточные вирусы или вызвать гибель инфицированных вирусом клеток посредством антителозависимой клеточной цитотоксичности (АЗКЦТ) естественных киллеров и других клеток. Оценка иммунного статуса включает количественную и качественную оценку основных факторов неспецифической защиты (фагоцитирующих клеток, системы комплемента, естественных киллеров, системы интерферонов) и основных звеньев иммунной системы: Т-лимфоцитов и их главных конечных продуктов — цитокинов; В-лимфоцитов и их главных конечных продуктов — иммуноглобулинов. Количественная оценка клеточных популяций начинается на этапе клинического анализа крови, который дает информацию о количестве циркулирующих в крови гранулоцитов, моноцитов и лимфоцитов. Дальнейшая дифференцировка лимфоцитов основывается на наличии у них так называемых поверхностных маркеров, т.е. особых молекул (их принято обозначать "CD" — сокращение от английского термина "clusters of differentiation") в составе клеточных мембран, которые в качестве антигенов выявляются при взаимодействии со специфическими моноклональными антителами. Качественная (функциональная) оценка клеточных популяций и субпопуляций проводится с помощью соответствующих функциональных тестов: у Т- и В-лимфоцитов оценивают про-лиферативный ответ на контакт со стандартными митогенами или микробными антигенами (реакция бласттрансформации лимфоцитов — РБТЛ) или ответ продукцией цитокинов на контакт с митогеном. У фагоцитирующих клеток оценивают функцию фагоцитоза: активность захвата стандартных частиц — объектов фагоцитоза, бактерицидность фагоцитов косвенно оценивается по высоте окислительного взрыва, индуцированного фагоцитозом (НСТ-тест). Концентрацию молекул иммуноглобулинов четырех основных изотипов — классов (IgG, IgM, IgA, IgE) в сыворотке крови и в других биологических жидкостях (слюна, спинномозговая жидкость и др.) определяют, пользуясь наборами специфических моноклинальных антител, полученных против изотипспецифических антигенов этих иммуноглобулинов. С помощью наборов таких антител можно проводить реакцию комплексообразования (иммуноглобулины, присутствующие в сыворотке крови, выполняют в этой реакции функцию антигенов), результаты которой поддаются количественному учету с помощью нефелометра или спектрофотометра. Другой вариант учета — проведение твердофазного иммуно-ферментного анализа с участием тех же изотипспецифических моноклональных антител и антииммуноглобулиновой меченной пероксидазой сыворотки против иммуноглобулинов мыши (так как все моноклональные антитела получены из клеток мышей). План Программа Изучение методов оценки факторов неспецифической защиты организма. Изучение методов оценки Т-системы иммунитета. Изучение методов оценки В-системы иммунитета. Демонстрация Характерная морфология гранулоцитов, моноцитов и лимфоцитов в мазке крови, окрашенном по методу Романовского-Гимзы. Отдельные стадии фагоцитоза бактерий и дрожжеподобных грибов рода Candida макрофагами и гранул о-цитами. 134 Задание студентам Произвести микроскопический учет фагоцитоза частиц латекса лейкоцитами крови. Рассчитать показатели активности фагоцитирующих клеток. Протоколировать и оценить результаты определения гемолитической активности комплемента сыворотки крови. По готовым результатам выявления поверхностных маркеров на мембранах мононуклеарных лейкоцитов крови рассчитать показатели относительного и абсолютного количества естественных киллеров, В-лимфоцитов, Т-лимфоцитов, их субпопуляций в крови и сопоставить с интервалами колебаний этих показателей у здоровых лиц. По готовым результатам иммуноферментного определения содержания в сыворотке крови иммуноглобулинов разных изотипов (IgG, IgM, IgA, IgE) сделать заключение, сопоставив эти результаты с интервалами колебаний этих показателей у здоровых лиц. Обосновать выбор специальных тестов для характеристики функций иммунокомпетентных клеток. Методические указания 1. Методы оценки фагоцитирующих клеток крови. Образец крови или лейковзвеси инкубируют с бактериями или другими объектами фагоцитоза (частицы латекса, полистиреновые частицы) в течение 1—2 ч, после чего из этой смеси приготавливают мазок, окрашивают по методу Романовского—Гимзы и микроскопируют, подсчитывая 100 клеток для определения процента фагоцитирующих клеток и количества бактерий (частиц), захваченных этими клетками (рис. 10.3.1; на вклейке). В норме процент фагоцитирующих лейкоцитов колеблется от 40 до 80 %, а количество захваченных частиц на 1 клетку — от 1 до 5. В качестве косвенного показателя бактерицидности фагоцитирующих клеток оценивают интенсивность окислительного взрыва в фагоцитах по способности восстанавливать желтый краситель нитросиний тетразолий (НСТ) с формированием в цитоплазме клеток осадка темно-синего формазана. Чем активнее окислительный взрыв в фагоцитах, тем большая доля клеток содержит осадок формазана. После подсчета клеток доля формазан-положительных выражается в процентах. При инкубации лейкоцитов здоровых лиц только с красителем без индуктора окислительного взрыва доля формазан-положительных клеток не превышает 1—2 %. При инкубации лейкоцитов здоровых лиц в присутствии индуктора окислительного взрыва (объекты фагоцитоза, бактериальный липополисахарид или полисахарид) все 100 % фагоцитов могут ответить окислительным взрывом и накоплением осадка формазана. Снижение доли формазан-положительных клеток свидетельствует о дефектности кислородзависимого механизма бактерицидности фагоцитов. 2. Методы определения количества лимфоцитов в крови. Изучение лимфоцитов начинается с их выделения из крови. Мо-нонуклеарные лейкоциты (лимфоциты, моноциты) отделяют от других клеток крови (гранулоцитов и эритроцитов) с помощью центрифугирования в градиенте плотности специальной смеси препаратов: фикол, верографин. Взятая из вены кровь смешивается с антикоагулянтом, вносится в пробирку с названной смесью и центрифугируется. Имеющие большую плотность эритроциты и гранулоциты образуют осадок на дне пробирки, а мононуклеарные клетки образуют кольцо на поверхности градиентной смеси, откуда могут быть перенесены в отдельную пробирку и отмыты от градиентной смеси. Все зрелые лимфоциты имеют одинаковую морфологию: малых лимфоцитов с плотным ядром и узким ободком цитоплазмы. Дифференцировка популяций и субпопуляций лимфоцитов связана с выявлением поверхностных маркеров — особых для каждого типа клеток антигенов с помощью соответствующих специфических антител. Естественные киллеры несут поверхностный маркер CD16. Все Т-лимфоциты (тотально) несут поверхностный маркер CD3. Т-лимфоциты делятся на субпопуляции: Т-хелперы несут маркер CD4, а цитотоксические Т-лимфоциты (CTL) несут маркер CD8. Все В-лимфоциты несут поверхностный маркер CD19. В-лимфоциты несут на поверхностной мембране поверхностные иммуноглобулины, которые могут быть выявлены в качестве антигенов с помощью флюоресцирующих антиимму-ноглобулиновых антител (в том числе — против отдельных изо-типов иммуноглобулинов). Эти поверхностные иммуноглобулины также рассматриваются как поверхностные маркеры В-лимфоцитов. Определение количества лимфоцитов разных популяций и субпопуляций по поверхностным маркерам проводится с помощью двух разных вариантов методов: люминесцентной или световой микроскопии мазков цельной крови или взвеси мононуклеаров, обработанных соответствующими моноклональными антителами, меченными флюорохромом или ферментом; автоматического подсчета клеток с использованием проточного цитофлюориметра (рис. 10.3.2). При использовании первого методического варианта важно получить видимый осадок комплексов антител с красителем на поверхности клетки. Этот метод очень трудоемкий и длительный. Подсчет количества основных субпопуляций лимфоцитов данным методом занимает неделю. 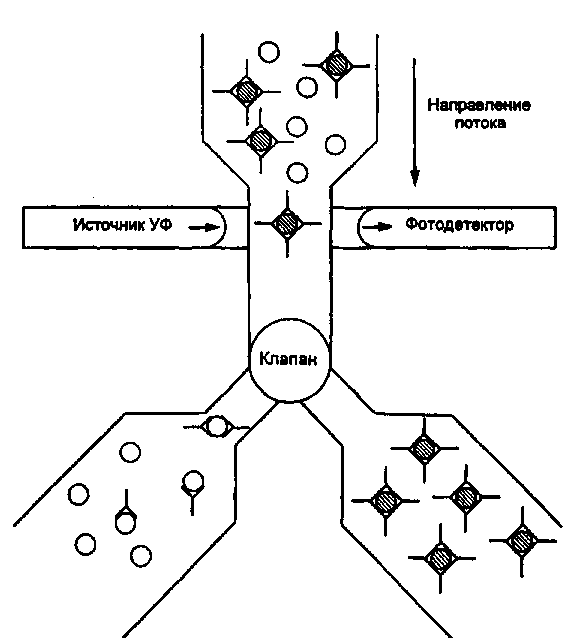 Клетки ниже порога флюоресценции Клетки выше порога флюоресценции Рис. 10.3.2. Подсчет лимфоцитов разных популяций и субпопуляций с помощью проточного цитофлюориметра. В отличие от этого с помощью автоматизированного подсчета с использованием современного прибора — проточного цитофлюориметра — это удается сделать за один день. Образец цельной крови инкубируют с моноклональными антителами, меченными флюоресцентным красителем, пропускают через тонкую трубочку, на выходе из которой формируется струя из капель. Многие из них содержат только по одной клетке. Каждая капля проходит перед лазерным лучом. Если капля содержит клетку, клетка вызывает отклонение лазерного луча, а лазерный луч возбуждает свечение флюорохрома в молекуле антитела, связанного с антигеном на поверхности клетки (с поверхностным маркером). Чувствительный фотоумножитель
| |||||||||
