Тец руководство. Руководство к практаческим занятиям по медицинской микробиологии, вирусологии и иммунологии под редакцией
 Скачать 2.14 Mb. Скачать 2.14 Mb.
|
|
Тема 12.1. АЭРОБНЫЕ БАКТЕРИИ -ВОЗБУДИТЕЛИ ГНОЙНО-ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ И РАНЕВЫХ ИНФЕКЦИЙ План Программа Биологические свойства возбудителей гнойно-воспалительной и раневой инфекции, их патогенность, экология, особенности инфекции и эпидемиология вызываемых заболеваний. Микробиологическая диагностика. Диагностические препараты, профилактические и лечебные препараты. а Демонстрация Рост а- и р-гемолитических стрептококков на кровяном агаре. Рост и образование пигмента P.aeruginosa на агаре. Диагностические и лечебно-профилактические препараты. ЗАНЯТИЕ 1 а Задание студентам Микроскопировать и зарисовать мазки из чистых культур возбудителей гнойных инфекций: S.aureus, S.pyogenes, P.aeruginosa, E.coli, P.vulgaris. Окраска по методу Грама. Микроскопировать и зарисовать мазки из гноя, содержащие возбудителей: стафилококков, стрептококков. Окраска по методу Грама. Ознакомиться с питательными средами, применяемыми при микробиологической диагностике гнойных и раневых инфекций. Указать назначение отдельных питательных сред. Микробиологическое исследование при раневых и гнойных инфекциях: а) указать материал, подлежащий исследованию; 159 б) микроскопический метод: микроскопировать мазок из гноя, окраска по методу Грама. Сделать вывод; в) наметить план дальнейшего исследования. ЗАНЯТИЕ 2 Задание студентам 1. Микробиологическое исследование гноя: а) учесть результат посева гноя на кровяной агар в чашке Петри, описать подозрительные колонии, отметить наличие гемолиза, составить план дальнейшего исследования; б) учесть результаты определения лецитиназы и плазмокоагулазы у выделенной культуры стафилококка. Сделать вывод; в) учесть результаты определения чувствительности культуры стафилококка к антибиотикам. Сделать вывод. Микробиологическое исследование мочи. Определить количество бактерий в 1 мл мочи по результатам метода секторных посевов. Дать заключение. Серодиагностика ревматизма. Ознакомиться с описанием стрептолизиновой реакции. Внести в протокол результаты определения анти-0-стрептолизина в сыворотке крови больного. Сделать вывод. Дать краткую характеристику демонстрируемым антимикробным, диагностическим и лечебно-профилактическим препаратам. Методические указания Материал для исследования: раневое отделяемое, гной, экссудат, моча, мазки со слизистых оболочек (носоглотки, зева и др.), кровь при подозрении на сепсис. • Микробиологическая диагностика стафилококковых инфекций МЕТОДЫ ДИАГНОСТИКИ: Бактериоскопическое исследование (схема 12.1.1). Из исследуемого материала (за исключением крови) готовят мазки для первичной бактериоскопии, окрашивают по методу Грама и микроскопируют. Наличие в препаратах грамположителькых кокков, располагающихся в виде гроздевидных скоплений (рис. 12.1.1; на вклейке), позволяет поставить предварительный диагноз стафилококковой инфекции. Следует иметь в виду, что в патологическом материале стрептококки редко образуют типичные скопления, чаще располагаются поодиночке или небольшими группами по 2—3 бактерии. Бактериологическое исследование. Испытуемый материал засевают петлей на чашки с кровяным и желточно-солевым агаром 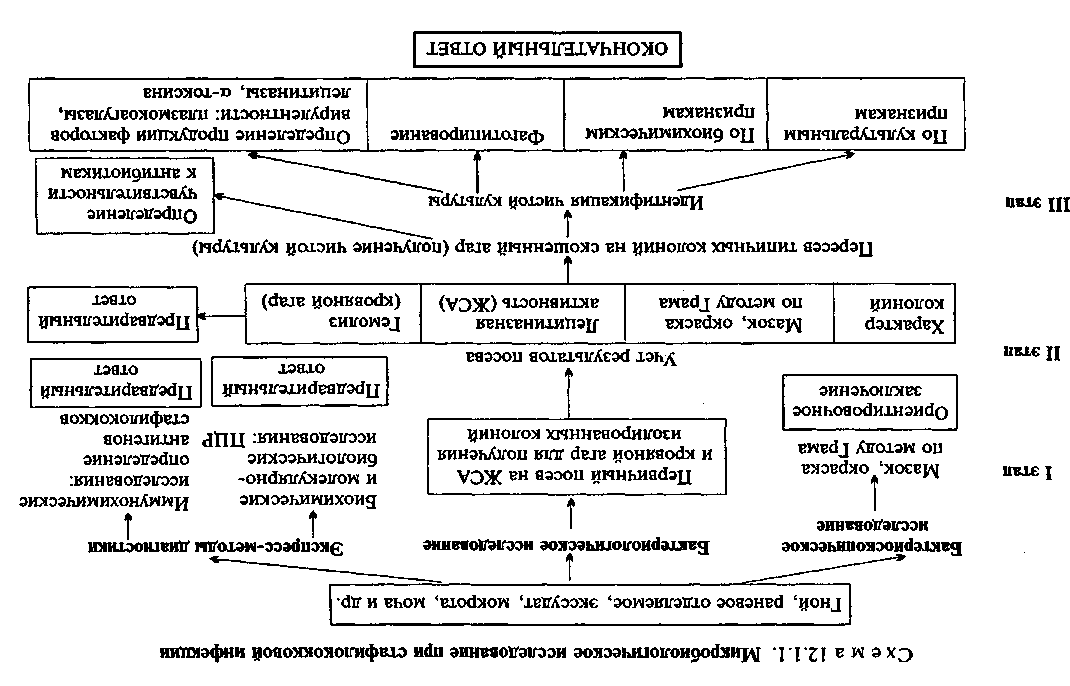
Определение чувствительности стафилококка к антибиотикам — см. тему 7.2. Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Основаны на обнаружении антигенов (токсинов и ферментов) возбудителя в материале от больного с помощью чувствительных серологических реакций. Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз. • Микробиологическая диагностика стрептококковых инфекций (схема 12.1.2) МЕТОДЫ ДИАГНОСТИКИ: Бактериоскопическое исследование. Мазки для первичной бактериоскопии готовят из патологического материала (за исключением крови), окрашивают по методу Грама и микроско-пируют. При положительном результате обнаруживают цепочки грамположительных кокков (см. рис. 12.1.1). Следует иметь в виду, что в патологическом материале стрептококки редко образуют типичные скопления, чаще располагаются поодиночке или небольшими группами по 2—3 бактерии. Бактериологическое исследование. Исследуемый материал засевают на кровяной агар в чашку Петри. После инкубации при 37 "С в течение 24 ч отмечают характер колоний и наличие вокруг них зон гемолиза. Из части материала, взятого из колоний, готовят мазок, окрашивают по методу Грама и микро-скопируют. Для получения чистой культуры 1—3 подозрительные колонии пересевают в пробирки со скошенным кровяным агаром и сахарным бульоном. На кровяном агаре Streptococcus pyogenes образует мелкие, величиной с булавочную головку, мутноватые круглые колонии. В бульоне стрептококк в отличие от стафилококка дает придонно-пристеночный рост в виде хлопьев или зерен, оставляя среду прозрачной. По характеру гемолиза на кровяном агаре стрептококки делятся на три группы: 1) негемолитические; 2) ссргемолити-ческие, или зеленящие, образующие зеленоватую зону частичного гемолиза; 3) р-гемолитические, образующие вокруг колонии полностью прозрачную зону гемолиза. Заключительным этапом бактериологического исследования является идентификация выделенной культуры по антигенным свойствам (табл. 12.1.2). Серогруппу стрептококков определяют в реакции преципитации с экстрактом из исследуемой культуры (полисахаридным преципитиногеном С) и группоспецифи- 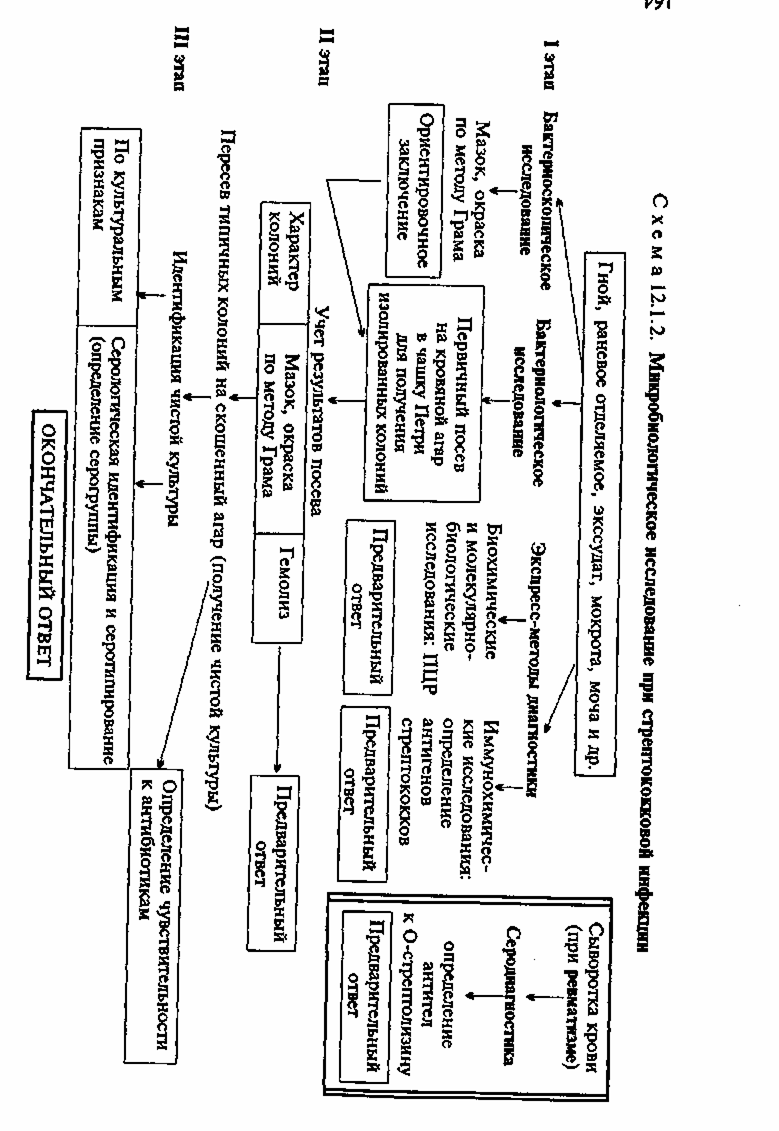
 1:50, 1:250, 1:1000. Диагностический препарат О-стрептолизина также разводят буфером и применяют в количестве 0,3 мл, в котором содержится 1 рабочая доза О-стрептолизина. Рабочая доза — количество О-стрептолизина, которое почти полностью нейтрализуется половиной международной единицы анти-О-стрептолизина стандарта ГИСК. О-стрептолизин в рабочей дозе должен вызывать полный лизис 0,2 мл 5 % взвеси эритроцитов. Разведенную сыворотку и другие ингредиенты разливают по пробиркам так, как указано в табл. 12.1.3, и инкубируют. После инкубации отмечают последнюю пробирку, в которой сыворотка еще нейтрализует рабочую дозу О-стрептолизина (гемолиз отсутствует). Титр сыворотки выражают числом единиц анти-О-стрептолизина в 1 мл (АЕ St-O в 1 мл). В табл. 12.1.3 приведено число АЕ St-O в 1 мл сыворотки при нейтрализации О-стрептолизина различными разведениями сыворотки. Титр анти-О-стрептолизина до 250 АЕ St-O обнаруживается у практически здоровых людей. При ревматизме с первых дней болезни антитела к О-стрептолизину выявляются в высоких титрах — 500 АЕ St-O и выше. • Микробиологическая диагностика гнойно-воспалительных заболеваний, вызванных грамотрицательными аэробными бактериями МЕТОДЫ ДИАГНОСТИКИ: Бактериоскопическое исследование. Из исследуемого материала (гной, раневое отделяемое, участки ожоговой ткани и др.) готовят мазки, окрашивают по методу Грама и микроско-пируют. Обнаружение в мазках грамотрицательных бактерий позволяет сделать предварительное заключение. Бактериологическое исследование. Для выделения культуры Pseudomonas aeruginosa исследуемый материал засевают в чашки Петри на основные (МПА) или селективные питательные среды (агар, содержащий цитилпиридиний хлорид, который угнетает рост сопутствующей микрофлоры — ЦПХ-агар). Посевы инкубируют при 37 °С в течение суток. P.aeruginosa образуют круглые плоские слизистые колонии, окрашивая среду характерным сине-зеленым пигментом. При бактериоскопии темнопольным методом нативных препаратов, приготовленных из колоний, в "раздавленной" или "висячей" капле обнаруживают подвижные и слегка изогнутые палочки; в мазках, окрашенных по методу Грама, — грамотрицательные палочки. Чистые культуры P. aeruginosa идентифицируют по биохимическим признакам и образованию пигмента. Для эпидемиологического анализа госпитальных инфекций определяют серовары в реакции агглютинации, пиоциновары и фаговары. Для выделения энтеробактерий исследуемый материал засевают на одну из дифференциально-диагностических сред, например на среду Эндо (см. тему 3.1). Для выделения бактерий рода Proteus используют метод Шукевича (см. тему 3.1). Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Патогенные штаммы P.aerugi-nosa выделяют различные растворимые белковые (экзотоксины и экзоферменты) и небелковые (экстрацеллюлярная слизь) антигены, которые могут быть обнаружены в материале от пациента (из очага, в крови или моче) с помощью чувствительных серологических реакций (ИФА и др.). Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз. • Микробиологическая диагностика сепсиса МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь; при септико-пиемиях исследуют также материал из первичных и вторичных местных очагов инфекции. Кровь берут в период подъема температуры до начала антибиотикотерапии из локтевой вены в количестве не менее 10 мл у взрослых и 5 мл у детей, так как микроорганизмы находятся в крови в сравнительно небольших количествах. Посевы делают у постели больного в колбы с 50—100 мл питательной среды. Сравнительно большие объемы питательной среды (в 10 раз превышающие количество крови) необходимы для устранения бактерицидного действия сывороточных белков. В случае необходимости транспортировки крови к ней добавляют антикоагулянты: цитрат или оксалат натрия, декстран сульфат, гепарин. В качестве добавки к среде для выделения бактерий из крови используют полианетолсульфонат натрия, являющийся антикоагулянтом и одновременно угнетающий бактерицидную активность сыворотки, фагоцитоз, инактиви-рующий комплемент и нейтрализующий лизоцим. МЕТОДЫ ДИАГНОСТИКИ: Бактериологическое исследование. Является ведущим при лабораторной диагностике сепсиса. Посевы производят на жидкие среды обогащения: сахарный бульон и др.; при подозрении на анаэробную флору — на тиогликолевую среду, среду Китта—-Тароцци или другие элективные среды для анаэробов (см. тему 3.1) и инкубируют их при 37 °С в течение 10 дней при ежедневном контроле. В случае отсутствия роста микроорганизмов дают отрицательный ответ. При наличии роста делают мазки, которые окрашивают по методу Грама. Выделенную чистую 
Иммуноглобулин человеческий противостафилококковый. Гамма-глобулиновая фракция сыворотки крови, содержащая стафилококковый антитоксин. Готовят из крови животных или людей, иммунизированных стафилококковым адсорбированным анатоксином. Применяют для специфического лечения при стафилококковых заболеваниях. Стафилококковый бактериофаг (жидкий). Фильтрат фаголи-зата стафилококков. Применяют наружно, внутрикожно, внутримышечно для лечения при стафилококковых заболеваниях. Диагностические стафилококковые фаги. Набор типоспеци-фических фагов для фаготипирования стафилококков. О-стрептолизин сухой. Лиофильно высушенный фильтрат бульонной культуры стрептококка — активного продуцента О-стрептолизина. Применяют для серодиагностики — определения антител к О-стрептолизину в сыворотках крови больных стрептококковыми инфекциями (чаще ревматизмом). Антибиотики. Грамположительные бактерии — р-лак-тамные антибиотики, ванкомицин, тетрациклины, аминогли-козиды, макролиды, линкомицины, сульфаниламиды, фторхи-нолоны и др. Грамотрицательные бактерии — р-лактамы, спектр действия которых сдвинут в сторону грамотрицательных микроорганизмов, хлорамфеникол, аминогликозиды, тетрациклины, сульфаниламиды, фторхинолоны и др. Тема 12.2. АНАЭРОБНЫЕ БАКТЕРИИ - ВОЗБУДИТЕЛИ ГНОЙНО-ВОСПАЛИТЕЛЬНЫХ И РАНЕВЫХ ИНФЕКЦИЙ План Программа Биологические свойства возбудителей анаэробных гнойно-воспалительных и раневых инфекций, их патогенность, экология, особенности инфекций и эпидемиология вызываемых заболеваний. Микробиологическая диагностика гнойных заболеваний, вызванных неспорообразующими анаэробами. Микробиологическая диагностика газовой гангрены. Микробиологическая диагностика столбняка. Биохимические и молекулярно-биологические методы диагностики анаэробной инфекции. Диагностические, профилактические и лечебные препараты. Демонстрация 1. Мазки из чистых культур Clostridium petfringens, С. teta-ni, Bacteroides fragilis. Мазки из раневого отделяемого, содержащие смешанную микрофлору (клостридии, стафилококки, грамотрицательные бактерии и др.). 171 Методика посева для выделения патогенных анаэробов. Аппаратура и питательные среды для выращивания анаэробов. Определение сс-токсина клостридий в раневом отделяемом с помощью летициназной пробы. а Задания для выполнения лабораторной работы Бактериоскопическое исследование: приготовить мазки из гноя, окрасить их по методу Грама и микроскопировать. Сделать предварительное заключение и наметить ход дальнейшего исследования. Сделать окончательное заключение о возбудителе или возбудителях раневой инфекции на основании бактериоскопических, бактериологических и других данных, полученных из бактериологической лаборатории. Методические указания МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: гной, раневое отделяемое, кусочки мышечной ткани, перевязочный материал и др., кровь — при сепсисе. Для обеспечения бескислородных условий взятие материала производят шприцем с хорошо притертым поршнем до полного его заполнения и вытеснения воздуха. Затем шприц надевают на иглу, вставленную через резиновую пробку в пробирку со смесью инертных газов (N2 + Н2) и СО2, и вводят в нее исследуемый материал, который изучают в микробиологической лаборатории. Используют также различные специальные транспортные среды, в которые помещают материал, взятый у больных. • Микробиологическая диагностика гнойно-воспалительных заболеваний, вызванных неспорообразующими анаэробными бактериями МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: гной из очага, кровь — при сепсисе. МЕТОДЫ ДИАГНОСТИКИ: Бактериоскопическое исследование (см. схему 12.1.1). Из исследуемого материала (за исключением крови) готовят мазки для первичной бактериоскопии, окрашивают по методу Грама и микроскопируют. Наличие в препаратах бактерий позволяет поставить ориентировочный диагноз и наметить план дальнейшего исследования. Бактериологическое исследование. Посевы производят на элективные обогатительные среды для анаэробов (среда Китта—Та-роцци, тиогликолевый бульон или полужидкий тиогликолевый агар), содержащие специальные добавки (гемин, витамин К и др.), и инкубируют при 37 °С в течение 24—48 ч. После просмотра выросшей культуры делают мазки, окрашивают их по методу Грама и микроскопируют. Бактериоскопия дает возможность установить однородность или неоднородность куль- 172
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Биохимические и молекулярно-биологические исследования. Анаэробные бактерии вырабатывают специфические метаболиты, включая летучие жирные кислоты с короткой цепью, спирты и нелетучие органические кислоты. Для их обнаружения в материале от больного используют ГЖХ (см. главу 11). • Микробиологическая диагностика раневой анаэробной кло-стридиальной инфекции — газовая гангрена (схема 12.2.1). МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: раневое отделяемое, отечная жидкость, кусочки мышечной ткани, перевязочный материал, кетгут. Рекомендуется брать материал из разных участков очага поражения, особенно из глубоких слоев. Кровь — при сепсисе. МЕТОДЫ ДИАГНОСТИКИ: Бактериоскопическое исследование. Проводят путем микроскопии мазков, приготовленных из отечной жидкости или некротизированной ткани. Наличие в препаратах крупных (1—1,5x3—10 мкм) грамположительных палочек, некоторые из которых (C.perfringens) образуют макрокапсулу (рис. 12.2.1; на вклейке), позволяет поставить предварительный диагноз. Бактериологическое исследование. Исследуемый материал вносят в несколько пробирок со средой Китта—Тароцци, железо -сульфитным агаром (среда Вильсона—Блера) и молоком. Часть пробирок прогревают при 80 "С в течение 30 мин для уничтожения неспорообразующих бактерий. Посевы инкубируют в обычном термостате при 37 'С. C.perfringens растет в глубине среды. В молоке уже через 3—4 ч посева образуется губкооб-разный сгусток, содержащий пузырьки газа и отделившуюся прозрачную жидкость. Через сутки на среде Китта—Тароцци отмечается помутнение и газообразование, а на железосуль-фитном агаре несколько позднее появляются черные колонии в глубине агарового столбика. Для получения культур других видов клостридий требуются более строгие анаэробные условия. Из всех посевов делают мазки, окрашивают их по методу Грама и микроскопируют. При положительном результате обнаруживаются крупные грамположительные палочки. Для получения чистой культуры делают пересевы на сахарный кровяной агар в чашки Петри и инкубируют в строго анаэробных условиях при 37 °С в течение 3—4 дней. Выросшие колонии пересевают в пробирки со средой Китта—Тароцци. Идентификацию чистой культуры производят на основании признаков, перечисленных в табл. 12.2.1. Идентификация по биохимическим признакам осуществляется традиционными методами или с помощью тест-систем для определения специфических бактериальных ферментов или метаболитов.
• Микробиологическая диагностика столбняка (см. схему 12.2.1) МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кусочки ткани вокруг предполагаемых входных ворот инфекции, перевязочный материал, кетгут. Рекомендуется брать материал из разных участков очага поражения, особенно из глубоких слоев. При подозрении на столбняк у женщин после родов или аборта — выделения из матки, у новорожденных — выделения из пупочной раны. МЕТОДЫ ДИАГНОСТИКИ: Бактериологическое исследование. Материал засевают в среду Китта—Тароцци и инкубируют в анаэробных условиях при 37 "С в течение 3—4 сут, наблюдая придонный рост бактерий. Затем делают посевы на сахарный агар в чашки Петри, в столбик сахарного питательного агара в пробирке. Посевы также инкубируют в анаэробных условиях. На поверхности кровяного агара С.tetan/образует нежные прозрачные колонии, окруженные малозаметной зоной гемолиза. Для получения чистой культуры подозрительные колонии пересевают в пробирки со средой Китта—Тароцци и сохраняют их под слоем вазелинового масла или в эксикаторе, заполненном смесью инертных газов. Для определения способности выделенной чистой культуры к образованию столбнячного токсина (токси-генности) используют серологические реакции (преципитации в геле и др.) с антителами к тетаноспазмину. Бактериологический метод используют в качестве дополнительного метода для подтверждения диагноза, поскольку он не дает своевременного результата. Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Токсин в материале может быть обнаружен с помощью серологических реакций in vitro (ИФА и др.). Метод позволяет получить ответ в течение нескольких часов и обеспечивает своевременную диагностику заболевания. Биопроба. Проводят для обнаружения столбнячного токсина в исследуемом материале. С этой целью материал растирают в стерильной ступке с песком, заливают изотоническим раствором хлорида натрия для экстрагирования токсина и фильтруют через бумажный фильтр. Фильтрат вводят внутримышечно белым мышам. Животным контрольной группы вводят смесь фильтрата с антитоксической сывороткой. Через 1—2 сут у мышей появляется ригидность мышц хвоста и задних конечностей. В результате резкого сокращения хвостовых мышц хвост поднимается в виде дуги. Затем подопытные животные погибают. У животных в контрольной группе признаки инток- сикации отсутствуют вследствие нейтрализации токсина антисывороткой. В настоящее время биопроба практически не применяется. • Диагностические, профилактические и лечебные препараты Антитоксические противогангренозные сыворотки — моновалентные (антиперфрингенс, антиэдематиенс — антинови, анти-септикум и др.) и поливалентная. Сыворотки получают путем иммунизации лошадей соответствующими анатоксинами, с последующей очисткой и концентрацией методом ферментативного гидролиза (диаферм-3). Препараты выпускаются в жидком и сухом виде. Применяют для экстренной пассивной профилактики и специфической иммунотерапии газовой гангрены. Адсорбированный столбнячный анатоксин. Получен путем обезвреживания формалином столбнячного токсина с последующей его очисткой, концентрацией и адсорбцией на гидрате оксида алюминия. Входит в состав ассоциированной коклюш-но-дифтерийно-столбнячной вакцины и других препаратов. Применяют для активной иммунизации против столбняка. Противостолбнячная сыворотка. Получена из крови лошадей, гипериммунизированных столбнячным анатоксином. Очищена и концентрирована методом диаферм-3. Активность измеряется в международных единицах. Применяют для экстренной пассивной профилактики и лечения столбняка. Иммуноглобулин человеческий противостолбнячный. Получен из гамма-глобулиновой фракции крови доноров, ревакциниро-ванных очищенным адсорбированным столбнячным анатоксином. Применяют для экстренной пассивной профилактики и лечения столбняка. Антибиотики. Грамположительные бактерии — р-лактамные антибиотики, ванкомицин, тетрациклины, макро-лиды, линкомицины, метронидазол. Грамотрицательные бактерии — р-лактамы, спектр действия которых сдвинут в сторону грамотрицательных микроорганизмов, хлорамфеникол, тетрациклины, сульфаниламиды, метронидазол. Аминогликозиды и фторхинолоны, как правило, не активны по отношению к анаэробным микробам. Глава 13 ВОЗБУДИТЕЛИ БАКТЕРИАЛЬНЫХ КИШЕЧНЫХ ИНФЕКЦИЙ Возбудители кишечных инфекций представлены большим числом микроорганизмов, принадлежащих к неродственным группам (табл. 13.1).
генность, экология, особенности инфекции и эпидемиология вызываемых заболеваний. Микробиологическая диагностика. Диагностические, профилактические и лечебные препараты. а Демонстрация Мазки из чистых культур возбудителей кишечных инфекций: Escherichia coli, Shigella sonnei, Campylobacter jejuni. Окраска по методу Грама. Диагностические и лечебно-профилактические препараты. а Задание студентам Микроскопировать и зарисовать мазки из чистых культур возбудителей кишечных инфекций. Бактериологическая диагностика кишечных инфекций. 2.1. Бактериологическая диагностика эшерихиозов: а) выбрать материал для исследования; б) учесть результаты первичного посева исследуемого материала на среду Эндо. Описать и зарисовать колонии, выросшие на среде Эндо, и обосновать выбор подозрительных колоний для дальнейшего исследования; в) провести серологическую идентификацию чистой культуры, полученной из подозрительных колоний, в ориентировочной реакции агглютинации на стекле с агглютинирующими ОВ-коли-сыворотками (серотипирование). Сделать вывод и наметить план дальнейшего анализа. 2.2. Бактериологическая диагностика дизентерии: а) выбрать материал для исследования; б) учесть результаты первичного посева исследуемого материала на среду Эндо. Описать и зарисовать колонии, выросшие на среде Эндо, и обосновать выбор подозрительных колоний длядальнейшего исследования; в) учесть результаты пересева подозрительных колоний на среду Ресселя; г) провести идентификацию чистой культуры: 4 по биохимическим свойствам, 4 по антигенным свойствам в ориентировочной реакции агглютинации на стекле с агглютинирующими сыворотками для идентификации шигелл. Сделать вывод и наметить план дополнительных исследований. 3. Ознакомиться с диагностическими и лечебно-профилактическими препаратами.
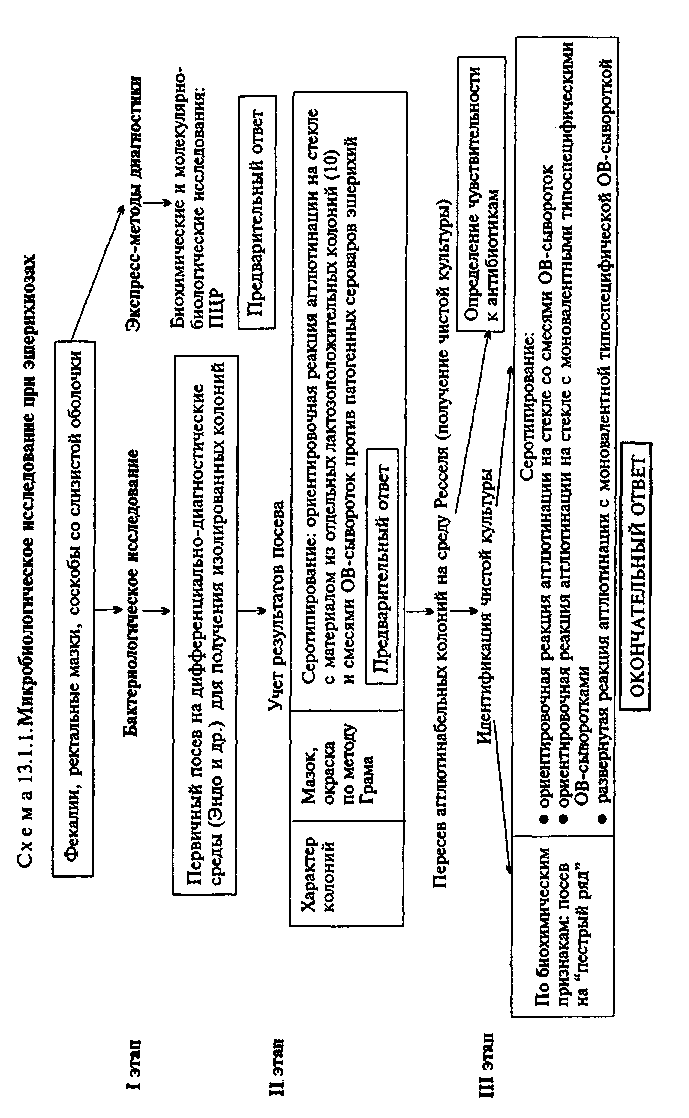 полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз. • Микробиологическая диагностика дизентерии МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: фекалии, ректальные мазки, соскобы со слизистой оболочки. МЕТОДЫ ДИАГНОСТИКИ: Бактериологическое исследование (схема 13.1.2). Фекалии больного засевают на дифференциально-диагностические среды (агар Эндо, Плоскирева и др.). При наличии в исследуемых испражнениях гнойных или слизисто-кровянистых комочков их выбирают петлей, промывают в изотоническом растворе хлорида натрия и наносят на поверхность питательной среды, после чего растирают шпателем. На 2-й день лактозоотрицательные (прозрачные бесцветные) колонии пересевают на среду Ресселя или на короткий "пестрый ряд" с лактозой и глюкозой. Среда Ресселя: питательный агар, 1 % раствор лактозы, 0,1 % раствор глюкозы и индикатор бромтимоловый синий. Среду готовят таким образом, чтобы внизу она была в виде столбика, а верхняя часть имела скошенную поверхность. Исследуемую культуру засевают уколом в столбик и на поверхность среды. При ферментации углеводов происходит изменение цвета среды (желтая окраска); разрывы столбика свидетельствуют о газообразовании. Изменение цвета во всем объеме среды наблюдается при ферментации лактозы, только столбика — при ферментации глюкозы, так как содержание ее в среде в 10 раз меньше, чем лактозы. Вместо среды Ресселя можно использовать трехсахарную среду (в ее состав входят глюкоза, лактоза, сахароза, мочевина, некоторые соли и индикатор феноловый красный) или другие дифференциально-диагностические среды, позволяющие различать бактерии по способности ферментировать лактозу и глюкозу. Оставшуюся часть колоний используют для постановки ориентировочной реакции агглютинации на стекле со смесью дизентерийных сывороток и смесью сывороток против сальмонелл (для исключения брюшного тифа или сальмонеллеза). Окончательное заключение дают на 4-й день по результатам ферментативных тестов (табл. 13.1.2) и реакции агглютинации. Выделенную чистую культуру используют для определения чувствительности возбудителя к антимикробным препаратам. Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
ческих признаков, чувствительности к антимикробным препаратам. Типирование штаммов возбудителей для эпидемиологического анализа проводят методом рестрикционного анализа ДНК. Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования: биохимические исследования. Выявление бактериального фермента уреазы. 4 Определение уреазной активности в биоптате. Биоптат помещают в бульон, содержащий мочевину и индикатор. В положительных случаях происходит изменение цвета индикатора в результате защелачивания среды при гидролизе мочевины с образованием аммиака. 4 Дыхательный тест на уреазу. После перорального приема мочевины, меченной радиоактивным изотопом 14С, определяют присутствие меченой двуокиси углерода 14СО2 в выдыхаемом воздухе. Появление 14СО2 свидетельствует об активности уреазы (результат гидролиза меченой мочевины), что является косвенным признаком присутствия в желудке или двенадцатиперстной кишке H.pylori. Тест используют преимущественно для предварительной диагностики и контроля результатов лечения. Молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз. Серодиагностика. Диагностическое значение имеет обнаружение антител к поверхностным антигенам возбудителя и уреа-зе. Используют методы: ИФА, РИА и РИГА. • Микробиологическая диагностика кампилобактериозов МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, ректальные мазки, при генерализованной форме инфекции — кровь, спинномозговая жидкость. При необходимости хранения материал помещают в транспортную среду (буферный солевой раствор с добавлением нейтрального угля и метиленово-го синего или тиогликолевый бульон) при температуре 4 °С, что позволяет микробам сохранять жизнеспособность до 4 сут. МЕТОДЫ ДИАГНОСТИКИ: Бактериологическая диагностика. Производят посев на специальные плотные среды, обогащенные аминокислотами с добавлением гемолизированной крови или нейтрального угля (для удаления токсичных метаболитов кислорода) и 3—5 антибиотиков для подавления роста сопутствующей микрофлоры (обычно используют ванкомицин, полимиксин, триметоприм, амфотерицин В и др.). Инкубация посевов осуществляется при 42 °С в микроаэрофильных условиях — в атмосфере, содержащей не более 5 % С>2 и 10 % СО2. Рост колоний наблюдается через 48—72 ч. Идентификация чистой культуры осуществляется на основании морфологии: мелкие грамотрицательные S-образно или спиралевидно (2—3 завитка) изогнутые микроорганизмы, моно- или амфитрихи; используют темнопольный и фазово-контрастный методы исследования для выявления характерной подвижности — штопорообразные движения, куль-туральных, биохимических признаков, чувствительности к антимикробным препаратам. Разработаны также биохимические (хемоидентификация) и молекулярно-биологические методы идентификации (см. главу 3). Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз. Серодиагностика. Применяют преимущественно для ретроспективной диагностики — антитела определяют в парных сыворотках в реакциях РСК, РИГА и др. • Диагностические, профилактические и лечебные препараты Агглютинирующие ОВ-сыворотки против патогенных кишечных палочек: ОВ-коли-сыворотка О26:В6, ОВ-коли-сыворотка О111: В4, ОВ-коли-сыворотка О55:В5 и др. Получают путем иммунизации кроликов взвесью эшерихий соответствующего серовара и применяют в реакции агглютинации для идентификации патогенных эшерихий. Адсорбированные агглютинирующие сыворотки для идентификации шигелл. Различают групповые и моновалентные сыворотки. Получают путем иммунизации кроликов определенными видами и сероварами S.dysenteriae, S.flexnery, S.sonnei и S.boydi с последующей адсорбцией межгрупповых и других лишних антител. Поливалентный дизентерийный бактериофаг. Содержит фаги, лизирующие шигеллы Флекснера и Зонне. Выпускается в виде таблеток с кислотоустойчивым покрытием. Применяют для экстренной профилактики и лечения. Дизентерийная вакцина спиртовая, сухая. Содержит шигеллы Флекснера и Зонне. Применяют для лечения хронических форм дизентерии. Препараты эубиотиков — коли-бактерин, бифидумбактерин, бификол, лактобактерин. Применяют с лечебно-профилактическими целями (см. тему 13.2). Антибиотики: полусинтетические пенициллины, цефалоспо-рины 2—4-го поколений, хлорамфеникол, тетрациклины, фторхинолины, сульфаниламиды, полимиксин и др. |
