Тец руководство. Руководство к практаческим занятиям по медицинской микробиологии, вирусологии и иммунологии под редакцией
 Скачать 2.14 Mb. Скачать 2.14 Mb.
|
Современная классификация бактерий рода Salmonella. Род Salmonella включает 2 вида: S.enterica (2307 сероваров) и S.bon-gori (17 сероваров). Вид S.enterica включает 5 подвидов: enterica (I), salamae (И), arizonae (Ilia), diarisonae (Illb), houtenae (IV), indica (V), которые вьщелены на основании молекулярно-гене-тических признаков (гибридизационного анализа ДНК) и фе-нотипически различаются по биохимическим свойствам. Внутри подвидов сальмонеллы подразделяются на серовары по О-и Н-антигенам согласно классификации Кауфмана—Уайта. Необходимо помнить, что представители разных подвидов могут иметь общие или идентичные антигены. Абсолютное большинство сероваров (1367) относятся к подвиду enterica. Согласно ранее существовавшей классификации, сальмонеллы — представители различных сероваров — рассматривались как самостоятельные виды и имели собственные видовые названия. В настоящее время старые видовые названия используют для обозначения биоваров (сероваров), например S.enterica подвида enterica серовара typhimurium соответствует S.typhimurium, cepo-вара typhi — S.typhi, серовара paratyphi A — S.paratyphi А и т.д. Природным резервуаром бактерий S.enterica подвида enterica являются теплокровные животные, для остальных — холоднокровные животные и окружающая среда. Возбудители заболеваний человека относятся к подвиду enterica. С эпидемиологической точки зрения сальмонеллы, вызывающие заболевания человека, относят к трем основным группам. Первая группа включает 3 биовара: typhi, paratyphi А и С, которые являются возбудителями строгих антропонозов (инфицируют только человека и передаются от человека к человеку прямо или опосредованно — через пищу, воду). Вторая группа включает серовары, которые адаптировались к определенному виду животных. Некоторые из этих сероваров патогенны для человека (dublin, gallinarum, schottmulleri и др.). К третьей группе относятся большинство сероваров, не имеющих специфических хозяев и способных инфицировать как человека, так и животных. По клинической классификации сальмонеллы подразделяют на возбудителей брюшного тифа (биовар typhi) и паратифов (биовары paratyphi А, С и schottmulleri) и возбудителей сальмонеллезов, включающих все остальные биовары сальмонелл, патогенных для человека. Большинство возбудителей сальмонеллезов относится к третьей группе по эпидемиологической классификации. План Программа Биологические свойства возбудителей брюшного тифа, паратифов и иерсиниозов. Их патогенность, экология, особенности инфекции и эпидемиология вызываемых заболеваний. Дисбактериоз. Лабораторная диагностика. Диагностические, профилактические и лечебные препараты. Демонстрация Мазки из чистых культур возбудителей кишечных инфекций: Salmonella enterica биоваров typhi, paratyphi A, typhimurium, Proteus vulgaris. Окраска по методу Грама. Диагностические и лечебно-профилактические препараты. Задание студентам Микроскопировать и зарисовать мазки из чистых культур возбудителей кишечных инфекций. Лабораторная диагностика кишечных инфекций. 2.1. Диагностика брюшного тифа и паратифов. А. Бактериологическая диагностика: выбрать материал для исследования; учесть результаты первичного посева исследуемого материала на среду Раппопорт; учесть результаты пересева бактерий со среды Раппопорт на среду Эндо. Описать и зарисовать колонии, выросшие на среде Эндо, и обосновать выбор подозрительных колоний для дальнейшего исследования; учесть результаты пересева подозрительных колоний со среды Эндо на среду Ресселя; учесть результаты идентификации выделенной чистой культуры по биохимическим свойствам; сделать вывод и наметить план дальнейшего исследования. Б. Серодиагностика. Проанализировать результаты реакции Видаля. 2.2. Бактериологическая диагностика сальмонеллезов: выбрать материал для исследования; учесть результаты первичного посева исследуемого материала на висмут-сульфит агар. Описать и зарисовать колонии и обосновать выбор подозрительных колоний для дальнейшего исследования; учесть результаты пересева подозрительных колоний на среду Ресселя; учесть результаты идентификации выделеннойчистой культуры по биохимическим свойствам; сделать вывод и наметить план дальнейшего исследования. 3. Ознакомиться с диагностическими и лечебно-профилактическими препаратами. Методические указания • Микробиологическая диагностика брюшного тифа и пара-тифов МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: исходя из особенностей патогенеза брюшного тифа, на 1-й неделе заболевания, в период бактериемии, возбудителей выделяют из крови (получение гемокультуры), со 2-й недели заболевания — из испражнений (получение копрокультуры), мочи или желчи. МЕТОДЫ ДИАГНОСТИКИ: Бактериологическое исследование (схема 13.2.1). Получение гемокультуры. В 1-й день из локтевой вены больного берут 5—10 мл крови и засевают в колбу с 50—100 мл селективной среды Раппопорт, содержащей желчный бульон (для подавления роста других бактерий), глюкозу, индикатор Андреде и поплавок для обнаружения газа. Указанные соотношения крови и среды необходимы для подавления бактерицидного действия белков крови. Посевы инкубируют при 37 °С в течение 18—20 ч. На 2-й день при росте сальмонелл наблюдается помутнение и изменение цвета среды. При росте паратифозных бактерий (биоварыparatyphi А, Си schottmuelleri) наряду с указанными изменениями появляются пузырьки газа в поплавке. Для ускорения ответа из среды Раппопорт делают мазки и препараты "висячая" капля. При наличии чистой культуры грамотрицательных подвижных палочек и изменении цвета среды (или наличии газа) дают первый предварительный ответ. Затем культуру из среды Раппопорт пересевают в пробирку со средой Ресселя, полагая при этом, что из крови выделена чистая культура и можно сразу приступить к ее идентификации. Одновременно со среды Раппопорт делают посевы на среду Эндо для получения изолированных колоний с целью проверки чистоты выделенной культуры. На 3-й день отмечают ферментацию глюкозы на среде Ресселя и ставят ориентировочную реакцию агглютинации на стекле. На основании полученных данных дают второй предварительный ответ. Для дальнейшего исследования отбирают несколько бесцветных колоний со среды Эндо и пересевают их в среду Ресселя или скошенный питательный агар (для контроля полученных результатов). Чистую культуру пересевают на среды "пестрого" ряда и серотипируют в реакции агглютинации на стекле со смесью групповых сывороток, а затем с 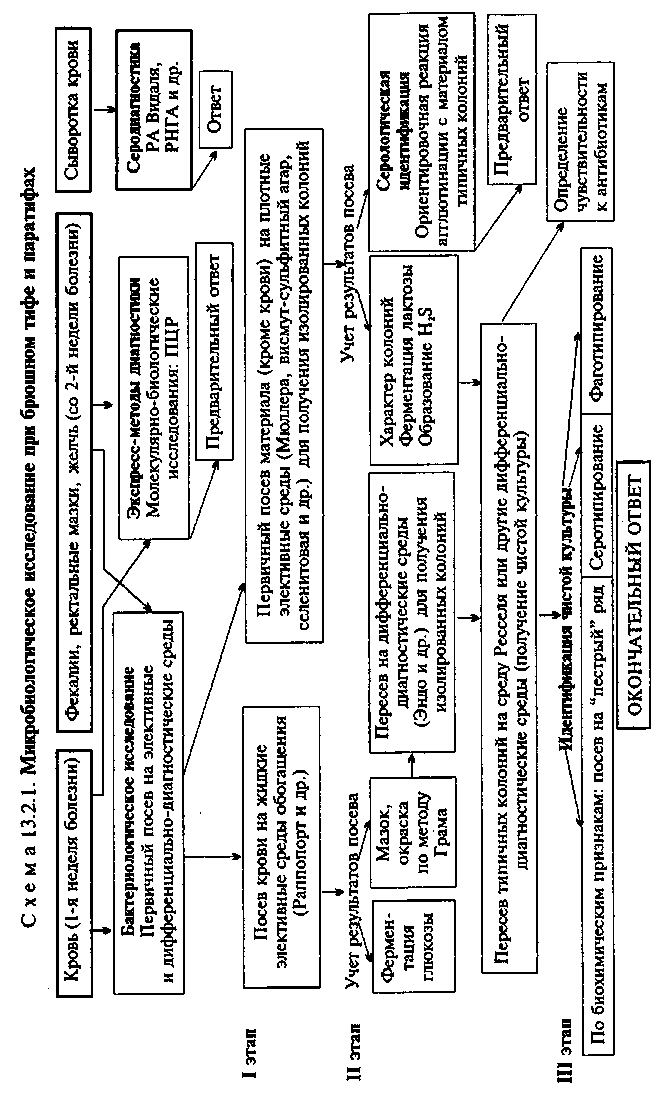 |
| Биовар Ферментация Образование S. enterica 1 1 i \ i лак- глю- маль- саха- ман- H2S NH3 индо- тозы козы тозы розы нита ла ТурЫ -КК-К + --ParatyphiA - КГ КГ - КГ - - -Schottmuelleri - КГ КГ - КГ + + - |
| Род Лизин- Ферментация углеводов р- декар- 1 1 1 1 1 Галак- бокси- дуль- сор- кси- рам- сали- 4 % този- лаза цита бита лозы нозы цина лактозы даза Salmonella ± К(-) К К К - - -Citrobacter - K(-) К К К К(±) К(±) К Hafnia + - - К К К(±) - К |
товая или висмут-сульфит агар). Для посева петлю фекалий вносят в пробирку с изотоническим раствором хлорида натрия и готовят суспензию. После оседания крупных комочков суспензию петлей наносят на поверхность агаровой среды — на одну половину чашки. Материал тщательно растирают шпателем по одной, а затем по другой половине чашки для получения изолированных колоний. Посевы инкубируют при 37 "С в течение 18—20 ч. На 2-й день изучают характер колоний, выросших на чашках (рис. 13.2.1; на вклейке), пересевают 2—3 бесцветные колонии (со среды Эндо или Левина) или колонии черного цвета (висмут-сульфит агар) на среду Ресселя и в пробирки со скошенным питательным агаром. При отсутствии подозрительных колоний на чашках делают высевы из среды Мюллера или селенитовой среды на чашки со средой Эндо для получения изолированных колоний. Для ускорения ответа ставят ориентировочную реакцию агглютинации на стекле с материалом, взятым из бесцветной колонии. Далее поступают так же, как и при идентификации гемокультуры.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика. В лабораторной практике широко применяют развернутую реакцию агглютинации Видаля, основанную на обнаружении в сыворотке крови людей антител — агглютининов, которые появляются в конце 1-й — начале 2-й недели заболевания. Реакцию ставят одновременно с четырьмя антигенами: О- и Н-брюшнотифозными, А- и В-паратифозными диагностикумами. Брюшнотифозные монодиагностикумы применяют для установления стадии болезни, так как содержание О- и Н-антител в разные ее периоды неодинаково. О-антитела появляются на 1-й неделе, накапливаются в разгар заболевания и исчезают к моменту выздоровления. Н-антитела появляются в разгар заболевания, накапливаются к концу заболевания и сохраняются у переболевших в течение длительного времени. У людей, вакцинированных против брюшного тифа и парати-фов, также наблюдается положительная реакция Видаля, причем в довольно высоком титре, поэтому "инфекционный Ви-даль" удается отличить от "прививочного" только по нарастанию титра агглютининов у больных в процессе заболевания. Реакцию Видаля ставят в четырех рядах пробирок по 7 пробирок в каждом ряду, из которых 5 опытных и 2 контрольные. Для контроля каждого диагностикума в пробирки вносят по 1 мл изотонического раствора хлорида натрия, в который добавляют 2 капли диагностикума. В контрольной пробирке с 1 мл сыворотки (без диагностикума) не должно быть хлопьев. При спонтанной агглютинации реакция не учитывается. Диагностический титр реакции Видаля равен 1:200. Для серологического исследования реконвалесцентов и выявления бактерионосителей широко используют реакцию непрямой К/'-гемаг-глютинации, с помощью которой в сыворотке крови людей определяют присутствие антител к К/-антигену. В качестве антигена используют эритроцитарный И-диагностикум, представляющий собой взвесь эритроцитов человека 1(0) группы, обработанных формалином и сенсибилизированных И-антиге-ном S.enterica биовара typhi. Готовят разведения испытуемой сыворотки от 1:10 до 1:1280. При положительной реакции эритроциты покрывают дно пробирки в виде диска с зазубренными краями, а надосадочная жидкость остается прозрачной. При отрицательной реакции, так же как и в контроле, эритроциты осаждаются на дно пробирки и имеют вид диска с ровными краями ("пуговки"). Диагностическое значение имеет титр пассивной К/-гемагглютинации, начиная с 1:40 и выше. Всех лиц, сыворотка крови у которых дает положительный результат в РИГА с эритроцитарным К/-диагностикумом, рассматривают как подозрительных на носительство S.enterica биовара typhi и подвергают многократному бактериологическому обследованию.
• Микробиологическая диагностика сальмонеллезов
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, при генерализованной форме — кровь.
МЕТОДЫ ДИАГНОСТИКИ: микробиологическая диагностика сальмонеллезов принципиально не отличается от диагностики брюшного тифа и паратифов. Серодиагностика не применяется по причине большого числа сероваров возбудителей.
• Микробиологическая диагностика кишечного иерсиниоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, при генерализованной форме — кровь, моча, спинномозговая жидкость.
МЕТОДЫ ДИАГНОСТИКИ:
Бактериологическое исследование. Посев материала на дифференциально-диагностические (среда Эндо, Мак-Конки, СБТС-агар с желчью и бромтимоловым синим) и селективные (CIN-агар с антибиотиками цефсулодином и новобиоцином) плотные среды или жидкие среды обогащения (буферно-казе-иново-дрожжевой бульон, 1 %, пептонная вода с рН 7,6—7,8). Посевы инкубируют при 25 "С в течение 24—48 ч. Идентификация чистой культуры осуществляется на основании морфологии, подвижности, тинкториальных свойств (грамотрицательные палочки с закругленными концами и характерным биполярным окрашиванием, неспорообразующие, перитрихи), культуральных, биохимических признаков.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика. Диагностическое значение имеет обнаружение антител к поверхностным антигенам возбудителей наиболее распространенных серотипов (ОЗ, О4, О5, Об, О8, О9) в РА. Положительной считается РА в титре не менее 1:160. Разработаны также ИФА-тесты.
• Микробиологическая диагностика кишечного дисбактериоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: фекалии. МЕТОДЫ ДИАГНОСТИКИ:
Бактериоскопическое исследование. Имеет ориентировочное значение. При резко выраженном дисбактериозе в мазках преобладают микроорганизмы определенных видов (например, дрожжеподобные грибы, стафилококки и др.) на фоне существенного уменьшения грамотрицательной микрофлоры.
Бактериологическое исследование. Проводится количественное исследование состава микрофлоры кишечника. Для этого из исследуемого материала готовят разведения 102, 104, 10^ и т.д. Первичные посевы по 0,1 мл каждого разведения производят параллельно на несколько питательных сред (Эндо, кровяной агар, ЖСА, агар Сабуро и др.) и инкубируют при 37 °С. Подсчитывают число выросших колоний и определяют число КОЕ в 1 г материала. Проводят отсев 2—3 колоний каждого вида для выделения и идентификации чистых культур микроорганизмов.
Для обнаружения анаэробных Bifidobacterium spp, делают мерные посевы материала в разведениях 107 и выше в пробирки с 13—15 мл модифицированной среды Блаурокка, в состав которой входит печеночный бульон, пептон — 1 %, лактоза — 1 %, хлорид натрия — 0,5 %, цистин — 0,01 %, агар-агар — 0,75%, твин-80 — 0,1 %. При росте Bifidobacterium spp. через 24—48 ч происходит помутнение всей среды с образованием тяжей или отдельных колоний. Готовят мазки и окрашивают по методу Грама. Выделение чистых культур Bifidobacterium spp. является весьма трудоемким и практически необязательным. При необходимости идентификацию представителей рода осуществляют по биохимическим свойствам.
Для оценки результатов бактериологического исследования
| Микроорганизмы Норма Патогенные микробы сем. Enterobacteriaceae 0 Общее количество E.coli, млн/г 300—400 E.coli со слабовыраженными ферментативными свойствами, % До 10 E.coli с гемолитическими свойствами, % Нет Энтеробактерии (лактозоотрицательные и лактозополо-жительные): Hafhia, Aerobacter, Citrobacter, Klebsiella, Serratia, % До 5 Кокковые формы, % До 25 Гемолитический стафилококк по отношению ко всем кокковым формам, % Нет Bifidobacterium spp. (рост при посеве разведения) 10 и выше Бактерии рода Proteus Нет Грибы рода Candida Нет |
Получают так же, как и другие диагностические сыворотки. Применяют для серотипирования сальмонелл в реакции агглютинации.
Сальмонеллезные О- и Н-монодиагностикумы. Представляют собой взвеси сальмонелл, убитых нагреванием (О-диагностику-мы) или обработкой формалином (Н-диагностикумы). Применяют для серодиагностики брюшного тифа в реакции Видаля.
Типовые сальмонеллезные бактериофаги. Применяют для фа-готипирования сальмонелл.
Брюшнотифозная моновакцинд и брюшнотифозная спиртовая вакцина, обогащенная Vi-антигеном. Применяют для специфической активной профилактики брюшного тифа.
Поливалентный брюшнотифозный бактериофаг. Выпускается в виде таблеток с кислотоустойчивым покрытием. Применяют для экстренной профилактики брюшного тифа.
Коли-бактерин. Содержит лиофильно высушенные живые клетки E.coli штамма М17, обладающего выраженными антагонистическими свойствами в отношении ряда патогенных кишечных бактерий. Применяют для нормализации кишечной микрофлоры при дисбактериозе и лечении дизентерии, главным образом у детей.
Бифидумбактерин. Содержит лиофильно высушенную взвесь живых клеток B.bifidum. Применяют для лечения хронических кишечных инфекций невыясненной этиологии у детей и дизентерии.
Бификол. Содержит смесь высушенных живых бактерий E.coli штамма М17 и B.bifidum. Показания к применению те же.
Лактобактерин. Содержит продукты жизнедеятельности лак-тобактерий. Выпускается в таблетированном виде. Применяют для лечения дисбактериозов у детей.
Антибиотики: сульфаниламиды, полусинтетические пени-циллины, цефалоспорины 2—4-го поколения, хлорамфеникол, тетрациклины, фторхинолоны, полимиксин.
Тема 13.3. ВОЗБУДИТЕЛИ ПИЩЕВЫХ
ТОКСИКОИНФЕКЦИЙ, ИНТОКСИКАЦИЙ, ХОЛЕРЫ
И ДРУГИХ БАКТЕРИАЛЬНЫХ КИШЕЧНЫХ ИНФЕКЦИЙ
План
Программа
Биологические свойства возбудителей холеры, пищевых токсикоинфекций и интоксикаций. Их патогенность, экология, особенности инфекции и эпидемиология вызываемых заболеваний.
Лабораторная диагностика.
Диагностические, профилактические и лечебные препараты.
Демонстрация
Мазки из чистых культур возбудителей пищевых интоксикаций кишечных инфекций: Staphylococcus aureus, Clostridium perfringens, Vibrio cholerae. Окраска по методу Грама.
Диагностические и лечебно-профилактические препараты.
Задание студентам
Микроскопировать и зарисовать мазки из чистых культур возбудителей кишечных инфекций.
Бактериологическая диагностика холеры.
Указать материал для исследования.
Идентификация чистой культуры вибрионов, выделенных от больного:
изучить морфологические и тинкториальные свойства: микроскопировать мазок из чистой
культуры, выделенной от больного;
изучить антигенные свойства: отметить результаты развернутой реакции агглютинации с диагностической 01-сывороткой;
изучить биохимические свойства: отметить результат гексаминового теста;
определить чувствительность выделенной культуры к диагностическим бактериофагам;
отметить способность к росту на среде с полимиксином;
дать заключение.
3. Диагностика ботулизма:
указать материал для исследования;
проанализировать результаты РИГА для обнаружения ботулотоксина в сыворотке крови больного
(реакция Бойдена). Дать заключение.
4. Ознакомиться с диагностическими и лечебно-профилактическими препаратами.
Методические указания
• МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА ПИЩЕВЫХ ТОКСИКОИНФЕКЦИЙ БАКТЕРИАЛЬНОЙ ПРИРОДЫ
• Микробиологическая диагностика пищевых токсикоинфек-иий, вызванных Escherichia spp., Salmonella spp., Proteus spp,
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: фекалии, рвотные массы, промывные воды желудка больного, остатки пищевых продуктов — возможные источники и факторы передачи инфекции.
МЕТОДЫ ДИАГНОСТИКИ:
Бактериологическое исследование. Производят путем посева
материала на дифференциально-диагностические и элективные среды (Эндо, висмут-сульфит агар и др.) для выделения чистой культуры сальмонелл и эшерихии, а также в конденсационную воду в пробирке со скошенным питательным агаром для выявления бактерий рода Proteus. После инкубации посевов при 37 °С в течение 20—24 ч отмечают цвет колоний на чашках с дифференциальной средой и наличие "ползучего" роста, характерного для Proteus spp., в пробирке со скошенным питательным агаром. Подозрительные колонии пересевают на скошенный питательный агар для получения чистых культур и одновременно ставят с ними ориентировочную реакцию агглютинации на стекле, используя смеси диагностических сывороток. На следующий день с чистой культурой ставят развернутую реакцию агглютинации с соответствующей монорецеп-торной сывороткой и делают посев на среды "пестрого" ряда. При выделении одного и того же серовара сальмонелл или эшерихии из организма больных людей и пищевого продукта делают окончательное заключение об этиологии пищевой ток-сикоинфекции — источнике заболевания. При наличии "ползучего" роста на скошенном питательном агаре из конденсационной воды петлей берут материал для приготовления препарата "висячая" капля с целью установления подвижности и для мазка, который окрашивают по методу Грама и микроско-пируют. Затем выделяют чистую культуру, определяют биохимические и другие признаки и устанавливают вид: P.vulgaris, P.mirabilis, P.morganii и P.rettgeri.
Оценка роли условно-патогенных микроорганизмов в этиологии пищевых токсикоинфекций должна быть строго аргументирована: а) бактериологическим, серологическим, эпидемиологическим и клиническим исключением сальмонеллезов, дизентерии, холеры; б) выделением идентичных штаммов условно-патогенных бактерий из рвотных масс, промывных вод желудка, испражнений, продуктов.
• МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА ПИЩЕВЫХ ИНТОКСИКАЦИЙ БАКТЕРИАЛЬНОЙ ПРИРОДЫ
• Микробиологическая диагностика стафилококковых пищевых интоксикаций
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: рвотные массы, промывные воды желудка, подозрительные пищевые продукты.
МЕТОДЫ ДИАГНОСТИКИ:
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Диагностика основана на обнаружении энтеротоксина в исследуемом материале. Энтеро-токсин Staphylococcm spp. экстрагируют изотоническим раствором хлорида натрия, затем определяют его присутствие и серологическую специфичность реакцией преципитации в геле с иммунными антитоксическими сыворотками А, В, С. Техника постановки реакции описана выше (см. рис. 10.1.6). Используют также латекс-агглютинацию, ИФА, РИА и др.
Бактериологическое исследование. С целью выделения чистой культуры стафилококка исследуемый материал, который может содержать жизнеспособные бактерии, засевают в чашки с ЖСА. Полученные по схеме (см. тему 12.1) чистые культуры проверяют на способность продуцировать энтеротоксины. Для эпидемиологического анализа массовых стафилококковых интоксикаций проводят фаготипирование выделенных культур с помощью набора стафилококковых фагов.
Биопроба. Для обнаружения энтеротоксина можно использовать биопробу — скормить изучаемый материал котятам-сосункам, у которых стафилококковый энтеротоксин вызывает рвоту и понос через 30—60 мин после скармливания.
• Микробиологическая диагностика пищевых интоксикаций,
вызванных C.perfringens типа А
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: подозрительные пищевые продукты (мясные, рыбные и др.), испражнения, рвотные массы, промывные воды желудка.
МЕТОДЫ ДИАГНОСТИКИ:
Бактериологическое исследование. Поскольку энтеротоксин C.perfringens типа А выделяется в процессе спорообразования в кишечнике больного и быстро разрушается, обнаружить его в продуктах или материале от больного практически не удается. Основным методом диагностики является бактериологический. Выделение чистой культуры производят стандартным методом (см. тему 12.2). Диагностическое значение имеет обнаружение большого количества бактерий в материале от больного и подозрительном продукте.
• Микробиологическая диагностика ботулизма
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: сыворотка крови, моча, испражнения, промывные воды желудка, остатки пищи или подозреваемые продукты (колбасы, мясные, рыбные, фруктовые, овощные консервы и др.).
МЕТОДЫ ДИАГНОСТИКИ:
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Диагностика основана на обнаружении ботулотоксина в исследуемом материале. С этой целью ставят реакцию Бойдена — РИГА с эритроцитами, нагруженными моновалентными антитоксическими противобо-тулиническими сыворотками типов А, В, Е. В качестве контроля используют нормальную сыворотку крови. Для выявления ботулотоксина могут быть использованы также ИФА и другие чувствительные серологические реакции.
Биопроба. Для обнаружения ботулотоксина в пищевых продуктах и определения токсигенности C.botulinum можно провести реакцию нейтрализации токсина на белых мышах. Для определения серотипа токсина реакцию ставят с моновалентными сыворотками типов А, В, Е. При нейтрализации токсина гемолитической антитоксической сывороткой мыши остаются живыми.
• Микробиологическая диагностика пищевых интоксикаций, вызванных бактериями рода Bacillus
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: рвотные массы, промывные воды желудка, фекалии, подозрительные пищевые продукты.
МЕТОДЫ ДИАГНОСТИКИ:
Бактериологическое исследование. Материал засевают на кровяной агар или селективные среды с лецитином и поли-миксином. При исследовании материала, содержащего постороннюю микрофлору (фекалии), образцы предварительно обрабатывают нагреванием при 63 °С в течение 15 мин или 50 % этиловым спиртом (45—60 мин) для уничтожения вегетативных форм бактерий. Споры возбудителя при этом сохраняются. Идентификацию выделенной чистой культуры производят по морфологии, наличию и расположению спор, тинкториальным свойствам и биохимическим признакам. Для эпидемиологического анализа осуществляется серотипирование по жгутиковому антигену (существует более 40 серотипов).
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Токсины Bacillus cereus могут быть обнаружены во всех вышеназванных видах материала, включая фекалии, с помощью серологических реакций (ИФА, РИА, иммунопреципитации и др.).
Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
• МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА ХОЛЕРЫ
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения больного, рвотные массы, вода, пищевые продукты; при постмор-тальной диагностике: отрезки тонкой кишки и желчный пузырь с частью печени. При необходимости хранения материал помещают в транспортную среду (буферный солевой раствор с глицерином). Для длительного сохранения рекомендуется полоску фильтровальной бумаги, смоченную в жидких испражнениях, поместить в герметически закрытый пластиковый контейнер — для предохранения от высыхания. Таким образом возбудитель сохраняется в материале до 5 нед.
МЕТОДЫ ДИАГНОСТИКИ:
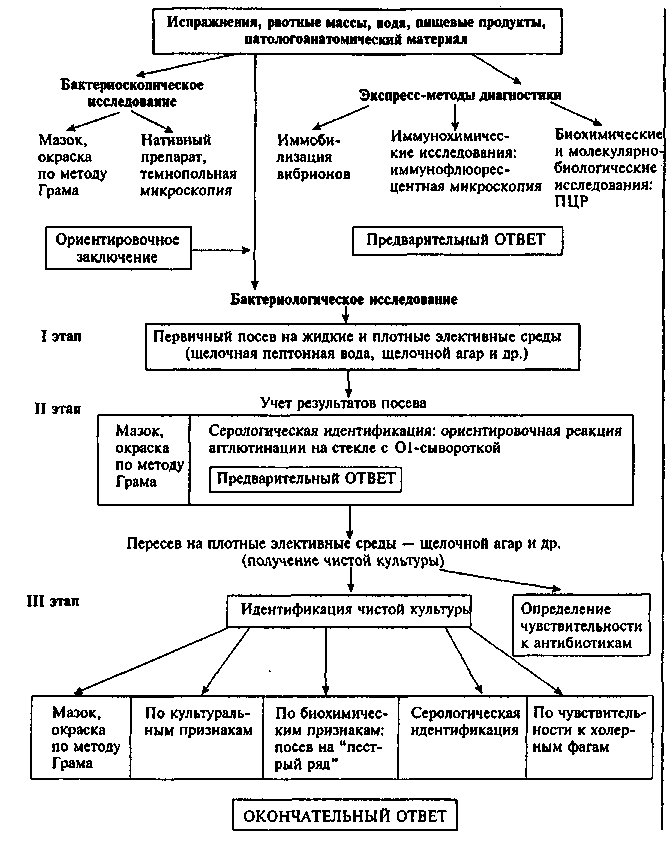
Бактериоскопическое исследование. Из исследуемого материала готовят мазки, окрашивают их по методу Грама и водным фуксином. Кроме того, из нативного материала готовят препарат "висячая" капля, в котором определяют наличие подвижных вибрионов при темнопольной или фазово-контраст-ной микроскопии. Обнаружение в мазках большого количества грамотрицательных, слегка изогнутых палочек (длиной от 1,5 до 3 мкм) и активно-подвижных вибрионов в препарате "висячая" капля позволяет дать первый предварительный положительный ответ (рис. 13.3.1; на вклейке).
Бактериологическое исследование. Материал засевают в различные жидкие и плотные элективные среды, в частности во флаконы со щелочной пептонной водой (1 % с теллуритом) и на чашки со щелочным питательным агаром. Посевы на пептонной воде инкубируют при 37 °С в течение 5—6 ч, на чашках — 10—12 ч. Из голубоватой пленки, образующейся на пептонной воде, или из ее поверхностного слоя делают мазки и препараты "раздавленная" и "висячая" капля. Этот же материал используют для постановки реакции агглютинации на стекле со специфической противохолерной 01-сывороткой. Часть пептонной воды переносят в другую пробирку для постановки нитрозоиндоловой пробы. Для этого добавляют туда же несколько капель серной кислоты. В положительном случае появляется розовое окрашивание вследствие образования нитрозоиндола под влиянием холерного вибриона. Независимо от результатов исследования делают пересев на вторую пептон-ную воду. Наличие грамотрицательных вибрионов, агглютинирующихся 01-сывороткой, позволяет дать второй предварительный ответ. Независимо от полученных результатов продолжают исследование, как показано на схеме 13.3.1.
Выделение чистой культуры и ее идентификацию проводят по 5—6 однотипным колониям, выросшим на щелочном агаре. Для ускорения хода анализа ставят развернутую реакцию агглютинации с бактериальной суспензией, приготовленной из колоний. Для этого агглютинирующую 01-сыворотку разводят в пробирках до титра пептонной водой (в объеме 0,5 мл). Затем в каждую пробирку вносят 1—2 капли суспензии бактерий. Результат реакции агглютинации учитывают после 3—4-часовой инкубации при 37 °С.
Идентификацию культуры проводят на основании опреде-
| Тест V.choterae V.cholerae Неагглюти-asiatici el-tor нирующиеся вибрионы Агглютинация О-сывороткой + + — Агглютинация типовыми сы- + + — воротками Огава и Инаба Лизис фагами: холерный фаг С (фаг IV) + + фаг Эль-Тор II — + + Агглютинация куриных эрит- — + + роцитов Гемолиз эритроцитов барана — + + Рост на агаре с 50 ЕД поли- — + + миксина Гексаминовый тест — + + Реакция Фогеса— Проскауэра — + + (образование ацетил метил -карбинола) |
кой, типовыми сыворотками Огава и Инаба или типовыми холерными фагами. Готовят из них препараты "раздавленная" капля, которые исследуют с помощью темнопольной и фазо-во-контрастной микроскопии. В положительном случае через 3—5 мин движение вибрионов прекращается.
Иммунохимические исследования. Применяют метод прямой ИФ. Мазки из исследуемого материала обрабатывают флюоресцирующей противохолерной сывороткой и исследуют в люминесцентном микроскопе. Положительным результатом считается обнаружение в препарате даже единичных вибрионов с ярким желто-зеленым свечением в виде блестящего ободка по периферии клетки. Положительный результат можно получить через 1—2 ч после начала исследования при концентрации вибрионов не менее 106 клеток в 1 мл, поэтому рекомендуется предварительное подращивание материала на питательных средах.
Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика. Выявление антител к возбудителю является вспомогательным и применяется для ретроспективной диагностики холеры, выявления вибрионосителей и оценки напряженности постинфекционного и поствакцинального иммунитета. Для этого обычно ставят реакцию агглютинации или РИГА, диагностический титр антител в этих реакциях 1:80—1:320, а также определяют вибриоцидные антитела в реакции лизиса.
• Диагностика носителъства
Во время вспышки холеры проводят массовое обследование на носительство V.cholerae.
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: ректальные мазки (фекалии, взятые тампоном из прямой кишки).
МЕТОДЫ ДИАГНОСТИКИ:
Бактериологическое исследование. Посев материала от 10 обследуемых на обогатительную среду с 01-агглютинирующей диагностической сывороткой. В положительных случаях через 3—4 ч начинается выпадение хлопьев в результате агглютинации размножившихся вибрионов. При обнаружении в осадке грамотрицательных подвижных вибрионов каждый из 10 пациентов обследуется индивидуально.
• МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА КИШЕЧНЫХ ИНФЕКЦИЙ, ВЫЗВАННЫХ БАКТЕРИЯМИ РОДА VIBRIO
Возбудители: V.cholerae не О1 (серовары О4, Об и др.), V.mimicm, V.parahaemolyticus, V.fluvialis и др.
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: фекалии, рвотные массы, ректальные мазки.
МЕТОДЫ ДИАГНОСТИКИ:
Бактериоскопическое исследование. Изучение нативных мазков ("висячая" или "раздавленная" капля) методом темнополь-ной или фазово-контрастной микроскопии и фиксированных препаратов, окрашенных по методу Грама. Предварительный диагноз ставится на основании обнаружения подвижных грам-отрицательных вибрионов при исключении холеры с помощью экспресс-методов (отрицательная реакция иммобилизации и иммунофлюоресценции с 01-специфической сывороткой). Метод имеет ориентировочное значение, поскольку не позволяет дифференцировать между собой различных представителей семейства Vibrionaceae.
Бактериологическое исследование. Посев материала на основные (кровяной агар), а также на элективные и дифференциально-диагностические среды для вибрионов. Возбудители дифференцируют по культуральным, антигенным и биохимическим признакам.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
• МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА КИШЕЧНЫХ ИНФЕКЦИЙ, ВЫЗВАННЫХ БАКТЕРИЯМИ РОДА AERO-MONAS
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: фекалии, рвотные массы, ректальные мазки.
МЕТОДЫ ДИАГНОСТИКИ:
Бактериоскопическое исследование. См. раздел "Микробиологическая диагностика кишечных инфекций, вызванных бактериями рода Vibrio".
Бактериологическое исследование. Посев материала на щелочную пептонную воду и селективную среду — агар с добавлением антибиотиков (ампициллина, новобиоцина и др.). При росте на кровяных средах характерен бета-гемолиз. Идентификацию чистой культуры производят на основании культураль-ных, биохимических признаков, серотипирования, фаготипи-рования, используют также молекулярно-биологические методы идентификации (риботипирование и др.).
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
• МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА КИШЕЧНЫХ ИНФЕКЦИЙ, ВЫЗВАННЫХ БАКТЕРИЯМИ РОДА PLESIOMONAS
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: фекалии, рвотные массы, ректальные мазки.
МЕТОДЫ ДИАГНОСТИКИ:
Бактериоскопическое исследование. См. раздел "Микробиологическая диагностика кишечных инфекций, вызванных бактериями рода Vibrio".
Бактериологическое исследование. Посев материала на щелочную пептонную воду, кровяной агар (гемолиз нехарактерен) и селективную среду — агар с добавлением инозитола, желчных кислот и бриллиантового зеленого. Идентификацию чистой культуры производят на основании культуральных, биохимических признаков, серотипирования по О- и Н-антигенам (необходимо помнить, что P.shigelloides имеет перекрестные антигены с S.sonnei и может давать положительную РА с соответствующими диагностическими сыворотками). Используют также молекулярно-биологические методы идентификации (риботипирование и др.).
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
• ДИАГНОСТИЧЕСКИЕ, ПРОФИЛАКТИЧЕСКИЕ И ЛЕЧЕБНЫЕ ПРЕПАРАТЫ
Стафилококковые бактериофаги (международный набор). Применяют для фаготипирования стафилококков с целью эпидемиологического анализа пищевой интоксикации.
Противоботулинические сыворотки. Получены из крови лошадей, гипериммунизированных ботулиническими анатоксинами. Очищены и концентрированы методом диаферм-3. Для лечебно-профилактических целей готовят Противоботулинические сыворотки четырех типов: А, В, Е, F. Моновалентные сыворотки перечисленных типов используют в диагностических целях для определения серотипа токсина в исследуемом материале.
Ботулинический трианатоксин адсорбированный очищенный.
Экзотоксины C.botulinum (серотипы А, В и Е) обезвреживают формалином при нагревании, а затем очищают от балластных веществ, концентрируют и адсорбируют на гидрате оксида алюминия. Применяют для проведения плановой активной иммунизации против ботулизма юношей допризывного возраста (16 лет).
Противохолерная агглютинирующая О-сыворотка, типовые сыворотки Огава и Инаба. Получены из крови кроликов, иммунизированных холерными вибрионами. Применяют для серологической идентификации и типирования холерных вибрионов в реакции агглютинации.
Холерные фаги. Типовые холерные фаги применяют для идентификации и типирования холерных вибрионов. Поливалентный холерный бактериофаг используют для лечебно-профилактических целей.
Холерная вакцина. Взвесь убитых холерных вибрионов применяют для активной иммунизации против холеры. Готовится из чистых культур V.cholerae O1 биоваров El-tor и asiatici cepo-типов Инаба и Огава.
Холероген-анатоксин. Обезвреженный холерный токсин. Применяют для специфической профилактики холеры (создание активного специфического антитоксического иммунитета).
Антибиотики. Могут быть использованы все препараты, действующие на соответствующие бактерии. Вместе с тем надо учитывать, что среди возбудителей достаточно широко распространены устойчивые варианты. Для большинства грамотрица-тельных возбудителей кишечных инфекций широко используют тетрациклины, ампициллин, цефалоспорины 2—4-го поколений, хлорамфеникол, фторхинолоны.
