Тец руководство. Руководство к практаческим занятиям по медицинской микробиологии, вирусологии и иммунологии под редакцией
 Скачать 2.14 Mb. Скачать 2.14 Mb.
|
|
Тема 8.3. МИКРОФЛОРА ОРГАНИЗМА ЧЕЛОВЕКА План Программа Особенности и основные понятия экологии микроорганизмов. Качественные и количественные методы изучения состава микрофлоры отдельных биотопов. Значение нормальной микрофлоры в жизни человека. Микробиологическое исследование при дисбактериозе. а Демонстрация Окрашенные мазки, приготовление из чистых культур бактерий, представителей облигатной микрофлоры человека. Рост на скошенном агаре E.coli, Proteus vulgaris, Staphylococcus epidermidis. Микрофлора зубного налета. Задание студентам 1. Приготовить мазки из зубного налета, микроскопиро-вать и зарисовать; сделать заключение.  кровяной агар, для выделения E.coli— на среду Эндо, для выделения дрожжеподобных грибов рода Candida — на среду Са-буро. Посевы производят таким образом, чтобы получить сосчитываемое количество колоний. Такие исследования повторяют через определенные сроки, чтобы сделать заключение о количественных изменениях состава микрофлоры в динамике заболевания (табл. 8.3.1). Таблица 8.3.1. Состав нормальной, резидентной микрофлоры биотопов организма человека Микрофлора биотопа Ориентировочное содержание микробов Кровь, лимфа, внутренние органы, головной и спинной мозг, спинномозговая жидкость г—сравнительно часто встречаются: i Vaphylococcus epidermidis \saprophyticus (+) А пеЬас1епит spp. (+) А rtococcus spp. (+) А Г/Ля fo. (+) А зрр. А mas aeruginosa (-) А 1ечный тракт ^благоприятные условия для йикрофлоры: ъиз salivarius, mitis, S. mutatis, S.sanguis (+) A Lactobacillus spp. (+) ah Bifidobacterium spp. (+) ah Leptotrichia buccalis (—) Veilonella spp. (—) ah Bacteroides spp. (-) ah Candida spp. A Treponema skoliodontum, T.denticola (—) A Neissena spp. (-) A Mycoplasma spp. A Staphylococcus spp. (+) A Желудок — многие микроорганизмы погибают при кислом значении рН, встречаются: Sarcina ventriculi (+) А Lactobacillus spp. (+) А Candida spp. A Тонкая кишка — в верхних отделах кишки микрофлора представлена скудно в связи с активностью ферментов. Число микроорганизмов постепенно нарастает в илеоцекальном отделе В норме не содержат микробов и являются стерильными 102-104 на 1 см3 108 в 1 мл слюны Не более 103 в 1 мл содержимого Около 105 в 1 мл содержимого Продолжение Микрофлора биотопа Ориентировочное содержание микробов Толстая кишка — благоприятные условия для 1010 в 1 г фекалий разнообразной микрофлоры, выделяются с фекалиями: Анаэробы (в совокупности) Bacteroides spp. (—) Bifidobacterium spp. (+) Lactobacillus spp. (+) Clostridium spp. (+) Veilonella spp. (—) Аэробы E.coli и др. энтеробактерии (—) Streptococcus faecalis (+) Bacillus spp. (+) Конъюнктива глаза — очень часто микроорганизмы полностью отсутствуют, могут встречаться: Staphylococcus epidermidis (+) А Corynebacterium spp. (+) А Уши (наружный слуховой проход) — факультативно встречаются: Staphylococcus epidermidis (+) А Corynebacterium spp. (+) А Candida spp. A Дыхательная система (верхние дыхательные пути) Staphylococcus saprophyticus (+) А Streptococcus spp. (+) А Klebsiella spp. (—) A Neisseria catarralis (-) A Candida spp. и др. Мелкие бронхи, альвеолы и паренхима легких обычно не содержат микробов Мочеполовая система Число микробов в совокупности составляет 1010 в 1 мл влагалищного секрета. Соотношение анаэробов к аэробам 10:1 Стерильна Женские половые органы (влагалище и шейка матки) Lactobacillus spp. (+) ан Corynebacterium spp. (+)Ан Peptococcus spp. Полость матки — Мужские половые органы Mycobacterium smegmatis (+) А Corynebacterium spp. (+) А Staphylococcus epidermidis (+) A и др.
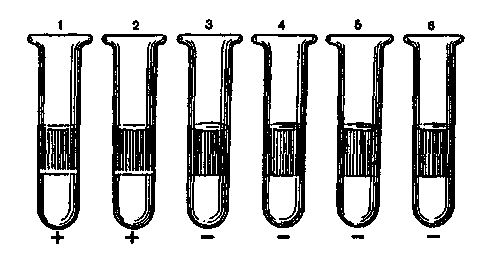
Бактериологическое исследование трупов павших животных. Методы изучения факторов вирулентности бактерий: а) изучение взаимодействия лиганд-рецепторного аппарата; б) определение токсигенности микробов; в) определение ферментов патогенности. 5. Особенности вирусных инфекций. а Демонстрация Капсула патогенных бактерий; окраска по методу Бурри—Гинса. Корд-фактор Mycobacterium tuberculosis (метод Прайса); окраска по методу Циля—Нильсена. а Задание студентам Зарисовать демонстрируемые препараты: а) капсулу патогенных бактерий; б) корд-фактор М.tuberculosis. Микроскопировать и зарисовать окрашенные метиленовым синим мазки-отпечатки из органов белой мыши, павшей после заражения культурой патогенных бактерий. Определить присутствие бактерий во внутренних органах и тканях. Сделать заключение о форме инфекции и возможных причинах гибели животного. Микроскопировать мазок со слизистой оболочки, окрашенный по методу Романовского—Гимзы. Найти и зарисовать "ключевые" клетки, покрытые адгезированными бактериями. Микроскопировать и зарисовать мазок, демонстрирующий явление незавершенного фагоцитоза гонококков; окраска по методу Грама. Учесть результаты опытов, поставленных с целью выявления факторов вирулентности стафилококков: гемолизина, лецитиназы, плазмокоагулазы. Определить гемолитическую активность бактериального экзотоксина (О-стрептолизина). а Методические указания Бактериоскопические методы выявления факторов вирулентности. Обнаружение капсулы у стрептококков (см. тему 2.2). Выявление корд-фактора микобактерий. При выращивании микобактерий на предметных стеклах, погруженных в жидкую среду на основе цитратной крови, вирулентные штаммы вырастают в виде переплетающихся тяжей — корд-фактор. Для их обнаружения стекла окрашивают по методу Циля—Нильсена (см. рис. 14.3.2). Выявление адгезии бактерий. При некоторых инфекциях бактерии в большом количестве прикрепляются к мембране эпителиальных клеток. Обнаружить это явление можно с помощью микроскопических методов в мазках со слизистой оболочки пораженного органа, окрашенных по методу Романовского— Гимзы. Такие клетки получили название ключевых. Выявление незавершенного фагоцитоза (см. рис. 15.2.1). При микроскопии наблюдается большое количество неразрушенных микроорганизмов, расположенных внутри профессиональных фагоцитов. Определение экзоферментов и экзотоксинов — факторов па-тогенности. Гиалуронидаза гидролизует гиалуроновую кислоту, которая перестает образовывать сгусток при добавлении уксусной кислоты. Для определения этого фермента в пробирку с субстратом (гиалуроновой кислотой) вносят суточную культуру бактерий или фильтрат бульонной культуры и инкубируют в течение 15 мин при 37 °С. Затем добавляют 2—3 капли концентрированной уксусной кислоты. В пробах, где содержится гиалуронидаза, не происходит образования сгустка. Плазмокоагулаза выявляется при посеве испытуемой культуры в 0,4 мл стерильной цитратной плазмы крови. Посевы ингибируют при 37 °С в течение 2—5 ч. В случае выработки фермента происходит свертывание плазмы, а в контроле она остается жидкой. Гемолизин определяют путем посева испытуемой культуры "бляшками" в чашки Петри с кровяным агаром. Чашки инкубируют в термостате при 37 °С в течение суток. В положительном случае вокруг "бляшек" образуются прозрачные зоны гемолиза. Определение титра гемолитической активности бактериального экзотоксина (0-стрептолизина). Из фильтрата бульонной культуры р-гемолитического стрептококка готовят ряд двукратных серийных разведений. К каждому из них добавляют равный объем 5 % взвеси отмытых эритроцитов кролика. Смесь инкубируют в термостате при температуре 37 °С в течение 1 ч. Параллельно инкубируют контрольную взвесь эритроцитов в питательном бульоне того же состава. Учет результатов производят по наличию гемолиза (красная, прозрачная "лаковая" кровь) или отсутствию гемолиза (осадок эритроцитов). Определяют наибольшее разведение (титр) фильтрата бульонной культуры стрептококка, при котором еще наблюдается гемолиз. В дальнейшем этим разведением пользуются при определении рабочей дозы О-стрептолизина для постановки антистрептолизиновой реакции. Лецитиназа выявляется при посеве на агар с лецитином. Вокруг колоний бактерий, выделяющих фермент, образуется зона помутнения с перламутровым блеском. Лецитиназная проба: для быстрого обнаружения и серологической идентификации а-токсина клостридий — возбудителей газовой гангрены — в раневом отделяемом определяют его лецитиназную активность в реакции нейтрализации с антисыворотками против токсинов клостридий разных видов (см. табл. 12.2.2). С этой целью исследуемый материал (раневое отделяемое) помещают в пробирки с раствором лецитина и добавляют антисыворотки. Присутствие лецитиназы в раневом отделяемом проявляется помутнением жидкости в пробирке. При нейтрализации лецитиназной активности токсина соответствующей антисывороткой жидкость остается прозрачной. Цитотоксины. Для обнаружения некоторых бактериальных токсинов, оказывающих цитопатическое действие на клетки (ЦПД), используют клеточные культуры. Бактерии выращивают в бульоне. Затем питательную среду отделяют от микробов и вносят в культуру чувствительных клеток. В положительном случае после инкубации наблюдается характерное ЦПД. Бактериальные токсины различаются по характеру ЦПД, которое может проявляться изменением формы, размеров клетки, появлением вакуолей в цитоплазме, нарушением целостности клеточного монослоя и т.д. Методы определения вирулентности бактерий и активности бактериальных токсинов на экспериментальных животных Экспериментальное заражение животных. Инфекционный процесс может быть искусственно воспроизведен путем заражения лабораторных животных: кроликов, морских свинок, белых мышей, белых крыс и др. Это производится для изучения патогенности и вирулентности микроорганизмов, выделения чистой культуры возбудителя из различных материалов (метод биопробы), воспроизведения экспериментальной инфекции и других целей. Заражают животных накожно, внутрикожно, подкожно, внутримышечно, внутривенно, внутрибрюшинно, перорально, интраназально, интратрахеально и интрацеребрально. Все манипуляции осуществляют с помощью стерильных инструментов. Перед началом опыта животных отбирают, взвешивают и маркируют. Мышь берут за хвост, опускают на стол, туловище быстро прижимают к столу двумя пальцами и, скользя ими по спине, захватывают кожу над головой и фиксируют животное в левой руке в растянутом положении. Взвесь микроорганизмов определенной концентрации набирают в шприц через иглу. Шприц держат как писчее перо в правой руке. При подкожном заражении иглой прокалывают кожную складку на спине или у корня хвоста и медленно вводят содержимое шприца под кожу. Затем иглу быстро извлекают, прикрыв место инъекции ватой, смоченной спиртом. При внутрибрю-шинном заражении животное фиксируют головой вниз, чтобы кишечник переместился к диафрагме. В левой нижней трети живота делают прокол кожи, удерживая иглу под острым уг-  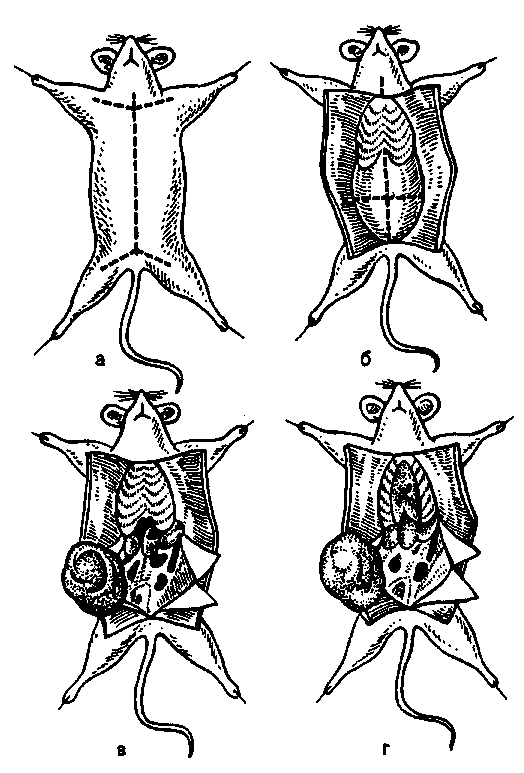 пипетки выдувают в пробирку со средой. Из ткани легких готовят мазки-отпечатки и делают посевы. Брюшную полость вскрывают продольным разрезом брюшины ножницами, не задевая кишечник. Осматривают органы брюшной полости, отмечая в протоколе наличие экссудата, величину, цвет и консистенцию печени, селезенки, надпочечников, брыжеечных лимфатических узлов. При необходимости делают посевы из этих органов на питательные среды. Для приготовления мазков-отпечатков вырезают из печени, селезенки, почек небольшие кусочки ткани, берут их пинцетом и прикасаются к предметному стеклу поверхностью разреза. Мазки-отпечатки фиксируют в жидком фиксаторе и окрашивают метиленовым синим. При микроскопии отмечают присутствие микроба-возбудителя в различных органах и тканях. Результаты посевов учитывают на следующий день после инкубации в термостате. Данные вскрытия трупа протоколируют. Труп животного после вскрытия подлежит уничтожению. Глава 10 ПРИКЛАДНАЯ ИММУНОЛОГИЯ Достижения современной фундаментальной иммунологии находят применение в области прикладной иммунологии, которая занимается вопросами иммунодиагностики, иммунотерапии, иммунопрофилактики и иммунокоррекции. Иммунодиагностика решает несколько разных диагностических задач: оценки иммунного статуса организма, выявления и идентификации специфических антигенов, выявления и количественного определения содержания специфических антител в сыворотке крови и других биологических жидкостях (серодиагностика), оценки эффективности клеточного и гуморального специфического иммунного ответа на конкретный антиген. Иммунотерапия включает применение иммунных сывороток или иммуноглобулинов, содержащих специфические антитела, с целью лечения или экстренной профилактики конкретного заболевания путем создания пассивного иммунитета, а именно — введения в организм готовых антител, способных нейтрализовать токсин или вирус и обеспечить специфическую защиту против возбудителя. Значительно реже с целью лечения хронических инфекций применяют препараты вакцин. Вакцины и анатоксины составляют арсенал иммунопрофилактики, которая преследует цель индуцировать в организме человека выработку собственного активного иммунитета против конкретного антигена, входящего в состав вакцины или анатоксина. При выявлении у больного какого-либо типа иммунопатологии с целью иммунокоррекции используют препараты: иммунодепрессанты или иммуностимуляторы. 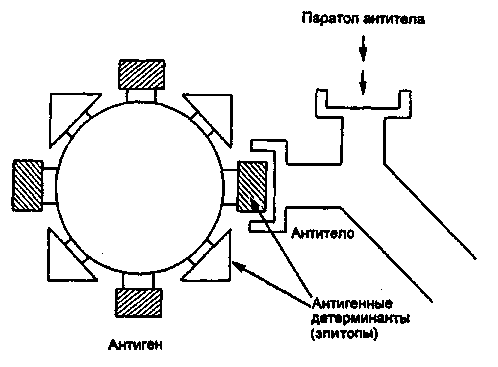 План Программа Методы выявления и идентификации специфических антигенов, основанные на реакциях непосредственного связывания антигена с антителами: иммунофлюоресцентный метод, радиоиммунный метод, иммуноферментный метод. Методы выявления и идентификации специфических антигенов, основанные на реакциях связывания антигена с антителами, проявляющихся изменением свойств антигена: реакция агглютинации, реакция преципитации, реакция иммобилизации, реакция нейтрализации. Демонстрация Иммунофлюоресцентный метод для индикации присутствия в исследуемом материале возбудителей: бактерий или вирусов. Наборы ингредиентов для иммуноферментного и радиоиммунного методов. Иммуноэлектрофореграммы. Задание студентам Поставить ориентировочную реакцию агглютинации на стекле с целью идентификации выделенной чистой культуры бактерий. Сделать заключение по результатам реакции. Протоколировать и оценить результаты РИГА, поставленной с целью выявления и идентификации бактериального экзотоксина в исследуемом материале. Сделать заключение по результатам реакции. Протоколировать и оценить результаты реакции преципитации в геле, поставленной с целью определения токсигенности возбудителя дифтерии. Сделать заключение по результатам реакции. Протоколировать и оценить результаты РТГА, поставленной с целью идентификации по гемагглютининам выделенного вируса гриппа. Сделать заключение по результатам реакции. Методические указания 1. Иммунофлюоресцентный анализ. Один из наиболее чувствительных методов выявления связывания антител с антигенами в клетках и тканях — Иммунофлюоресцентный анализ. Специальный флюоресцентный краситель (флюорохром) прикрепляется химической связью к молекуле специфического антитела, не нарушая его специфичности. Часто используют краситель изотиоцианат флюоресцеина, обладающий желто-зеленой флюоресценцией. Красители, выбранные для иммунофлюоресцентного метода, активируются светом одной длины волны (чаще — ультрафиолетовой части спектра), а сами испускают лучи другой длины волны (видимого спектра). В люминесцентном микроскопе используется в качестве источника света, возбуждающего люминесценцию, ртутная лампа с системой селективных фильтров, пропускающих в окуляр только свет флюоресцирующего красителя. Прикрепляя разные красители к разным антителам, можно одновременно выявлять несколько антигенов в одной клетке. Иммунофлюоресцентный метод является методом выбора для быстрого выявления и идентификации неизвестного микроорганизма в исследуемом материале, в связи с чем его называют методом экспресс-диагностики. Недостатком прямого иммунофлюоресцентного метода является необходимость приготовления широкого набора флюоресцирующих специфических антител против каждого из изучаемых антигенов. Поэтому чаще используют непрямой имму-нофлюоресцентный метод, при котором связанные с антигеном специфические антитела (немеченые) выявляются с помощью флюоресцирующих антииммуноглобулиновых антител против иммуноглобулинов того вида, которому принадлежат антиген-специфические антитела. Применяют и иммуногистохимический метод, при котором к специфическим антителам прикрепляется фермент (например, пероксидаза хрена), способный превратить бесцветный субстрат в окрашенные продукты его ферментативного разложения, видимые в обычный световой микроскоп. Для использования при электронной микроскопии антиген-специфические антитела можно метить частицами золота, локализация которых укажет на расположение соответствующего антигена. При прямом иммунофлюоресцентном методе Кунса специфические флюоресцирующие антитела образуют комплексы с микробными антигенами, которые светятся при люминесцентной микроскопии препаратов (рис. 10.1.2). Непрямой метод предусматривает использование одной универсальной флюоресцирующей сыворотки — антиглобули-новой, содержащей антитела против кроличьих глобулинов, поскольку диагностические антисыворотки получают путем иммунизации кроликов. При этом на образующемся комплексе (специфические антитела + исследуемый антиген) фиксируются флюоресцирующие антиглобулиновые антитела, обеспечивая его свечение при люминесцентной микроскопии (см. рис. 10.1.2). На предметном стекле готовят мазок из исследуемого материала, фиксируют на пламени и обрабатывают иммунной кроличьей сывороткой, содержащей антитела против антигенов возбудителя. Для образования комплекса антиген—антитело 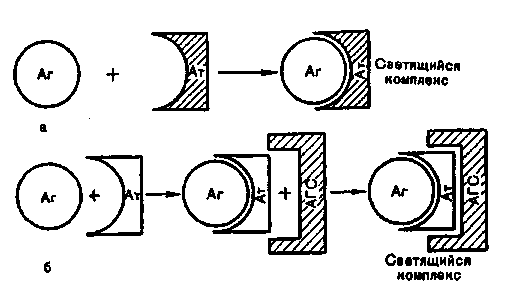 Повышение специфичности и чувствительности иммуно-ферментного анализа, так же как и иммунофлюоресцентного и радиоиммунного методов, связано с использованием моно-клональных антител (МКАТ). Для получения МКАТ мышей иммунизируют очищенным препаратом антигена, затем выделяют лимфоциты из селезенки и лимфатических узлов и проводят слияние их с миеломными клетками-партнерами. Неслившиеся миеломные клетки погибают, так как они дефектны по синтезу некоторых нуклеотидов и не могут выжить на селективной среде без этих нуклеотидов. Неслившиеся лимфоциты погибают в культуре из-за отсутствия в среде необходимых им трофических факторов. Выживают только гибридные клетки (гибридомы), унаследовавшие от ми-еломных клеток способность к пролиферации в культуре, а от лимфоцитов — способность к синтезу антител соответствующей специфичности. Надосадочную жидкость культур гибридом исследуют с помощью ИФА с соответствующим антигеном. После выявления клеток, секретирующих нужные антитела, их клонируют методом лимитирующих разведений, т.е. клетки разводят таким образом, чтобы получить дочернюю культуру из одной клетки. Тогда все потомство будет генетически идентично: одна клетка дает один клон, который продуцирует МКАТ. 3. Радиоиммунный анализ. Радиоиммунный анализ (РИА) является чрезвычайно чувствительным методом, который может быть использован для количественного определения любого антигена. Чувствительность метода позволяет выявлять незначительные количества антигена. Для проведения жидкостного радиоиммунного анализа очищенный известный антиген метят радионуклидами, чаще всего 1251. В этом случае используют конкурентный вариант связывания, когда для определения количества антигена в исследуемом образце оценивают его способность конкурировать с меченым референс-антигеном в связывании со специфическими антителами. Образующиеся комплексы антиген—антитело выделяют осаждением (сульфатом аммония или антиантителами) и определяют их радиоактивность в сопоставлении с радиоактивностью несвязанного антигена в надосадочной жидкости. Использование ряда концентраций немеченого антигена позволяет построить стандартную калибровочную кривую, с помощью которой определяется концентрация исследуемого антигена. Более современный метод — твердофазный РИА, при котором специфические антитела фиксируются на твердой фазе, к ним добавляется исследуемый антиген, а затем меченый стандартный антиген. Определение связанной и несвязанной метки позволяет построить калибровочную кривую и определить количество исследуемого антигена. РИА широко применяют для количественного определения различных веществ: гормонов (инсулина, гормона роста, адре-нокортикотропного гормона, трииодтиронина, тироксина, эстрогена), белков сыворотки крови (IgE, сс-фетопротеина и др.), метаболитов (фолиевой кислоты, циклических нуклеотидов и др.), лекарственных препаратов (дигоксина, дигитоксина, морфина), микробных антигенов (HBsAg). 4. Реакция агглютинации. В лабораторной диагностике инфекционных заболеваний реакцию агглютинации очень часто применяют для идентификации видов и сероваров (серотипирование) бактерий с помощью диагностических агглютинирующих сывороток. Реакция агглютинации (РА) на стекле (пластинчатая реакция агглютинации) ставится с одним разведением диагностической агглютинирующей сыворотки, которое в зависимости от ее титра составляет 1:10, 1:25, 1:50 или 1:100. Предметное стекло делят на квадраты восковым карандашом. В один квадрат наносят каплю изотонического раствора хлорида натрия, в другой — каплю сыворотки. Затем петлей в каждую каплю вносят небольшое количество бактериальной культуры и перемешивают круговыми движениями в каждой капле до получения равномерной взвеси. Стекло можно слегка подогреть, высоко держа над пламенем горелки в течение 2—4 мин. Реакция протекает быстро. Наблюдают за появлением зерен и хлопьев агглютината в каплях. Учет производят через 3—5 мин (рис. 10.1.3). Кроме специфической агглютинации бактерий, вызванной антителами, возможна спонтанная агглютинация (в отсутствие иммунной сыворотки). Спонтанную агглютинацию дают R-формы бактерий, не образующие гомогенной взвеси в изотоническом растворе хлорида натрия и осаждающиеся в виде клеточных агрегатов. При кислой реакции среды в результате снятия одноименного заряда с поверхности бактериальных клеток в изоэлектрической зоне также происходит склеивание — наступает "кислотная" агглютинация. Чтобы исключить возможность учета ложноположительных результатов спонтанной агглютинации, всегда ставят контрольную пробу с < изотоническим раствором хлорида натрия. 5. Реакция непрямой гемагглютинации. Реакция непрямой гемагглютинации (РИГА) отличается значительно более высокой чувствительностью и специфичностью, чем реакция агглютинации. Ее используют для идентификации возбудителя по его антигенной структуре или для индикации и идентификации бактериальных продуктов — токсинов — в исследуемом патологическом материале. Соответственно используют стандартные (коммерческие) эритроцитарные антительные диагностикумы, полученные путем адсорбции специфических антител на поверхности танизированных (обработанных танином) эритроцитов. В лунках пластмассовых пластин готовят последовательные разведения исследуемого материала. Затем в каждую лунку 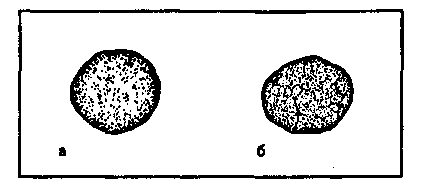
|
