Тец руководство. Руководство к практаческим занятиям по медицинской микробиологии, вирусологии и иммунологии под редакцией
 Скачать 2.14 Mb. Скачать 2.14 Mb.
|
|
Тема 14.2. ВОЗБУДИТЕЛИ МЕНИНГОКОККОВОЙ ИНФЕКЦИИ, КОКЛЮША И ДИФТЕРИИ План Программа 1. Биологические свойства возбудителей менингококко-вой инфекции, коклюша и дифтерии; их патоген- 220 ность, экология, особенности инфекции и эпидемиология вызываемых заболеваний. Микробиологическая диагностика. Диагностические, профилактические и лечебные препараты. а Демонстрация [.Приспособления и тампоны (простые, проволочные, сывороточные) для взятия материала из зева и носоглотки. 2. Мазки для микроскопии. Neisseria meningitidis — мазки из чистой культуры и спинномозговой жидкости, окраска по методу Грама и метиленовым синим. BordeteНа pertussis — мазок из чистой культуры, окраска по методу Грама. Corynebacterium diphtheriae: мазок из чистой культуры, окраска по методу Грама, метиленовым синим по Леффлеру, по Нейссеру; мазок из чистой культуры в люминесцентном микроскопе, окраска корифосфином. Культура N.meningitidis на сывороточном агаре. Обнаружение менингококкового антигена в спинномозговой жидкости в РИГА. Колонии В.pertussis на казеиноутольном агаре (КУА) и среде Борде—Жангу. Определение уреазной активности возбудителя паракоклюша. PC К для серодиагностики коклюша. Экспресс-диагностика коклюша с помощью иммунофлюоресцентного метода. Рост коринебактерий на свернутой сыворотке и теллуритовой среде. "Пестрые" ряды культур коринебактерий. Пробы на цистиназу и уреазу. Определение токсигенности C.diphtheriae (реакция преципитации в агаре). Ускоренный метод диагностики дифтерии. а Задание студентам Указать приспособления (виды тампонов) для взятия материала при менингококковой инфекции, коклюше и дифтерии. Микробиологическое исследование при менингококковой инфекции: указать материал, подлежащий исследованию; бактериоскопический метод: микроскопировать готовые мазки из спинномозговой жидкости и носоглотки, сделать заключение; бактериологическое исследование и иммунохимический метод; по результатам, полученным из лаборатории, сделать заключение. 3. Микробиологическое исследование при коклюше и паракоклюше: указать материал, подлежащий исследованию; бактериоскопический метод: микроскопировать готовые мазки из носоглотки. Сделать вывод и наметить план дальнейшего исследования; бактериологический метод: по результатам, полученным из лаборатории, сделать заключение. 4. Микробиологическое исследование при дифтерии: указать материал, подлежащий исследованию; бактериоскопический метод: микроскопировать мазки из материала, взятого из зева лиц с подозрением на дифтерию или бактерионосительство, сделать предварительное заключение и наметить ход дальнейшего исследования для подтверждения бактериоскопического диагноза; бактериологический метод: описать рост культуры, полученной на свернутой сыворотке, и колоний на теллуритовой среде, отметить результаты готовых посевов исследуемых культур на средах "пестрого" ряда, в случае обнаружения C.diphtheriae определить ее токсигенность. Сопоставить данные бактериоскопического и бактериологического исследований с целью идентификации выделенной культуры и поставить окончательный микробиологический диагноз. 5. Дать краткую характеристику диагностическим, профилактическим и лечебным препаратам. Методические указания • Микробиологическая диагностика метнгококковой инфекции МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: спинномозговая жидкость, кровь, мазки со слизистой оболочки верхних отделов носоглотки, аспират из высыпных элементов. При обследовании на носительство материал из верхних отделов носоглотки берут специальным носоглоточным тампоном (который на 3/4 Длины сгибают под углом 45°). При доставке в лабораторию его предохраняют от охлаждения и высушивания, поскольку менингококк очень чувствителен к воздействию этих факторов. Спинномозговую жидкость берут в количестве 2—5 мл и делят на две части: одну центрифугируют и исследуют осадок, к другой добавляют полужидкую питательную среду и выдерживают при 37 °С для накопления бактерий. Из исследуемого материала готовят мазки и производят посевы. МЕТОДЫ ДИАГНОСТИКИ: Бактериоскопическое исследование (схема 14.2.1). Мазки из осадка спинномозговой жидкости окрашивают по методу Гра-ма и микроскопируют. При наличии гноя в большинстве случаев обнаруживаются типичные грамотрицательные диплококки, имеющие характерное расположение внутри лейкоцитов, что позволяет сделать окончательное заключение о менинго-кокковой инфекции. При микроскопии мазков из носоглотки бактерионосителей наряду с менингококком обнаруживаются грамположительные стафилококки и стрептококки, а также непатогенные нейссерии (Moraxella spp. и др.). Дифференцировать их по морфологическим признакам не представляется возможным. Бактериологическое исследование. Исследуемый материал засевают петлей на чашки с питательным агаром, содержащим кровь, сыворотку крови или асцитическую жидкость. В среды добавляют антибиотик ристомицин (150 ЕД/мл), который задерживает размножение грамположительных кокков, содержащихся в исследуемом материале, и тем самым способствует выделению чистой культуры менингококка. Образование колоний менингококка на этих средах наблюдается через 48 ч после инкубации посевов при 37 °С в атмосфере с повышенным содержанием СО2 (3—10 %) и высокой влажностью. В отличие от других кокков колонии менингококка величиной с булавочную головку прозрачны, имеют голубоватый оттенок и ровные края. Такие колонии пересевают в пробирку со скошенным агаром для получения чистой культуры. Идентификацию чистой культуры, дифференциацию от сапрофитных нейссерии, обитающих в носоглотке, проводят по ряду культуральных и биохимических признаков. Так, менингококк растет только в присутствии нативного белка, в то время как другие нейссерии размножаются на простых средах и образуют пигмент; на средах Гисса с добавлением сыворотки крови менингококк ферментирует глюкозу и мальтозу до кислоты (табл. 14.2.1). Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Для выявления антигенов менингококков в мазках из исследуемого материала используют метод ИФ. 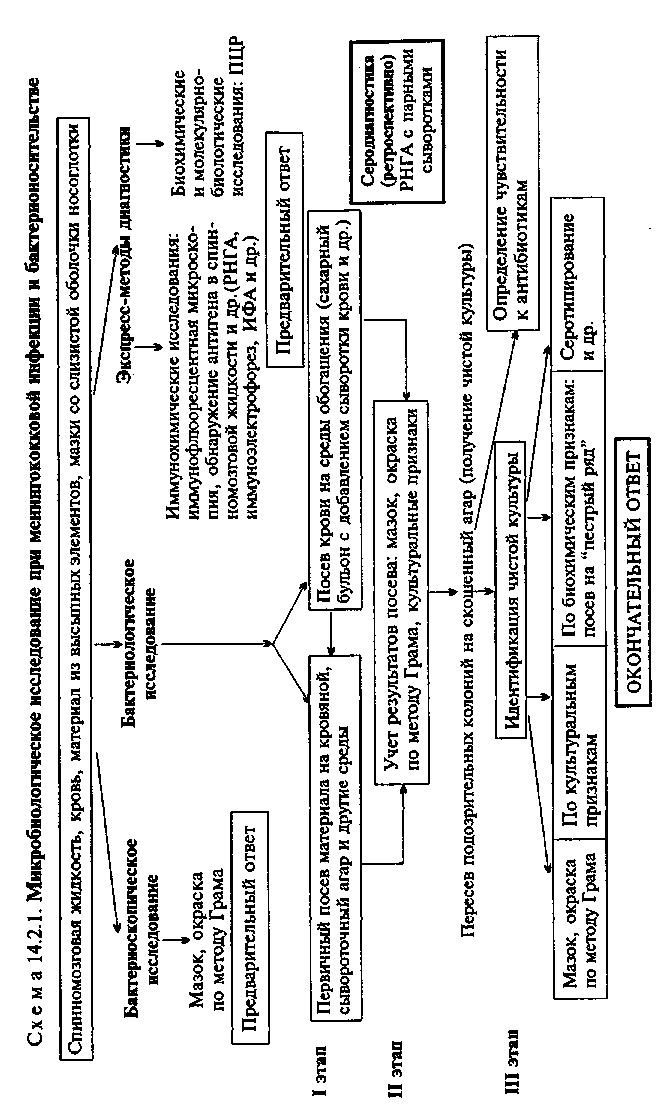
• Микробиологическая диагностика коклюша и паракоклюша МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: мокрота, слизь из носоглотки. Материал берут стерильным ватным тампоном из носоглотки больного ребенка. Для взятия материала у маленьких детей тампон, приготовленный на тонкой эластичной проволоке, вводят через нос. МЕТОДЫ ДИАГНОСТИКИ: Бактериоскопическое исследование (схема 14.2.2). Бактерио-скопический метод как таковой при диагностике коклюша не применяется. Для быстрого обнаружения и идентификации Bordetella pertussis используют иммунофлюоресцентный метод (см. ниже). Бактериологическое исследование. Основной метод лабораторной диагностики коклюша. Материал для посева берут с помощью носоглоточного тампона или методом "кашлевых пластинок". Для этого в момент появления кашля открытую чашку Петри с питательной средой подносят ко рту ребенка и держат в течение 6—8 кашлевых толчков. Правильное и раннее взятие материала позволяет выделить возбудителя в начальном периоде болезни от 80—90 % больных. Материал засевают на КУА или кровяные среды — картофельно-глицериновый кровяной агар (среда Борде—Жангу) и молочно-кровяной агар. В питательные среды добавляют пенициллин для угнетения роста посторонней микрофлоры. Колонии В.pertussis на указанных средах обычно появляются через 48—72 ч культивирования. B.parapertussis — несколько раньше: через 24—72 ч. Борде-теллы образуют мелкие (диаметром около 1 мм) выпуклые влажные блестящие колонии. На КУА колонии имеют серовато-кремовый цвет, а на среде Борде—Жангу приобретают жемчужный или ртутный блеск. Колонии B.parapertussis более крупные. На среде Борде—Жангу и молочно-кровяном агаре они образуют ограниченную зону гемолиза. Из колоний, выросших на чашках, готовят мазки, окрашивают их по методу Грама и микроскопируют. При наличии в мазках овоидных грамотри-цательных палочек ставят ориентировочную реакцию агглютинации с коклюшной и паракоклюшной сыворотками. Затем подозрительные колонии пересевают в пробирки для дальнейшего изучения чистых культур. Идентификацию выделенной культуры производят на основании комплексного изучения морфологических, культураль-ных, биохимических и серологических свойств (табл. 14.2.2). В отличие от других бордетелл B.pertussis не растет на простом питательном агаре и не изменяет цвета специальных питательных сред. 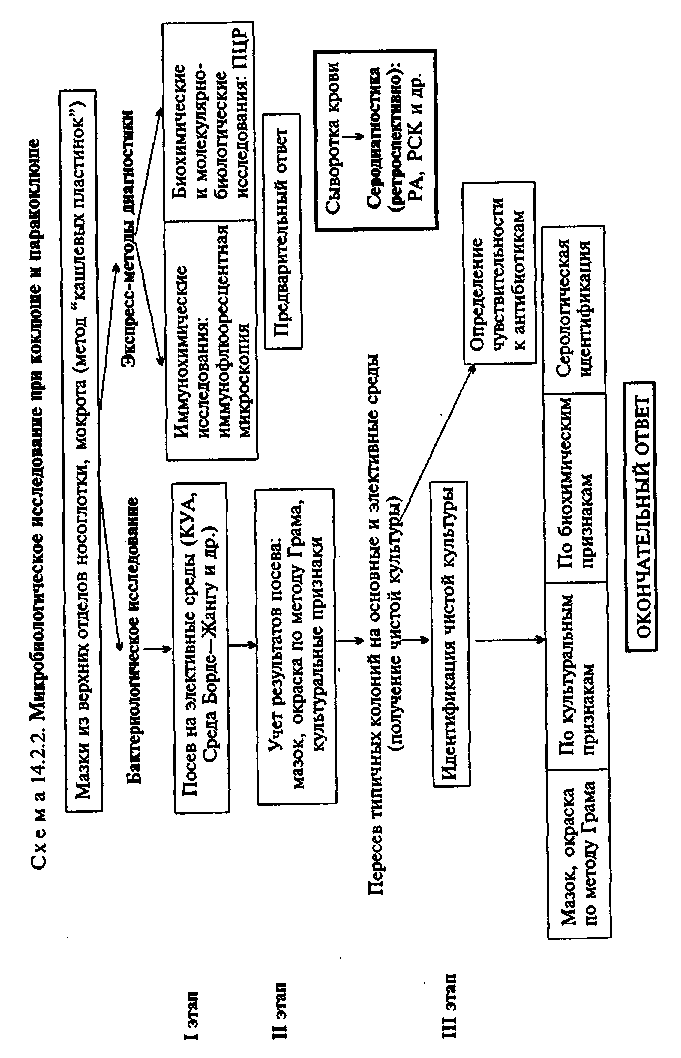
люшными антителами, другой — паракоклюшными антителами. Препараты микроскопируют в люминесцентном микроскопе, просматривая не менее 50 полей зрения. О положительном результате свидетельствует обнаружение темных бактериальных клеток с четким светящимся венчиком. Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз. Серодиагностика. Реакции агглютинации и РСК применяют в основном для ретроспективного подтверждения диагноза и дифференциальной диагностики атипичных форм коклюша. Агглютинины в крови больных появляются на 3—4^й неделе заболевания в титрах 1:20 и выше. В условиях массовой вакцинации детей против коклюша диагностическое значение имеет нарастание титра антител в динамике болезни, поэтому реакцию ставят повторно через 4—5 дней. • Микробиологическая диагностика дифтерии МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: мазки со слизистой оболочки зева и носа, пленки с поверхности миндалин и носоглотки. Материал берут двумя ватными стерильными тампонами, один из которых используют для приготовления мазков, другой — для посева. МЕТОДЫ ДИАГНОСТИКИ: Бактериоскопическое исследование (схема 14.2.3). Мазки окрашивают по методу Грама, метиленовым синим по Леффлеру, по Нейссеру. Для Corynebacterium diphtheriae характерно наличие полярно расположенных зерен волютина и расположение в виде буквы "V" (см. рис. 2.2.4). Corynebacterium pseudodiphth-eriae и дифтероиды не имеют зерен волютина или содержат их не на концах, а по длине палочки. Кроме того, сами бактерии располагаются в виде частокола. Применение люминесцентной микроскопии позволяет повысить эффективность исследования. При этом C.diphtheriae можно отличить от других корине-бактерий по коричнево-красному свечению зерен волютина, которое они приобретают после окраски флюорохромом кори-фосфином. Цитоплазма этих бактерий дает зеленое или желтое свечение. Однако C.diphtheriae часто изменяют свою морфологию, в частности при санации зева антибиотиками. В настоящее время бактериоскопическое исследование при дифтерии практически не используют в связи с его низкой надежностью (высокой частотой ложноположительных и ложноотрицатель-ных результатов). Бактериологическое исследование. Является ведущим мето- 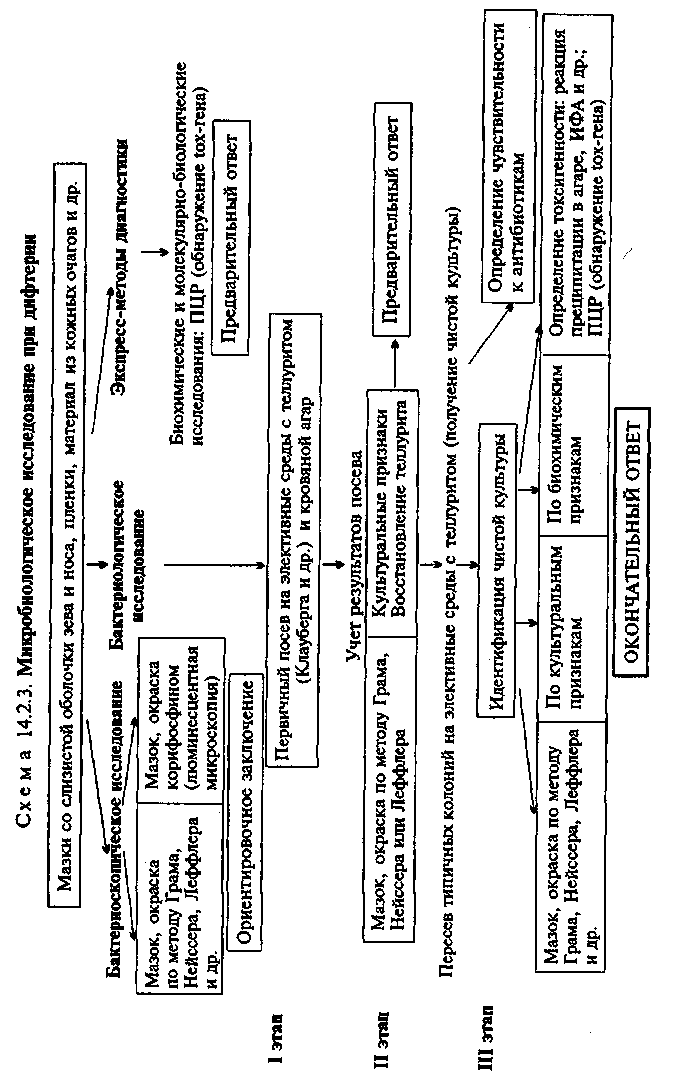 дом диагностики дифтерии. Материал засевают на кровяной агар и элективные питательные среды, содержащие теллурит: среда Клауберга (питательный агар с теллуритом натрия, глицерином и дефибринированной кровью) и др. На средах с теллуритом задерживается рост кокков и другой микрофлоры зева, что способствует размножению возбудителя дифтерии. На теллуритовой среде C.diphtheriae образует черные колонии (рис. 14.2.1; на вклейке) за счет восстановления теллурита (биовар gravis формирует колонии серовато-черного цвета с радиальной исчерченностью поверхности, напоминающие цветок маргаритки, биовар mitis — круглые выпуклые колонии черного цвета). Типичные колонии, представленные грамполо-жительными палочками булавовидной формы с характерным расположением, содержащими зерна волютина, пересевают на кровяной агар для получения чистой культуры. Для подтверждения диагноза дифтерии в первую очередь необходимо установить токсигенность выделенной культуры (способность к продукции дифтерийного токсина). Наличие токсина определяют с помощью различных серологических реакций (преципитации в агаре, ИФА и др.). Применяют также метод ПЦР, позволяющий обнаружить присутствие у выделенных бактерий tox-гена, контролирующего синтез дифтерийного токсина. До последнего времени общепринятым методом определения токсигенности являлась реакция преципитации в агаре с антитоксической противодифтерийной сывороткой. Методы ИФА и ПЦР, разработанные в последние годы, являются более чувствительными и позволяют получить результат в течение 3—5 ч. Определение токсигенности в реакции преципитации: в чашку Петри с питательным агаром, содержащим 15—20 % лошадиной сыворотки, 0,3 % мальтозы и 0,03 % цистина, кладут полоску фильтровальной бумаги, пропитанную антитоксической противодифтерийной сывороткой, содержащей 5000 АЕ/мл. Чашку подсушивают при 37 "С в течение 30 мин и засевают исследуемые культуры в виде перпендикулярных к бумаге штрихов на расстоянии 0,6—0,8 см от края бумаги. В качестве контроля используют заведомо токсигенную культуру. Посевы инкубируют при 37 "С до следующего дня. При размножении токсигенной культуры в месте соединения токсина с антитоксическими антителами в плотной питательной среде образуется преципитат в виде белых линий — "усов" (см. рис. 10.1.7). Выделенную культуру идентифицируют и дифференцируют от сходных с ней непатогенных коринебактерий по морфологическим особенностям, культуральным и биохимическим признакам: пробы на цистиназу, уреазу, ферментация углеводов и др. (табл. 14.2.3). В случае выделения нетоксигенной культуры ставят дополнительную реакцию агглютинации с
Применяют для обнаружения антигенов N.meningitidis в спинномозговой жидкости в РИГА. Коклюшная вакцина. Содержит взвесь В.pertussis, убитых формалином. Применяют для обязательной активной специфической профилактики коклюша. Входит в состав АКДС (адсорбированная коклюшно-дифтерийно-столбнячная вакцина), которая включает также очищенные концентрированные дифтерийный и столбнячный анатоксины, адсорбированные на гидрате оксида алюминия. Иммуноглобулин нормальный человеческий. Получен из плацентарной или венозной крови человека. Содержит специфические антитела против возбудителей многих инфекционных заболеваний, в том числе возбудителя коклюша. Применяют для создания пассивного иммунитета с целью профилактики и лечения коклюша. Агглютинирующие адсорбированные (факторные) сыворотки. Применяют для серологической дифференциации возбудителей коклюша. Дифтерийный адсорбированный очищенный анатоксин (АД). Дифтерийный экзотоксин обезвреживают формалином при нагревании, а затем очищают от балластных веществ, концентрируют и адсорбируют на гидрате оксида алюминия. Применяют для профилактики дифтерии путем создания активного иммунитета. Входит в состав адсорбированного дифтерийно-столбнячного анатоксина (АДС) и АКДС. Противодифтерийная антитоксическая сыворотка. Получена из крови лошадей, гипериммунизированных дифтерийным анатоксином, очищена и концентрирована методом диаферм-3. Активность сыворотки изменяется в международных единицах. Применяют для экстренной профилактики и лечения дифтерии за счет создания пассивного иммунитета. Агглютинирующая противодифтерийная сыворотка (поливалентная и типовые). Применяют для дифференциации C.diph-theriae от дифтероидов. Антимикробные препараты: пенициллин и другие р-лактамы, хлорамфеникол, рифампицин, сульфаниламиды, тетрациклин, эритромицин. Тема 14.3. ВОЗБУДИТЕЛИ ТУБЕРКУЛЕЗА, ПРОКАЗЫ И АКТИНОМИКОЗА План Программа 1. Биологические свойства возбудителей туберкулеза, микобактериозов, проказы и актиномикозов; их пато-генность, экология, особенности инфекции и эпидемиология вызываемых заболеваний. Микробиологическая диагностика. Диагностические, профилактические и лечебные препараты. Демонстрация 1. Мазки для микроскопии: Mycobacterium tuberculosis — мазки из чистой культуры и мокроты, окраска по методу Циля—Нильсена; препарат М.tuberculosis в люминесцентном микроскопе; Mycobacterium leprae — мазок со слизистой оболочки носа, окраска по методу Циля—Нильсена; Actinomyces spp. — друзы актиномицетов в ткани легкого. Питательные среды для культивирования М.tuberculosis. Рост микобактерий на среде Левенштейна—Йенсена. Ниациновая проба для идентификации М.tuberculosis. Определение чувствительности микобактерий к противотуберкулезным препаратам. Рост актиномицетов на питательных средах. Биохимические признаки для дифференциации актиномицетов. РСК для серодиагностики актиномикоза. Задание студентам 1. Микробиологическое исследование при туберкулезе: указать материал, подлежащий исследованию; бактериоскопический метод: окрасить по методу Циля—Нильсена приготовленные из мокроты мазки и провести микроскопическое исследование. Сделать заключение и наметить ход дальнейшего исследования для подтверждения бактериоскопического диагноза; бактериологический метод: 4 отметить характер роста исследуемой культуры на среде Левенштейна—Йенсена, Ф отметить результаты ниациновой пробы, 4 определить чувствительность М.tuberculosis к антимикробным препаратам: отметить наличие или отсутствие, роста микобактерий на среде Левенштейна—Йенсена с разными концентрациями противотуберкулезных препаратов и сопоставить полученные данные с клиническими границами устойчивости микобактерий. Дать окончательное заключение по проведенным исследованиям. 2. Микроскопическое исследование при проказе: 1) указать материал, подлежащий исследованию; 2) бактериоскопический метод: микроскопировать и зарисовать окрашенный по методу Циля—Нильсена мазок со слизистой оболочки. Сделать заключение. 3. Микробиологическое исследование при актиномикозе: указать материал, подлежащий исследованию; бактериоскопический метод: микроскопировать препарат из патологического материала. Сделать заключение; бактериологический метод: на основании результатов исследования (морфологических, культуральных и биохимических свойств) идентифицировать культуру актиномицетов. Сделать окончательное заключение. а Методические указания • Микробиологическая диагностика туберкулеза МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: при легочном туберкулезе материалом для исследования являются мокрота, промывные воды бронхов, бронхоальвеолярная жидкость, плевральный экссудат, промывные воды желудка. Образцы мокроты необходимо собирать в течение 3—6 дней. Если пациент откашливает недостаточное количество мокроты, отделение можно облегчить (индуцировать) путем вдыхания аэрозоля подогретого гипертонического (5—15 %) раствора поваренной соли. При внелегочном туберкулезе материал для исследования выбирают в зависимости от локализации поражений. Это может быть кровь, спинномозговая жидкость, моча, синовиальная жидкость, тканевые биоптаты (лимфатических узлов, костного мозга, печени, кожи и подкожной жировой клетчатки и др.), испражнения. Нестерильный материал, контаминирован-ный нормальной микрофлорой (мокрота, промывные воды бронхов, бронхоальвеолярная жидкость, промывные воды желудка, материал из пораженных участков кожи и подкожной жировой клетчатки, испражнения) для предотвращения размножения посторонних бактерий сразу после отбора должен быть помещен в холодильник и храниться до исследования при температуре 4—8 °С. МЕТОДЫ ДИАГНОСТИКИ: Первичная обработка клинического материала. Нестерильный материал нуждается в предварительной деконтаминации (уничтожении посторонней микрофлоры). Для исследования вязкого и негомогенного материала, содержащего тканевой детрит (мокрота, бронхоальвеолярная жидкость и др.), требуется также произвести процедуру разжижения и гомогенизации. Поскольку клинические образцы обычно содержат малое количество микобактерий, желательно производить обогащение исследуемого материала. Обычно с целью гомогенизации/декон-таминации материал обрабатывают муколитическими (М-аце-тил-Ь-цистеин) и антибактериальными агентами (10 % Na3PO4, 1—2 % NaOH и др.). Далее бактерии концентрируют путем осаждения (центрифугирование 15—20 мин при 3000 g). При этом клеточный детрит и погибшие посторонние микроорганизмы удаляются в виде супернатанта. Осадок ресуспендируют в минимальном объеме стерильной воды или изотонического раствора хлорида натрия и используют для дальнейшего исследования. Применяют и другие методы деконтаминации, гомогенизации и обогащения материала. Тканевые биоптаты перед исследованием необходимо гомогенизировать. Бактериоскопическое исследование (схема 14.3.1). Бактерио-скопическая диагностика туберкулеза основана на выявлении в материале кислотоустойчивых бактерий с помощью специальных сложных методов окраски. Выявление микобактерий классическим методом Циля— Нильсена является весьма трудоемкой процедурой. Кислотоустойчивые бактерии окрашиваются в ярко-красный цвет, располагаются поодиночке или небольшими скоплениями (см. рис. 2.2.2). Препараты из мочи обязательно обесцвечивают не только кислотой, но и спиртом для дифференциации M.tuber-culosis от M.smegmatis, которые могут находиться в моче здоровых людей. В отличие от М.tuberculosis они обесцвечиваются спиртом. Мазок исследуют иммерсионным методом при увеличении 900х—ЮООх, просматривая до 300 полей зрения. Результат считается положительным при обнаружении 1 или более кислотоустойчивых бактерий на 100 полей зрения. Отсутствие кислотоустойчивых бактерий при просмотре 300 полей зрения следует трактовать как отрицательный результат. Окраску по методу Циля—Нильсена применяют преимущественно для изучения выделенных чистых культур. В качестве основного метода выявления микобактерий в материале от больного в настоящее время применяют люминесцентную микроскопию мазков, окрашенных флюорохро-мом аурамином О по методу Боя (последующая обработка 3 % раствором НС1 в абсолютном этаноле обеспечивает обесцвечивание некислотоустойчивых бактерий). Этот метод облегчает исследование, поскольку позволяет использовать меньшее увеличение (250х или 450х) и просматривать меньшее число полей зрения (30—70 в зависимости от увеличения). Независимо от метода окраски бактериоскопическое исследование позволяет обнаружить бактерии при их концентрации не менее 5000—10 000 в 1 мл образца, поэтому отрицательный результат не позволяет исключить заболевание. 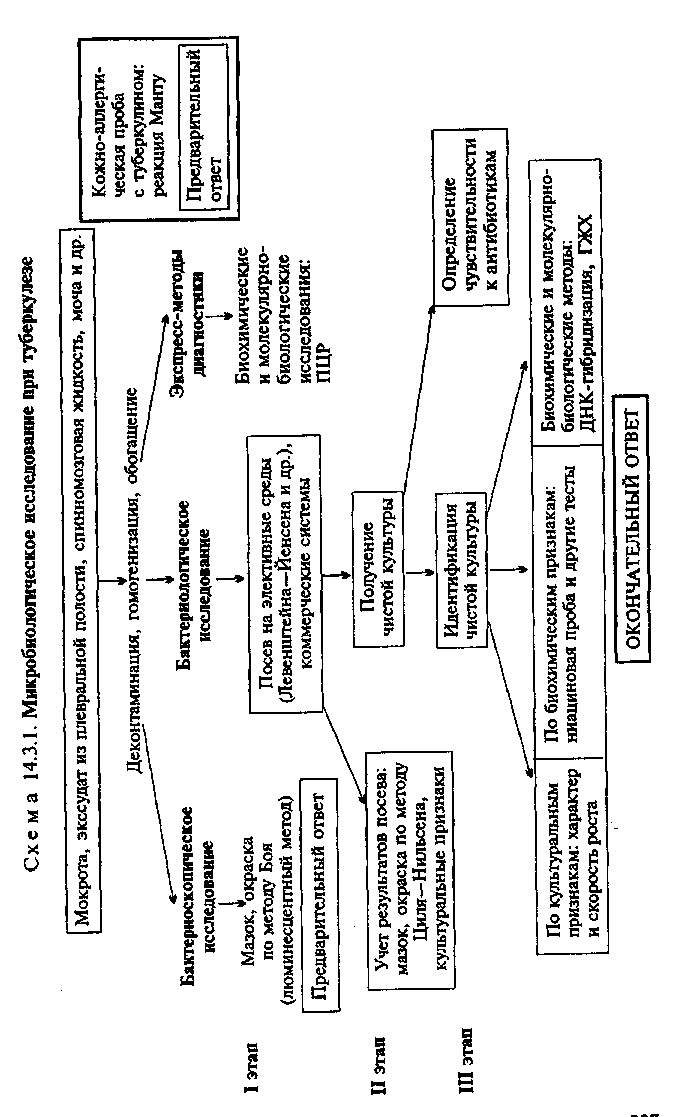 Микроскопическое исследование является ориентировоч* ным и дает возможность судить лишь о наличии в материале кислотоустойчивых бактерий без определения их видовой при* надлежности. Метод не позволяет дифференцировать микобак-терии между собой и от других кислотоустойчивых микроорганизмов. Легочные и внелегочные поражения в первую очередь у лиц с иммунодефицитом различной этиологии могут быть вызваны не только бактериями комплекса Mycobacterium tuberculosis (МТС), но также и нетуберкулезными микобакте-риями: бактериями комплекса M.avium (MAC), M.kansassii, реже другими представителями рода Mycobacterium, Поскольку нетуберкулезные микобактерии являются обитателями окружающей среды, загрязняющими воду, продукты, системы принудительной вентиляции/кондиционирования воздуха и др., они могут также присутствовать в образце как контами-нанты. Бактериоскопическое исследование считается оптимальным методом ориентировочной экспресс-диагностики туберкулеза. Бактериологическое исследование. Считается ведущим методом диагностики туберкулеза, поскольку обладает достаточно высокой чувствительностью, специфичностью и обеспечивает материал (чистую культуру), необходимый для определения чувствительности возбудителя к противомикробным препаратам. Для выделения чистой культуры микобактерии производят посев исследуемого материала на специальные жидкие или плотные питательные среды. Для выделения микобактерии из нестерильного материала желательно использовать селективные среды, содержащие антимикробные препараты, подавляющие рост посторонних микробов. Для культивирования микобактерии применяют плотные яичные (среда Левенштейна— Йенсена) и агаровые среды, а также ряд синтетических жидких питательных сред. Среда Левенштейна—Йенсена готовится из суспензии свежих яиц, картофельной муки, глицерина, аспарагина, Ю^РОф сульфата и цитрата магния и малахитового зеленого. Среду свертывают в наклонном положении при 85 "С в течение 45 мин. Большинство питательных сред выпускаются микробиологической промышленностью в виде полуфабрикатов или в готовом виде. Поскольку на жидких средах скорость роста микобактерии выше, чем на плотных, для ускорения исследования рекомендуется осуществлять посев одновременно на плотную и жидкую среду. Посевы необходимо инкубировать в атмосфере с повышенным содержанием СС>2 (5—10 %). Минимальный срок инкубации составляет не менее 8 нед. Посевы первый раз просматривают на 3—5-й день после внесения материала, далее — 2 раза в неделю. Начиная с 5-й недели культивирования — 1 раз в неделю. Культуры М.tuberculosis имеют вид сероватого или светло-кремового морщинистого или крошкообразного сухого налета (рис. 14.3.1; на вклейке). Еще до появления видимых невооруженным глазом макроскопических колоний на плотных средах с помощью микроскопии могут быть обнаружены микроколонии. Отсутствие микробного роста через 8 нед культивирования следует расценивать как отрицательный результат. В последнее время широкое применение нашли также различные коммерческие системы культивирования микобакте-рий, использующие как жидкие, так и плотные питательные среды, а также различные высокочувствительные способы автоматизированного контроля роста бактерий на основании их метаболической активности — по потреблению компонентов питательной среды и/или образованию продуктов жизнедеятельности. Это позволяет обнаружить присутствие бактерий значительно раньше появления видимых признаков роста. Для посева используют стандартные емкости, заполненные готовой средой. Определение концентрации соответствующего метаболита в каждой пробе осуществляется непрерывно с помощью радиометрических, флюорометрических, колориметрических, манометрических или других методов в специальной камере для инкубации посевов, регистрируется и анализируется с помощью компьютера. В настоящее время изотопные методы контроля роста вытесняются неизотопными, основанными на различных способах детекции поглощения и выделения газов (О2 и/или СО2) микроорганизмами в ходе активного метаболизма. Использование указанных методов контроля роста позволяет в большинстве случаев существенно ускорить процесс выделения чистой культуры микобактерий. Положительный результат может быть получен уже через 3—5 дней, средний срок составляет 7—14 дней. Однако, учитывая вероятную низкую концентрацию возбудителя в исследуемом материале, максимальный срок инкубации достаточно велик — результат бактериологического исследования считается отрицательным при отсутствии признаков роста в течение 40 дней. В случае регистрации положительного результата культивирование продолжают до тех пор, когда количество бактерий в среде достигает определенной концентрации, необходимой для проведения дальнейшего изучения выделенной чистой культуры — идентификации и определения чувствительности к антимикробным препаратам. Среднее время культивирования составляет 9—20 дней. Бактериологический метод дает положительный результат при наличии не менее 10—30 жизнеспособных микобактерий в 1 мл исследуемого материала после обогащения. Чувствительность бактериологического метода приближается к 100 %, однако не всегда позволяет однозначно исключить заболевание. Отрицательный результат в ряде случаев может быть обусловлен очень низким содержанием возбудителя в клиническом образце. Идентификация чистой культуры. Выделенные чистые культуры микобактерий обычно идентифицируют до вида. Идентификация осуществляется с помощью традиционных методов (на основании фенотипических признаков бактерий — культуральных и биохимических), а также с использованием молекулярно-генетических и химических методов анализа выделенной культуры. Традиционные методы идентификации основаны на изучении достаточно большого числа признаков, включая скорость роста, морфологию колоний, способность к пигментообразо-ванию, продукции никотиновой кислоты, восстановлению нитратов и теллурита калия, гидролизу твина-80, мочевины (уре-азная активность), пиразинамида до пиразиновой кислоты (пиразинамидазная активность), перекиси водорода при повышенной температуре (термоустойчивая каталазная активность) и некоторых других. На основании этих признаков можно однозначно идентифицировать представителей основных видов Mycobacterium spp., вызывающих заболевания человека. Процедура идентификации по фенотипическим признакам может занимать до 3 нед. Специфичность метода составляет 100%. Способность исследуемой культуры синтезировать никотиновую кислоту (ниациновая проба Конно) является одним из важных признаков, с помощью которого удается отличить М. tuberculosis, хорошо синтезирующие никотиновую кислоту, от M.bovis, образующих ее в минимальных количествах. Для определения ниацина к культуре микобактерий в жидкой питательной среде добавляют 1 мл раствора KCN и 1 мл 5 % раствора хлорамина. При наличии ниацина через несколько минут появляется ярко-желтая окраска. Для нейтрализации KCN после учета результатов реакции в пробирки добавляют 3—5 мл 10 % раствора гидрокарбоната натрия. При выращивании микобактерий на предметных стеклах (метод микрокультур Прайса) вирулентные штаммы характеризуются ростом в виде жгутов или кос за счет образования корд-фактора (рис. 14.3.2; на вклейке). На нескольких предметных стеклах делают толстые мазки, высушивают, обрабатывают несколько минут 2—6 % серной кислотой и нейтрализуют. Затем стекла опускают во флаконы с гемолизированной цит-ратной кровью в разведении 1:4—1:8 и ставят в термостат. Через 7—14 дней извлекают стекла, фиксируют препарат, окрашивают по методу Циля—Нильсена и микроскопируют. Идентификация микобактерий методом гибридизации ДНК ("ДНК-зондов"). Метод гибридизации ДНК применяют для быстрой идентификации чистой культуры микобактерий. Использование ДНК-зондов позволяет получить окончательный ответ в течение суток после завершения культивирования и, таким образом, существенно сокращает общий срок исследования. На сегодня существуют ДНК-зонды для идентификации только наиболее клинически значимых и широко распространенных микобактерий, вызывающих заболевания человека: комплекса M.tuberculosis, комплекса M.avium и M.kansassii. Таким образом, метод позволяет надежно идентифицировать представителей указанных видов и дифференцировать их от других патогенных микобактерий, а также от непатогенных сапрофитов, загрязняющих клинические образцы. Метод основан на гибридизации материала из чистой культуры с меченым ДНК-зондом, комплементарным видоспеци-фическим последовательностям в составе рРНК бактерий. Образовавшиеся в результате гибридизации ДНК-РНК-комплексы выявляют по наличию метки. Обычно используют флюоресцентную метку, присутствие которой легко обнаружить с помощью флюориметрии. Для надежной идентификации требуется не менее 105 бактерий. При этом чувствительность и специфичность метода составляют 100 %. При высоком содержании возбудителя в клиническом образце использование коммерческих систем культивирования в сочетании с гибридизацией ДНК позволяет получить окончательный результат бактериологического исследования уже на 4—7-й день. Идентификация микобактерий по липидному составу (хе моидентификация). Анализ количественного и качественного состава липидов клеточной стенки микобактерий (миколовых кислот) осуществляют с помощью газожидкостной или жидкостной хроматографии. Метод позволяет осуществить идентификацию любого из известных 50 видов микобактерий в течение 4 ч. Основными факторами, ограничивающими его широкое применение, являются необходимость использования дорогостоящего оборудования и техническая сложность интерпретации результатов. Определение чувствительности возбудителя к антимикробным препаратам. Является обязательным этапом микробиологической диагностики туберкулеза и основой назначения адекватной этиотропной терапии. Традиционно определение чувствительности микобактерий осуществляют методом серийных разведений препарата в питательной среде. Наиболее надежным считается использование плотных питательных сред с последующим подсчетом числа выросших колоний. Исследование может занимать более 3 нед (до 3 мес), что обусловлено чрезвычайно низкой скоростью роста резистентных вариантов. Клинические границы устойчивости М.tuberculosis (МПК): стрептомицин — 5 мкг/мл, ПАСК — 10 мкг/мл, туба-зид — 1 мкг/мл, циклосерин и этионамид — 30 мкг/мл. Бактерии считают резистентными в том случае, если более 1 % клеток чистой культуры сохраняет способность к образованию колоний в присутствии указанной концентрации препарата. Применение современных методов контроля роста бактерий (см. выше) позволило существенно сократить срок исследования (до 7—14 дней). Однако следует учитывать, что определение жизнеспособности бактерий в присутствии антибиотика по интенсивности их метаболической активности не всегда позволяет надежно дифференцировать чувствительную культуру от смешанной, содержащей 1—10 % резистентных бактерий. В настоящее время осуществляется интенсивная разработка более надежных методов контроля жизнеспособности, основанных на прямом подсчете числа живых бактерий с использованием проточной цитофлюориметрии, позволяющих избежать подобных ошибок. Молекулярно-генетические методы определения чувствительности микобактерий к антимикробным препаратам. Методы ПЦР-диагностики позволяют обнаружить наличие у возбудителя генов, контролирующих резис-тентность к определенному препарату. Уже разработаны тест-системы на основе ПЦР для определения резистентности к препаратам группы рифампицинов. Биопроба. Ранее для диагностики туберкулеза применяли биопробу: чистую культуру М. tuberculosis выделяли из органов животного, зараженного исследуемым материалом. Исследуемый материал обрабатывают серной кислотой для освобождения от посторонней микрофлоры, нейтрализуют и вводят подкожно в количестве 2—3 мл морской свинке и кролику с отрицательными туберкулиновыми реакциями. Через 4 мес, если животное не погибнет, его забивают, проводят макро- и микроскопическое исследование органов и делают посевы. Метод также применяется для определения вирулентности микобактерий. М.tuberculosis высокопатогенны для морских свинок и малопатогенны для кроликов. M.bovis высокопатогенны для кроликов. В настоящее время метод практически не применяется. Экспресс-методы диагностики. Биохимические и молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. Метод позволяет обнаружить наличие видоспецифических нуклеиновых кислот микобактерий непосредственно в клиническом образце после обогащения. Исследование занимает около 4 ч. Существующие коммерческие тест-системы позволяют выявить в образце (мокроте, плевральном экссудате, пунктате лимфатических узлов и др.) присутствие МТС — бактерий комплекса М.tuberculosis (М.tuberculosis, M.bovis/BCG, M.africanum) и надежно дифференцировать их от нетуберкулезных микобактерий. Последнее имеет принципиальное значение для раннего эмпирического назначения этиотропной терапии, поскольку нетуберкулезные микобактерии, включая МЛ С, существенно отличаются от МТС по чувствительности к антимикробным препаратам. Чувствительность метода приближается к 100 % только для образцов, в которых микобактерии были обнаружены бакте-риоскопическим методом, в других случаях она не превышает 90 %. Нельзя также исключить вероятность ложноположитель-ных результатов. Специфичность ПЦР по различным оценкам составляет 70—100 %. Таким образом, по чувствительности метод ПЦР сопоставим с бактериологическим исследованием, однако позволяет получить результат в течение 24 ч от момента получения материала. Результаты ПЦР-диагностики рекомендуется интерпретировать в зависимости от данных бактериоскопического исследования. Получение положительного ответа бактериоскопичес-ким методом и ПЦР позволяет диагностировать туберкулез и рекомендовать немедленное назначение противотуберкулезных препаратов по классической схеме. Отрицательный результат ПЦР при наличии кислотоустойчивых микобактерии в мазках позволяет исключить присутствие МТС и рекомендовать назначение антимикробных препаратов, активных в отношении нетуберкулезных микобактерии. В других ситуациях рекомендуется ожидать результатов бактериологического исследования. Серодиагностика. Антитела к антигенам возбудителя в крови пациентов можно обнаружить с помощью РСК, РИГА и других серологических реакций. Необходимо иметь в виду, что положительные результаты отмечаются не только при активном туберкулезном процессе в организме, но также при инфицировании М.tuberculosis и вакцинации, поэтому существенного диагностического значения не имеют. Кожно-аллергическая проба. Ставится с туберкулином — очищенной белковой фракцией, полученной из фильтрата бульонной культуры М.tuberculosis. Используется для оценки течения туберкулезного процесса, определения эффективности вакцинации и отбора контингентов для ревакцинации против туберкулеза. Туберкулин вводят внутрикожно в строго определенной дозировке (реакция Манту). Результаты (появление гиперемии и образование папулы в положительном случае) учитывают через 24—48 ч (см. рис. 10.4.1). • Микробиологическая диагностика проказы МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: соскоб слизистой оболочки носа, кожные лепрозные узлы, пунктат лимфатических узлов, мокрота и др. 243 МЕТОДЫ ДИАГНОСТИКИ: Бактериоскопическое исследование. Является основным методом лабораторной диагностики проказы, так как M.leprae на питательных средах не культивируется. В мазках, приготовленных из материала и окрашенных по методу Циля—Нильсена, микобактерии располагаются скоплениями в виде пачек сигар или наподобие шаров. Кожно-аллергическая проба (реакция Мицуды) ставится с лепромином. Учитывают реакцию через 24—48 ч по образованию инфильтрата на месте введения. Аллергическая реакция диагностического значения не имеет и применяется для характеристики клинического течения болезни. • Микробиологическая диагностика актиномикоза МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: биоптаты ткани и пунктаты из глубоких очагов поражения, гнойное отделяемое^ экссудат, мокрота, промывные воды бронхов, моча. МЕТОДЫ ДИАГНОСТИКИ: Бактериоскопическое исследование. Подозрительные плотные комочки из патологического материала переносят на предметные стекла в каплю 10—20 % раствора гидрокарбоната натрия, слегка подогревают и готовят препарат "раздавленная" капля, который исследуют под микроскопом с объективами 8х и 40х. В положительном случае в препарате обнаруживают актиномицеты в виде друз — характерных зернистых образований с плотным гиалиновым центром, окруженным лучистыми нитевидными клетками. Наряду с друзами встречаются отдельные грамположительные неравномерно окрашивающиеся ветвистые бактерии (см. рис. 2.3.1). Друзы также могут быть обнаружены в гистологических срезах биоптатов органов, окрашенных стандартными (гематоксилин-эозин) или специальными (окраска Брауна—Брена и др.) методами. Бактериологическое исследование. Материал засевают на несколько питательных сред (тиогликолевую среду, кровяной агар, сердечно-мозговой агар, агар Сабуро и др.). Посевы инкубируют в анаэробных и аэробных условиях с добавлением 5 % СО2. Через 18—24 ч на плотных питательных средах образуются микроколонии, а через 1—2 нед — зрелые колонии. Характерным признаком является "паукообразная" структура микроколонии с многочисленными ветвящимися нитями по периферии. Зрелые колонии могут быть плоскими, морщинистыми, бугристыми или пленчатыми. Характер колонии и морфология клеток во многих случаях позволяет отнести исследуемую культуру к роду Actinomyces. Окончательная идентификация культуры до вида проводится на основании биохимических и антигенных свойств. Для идентификации используют также методы ГЖХ. 244 Экспресс-методы диагностики. Иммунохимические исследования. Метод ИФ: для обнаружения возбудителя в патологическом материале фиксированные мазки обрабатывают специфическими флюоресцирующими антителами к антигенам актиномицетов. Свечение бактерий в образце свидетельствует о положительном результате. Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз. Метаболиты возбудителя могут быть обнаружены в материале методом ГЖХ. Серодиагностика. Ставится РСК с сывороткой крови больного и антигеном, представляющим собой поливалентный ак-тинолизат. Положительная реакция наблюдается у 80 % больных людей. Кожно-аллергическая проба. Ставится с экстрактом из актиномицетов. • Диагностические, профилактические и лечебные препараты Туберкулин сухой очищенный (PPD). Получен из фильтрата бульонной культуры микобактерий путем добавления химических веществ, осаждающих белок, с последующей очисткой и лиофилизацией. Применяют для постановки кожно-аллерги-ческой пробы. Вакцина BCG. Живая лиофильно высушенная культура ави-рулентного штамма M.bovis BCG, полученного французскими учеными Кальметтом и Гереном. Применяется внутрикожно для активной специфической профилактики туберкулеза. Лепромин. Гомогенизированная взвесь лепрозного узелка, инактивированного нагреванием. Применяют для постановки кожно-аллергической пробы при лепре. Актинолизат. Фильтрат бульонной культуры спонтанно ли-зированных штаммов актиномицетов. Применяют для специфической иммунотерапии и в качестве антигена для постановки РСК. Актиномицетная поливалентная убитая вакцина. Готовится из спороносных штаммов актиномицетов. Применяют с лечебной целью. Антибиотики. Для лечения туберкулеза: стрептомицин, ПАСК, производные ГИНК (тубазид, фтивазид, метазид и др.), этионамид, этамбутол, пиразинамид, рифампицин, цик-лосерин, канамицин, фторхинолоны и др. Обычно используют комбинации препаратов (не менее трех препаратов различных групп) с учетом чувствительности М.tuberculosis и клинической характеристики заболевания. 245
ражением других органов возможен для вирусов иммунодефицита человека, гепатита В, цитомегаловирусной инфекции. Микробиологическая диагностика урогенитальных инфекций, вызванных простейшими, грибами и вирусами, излагается в соответствующих главах Руководства. |
