Системы крови
 Скачать 7.82 Mb. Скачать 7.82 Mb.
|
|
26.1. Гемостаза и основные его механизмы 26.1.1. Тромбоцитарно-сосудистый гемостаз Остановка кровотечения при повреждении сосудов микроциркуляторного русла, главным образом, происходит благодаря спазму сосудов и образованию тромбоцитарного тромба. Совокупность этих процессов и составляет сущность сосудисто-тромбоцитарного гемостаза. Спазм кровеносных сосудов осуществляется с участием нервно-рефлекторного и гуморального механизмов. Сосуды одних органов и тканей (кожа, подкожная жировая клетчатка, органы брюшной полости и др.) сужаются в результате активизации симпатической нервной системы, ответственной за продукцию медиатора норадреналина. Сосуды других органов (сердце, мозг, легкие) сужаются в результате активизации парасимпатической нервной системы, ответственной за продукцию медиатора ацетилхолина. Сосуды большинства органов спазмируются под влиянием усиленно продуцируемых как пресинаптическими адренергическими везикулами норадреналина, так и хромаффинной тканью надпочечникового и вненадпочечникого происхождения адреналина и норадреналина, а также повышенной продукции гипоталамо-нейрогипофизарными структурами вазопрессина, либо увеличенного образования в крови ангиотензина – II, ангиотензина – III, тромбоксана А2, серотонина, либо избытка ионов внеклеточного натрия, кальция и недостатка простациклина (PgI2) и других вазодилятаторов (гистамина, аденозина и др.). Тромбоциты образуются путем их отшнуровки от цитоплазмы мегакариоцитов. Из одного мегакариоцита обычно образуется от 3000 до 4000 тромбоцитов (двояковыпуклых красных кровяных пластинок диаметром от 2 до 4 мкм). В норме количество тромбоцитов колеблется от 150 до 40010 9 /л, чаще - от 180 до 350109/л. Нормальная продолжительность жизни тромбоцита составляет 6-10 и даже 8-12 суток. Кроме того, 15-25% тромбоцитов ежесуточно поглощаются эндотелием сосудов, что обеспечивает ангиотрофическую и эндотелиоподдерживающую функцию тромбоцитов. Тромбоциты способствуют реэндотелизации в месте повреждения с участием секреции факторов роста. Поэтому правомочно называть тромбоциты “физиологическими кормильцами эндотелия” (З.С. Баркаган, 1988) . В образовании тромбоцитарного тромба выделяют следующие стадии (схема 1): - активация тромбоцитов и адгезия тромбоцитов к сосудистой стенке; - агрегация тромбоцитов; - реакция высвобождения ФАВ; - уплотнение тромбоцитарного тромба. 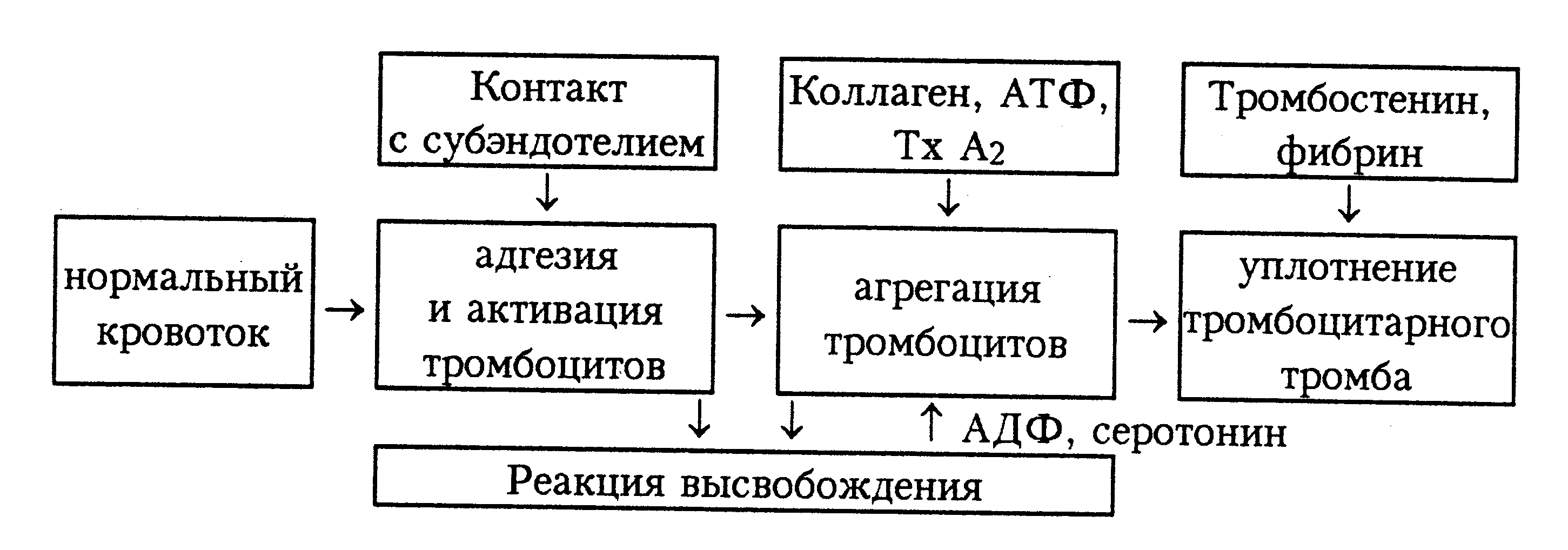 Схема 1. Стадии образования тромбоцитарного тромба Активация и адгезия тромбоцитов. В месте повреждения стенки сосуда наблюдается быстро возникающее скопление тромбоцитов и взаимодействие их с элементами субэндотелия - коллагеном и микрофибриллами. Спустя 1-2 сек после повреждения, происходит адгезия тромбоцитов к эндотелию сосудистой стенки. Это представляет собой начальный период формирования тромбоцитарного тромба. Наиболее выраженными адгезивными свойствами обладает коллаген I и III типов и фактор Виллебранда (ф.W) сосудистой стенки, к которым на поверхности еще не активированных тромбоцитов имеются соответствующие рецепторы. В процессе адгезии изменяется форма тромбоцитов, из дисковидных они сначала превращаются в сферические (чувствительные к адреналину), а затем с помощью цАМФ (образующейся в результате активизации адреналином аденилатциклазы) - в распластанные отростчатые клетки (активированные тромбоциты). Адгезии тромбоцитов к субэндотелию способствуют замедление тока крови, агрегация эритроцитов, увеличение вязкости крови, увеличение содержания в плазме крупнодисперсных белков и липидов. Агрегация тромбоцитов и реакция высвобождения ФАВ. Наряду с адгезией происходит агрегация тромбоцитов, то есть соединение их друг с другом и образование конгломератов (агрегатов) разной величины и плотности. Индукторами агрегации являются Са2+, коллаген, арахидоновая кислота, тромбин, тромбоксан А2, аденозиндифосфорная кислота (АДФ), серотонин, вазопрессин, адреналин, норадреналин и др. Тромбин, арахидоновая кислота, коллаген стимулируют секрецию содержимого гранул тромбоцитов – реакцию "высвобождения” и синтез циклических эндоперекисей в тромбоцитах, в том числе тромбоксана А2 (ТхА2). В тромбоцитах имеются гранулы четырех типов - плотные (1 тип), - гранулы (2 тип), пероксисомы (3 тип), лизосомы (4 тип). В процессе реакции высвобождения из - гранул секретируются - -тромбоглобулин, тромбоцитарный фактор 4, фактор Виллебранда, тромбоцитарный фактор роста, антигепариновый фактор, из плотных гранул - адреналин, серотонин и АДФ, вызывающие вторичную агрегацию тромбоцитов, изпероксисом и лизосом - такие ферменты, как арабинозидазы, кислые гидролазы, протеазы. В процессе агрегации тромбоцитов выделяют две фазы - обратимую и необратимую. Первая фаза - обратимая агрегация - образование рыхлых тромбоцитарных агрегатов из 10-15 тромбоцитов с псевдоподиями. Такие тромбоцитарные агрегаты легко разрушаются и уносятся током крови. На этом этапе возможна спонтанная дезагрегация под влиянием АТФ, АМФ, аденозина, продуктов деградации фибриногена и фибрина. Наиболее выраженным дезагрегирующим действием обладает простациклин (PgI2), образующийся преимущественно в эндотелии сосудов из циклических эндоперекисей, в том числе и тромбоцитарных, под влиянием простациклин-синтетазы. Простациклин стимулирует аденилатциклазу тромбоцитов, что сопровождается накоплением цАМФ и ингибированием агрегации. Период полураспада простациклина составляет около 2 мин. В отличие от других простагландинов, простациклин не инактивируется в легких. Концентрация простациклина в крови мала, но этого вполне достаточно для предупреждения образования тромбоцитарных агрегатов в кровеносном русле и дезагрегации тромбоцитов в месте повреждения сосудов. Дисбаланс между образованием простациклина и тромбоксана А2 сопровождается не только нарушением регуляции агрегации тромбоцитов, но и приводит к изменению тромборезистентных свойств сосудистой стенки. Вторая фаза - необратимая агрегация - образование стойких тромбоцитарных агрегатов происходит при высокой концентрации (описанных выше) веществ, вызывающих агрегацию, а также при действии низких концентраций таких агрегантов, которые обладают выраженным стимулирующим эффектом и активируют реакцию высвобождения тромбоцитарных гранул (тромбин, арахидоновая кислота, тромбоксан А2, коллаген и др.). В механизме агрегации тромбоцитов исключительно важную роль играют циклические эндоперекиси и тромбоксаны. Под влиянием индукторов агрегации (коллагена и тромбина) активируется фосфолипаза А2 мембраны тромбоцитов, что обеспечивает активацию процесса перекисного окисления липидов (ПОЛ), приводя к расщеплению фосфолипидов мембраны. В результате активируется арахидоновый каскад и образуются циклические эндоперекиси - простагландины (PgG2 и PgЕ2) и тромбоксаны (ТхА2 и ТхВ2). PgG2 и PgЕ2 и, особенно, ТхА2 являются мощными индукторами агрегации. Под влиянием ТхА2 ингибируется аденилатциклаза тромбоцитов, уменьшается образование цАМФ, увеличивается внутриклеточная концентрация ионов Са2+, активируется фосфотидилинозитидный путь гидролиза фосфолипидов мембран и происходит агрегация тромбоцитов. В нормальных условиях образование тромбоцитарных циклических эндоперекисей и тромбоксанов незначительно. В механизме ограничения биосинтеза этих тромбогенных веществ ведущая роль принадлежит цАМФ, которая через систему протеинкиназ регулирует концентрацию внутриклеточного Са2+ и ингибирует фосфолипазу А2. При увеличении содержания цАМФ в тромбоцитах агрегация их угнетается, а при снижении - усиливается. Активное влияние на ПОЛ и обмен тромбоцитарного цАМФ является одним из путей фармакологической коррекции агрегации тромбоцитов. В условиях агрегации определяющая роль принадлежит тромбину, который секретируется из тромбоцитов и образуется в процессе коагуляционного гемостаза. Тромбин быстро активирует необратимую агрегацию тромбоцитов, которая заканчивается вязким метаморфозом - комплексом морфологических и биохимических изменений тромбоцитов, включающих образование между ними прочных "мостиков", увеличение проницаемости мембран, дегрануляцию и разрушение клеток. Уплотнение тромбоцитарного тромба. Во время агрегации активируется сократительный белок тромбоцитов - тромбостенин. С его участием происходит изменение формы тромбоцитов и их максимальное приближение друг к другу в агрегатах, которые становятся плотными и малопроницаемыми для крови. Уплотнению (формированию стабильного) тромбоцитарного тромба способствуют также нити нерастворимого фибрина, образующиеся в зоне повреждения сосудистой стенки. Таким образом, ведущую роль в механизмах гемостаза играют тромбоциты. Выделение ими тромбопластина способствует активации внешнего пути свертывания крови. 26.1.2. Коагуляционный гемостаз При повреждении более крупных сосудов (артерий и вен) гемостаз осуществляется не только при участии тромбоцитов, но и благодаря свертыванию крови и образованию коагуляционного тромба. Необходимым условием для возникновения коагуляционного тромба является взаимодействие не только плазменных и тромбоцитарных, но и тканевых факторов. Фосфолипиды тромбоцитарных мембран (ф.3 тромбоцитов) являются местом, где происходит фиксация прокоагулянтов и их активация. Свертывание крови - сложный аутокаталитический процесс, при котором происходит последовательная активация неактивных плазменных факторов и образование сериновых протеаз. Выделяют три последовательные стадии коагуляционного гемостаза, в частности представенные образованием: 1) активной протромбиназы; 2) тромбина; 3) фибрина. Образование активной протромбиназы происходит по внутреннему и внешнему пути. Внутренний путь образования протромбиназы начинается с контактной активации фактора XII при повреждении сосудистой стенки. Этому способствуют обнаженные нити коллагена и действие протеаз поврежденного эндотелия (рис.26-1). Фаза контактной активации завершается образованием активного ф. XI (ф. ХIа). В этом процессе участвуют факторы Флетчера (плазменный прекалликреин, ПП) и Фитцджеральда (высокомолекулярный кининоген, ВМК), которые ускоряют активацию ф. ХI и дополнительно обеспечивают активацию ф. XII, а также ионы цинка . Фактор ХIа на мембране тромбоцитов превращает ф.IХ в ф. IХа. Далее образуется энзимсубстратный комплекс с включением ф.IХа, ф. Х, кофермента ф.VIII и участием ионов Са2+. Результатом этого процесса служит образование ф.Ха. . Повреждение сосудистой стенки нарушения слоя эдотелиальных гликозаминогликанов, обнажение коллагеновых нитией,высвобождение ф.III и ферментов)  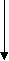 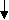 ф.VII ф.VIIa +ф.III-+ Ca2+  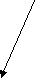            Внутренний путь (время : 25-38 сек) Внешний путь (время 10-14 сек) ф.Х II ф.ХIIa Тканевой фактор (ф.III) +Ca2+ ф.Х I ф.Х a  ф.IХ-+Ca2+ ф.IХ a + фVIII  Рис. 26-1. Схема образования активной протромбиназы Фактор VIII является сложным мультимерным белком, состоящим из нескольких субъединиц. В качестве транспортной субъединицы ф.VIII служит фактор Виллебранда (ф.W), который обеспечивает стабильность в циркуляторном русле ф.VIII и необходимую концентрацию его в зоне поврежденияПоэтому при выраженном дефиците ф.W отмечается дефицит активности ф.VIII. Внешний путь образования протромбиназы реализуется при повреждении сосудистой стенки и взаимодействии тканевых, тромбоцитарных и плазменных факторов гемостаза. При повреждении тканей (например, сосудистой стенки) в кровь попадает тканевой тромбопластин (ф.III), представляющий собой липопротеид, содержащий фосфолипиды и обладающий протеазной активностью. Большую роль в механизмах высвобождения данного тканевого фактора могут играть цитокины (ИЛ-1, ИЛ-8, ФНОα), которые активируют образование и выделение ф. III из эндотелиальных клеток и моноцитов. Тканевой тромбопластин образует комплекс с ф.VII и ионами Са2+; этот комплекс активирует ф. Х. Внешний механизм ускоряет образование активной протромбиназы, представленной комплексом (ф. Ха + ф.V + ф.3 тромбоцитов + Са2+). Существует дополнительная возможность активации ф.IX и XI комплексом ф.III- ф.VII (петля Джоссо), что способствует усилению образования тромбина во внутреннем пути. Образование тромбина происходит из протромбина, расщепляемого с участием активной протромбиназы (рис. 26-2). Фактор Ха, входящий в состав протромбиназы, отщепляет от молекулы протромбина большой фрагмент и образуется неактивный промежуточный продукт - протромбин 2, в дальнейшем он расщепляется ф.Ха до тромбина, который расщепляет фибриноген до фибрина. Образовавшийся тромбин регулирует тромбиногенез, расщепляя молекулу протромбина до неактивного протромбина 1 и тем самым, препятствуя образованию новых порций тромбина. Основная функция тромбина – расщепление фибриногена и образование фибрина. Он также способствует агрегации и реакции высвобождения тромбоцитов, биосинтезу тромбоксана А2, активации ф.XIII и др. (рис. 26-3) В клинике многофакторное влияние тромбина (особенно при гипертромбинемии) на гемостаз имеет определяющее значение у больных с синдромом диссеминированного внутрисосудистого свертывания крови. Образование фибрина происходит под влиянием тромбина, расщепляющего фибриноген и превращающего его сначала в растворимый, а позже - и в нерастворимый фибрин (рис. 26-2). Превращение фибриногена в фибрин осуществляется в три стадии. 1-я стадия - протеолиз фибриногена тромбином (пептиды А и В отщепляются от аминокислотного участка - и -цепей) и образование фибрин-мономера. 2-я стадия - полимеризация фибрин-мономера и образование растворимого фибрин - полимера, чувствительного к плазмину. З-я стадия - стабилизация растворимого фибрина под влиянием ф. ХIII и образование нерастворимого фибрина, устойчивого к плазмину. 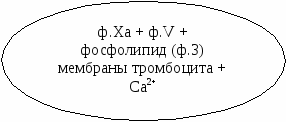 Протромбин (ф.II) тромбин (II a )  Ретракция фибрина         Фибриноген фибрин - (Ф.I) мономер ( Ф.i А) XIII +Ca 2+ XIIIa  +ФПА+ФПВ   Фибрин I полимер растворимый Фибрин II- полимер ( нерастворимый ) ФП В Тромбостенин тромбоцитов Рис. 26-2. Схема образования тромбина и фибрина (общий путь) Ф.ХIII (трансамидаза, фибринстабилизирующий фактор) синтезируется в печени, находится в плазме, тромбоцитах, эритроцитах и сосудистой стенке. В плазме ф. ХIII находится в виде неактивного предшественника, который активируется тромбином в присутствии ионов Са2+. Ф.ХIIIа стабилизирует фибрин посредством образования в молекуле фибрин-полимера ковалентных поперечных связей. После стабилизации фибрина образуется красный тромб, состоящий из нерастворимого фибрина и форменных элементов крови (преимущественно эритроцитов). Дальнейшее уплотнение тромба происходит за счет ретракции (сжатия) под влиянием тромбостенина тромбоцитов. 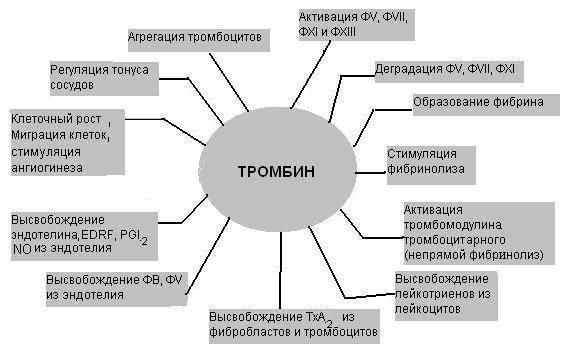 Рис. 26-3. Эффекты действия тромбина 26.1.3. Антикоагулянтная система крови Скорость образования тромба, его размеры, возможность спонтанного лизиса зависят не только от активности факторов свертывания, но и от содержания естественных антикоагулянтов в крови и активности фибринолитической системы. Естественные антикоагулянты подразделяются на первичные и вторичные. Первичные антикоагулянты постоянно образуются в организме и поступают в кровь, где взаимодействуют с активной формой прокоагулянтов и ингибируют их. К первичным антикоагулянтам относят антитромбин III, гепарин, кофактор II гепарина, протеин. С, протеин S, тромбомодулин, альфа2-макроглобулин и др. Антитромбин III (АТIII)- является 2-глобулином с молекулярной массой 58000, образующемся в печени и эндотелиальных клетках. АТ III инактивирует факторы IIа, IХа, Xа, XIIа, XIа, XIIIа, стимулируя образование энзим-ингибиторного комплекса с включением в них гепарина. Кинетика этого процесса зависит от последовательности включения в комплекс АТ III, гепарина и энзима-коагулянта. Гепарин - сульфатированный гликозаминогликан с молекулярной массой от 4000 до 40 000. Он синтезируется в базофилах крови и тучных клетках. В большом количестве содержится в печени и легких.  Суммарно гепарин увеличивает активность АТ III примерно в 2000- 3000 раз, то есть включается как ингибитор свертывания крови немедленного действия. Гепарин, соединяясь с АТ III, изменяет его конформационную структуру. При этом активный центр АТ III становится “ доступнее “ для тромбина. Суммарно гепарин увеличивает активность АТ III примерно в 2000- 3000 раз, то есть включается как ингибитор свертывания крови немедленного действия. Гепарин, соединяясь с АТ III, изменяет его конформационную структуру. При этом активный центр АТ III становится “ доступнее “ для тромбина. На долю АТ III и гепарина приходится примерно 80% всей антикоагулянтной активности крови. Комплекс АТ III-гепарин может фиксироваться на мембранах эндотелиальных клеток, обеспечивая тромборезистентность сосудистой стенки. 2-макроглобулин - гликопротеин, обладающий неспецифической антипротеазной активностью. Он обратимо связывает и транспортирует ф.IIа , XIIa , XIа, калликреин, плазмин, трипсин, хемотрипсин и протеазы острой фазы воспаления. -2-макроглобулин взаимодействует с тромбином значительно медленнее, чем АТ III. Протеин С - витамин К-зависимый белок, образующийся в печени. Антикоагулянтные свойства проявляет только активная форма протеина С (А-ПрС). Естественным активатором ПрС является тромбин. В организме активации ПрС осуществляется на поверхности мембран эндотелиоцитов с участием мембранного белка эндотелиальных клеток - тромбомодулина. Протеолитическая активность комплекса тромбомодулин - ПрС значительно усиливается в присутствии другого витамин К-зависимого белка - протеина S, фосфолипидов клеточной мембраны тромбоцитов. А-ПрС ингибирует неферментные факторы свертывания -Va и VIIIa , подвергая их протеолизу. Тромбомодулин - белок, интегрированный в состав клеточной мембраны эпителия. Он обнаружен в эндотелии макро - и микрососудов всех органов, за исключением микрососудов мозга. Тромбомодулин имеет большое сродство к тромбину и обратимо связывается с ним, при этом ионы Са 2+ не требуются. После соединения с тромбомодулином в молекуле тромбина происходят конформационные изменения и вновь образованный комплекс проявляет в присутствии ионов Са2+ свойства активации ПрС. Скорость этого процесса индуцируется тромбином в 20000 раз. Тромбомодулин способствует высвобождению тканевого активатора плазминогена, снижает активность ингибитора тканевого тромбопластина (антитромбопластина). Протеин S (ПрS) - гликопротеин, который образуется в печени и эндотелии и содержится в гранулах тромбоцитов. ПрS значительно усиливает антикоагулянтное действие А-ПрС. Основная функция ПрS - оптимизация связывания активного ПрС с поверхностью мембран, что катализирует протеолитическую инактивацию ф.Vа и фVIIIа. ПрS с участием А-ПрС. блокируют рецепторы тромбоцитов к фактору Xa. Взаимодействие ПрС, тромбина, тромбомодулина и ПрS происходит при участии клеточной мембраны эндотелия, являющейся не только ареной, на которой разыгрываются события, приводящие к образованию А-ПрС и реализации соответствующего антикоагулянтного механизма, но и активным участником процесса, так как в нем образуются тромбомодулин и ПрS (рис .26-4). Помимо антикоагулянтной активности А-ПрС и ПрS обладают профибринолитическим действием. 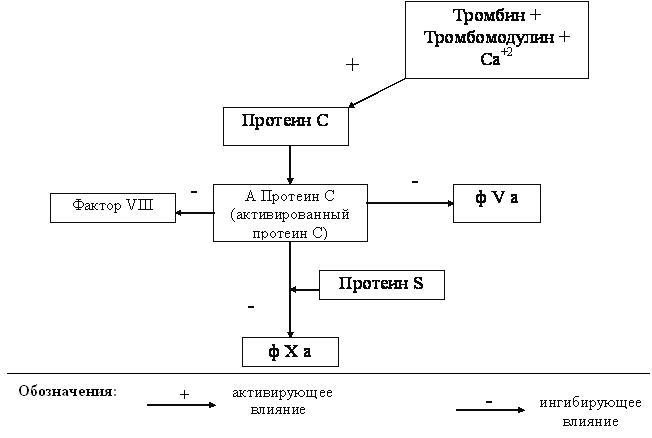 |
