Справочный материал. Глава 24 – Кровь. Справочный материал по Физиологии. Глава 24 Кровь. Кровь относится к жидкостям внутренней среды организма
 Скачать 1.04 Mb. Скачать 1.04 Mb.
|
|
Рис. 24–21. Тромбоцит имеет форму овального или округлого диска. В цитоплазме видны мелкие скопления гликогена и крупные гранулы нескольких типов. Периферическая часть содержит циркулярные пучки микротрубочек (необходимы для сохранения овальной формы тромбоцита), а также актин, миозин, гельзолин и другие сократительные белки, нужные для изменения формы тромбоцитов, их взаимной адгезии и агрегации, а также для ретракции образовавшегося при агрегации тромбоцитов сгустка крови. По периферии тромбоцита расположены также анастомозирующие мембранные канальцы, открывающиеся во внеклеточную среду и необходимые для секреции содержимого a гранул. В цитоплазме рассеяны узкие, неправильной формы мембранные трубочки, составляющие плотную тубулярную систему; трубочки содержат циклооксигеназу (необходима для окисления арахидоновой кислоты и образования тромбоксана TXA2; ацетилсалициловая кислота (аспирин) необратимо ацетилирует циклооксигеназу, локализованную в трубочках плотной тубулярной системы, что блокирует образование тромбоксана, необходимого для агрегации тромбоцитов; в результате функция тромбоцитов нарушается, и время кровотечения удлиняется). [11]. Гликокаликс. Выступающие наружу части молекул интегральных белков плазматической мембраны, богатые полисахаридными боковыми цепями (гликопротеины), создают внешнее покрытие липидного бислоя — гликокаликс. Здесь же адсорбированы факторы коагуляции и иммуноглобулины. На наружных частях гликопротеиновых молекул находятся рецепторные места. После их соединения с агонистами индуцируется сигнал активации, передающийся к внутренним частям периферической зоны тромбоцитов. Плазматическая мембрана содержит гликопротеины, выполняющие роль рецепторов при адгезии и агрегации тромбоцитов (рис. 24–22). Так, гликопротеин Ib (GP Ib, Ib IX) важен для адгезии тромбоцитов, он связывается с фактором фон Виллебранда и подэндотелиальной соединительной тканью. Гликопротеин IV (GP IIIb) — рецептор тромбоспондина. Гликопротеин IIb IIIa (GP IIb IIIa) — рецептор фибриногена, фибронектина, тромбоспондина, витронектина, фактора фон Виллебранда; эти факторы способствуют адгезии и агрегации тромбоцитов, опосредуя формирование между ними «мостиков» из фибриногена. 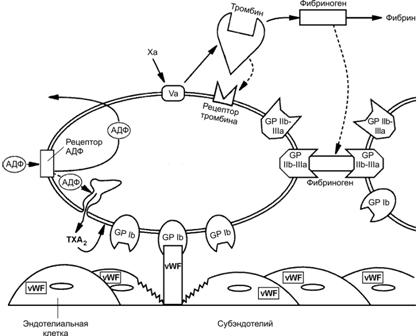 Рис. 24–22. Мембранные рецепторы тромбоцита [11]. При повреждении стенки сосуда рецепторы тромбоцитов связывают различные факторы. В результате происходят адгезия и агрегация тромбоцитов. Так, гликопротеин Ib (GP Ib) связывает фактор фон Виллебранда (vWF) и опосредует адгезию к стенке повреждённого сосуда. Гликопротеин IIb-IIIa (GP IIb-IIIa) связывает фибриноген и опосредует взаимодействия между тромбоцитами. Плазменный фактор свёртывания Va мембраны тромбоцита связывает фактор гемокоагуляции Xa. Взаимодействие АДФ с соответствующим рецептором тромбоцита стимулирует циклооксигеназный путь окисления арахидоновой кислоты с выделением тромбоксана TXА2, способствующего дальнейшей агрегации тромбоцитов. Гранулы. Тромбоциты содержат 3 типа гранул (-, -, ) и микропероксисомы. -Гранулы содержат различные гликопротеины (фибронектин, фибриноген, фактор фон Виллебранда), связывающие гепарин белки (например, фактор 4 тромбоцитов), тромбоцитарный фактор роста PDGF и трансформирующий фактор роста b, плазменные факторы свёртывания VIII и V, а также тромбоспондин (способствует адгезии и агрегации тромбоцитов) и рецептор клеточной адгезии GMP-140. Таким образом, -гранулы содержат белки, выделяющиеся из активированных тромбоцитов. Так, фактор 4 тромбоцитов регулирует проницаемость стенки сосудов, мобилизацию Са2+ из кости, хемотаксис моноцитов и нейтрофилов, способен нейтрализовать противосвёртывающие свойства гепарина. Тромбоцитарный фактор роста (PDGF) и трансформирующий фактор роста b (TGFb), как и фактор 4, выступают в роли хемоаттрактантов для лейкоцитов и фибробластов. PDGF влияет на пролиферацию многих клеток и имеет большое значение при заживлении ран, поскольку стимулирует пролиферацию фибробластов, ускоряя заживление ран. Тромбоспондин, секретируемый активируемым тромбоцитом, связывается с GP IIIb плазмолеммы и внеклеточными компонентами (гепарином, фибриногеном, фибронектином, коллагеном типа V, ламинином, плазминогеном), способствуя адгезии и агрегации тромбоцитов. Фактор V необходим в качестве кофактора для опосредованной фактором Xa активации протромбина с последующим его конвертированием в тромбин. В активированных тромбоцитах фактор V встраивается в плазмолемму и в виде Va служит рецептором для фактора Xa (см. рис. 24–22). GMP 140 (селектин P) — мембранный белок гранул, при активации и дегрануляции тромбоцита встраивается в плазмолемму и служит рецептором адгезии. Гранулы содержат также фибронектин, фибриноген, фактор фон Виллебранда. Другие гранулы. Гранулы накапливают неорганический фосфат Pi, АДФ, АТФ, Ca2+, серотонин и гистамин (серотонин и гистамин не синтезируются в тромбоцитах, а поступают из плазмы). Гранулы содержат лизосомные ферменты и могут участвовать в растворении тромба. Микропероксисомы обладают пероксидазной активностью. Функции тромбоцитов. В физиологических условиях тромбоциты находятся в неактивном состоянии, т.е. свободно циркулируют в крови, не адгезируют друг с другом и не прикрепляются к эндотелию сосуда (частично это связано с тем, что эндотелиальные клетки вырабатывают простациклин PGI2, препятствующий адгезии тромбоцитов к стенке сосуда). Однако при повреждении кровеносного сосуда тромбоциты вместе с плазменными факторами свёртывания крови образуют сгусток крови — тромб, предотвращающий кровотечение (рис. 24–23). Остановка кровотечения происходит в 3 этапа. 1. Сначала происходит сокращение просвета кровеносного сосуда. 2. Далее в повреждённом участке сосуда тромбоциты прикрепляются к стенке сосуда и, наслаиваясь друг на друга, образуют тромбоцитарную гемостатическую пробку (белый тромб). Эти события (изменение формы кровяных пластинок, их адгезия и агрегация) обратимы, так что слабо агрегированные тромбоциты могут отделяться от гемостатических тромбоцитарных пробок и возвращаться в кровоток. 3. Наконец, растворимый фибриноген превращается в нерастворимый фибрин, который формирует прочную трёхмерную сеть, в петлях которой расположены клетки крови, в том числе и эритроциты; это фибриновый — красный тромб. 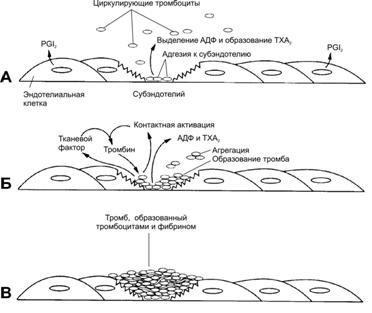 Рис. 24–23. Образование тромба [11]. А — образование тромба начинается с прикрепления тромбоцитов к подэндотелиальной соединительной ткани. Свойства интактного эндотелия совместно с секретируемым эндотелиальными клетками простациклином PGI2 препятствуют адгезии тромбоцитов. Однако, тромбоциты прикрепляются к коллагену подэндотелиальной соединительной ткани в местах повреждения стенки сосуда. Эта адгезия вызывает активацию и агрегацию тромбоцитов с последующим освобождением АДФ и образованием тромбоксана TXА2. Б — образование тромбоксана TXА2 и дальнейшее выделение АДФ стимулируют дополнительную агрегацию тромбоцитов в месте повреждения до тех пор, пока не образуется тромбоцитарная пробка. Освобождение тканевого фактора и контактная активация также запускают процессы внешней и внутренней коагуляции, в результате которых образуется тромбин. В — в результате коагуляции формируются нити фибрина, вплетающиеся в тромбоцитарный тромб и стабилизирующие его. Адгезия. В адгезии тромбоцитов участвуют коллаген, гликопротеин Ib, фактор фон Виллебранда, Ca2+ и другие факторы (например, тромбоспондин, фибронектин). Коллаген базальной мембраны эндотелия и подэндотелиальной соединительной ткани служит субстратом для адгезии тромбоцитов и стимулирует их последующую агрегацию. Гликопротеин Ib тромбоцита взаимодействует с фактором фон Виллебранда — комплексом белков, содержащихся в основном в гранулах тромбоцитов, частично в эндотелии и его базальной мембране. Первичная агрегация. Вслед за адгезией начинается агрегация тромбоцитов. При этом Ca2+–зависимый трансмембранный гликопротеин IIb IIIa связывается с фибриногеном. Фибриноген опосредует связывание тромбоцитов, обеспечивая их агрегацию. Агрегацию запускают различные вещества: адреналин (через адренорецепторы в плазматической мембране тромбоцитов), АДФ (из гранул), тромбин. Вторичная агрегация (образование тромбоцитарной пробки). По мере прикрепления всё большего количества тромбоцитов к подэндотелиальной соединительной ткани они активируются. Активированные тромбоциты приобретают шаровидную форму, образуют метаболиты арахидоновой кислоты и секретируют содержимое - и гранул. Если повреждение сосуда небольшое, то достаточно тромбоцитарной пробки (в частности, она может сама по себе остановить кровотечение). В противном случае включается механизм свёртывания крови. Коагуляция, или свёртывание крови. Тромбоциты высвобождают фибриноген в дополнение к уже присутствующему в плазме в норме. Фибриноген с помощью факторов свёртывания конвертируется в фибрин, образующий плотную фиброзную прокладку, к которой прикрепляется всё больше тромбоцитов и других клеток крови. Ретракция фибринового сгустка. Сгусток крови, или фибриновый гель — прикреплённая к повреждённой поверхности сосудов трёхмерная сеть фибриновых волокон, в которой находятся клетки крови, кровяные пластинки и сыворотка крови. В течение десятков минут после образования сгустка происходит его ретракция (сжатие), в результате которой из фибринового геля удаляется его жидкая часть (сыворотка), т.е. сгусток крови становится плотным тромбом. Ретракция кровяного сгустка предупреждает полную закупорку сосудов, создавая возможность восстановления кровотока. Судьба тромба. Тромб первоначально выступает в просвет сосуда, но позже он сокращается (ретракция тромба) и уплотняется. По мере заживления стенки сосуда тромб удаляется при помощи плазмина. Плазмин образуется из плазминогена, синтезируемого в печени. Дополнительно из гранул тромбоцитов выделяются ферменты, разрушающие тромб. Стенка сосуда восстанавливается благодаря пролиферации ГМК и фибробластов, накоплению нового соединительнотканного матрикса, восстановлению эндотелия. Образованию фибринового тромба предшествует каскад протеолитических реакций, приводящий к активации фермента тромбина, который и превращает фибриноген в фибрин. Таким образом, на одном из этапов тромбообразования происходит свёртывание крови — гемокоагуляция — часть системы гемостаза, самое непосредственное отношение к которой имеют тромбоциты. Гемостаз В прикладном смысле термин «гемостаз» (от гр. haima кровь, stasis остановка) применяют для обозначения собственно процесса остановки кровотечения. Система гемостаза включает факторы и механизмы трёх категорий: свёртывающую, противосвёртывающую и фибринолитическую. Свёртывающая система, а именно плазменные факторы свёртывания (прокоагулянты), формируя сложный гемокоагуляционный каскад, обеспечивает коагуляцию фибриногена и тромбообразование (Рис. 24–24). Каскад реакций, ведущий к образованию тромбина, может реализоваться двумя путями — внешним (на рисунке слева и сверху) и внутренним (на рисунке справа и сверху). Для инициации реакций внешнего пути необходимо появление тканевого фактора на внешней поверхности плазматической мембраны тромбоцитов, моноцитов и эндотелия. Внутренний путь начинается с активации фактора ХII при его контакте с повреждённой поверхностью эндотелия. Понятие о внутреннем и внешнем путях свёртывания достаточно условно, т.к. каскад реакций свёртывания крови идёт преимущественно внешним путём, а не по двум относительно независимым путям. Противосвёртывающая система физиологических антикоагулянтов обусловливает торможение или блокаду свёртывания крови. Фибринолитическая система реализует лизис фибринового тромба. 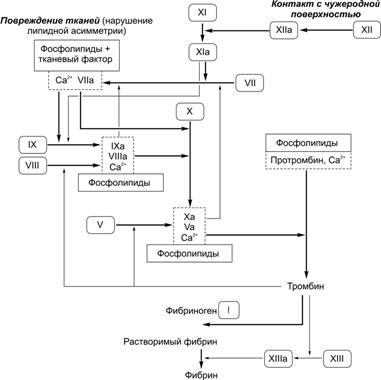 Рис. 24–24. Гемокоагуляционный каскад [8]. Активация фактора XII запускает внутренний (контактный) механизм; высвобождение тканевого фактора, а активация фактора VII запускает внешний механизм свёртывания. Оба пути приводят к активации фактора Х. В прямоугольниках с закруглёнными углами — номера плазменных факторов свёртывания. Ферментные комплексы — рядом расположенные прямоугольники сплошного и прерывистого начертания границ. Плазменные факторы свёртывания — различные компоненты плазмы, реализующие образование сгустка крови. Факторы свёртывания обозначают римскими цифрами (к номеру активированной формы фактора добавляют строчную букву «а»). I — растворимый фибриноген, превращающийся в нерастворимый фибрин под влиянием тромбина (фактор IIа). II — протромбин (профермент), превращающийся в протеазу тромбин (фактор IIa) под влиянием комплекса фактора Xa, фосфолипидов мембран тромбоцитов и других клеток, Са2+ и фактора Va. III — тканевый фактор. Комплекс тканевого фактора, фосфолипидов, фактора VIIa и Са2+ запускает внешний механизм свёртывания. IV — Ca2+. V — проакцелерин — предшественник акцелерина (Va) — белка-активатора мембранного комплекса Xa-Va-Ca2+. VII — проконвертин (профермент), VIIа — протеаза, активирующая факторы X и IX. VIII — неактивный антигемофильный глобулин А — предшественник фактора VIIIa (активного антигемофильного глобулина) — белка-активатора мембранного комплекса IXa-VIIIa-Ca2+. Недостаточность фактора VIII приводит к развитию классической гемофилии А, наблюдающейся только у мужчин. IX — неактивный антигемофильный глобулин В (профермент, неактивный фактор Кристмаса) — предшественник активного антигемофильного фактора В (активный фактор Кристмаса) — протеазы, активирующей фактор X. Недостаточность фактора IX приводит к развитию гемофилии В (болезнь Кристмаса). X — неактивный фактор Стюарта–Прауэр (активная форма — фактор Xa — протеаза, активирующая фактор II), недостаточность фактора Стюарта приводит к дефектам свёртывания. XI — профермент контактного пути свёртывания крови — неактивный плазменный предшественник тромбопластина (активная форма — фактор XIa — сериновая протеаза, превращающая фактор IX в фактор IXa). Недостаточность фактора XI приводит к кровоточивости. XII — неактивный фактор Хагемана — профермент контактного пути свёртывания крови, активная форма — фактор XIIa (активный фактор Хагемана) — активирует фактор XI, прекалликреин (профермент контактного пути свёртывания крови), плазминоген). XIII — фибринстабилизирующий фактор (фактор Лаки–Лорана) — активированный тромбином фактор XIII (фактор XIIIа), образует нерастворимый фибрин, катализируя образование амидных связей между молекулами фибрина-мономера, фибрином и фибронектином. Внешний путь занимает центральное место в свёртывании крови. Ферментные мембранные комплексы (см. ниже) образуются только при наличии на внешней поверхности плазматической мембраны тромбоцитов и эндотелиальных клеток тканевого фактора и отрицательно заряженных фосфолипидов, т.е. при формировании отрицательно заряженных (тромбогенных) участков и экспозиции апопротеина тканевого фактора. При этом тканевый фактор и поверхность клеточной мембраны становятся доступными для плазменных факторов. Активация ферментов. В циркулирующей крови содержатся проферменты (факторы II, VII, IX, X). Белки–кофакторы (факторы Vа, VIIIa, а также тканевый фактор — фактор III) способствуют превращению проферментов в ферменты (сериновые протеазы). Ферментные мембранные комплексы. При включении каскадного механизма активации ферментов последовательно образуются 3 связанных с фосфолипидами клеточной мембраны ферментных комплекса. Каждый комплекс состоит из протеолитического фермента, белка–кофактора и ионов Са2+: VIIa–тканевый фактор–фосфолипид–Ca2+, IXa–VIIIa–фосфолипид–Ca2+ (теназный комплекс, активатор фактора Х); Xa–Va–фосфолипид–Ca2+ (протромбиназный комплекс, активатор протромбина). Каскад ферментативных реакций завершается образованием мономеров фибрина и последующим формированием тромба. Ионы Ca2+. Взаимодействие ферментных комплексов с клеточными мембранами происходит с участием ионов Са2+. Остатки карбоксиглутаминовой кислоты в факторах VIIа, IXа, Xа и протромбине обеспечивают взаимодействие этих факторов посредством Са2+ с отрицательно заряженными фосфолипидами клеточных мембран. Без ионов Са2+ кровь не свёртывается. Именно поэтому для предотвращения свёртывания крови снижают концентрацию Ca2+ деионизацией кальция цитратом (цитратная кровь) либо осаждением кальция в виде оксалатов (оксалатная кровь). Витамин К. Карбоксилирование остатков глутаминовой кислоты в проферментах прокоагулянтного пути катализирует карбоксилаза, коферментом которой является восстановленная форма витамина К (нафтохинона). Поэтому недостаточность витамина К тормозит свёртывание крови и сопровождается кровоточивостью, подкожными и внутренними кровоизлияниями, а структурные аналоги витамина К (например, варфарин) применяют в клинической практике для предупреждения тромбозов. Контактный путь свёртывания крови начинается с взаимодействия профермента (фактора XII) с повреждённой эндотелиальной поверхностью сосудистой стенки. Такое взаимодействие приводит к активации фактора XII и инициирует образование мембранных ферментных комплексов контактной фазы свёртывания. Эти комплексы содержат ферменты калликреин, факторы XIа (плазменный предшественник тромбопластина) и XIIа (фактор Хагемана), а также белок–кофактор — высокомолекулярный кининоген. Противосвёртывающая система крови. Физиологические ингибиторы играют важную роль в поддержании крови в жидком состоянии и препятствуют распространению тромба за пределы повреждённого участка сосуда. Тромбин, образующийся в результате реакций свёртывания крови и обеспечивающий формирование тромба, вымывается током крови из тромба; в дальнейшем тромбин инактивируется при взаимодействии с ингибиторами ферментов свёртывания крови и в то же время активирует антикоагулянтную фазу, тормозящую образование тромба. Антикоагулянтная фаза. Эту фазу запускает тромбин (фактор II), вызывая образование ферментных комплексов антикоагулянтной фазы на неповреждённом эндотелии сосудов. В реакциях антикоагулянтной фазы, помимо тромбина, участвуют тромбомодулин эндотелиальных клеток, витамин К–зависимая сериновая протеаза — протеин С, активирующий протеин S и плазменные факторы свёртывания Va и VIIIa. Последовательность событий антикоагулянтной фазы такова: тромбин в сочетании с Са2+ образует мембранный комплекс с тромбомодулином; этот комплекс активирует протеин С, активированный протеин С вместе с Са2+ образует мембранный комплекс с протеином S; активированный протеин С в составе комплекса гидролизует пептидные связи факторов Vа и VIIIа и превращает их в неактивные пептиды. Таким образом, тромбин, активируя протеин С, тормозит процесс свёртывания крови. Физиологические ингибиторы ферментов свёртывания крови (антитромбин III, гепарин, 2-макроглобулин, антиконвертин, 1-антитрипсин) ограничивают распространение тромба местом повреждения сосуда. Антитромбин III — наиболее сильный ингибитор свёртывания крови; на его долю приходится до 80% антикоагулянтной активности крови. Этот ингибитор инактивирует сериновые протеазы тромбин, факторы IXa, Xa, XIIa, калликреин, плазмин и урокиназу. Гепарин синтезируется в тучных клетках. В присутствии гепарина повышается сродство мощного антикоагулянта антитромбина III к сериновым протеазам крови. После образования комплекса «антитромбин III–гепарин–фермент» гепарин освобождается из комплекса и может присоединяться к другим молекулам антитромбина. 2-Макроглобулин образует комплекс с тромбином, в результате чего фибриноген становится недоступным для тромбина. Тканевый ингибитор прокоагулянтного пути свёртывания — синтезируется в эндотелии сосудов и связывается с комплексом «VIIa–тканевый фактор–фактор Ха–Ca2+». 1-Антитрипсин ингибирует активность тромбина, фактора ХIа и калликреина. Фибринолитическая система. Тромб может раствориться в течение нескольких дней после образования. При фибринолизе — ферментативном расщеплении волокон фибрина — образуются растворимые пептиды. Фибринолиз происходит под действием сериновой протеазы плазмина, точнее — при взаимодействии фибрина, плазминогена и тканевого активатора плазминогена. Плазминоген — неактивный профермент плазмина — синтезируется в печени, почках и костном мозге. Плазмин образуется из плазминогена под влиянием активаторов — тканевого активатора плазминогена, урокиназы, стрептокиназы, фактора XIIа, калликреина. Активность плазмина подавляют ингибиторы сериновых протеаз 2-антиплазмин, 2-макроглобулин, 1-антитрипсин, комплекса «антитромбин–гепарин». Тканевый активатор плазминогена — протеолитический фермент, содержащийся в эндотелии сосудов —превращает плазминоген в плазмин. Абсорбированный на фибриновом сгустке плазминоген под действием активаторов превращается в плазмин, а плазмин гидролизует фибрин с образованием растворимых пептидов. Тромболитическая терапия. Снижение фибринолитической активности крови сопровождается тромбозами (образование тромбов в кровеносных сосудах). Для тромболитической терапии при инфаркте миокарда, тромбозах вен и артерий применяют урокиназу, стрептокиназу и тканевый активатор плазминогена. Лабораторные показатели системы гемостаза. Кровь здорового человека in vitro свёртывается за 5–10 мин. При этом образование протромбиназного комплекса занимает 5–8 мин, активация протромбина — 2–5 с и превращение фибриногена в фибрин — 2–5 с. В клинической практике для оценки гемостаза оценивают содержание разных компонентов системы свёртывания, антикоагулянтов и фибринолиза. К простейшим лабораторным методам относят определение времени кровотечения, тромбинового и протромбинового времени, активированного частичного тромбопластинового времени и протромбинового индекса. Определение времени кровотечения. Существует несколько методов определения времени кровотечения. Классический метод — метод Дьюка. Техника проведения: 1. В нижненаружный край уха (или в кончик мякоти пальца при модификации пробы Дьюка) иглой или пером-скарификатором производят укол на глубину около 4 мм, после чего каждые 15–30 с фильтровальной бумагой, не касаясь ранки, снимают каплю крови. 2. Счёт времени ведут от момента появления первой капли до остановки кровотечения. 3. В норме кровотечение прекращается через 1–4 мин. Определение протромбинового индекса. Протромбиновый индекс — лабораторный показатель содержания в плазме крови протромбина (фактора II) и других компонентов протромбинового комплекса (факторов VII, X, V). 1. Устанавливают время свёртывания цитратной плазмы крови, добавляя к ней тромбопластин определённой активности и раствор хлорида кальция. 2. Сравнивают протромбиновое время плазмы крови больного (в секундах) и контрольной нормальной плазмы донора (в секундах) и вычисляют протромбиновый индекс (в процентах) как частное от деления протромбинового времени донора на протромбиновое время пациента. В норме протромбиновый индекс составляет 85–100%. Нарушения системы гемостаза подразделены на три группы. Усиление свёртываемости крови и тромбообразования — гиперкоагуляция и развитие тромботического синдрома. Уменьшение свёртываемости крови и тромбообразования — гипокоагуляция и развитие геморрагических синдромов. Фазное нарушение состояния системы гемостаза: фаза гиперкоагуляции, сопровождаясь интенсивным потреблением прокоагулянтов, переходит в фазу гипокоагуляции. В результате развивается коагулопатия потребления и тромбогеморрагический синдром. Патология тромбоцитов и расстройства системы коагуляции. Тромбоциты играют ведущую роль в остановке кровотечения; наличие дефицита и/или дефекта кровяных пластинок приводят к удлинению времени кровотечения и геморрагическому диатезу. Тромбоцитопения — частая причина патологической кровоточивости. Созревание мегакариоцитов избирательно подавляют тиазидные диуретики, этанол и препараты, используемые при химиотерапии опухолей. Неэффективный тромбоцитопоэз возникает при дефиците витамина В12 и фолиевой кислоты. В костном мозге находят морфологически и функционально аномальные мегакариоциты, дающие начало дефектным и быстро разрушающимся тромбоцитам. Усиленное разрушение тромбоцитов на периферии — наиболее распространённая форма тромбоцитопений, характеризуется укороченным периодом жизни тромбоцитов и увеличенным количеством мегакариоцитов костного мозга; эти расстройства обозначают как иммунная или неиммунная тромбоцитопеническая пурпура. Тромбоцитопатия — состояние, характеризующееся нормальным количеством тромбоцитов, не способных адекватно участвовать в гемостазе. Вызванная ЛС дисфункция тромбоцитов — наиболее частая причина тромбоцитопатий. Коагулопатии (расстройства свёртывания крови) подразделяют на наследственные и приобретённые. Наследственные заболевания обычно обусловлены дефектом одного из факторов коагуляции. Классические примеры — дефекты фактора VIII (развивается гемофилия типа А и болезнь фон Виллебранда). Гемофилия типа А — Х–сцепленная рецессивная патология (носители дефектного гена — женщины, болеют мужчины). При дефиците фактора IХ развивается гемофилия типа В. Приобретённые коагулопатии. Их патогенез сложнее, они могут быть обусловлены сочетанием недостаточности факторов свёртывания и другими расстройствами (например, витамин К–зависимые коагулопатии, определяемые недостатком витамина К). Наследственные и приобретённые нарушения гемостаза могут привести как к геморрагическим заболеваниям, характеризующимся кровоточивостью, так и к тромботической болезни. Следует отметить, что повышенная склонность к тромбообразованию и внутрисосудистому свёртыванию (тромбофилии) встречается гораздо чаще, чем гемофилии. Например, частота разных форм гемофилий колеблется в разных странах от 6 до 18 на 100 000 мужчин, в то время как тромбофилии, вызванные дефицитом антитромбина III, встречаются у 1–2 больных на 5000, а при недостатке протеина С — у одного на 15 000 человек. |
