Справочный материал. Глава 24 – Кровь. Справочный материал по Физиологии. Глава 24 Кровь. Кровь относится к жидкостям внутренней среды организма
 Скачать 1.04 Mb. Скачать 1.04 Mb.
|
|
МЕТАБОЛИЗМ ЖЕЛЕЗА Железо участвует в функционировании всех систем организма. Суточная потребность в железе составляет для мужчин 10 мг, для женщин 18 мг (в период беременности и лактации — 38 и 33 мг соответственно). Общее количество железа (преимущественно в составе гема Hb) в организме — около 3,5 г (у женщин — 3,0 г). Железо абсолютно необходимо для эритропоэза. Различают клеточное железо, внеклеточное железо и железо запасов (рис. 24–17). 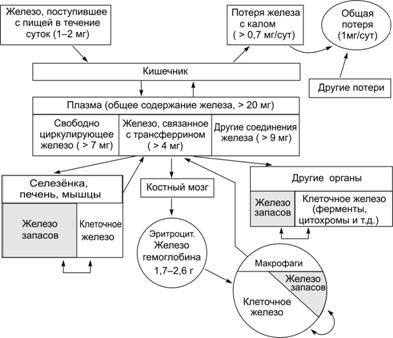 Рис. 24–17. Схема обмена железа (Fe) в организме здорового мужчины с массой тела 70 кг [16] Клеточное железо. Составляет значительную часть от общего количества железа в организме, участвует во внутреннем обмене железа и входит в состав гемсодержащих соединений (гемоглобина, миоглобина, ферментов, например, цитохромов, каталаз, пероксидазы), негемовых ферментов (например, НАДН–дегидрогеназы), металлопротеидов (например, аконитазы). Внеклеточное железо. К нему относят свободное железо плазмы и железосвязывающие сывороточные белки (трансферрин, лактоферрин), участвующие в транспорте железа. Железо запасов. Находится в организме в виде двух белковых соединений — ферритина и гемосидерина — с преимущественным отложением в печени, селезёнке и мышцах и включается в обмен при недостаточности клеточного железа. Основная масса железа организма входит в состав гема (Hb, миоглобин, цитохромы). Часть железа запасается в виде ферритина (в гепатоцитах, макрофагах костного мозга и селезёнки) и гемосидерина (в клетках фон Купффера печени и макрофагах костного мозга). Некоторое количество находится в лабильном состоянии в связи с трансферрином. Железо, необходимое для синтеза гема, извлекается преимущественно из разрушенных эритроцитов. Источники железа — поступление с пищей и разрушенные эритроциты. Железо, поступающее с пищей, всасывается в кишечнике в двенадцатиперстной кишке и начальном отделе тощей кишки. Железо всасывается преимущественно в двухвалентной форме (Fe2+). Всасывание Fe2+ в ЖКТ ограничено и контролируется его концентрацией в плазме крови [соотношением белков — апоферритина (свободного от железа) и ферритина]. Усиливают всасывание аскорбиновая, янтарная, пировиноградная кислоты, сорбит, алкоголь; подавляют — оксалаты, препараты кальция и содержащие кальций продукты (например, творог, молоко и т.д.). В среднем в сутки всасывается 10 мг железа. В ЖКТ железо накапливается в эпителиальных клетках слизистой оболочки тонкого кишечника. Отсюда трансферрин переносит железо в красный костный мозг (для эритропоэза, это всего 5% всосавшегося Fe2+), в печень, селезёнку, мышцы и другие органы (для запасания). Железо погибших эритроцитов при помощи трансферрина поступает в эритробласты красного костного мозга (около 90%), часть этого железа (10%) запасается в составе ферритина и гемосидерина. Физиологическая потеря железа происходит с калом. Незначительная часть железа теряется с потом и клетками эпидермиса. Общая потеря железа — 1 мг/сут. Также физиологическими считают потери железа с менструальной кровью и с грудным молоком. Дефицит железа наступает, когда его потери превышают 2 мг/сут. При дефиците железа развивается самая распространённая анемия — железодефицитная, т.е. анемия вследствие абсолютного снижения ресурсов железа в организме. Причины развития дефицита железа Снижение поступления железа в организм вследствие общего голодания, значительного уменьшения в рационе продуктов питания, содержащих железо, нарушения всасывания железа в ЖКТ (нарушение всасывания Fe2+ развивается при хронических гастритах, энтеритах, резекциях желудка и особенно тонкой кишки). Увеличение потерь железа при хронических, повторных кровопотерях (желудочных, кишечных, маточных и др.), а также массированных кровоизлияниях. Возрастание расходования железа организмов при беременности и последующем вскармливании ребёнка (за этот период теряется в общей сложности более 800 мг железа), особенно на фоне ещё не проявляющегося клинического дефицита железа). Анемия — любое состояние, при котором количество эритроцитов, содержание Hb и Ht снижены относительно нормы (содержание Hb <100 г/л, количество эритроцитов <4,01012/л, содержание железа сыворотки крови <14,3 мкмоль/л). Термин «анемия» без детализации не определяет конкретного заболевания, а лишь указывает на изменения в анализах крови, т.е. анемию следует считать всего лишь одним из симптомов патологических состояний. Важными критериями объективной оценки при анемиях являются средний эритроцитарный объём (в норме составляет 80 94 фемтолитра — фл), среднее содержание Hb в эритроците (в норме — 27 33 пикограмма — пг), содержание железа в крови (норма составляет 14,3–28 мкмоль/л), общая железосвязывающая способность сыворотки (норма — 55–65 мкмоль/л). ФОЛИЕВАЯ КИСЛОТА И ВИТАМИН B12 При массовом образовании новых клеток крови активно синтезируется ДНК. Для этого необходимы витамин B12 и фолиевая кислота. Фолаты и витамин B12 поступают с пищей и всасываются в тонком кишечнике. Витамин В12 Внутренний фактор. Для всасывания витамина B12 в кишечнике необходим (внутренний) фактор Касла, синтезируемый париетальными клетками желудка. Фактор связывает витамин B12 и защищает его от разрушения ферментами. Комплекс внутреннего фактора с витамином B12 в присутствии ионов Ca2+ взаимодействует с рецепторами эпителиальной клетки дистального отдела подвздошной кишки. При этом витамин B12 поступает в клетку, а внутренний фактор высвобождается. Отсутствие внутреннего фактора приводит к развитию анемии. Транспорт витамина B12. Из эпителия кишечника витамин B12 с помощью транскобаламина II переносится в костный мозг (витамин B12 деметилирует фолаты, предотвращая их выход из клеток; участвует в синтезе ДНК) и в печень (для запасания). Транскобаламин II вырабатывают эпителиальные клетки кишечника. Дефицит витамина В12. Алиментарный (пищевой) дефицит витамина В12 в развитых странах встречается редко; исключение составляют грудные дети матерей — строгих вегетарианок. Обычная причина дефицита — нарушение процессов всасывания; одна из причин — дифиллоботриоз (гельминтоз, вызванный Diphyllobothrium latum [Лентец широкий], эндемичен для некоторых районов России). Фолиевая кислота. Фолаты в качестве кофермента участвуют в синтезе пуриновых и пиримидиновых оснований. Алиментарный дефицит фолиевой кислоты — редкое явление; может развиться у грудного ребёнка, вскармливаемого кипячёным или козьим молоком. Нарушение всасывания фолатов наблюдают при синдроме мальабсорбции (болезнь Крона, целиакия), характеризующемся поражением тонкого кишечника. Повышенная потребность в фолатах развивается при состояниях, сопровождающихся усилением метаболических процессов (беременность, хронический гемолиз, злокачественные новообразования). Нарушения метаболизма фолатов могут вызвать некоторые противосудорожные препараты (фенитоин и фенобарбитал). Эритроцитарные антигены и группы крови В составе гликопротеинов и гликолипидов на поверхности эритроцитов существуют сотни антигенных детерминант, или антигенов (Аг), многие из которых определяют групповую принадлежность крови (группы крови). Эти Аг потенциально могут взаимодействовать с соответствующими им антителами (АТ), если бы такие АТ содержались в сыворотке крови. Однако такое взаимодействие в крови конкретного человека не происходит, так как иммунная система уже удалила клоны секретирующих эти АТ плазматических клеток (см. подробнее в главе 29). Однако, если соответствующие АТ попадают в кровь (например, при переливании чужой крови или её компонентов), развивается реакция взаимодействия между эритроцитарными Аг и сывороточными АТ с зачастую катастрофическими последствиями (несовместимость по группам крови). В частности, при этом происходит агглютинация (склеивание) эритроцитов и их последующий гемолиз. Именно по этим причинам столь важно определение как групповой принадлежности переливаемой крови (донорская кровь), так и крови того лица, кому переливают кровь (реципиент), а также неукоснительное выполнение всех правил и процедур при переливании крови или её компонентов (в РФ порядок переливания крови регламентирован приказом МЗ РФ и приложенной к приказу инструкцией по применению компонентов крови). Из сотен эритроцитарных Аг Международное общество переливания крови (The International Society of Blood Transfusion — ISBT) к системам групп крови по состоянию на 2003 г. отнесло следующие (в алфавитном порядке): ABO [в англоязычной литературе принято наименование ABO (буква «O»), в русскоязычной — AB0 (цифра «0»)], Cartwright, Chido/Rodgers, Colton, Cost, Cromer, Diego, Dombrock, Duffy, Er, Gerbich, GIL, GLOB (Globoside), Hh, Ii, Indian, JMH (John Milton Hagen), Kell, Kidd, Knops, Kx, Landsteiner–Wiener, Lewis, Lutheran, MNS, OK, P, Raph, Rh, Scianna, Wright, Xg, Yt. В практике переливания крови (гемотрансфузия) и её компонентов обязательная проверка на совместимость по Аг систем AB0 (4 группы) и Rh (2 группы), итого по 8 группам. Остальные системы (они известны как редкие) к несовместимости по группам крови приводят значительно реже, но также должны учитываться при гемотрансфузиях и при тестировании возможности развития гемолитической болезни новорождённого (см. далее «Rh-система»). Таблица 24–6. Системы групп крови
По классификации Международного Общества Переливания Крови (The International Society of Blood Transfusion — ISBT), 2003. ISBT имеет собственную цифровую классификацию эритроцитарных Аг, номера присваиваются в порядке открытия систем (так, AB0 имеет номер 001, Rh — 004). Помимо перечисленных в табл. 24–6 систем (26 систем Аг с номерами от 001 до 026), ISBT зарегистрировало 6 коллекций Аг (номера 205, 207–211, Аг: Cost; Ii; Er; P, P1, LKE; Lewis-like: Le-c, Le-d; Wright соответственно), а также не входящие ни в системы, ни в коллекции «публичные» Аг (номер 911, 11 Аг) и «частные» Аг (номер 700, 36 Аг). AB0-СИСТЕМА Эритроцитарные Аг системы AB0 — A, B и 0 — относятся к классу гликофоринов. Их полисахаридные цепи содержат Аг–детерминанты — агглютиногены А и В. Формирование агглютиногенов А и В происходит под влиянием гликозилтрансфераз, кодируемых аллелями гена АВ0. Этот ген кодирует три полипептида (А, В, 0), два из них (гликозилтрансферазы А и В) модифицируют полисахаридные цепи гликофоринов, полипептид 0 функционально не активен. В результате поверхность эритроцитов разных лиц может содержать либо агглютиноген А, либо агглютиноген В, либо оба агглютиногена (А и В), либо не содержать ни агглютиногена А, ни агглютиногена В. В соответствии с типом экспрессии на поверхности эритроцитов агглютиногенов А и В в системе AB0 выделено 4 группы крови, обозначаемых римскими цифрами I, II, III и IV. Эритроциты группы крови I не содержат ни агглютиногена А, ни агглютиногена В, её сокращённое наименование — 0(I). Эритроциты группы крови IV содержат оба агглютиногена — AB(IV), группы II — A(II), группы III — B(III). Первые три группы крови обнаружил в 1900 г. Карл Ландштайнер, а четвёртую группу немного позже Декастрелло и Штурли. |
