Справочник практического врача под ред проф. В. В. Гриценко, проф. Ю. Д. Игнатова. Издательский Дом Нева
 Скачать 5.72 Mb. Скачать 5.72 Mb.
|
|
2.1.7. Ганглий Ганглий (греч. ganglion — узел) представляет собой кистозное образование, связанное, как правило, с сухожилием или капсулой сустава [5, 13, 27]. Однако с полостью сустава или сухожильного влагалища он обычно не сообщается. Наиболее частая его локализация — тыльная сторона кистей вдоль разгибателей пальцев в области запястья, близ голеностопного сустава, коленного, реже тазобедренного, иногда в подкожной клетчатке в толще сухожилия, мышцы. Возраст больных — от молодого до старческого, чаще средний. Некоторые авторы отмечают преобладание лиц женского пола. В анамнезе у больных нередко отмечается перенесенная травма кисти. Клинически ганглий определяется как кистозное образование, подвижное, несколько флюктуирующее, величиной с лесной орех или несколько больше. Как правило, ганглий одиночен, в редких случаях наблюдается множественное поражение. Макроскопически ганглий представляет собой кистозную полость, большей частью однокамерную, но иногда и многокамерную, неправильных очертаний, с боковыми ответвлениями. В полости — серозное или слизистое, тягучее желеобразное содержимое. В настоящее время существует два взгляда на природу ганглиях. Одни авторы относят ганглий к истинным опухолям синовиального характера. Другие считают его следствием слизистой дистрофии тканей сухожилия, капсулы суставов или соседней с ними соединительной тканью. Третьи указывают на связь полости ганглия с полостью сустава или сухожильного влагалища и характеризуют его как их грыжевое выпячивание или отшнуровка полости на почве воспалительного процесса. Это сближает его с гигромой, которую одни рассматривают как ретенционное образование, а другие объединяют оба эти процесса и пользуются обоими этими терминами как синонимами. Для консервативного лечения ганглия рекомендовалось, а иногда и сейчас применяется разминание, раздавливание, отсасывание путем пункции, введение различных склерозирующих веществ и ферментов. Однако ни один из перечисленных способов не гарантирует окончательного излечения. Рецидивы ганглия после консервативных мероприятий наблюдаются в 80—90 % случаев, а после удаления хирургическим путем — только в 8—20 %. Поперечный разрез по линии кожных бороздок обеспечивает достаточный обзор запястья и дает лучший косметический рубец. Поперечный разрез всегда легко расширить. При иссечении ганглия часто необходимо сдвинуть, иногда подсечь retinaculum extensorum, чтобы осмотреть щели между сухожильными влагалищами. Сначала вылущивается основной ганглий, затем мелкие кистевидные образования рассекаются, края их подшиваются к капсуле. Восстанавливается retinaculum extensorum. После операции кисть фиксируют гипсовой лонгетой на 10—14 дней. 2.1.8. Гигрома Гигрома (hygroma; греч. hygros, жидкий + оmа, опухоль, синонимы — хронический бурсит, хронический тендовагинит) — скопление серозно-слизистой или серозно-фибринозной жидкости в полости околосуставной или вновь образовавшейся синовиальной сумки вследствие хронического воспаления [5, 13, 27]. Наиболее часто гигрома возникает в местах, подвергающихся постоянной травматизации или длительному давлению при определенных видах профессиональной деятельности. Гигромы наиболее часто встречаются в поверхностно расположенных подкожных синовиальных сумках (локтевая, препателлярная), которые более подвержены механическому воздействию. У мужчин это заболевание встречается чаще (рис. 2.9). 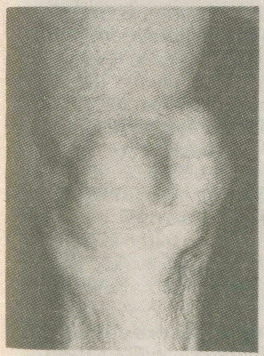 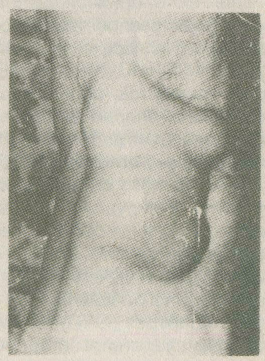 Рис. 2.9. Гигрома коленного сустава. Собственное наблюдение. Симптоматика заболевания определяется размерами гигромы. При небольших размерах больной обычно жалоб не предъявляет. С увеличением размеров появляются тупые боли в области растянутой синовиальной сумки, возможны парестезии, иррадиация болей при сдавлении нервов. Если воспаление в стенках синовиальной сумки отсутствует, гигрома при пальпации определяется как малоболезненное образование округлой формы, мягко-эластической консистенции. Флюктуация определяется редко. Гигрома может осложниться разрывом или нагноением, В последнем случае клиническая картина характеризуется классическими признаками острого воспаления с местными и общими проявлениями. Диагностика заболевания при типичном и поверхностном расположении проста. Дифференциальный диагноз проводят с ганглием, натечным абсцессом, доброкачественными и злокачественными опухолями, Консервативные методы лечения (повторные пункции с введением глюкокортикоидов, склерозирующих веществ, физиотерапия) имеют, как правило, временный эффект. Единственным радикальным методом лечения гигромы следует признать операцию иссечения синовиальной сумки (бурсэктомия). 2.2. ЗАБОЛЕВАНИЯ СУСТАВОВ (ОСТЕОАРТРОЗЫ) О значимости проблемы артритов и близких заболеваний опорно-двигательного аппарата свидетельствуют данные об инвалидности и экономическом ущербе. Например, в США артритами (в широком смысле) страдает более 42 млн. человек, а более чем у 7 млн. человек ограничена подвижность, приводящая к потере независимости. В России общая распространенность заболеваний опорно-двигательного аппарата за 10 лет (1988—1997 гг.) выросла с 7,5 до 11,2 млн., увеличившись более чем на 39 %. Две трети пациентов, обращающихся в поликлиники с болями со стороны опорно-двигательного аппарата, страдают дегенеративными заболеваниями: остеоартрозом — 12,8 %; спондилезом, остеохондрозом и др. — 33,8 % [35]. Учитывая это обстоятельство и то, что в амбулаторной практике к хирургу в основном обращаются больные с симптомокомплексом — остеоартрозом, мы сочли для себя возможным уделить больше внимания этому понятию, его диагностике и лечению, тем более что его этиология более чем многообразна. Остеоартроз (ОА) в настоящее время уже не считается простым следствием старения и дегенерации хряща. Скорее его причиной являются активные процессы не только деструктивного, но и репаративного характера. ОА, возможно, не единая болезнь, а целая группа отдельных заболеваний со сходными признаками. Разнообразие патофизиологии, клинических проявлений и исходов ОА оправдывает термин «остеоартрозные нарушения». Общие сведения Само определение ОА остается не вполне ясным. В 1995 г. было принято следующее определение: «ОА — это результат как механических, так и биологических воздействий, нарушающих баланс деградации и синтеза хондроцитов и внеклеточного матрикса суставного хряща, а также субхондральной кости». Начало ОА провоцируют весьма многообразные факторы, в том числе генетические, метаболические и травматические, но в любом случае в патологический процесс вовлекаются все ткани сустава. ОА проявляется морфологическими, биохимическими, молекулярными и биомеханическими нарушениями как в клетках, так и в матриксе хряща. Это приводит к размягчению, разволокнению, изъязвлению суставного хряща, склерозу и альтерации субхондральной кости, образованию остеофитов и субхондральных кист. Клинически заболевание проявляется болями в суставах ограничением подвижности, хрустом в суставах при движении, v периодическим появлением выпота (припуханием) ^воспалением различной степени выраженности без каких-либо системных проявлений. Согласно классификации, принятой Американской ассоциацией ревматологов, выделяют первичный и вторичный ОА (табл. 2.1); разработаны критерии, позволяющие выделять ОА суставов кистей, тазобедренных и коленных суставов. В большинстве случаев диагноз ОА основывается на наличии типичных рентгенологических признаков. Рентгенологические признаки ОА по крайней мере одной группы периферических суставов (чаще всего кистей, затем суставов стоп, коленных и тазобедренных суставов) выявляются примерно у 1/3 населения Северной Америки, Северной Европы и России в возрасте от 25 до 74 лет [35]. Возраст — наиболее значимый фактор риска ОА; с увеличением возраста повышается распространенность заболевания всех локализаций. Частота случаев ОА также увеличивается с возрастом и достигает плато после 70 лет. Вероятно, биомеханические изменения, связанные со старением суставного хряща, способствуют его повреждению и разрушению. Однако четкие доказательства этого предположения отсутствуют. Женщины, особенно в менопаузе, подвержены большему риску ОА, чем мужчины. Хотя данные о биохимическом воздействии половых гормонов на обмен веществ в хряще противоречивы, в эпидемиологических исследованиях показано защитное действие гормональной заместительной терапии в отношении развития ОА коленных и тазобедренных суставов. Таблица 2.1. Классификация остеоартрозов
В проспективных перекрестных исследованиях показано существенное влияние ожирения на риск ОА коленных суставов и в меньшей степени — тазобедренных. Ожирение приводит к увеличению нагрузки на опорные суставы и таким образом способствует развитию ОА. Однако поскольку женщины более часто страдают ожирением, и, кроме того, ожирение может быть фактором риска и ОА кистей, в развитии ОА, возможно, играют роль и системные факторы. Таблица 2.2. Факторы, ассоциированные с остеоартрозами
Работа, связанная с длительным пребыванием в положении стоя на коленях, сидя на корточках, подъемом по ступенькам, ассоциируется с более высокой распространенностью ОА коленных суставов, работа, связанная с подъемом тяжестей (например, в сельском хозяйстве), сопровождается риском ОА тазобедренных суставов. Спортивная нагрузка также ассоциируется с риском ОА суставов нижних конечностей. Тем не менее активный отдых с физическими упражнениями, например оздоровительный бег, к повышению риска ОА не приводит, так как в этом случае имеет место нормальная биомеханическая нагрузка на суставы. В развитии заболевания имеют значение наследственные факторы. В исследовании, проведенном среди женщин-близнецов, показана роль наследственных факторов при рентгенологически подтвержденном ОА коленных и тазобедренных суставов. Хотя мутации в гене коллагена II типа (COL2A1) приводят к развитию раннего распространенного ОА с хондродисплазией легкой степени, вероятно, это не единственный ген, ответственный за структурные компоненты хряща, полностью опосредующий влияние генетических факторов на развитие ОА. Патогенез ОА обычно считается заболеванием суставного хряща, хотя изменения, затрагивающие субхондральную кость, также играют определенную роль. Неизвестно, где изначально возникают нарушения при идиопатическом ОА — в суставном хряще или субхондральной кости. Суставной хрящ выполняет две функции: ослабление нагрузки при воздействии механических факторов и обеспечение скольжения суставных поверхностей при движении. Это возможно благодаря уникальному строению хрящевой ткани, в которой хондроциты встроены в матрикс, состоящий из коллагена и протеогликанов (ПГ). Основной структурный белок матрикса — коллаген II типа. Важность этого белка подтверждает тот факт, что при ОА имеют место случаи мутации COL2A1; кроме того, коллаген II типа связывается с другими макромолекулами матрикса (коллаген IX и XI типов), присутствующими в небольшом количестве, но необходимыми для обеспечения стабильности хряща. Другой важный компонент хряща — это протеогликаны, представленные, главным образом, аггреканом. В норме в суставном хряще уравновешены процессы синтеза и деградации. Причиной ОА может быть недостаточное образование или усиленный катаболизм хрящевой ткани. Так, содержание металлопротеиназ матрикса (ферментов, катализирующих деградацию коллагена и протеогликанов) в хряще при ОА повышено. Их синтез хондроцитами стимулируется воздействием интерлейкина 1 (ИЛ-1). Кроме того, блокада этих ферментов доксициклином или тетрациклином с измененной химической формулой, по крайней мере на модели животных, приводит к уменьшению поражений при ОА. В то же время синтез компонентов хряща зависит от многочисленных факторов роста. При ОА часто выявляются рентгенологические изменения субхондральной кости, которые могут рассматриваться скорее как причина, а не как следствие повреждения хряща. О важности изменений в кости свидетельствует обратная зависимость между ОА и заболеваниями, связанными с уменьшением плотности кости, в том числе остеопорозом. Минеральная плотность костной ткани при ОА тазобедренных суставов выше, чем в норме, даже с поправкой на массу тела, причем не только в участках костей, прилегающих к пораженным суставам, но и в других, отдаленных участках. Клинические проявления Клинические проявления ОА представлены в табл. 2.3. Боль — наиболее частый симптом, по поводу которого больной обращается за врачебной помощью; боль возникает внезапно, ее интенсивность может варьировать от легкой до умеренной, усиливается при движении в пораженном суставе и уменьшается в покое. Боль в состоянии покоя или ночью свидетельствует о тяжелом поражении. Источником боли могут быть синовиальная оболочка, капсула сустава, периартикулярные связки, периартикулярные мышцы (при их спазме), надкостница и субхондральная кость. Хотя болевой синдром часто наблюдается при рентгенологически подтвержденном ОА, корреляция между болевым синдромом и рентгенологическими изменениями, характерными для ОА, выражена слабо. Тем не менее оценка выраженности боли используется в качестве критерия результата терапии. Как правило, клинический диагноз ОА подтверждается типичной рентгенологической картиной, характеризующейся наличием краевых остеофитов, несимметричным сужением суставной щели, субхондральным остеосклерозом, образованием субхондральных кист и в тяжелых случаях — деформацией эпифизов костей. Околосуставной остеопороз и краевые эрозии, характерные для ревматоидного артрита, при ОА не наблюдаются. При обычном лабораторном обследовании, включающем общий клинический и биохимический анализы, как правило, отклонений не выявляется. Лабораторные исследования надо проводить до начала приема нестероидных противовоспалительных средств, а также в перерывах между курсами приема этих препаратов при длительном лечении. Таблица 2.3. Клинические проявления остеоартроза
Клиническое течение ОА весьма вариабельне. Хотя рентгенологические изменения, как правило, прогрессируют, в некоторых случаях состояние больных остается стабильным в течение многих лет. Может также уменьшаться выраженность болевого синдрома и реже — улучшаться функция суставов. Рентгенологические изменения не соответствуют колебаниям выраженности болевого синдрома, в связи с чем использование в исследованиях рентгенологических признаков в качестве критерия оценки результата лечения при ОА нецелесообразно. Прогностическими факторами прогрессирования рентгенологических изменений могут быть патологические отклонения по данным сцинтиграфии костей, ожирение, генерализованный ОА с узелками Гебердена, хондрокальциноз и повышение уровня С-реактивного белка и гиалуроната. В настоящее время заболевание плохо поддается лечению, поскольку отсутствуют препараты, влияющие на течение заболевания. Основным критерием эффективности лечения обычно считается интенсивность болевого синдрома, хотя в некоторых клинических испытаниях учитывается влияние на функцию суставов и качество жизни. В лечении ОА важное значение имеют физические упражнения, в том числе упражнения для укрепления мышц и занятия аэробикой. В исследованиях выявлено, что упражнения на укрепление четырехглавой мышцы бедра и аэробика уменьшают боль и улучшают функцию при ОА коленных суставов, причем эффект сохраняется до 6 мес. Необходимо лежа на спине одну ногу согнуть в колене, а другую выпрямить, приведя голеностопный сустав в положение тыльного сгибания на 90°. Четырехглавая мышца бедра выпрямленной ноги напряжена, нога поднята на высоту 25—50 см. Удерживать ногу в таком положении 10 секунд, затем опустить, мышцу расслабить. Упражнение повторять не менее 10 раз для каждой ноги. Снижение массы тела приводит к уменьшению риска клинически проявляющегося ОА коленных суставов. В одном из исследований показано положительное влияние снижения массы и на болевой синдром, и на функциональную активность у женщин в постменопаузе, страдающих ожирением и ОА коленных суставов. Боль является основным показанием к назначению медикаментозного лечения при ОА. Препаратом выбора в настоящее время считается парацетамол. При отсутствии достаточного эффекта от немедикаментозного лечения и приема парацетамола целесообразна попытка применения нестероидных противовоспалительных средств (НПВС). Явных преимуществ какого-либо препарата из группы НПВС не выявлено, однако из-за большей токсичности применение индометацина не рекомендуется. На фоне применения пироксикама, кетопрофена отмечается больший риск осложнений со стороны желудочно-кишечного тракта (перфорация, образование язв, кровотечение), чем при использовании других НПВС, особенно ибупрофена в низкой дозе. Основные принципы применения НПВС при ОА заключаются в использовании минимальной эффективной дозы, исключении одновременного приема двух препаратов из группы НПВС. Эффект лечения оценивают примерно через 1 мес. и при его отсутствии препарат отменяют Мази на основе НПВС для местного применения могут быть эффективны либо в качестве монотерапии, либо при сочетании с пероральными обезболивающими препаратами, особенно при поражении небольшого числа суставов. Мази позволяют больным самостоятельно контролировать лечение. Внутрисуставные введения глюкокортикоидов для лечения ОА используются давно, главным образом для коленного сустава при наличии суставного выпота. Однако несмотря на большой клинический опыт, остаются противоречивыми отдельные аспекты этой терапии: ее относительная эффективность, потенциально повреждающее действие, — поэтому место длительного применения внутрисуставной кортикостероидной терапии для лечения ОА остается не ясным. В настоящее время считается, что число внутрисуставных введений в один сустав не должно превышать 4 на протяжении 1 года, однако их действие продолжается только 1—3 нед. Наиболее эффективен триамциналон. Хондропротекторы. Медленно действующие симптоматические препараты занимают как бы промежуточное положение: с одной стороны, они обладают выраженным действием на боль и функциональное состояние суставов, как и НПВС, с другой — некоторыми хондропротективными свойствами. Эффективность при ОА для ряда препаратов уже доказана — это хондроитин сульфат, гликозамин сульфат, диацереин для перорального лечения и гиалуроновая кислота, вводимая внутрь сустава. Отличительной особенностью этих препаратов является время наступления эффекта, обычно спустя 2—8 нед. от начала лечения, и сохранение эффекта в течение 2—3 мес. после прекращения лечения. Хондроитин сульфат (ХС) — сульфатированный гликозаминогликан, который находится в экстрацеллюлярном матриксе суставного хряща. При пероральном приеме биодоступность препарата составляет 15 %. Фармакокинетические исследования показали, что при приеме внутрь он хорошо адсорбируется и обнаруживается в высоких концентрациях в синовиальной жидкости [34, 37]. В исследованиях in vitro получены доказательства, что ХС обладает противовоспалительной активностью, направленной в основном на клеточный компонент воспаления, стимулирует синтез гиалуроновой кислоты и протеогликанов и ингибирует действие протеолитических ферментов [38]. В процессе экспериментальных исследований in vivo было установлено, что введение ХС перорально или внутримышечно кроликам (с дегенерацией хряща, вызванной химопапаином), значительно повышало содержание ПГ хряща по сравнению с контрольными животными, что свидетельствует о том, что ХС защищает хрящ при повреждении и обладает способностью поддерживать ресинтез ПГ матрикса [17]. В клинических исследованиях продемонстрирована эффективность ХС в отношении влияния на болевой синдром и функциональное состояние суставов. В 3-месячном двойном слепом рандомизированном исследовании ХС (1200 мг) в сравнении с диклофенаком (4 нед., затем плацебо 2 мес.) показано небольшое превышение эффективности последнего, возможно, из-за медленного начала действия ХС, но эффективность ХС была выше плацебо и эффект после прекращения лечения держался в течение 6 мес [36]. Открытое рандомизированное контролируемое изучение 100 больных гонартрозом, проведенное в Институте ревматологии [17], подтвердило эффективность и хорошую переносимость ХС, причем терапевтический эффект препарата сохранялся в течение 3 мес. после его отмены. Длительное (12 мес.) двойное слепое плацебо-контролируемое исследование влияния ХС на прогрессирование ОА коленных суставов показало, что этот препарат оказывал стабилизирующее влияние на ширину суставной щели и метаболические процессы в субхондральной кости и хряще, а тем самым, по-видимому, и на течение заболевания. Дальнейшие длительные исследования с включением большего числа больных подтвердят, возможно, его модифицирующие структуру болезни свойства. Глюкозамин сульфат (ГС) также является компонентом суставного хряща. In vitro показано, что ГС, добавленный к культуре хондроцитов, стимулирует синтез протеогликанов. Ранние краткосрочные исследования выявили эффективность ГС при пероральном приеме. Позже в двойном слепом рандомизированном исследовании больных с ОА коленных суставов применение 1500 мг ГС оказалось эффективнее, чем 1200 мг ибупрофена в течение 4 нед. лечения, в подобном исследовании ГС превосходил по эффективности плацебо. В двойном слепом плацебо-контролируемом рандомизированном исследовании ОА коленных суставов внутримышечное введение ГС в течение 6 нед, также оказалось эффективнее плацебо, показана эффективность препарата при ОА шейного и поясничного отделов позвоночника. Диацереин или диацетилреин — антивоспалительное лекарство, не оказывающее эффекта на циклооксигеназу или липооксигеназу. In vitro он ингибирует продукцию ин-терлейкина-1 и уменьшает содержание металлопротеиназ в суставном хряще человека. С другой стороны, он стимулирует синтез протеогликанов и гиалуроновой кислоты. In vivo на моделях ОА у животных диацереин эффективно уменьшал синовиальное воспаление и повреждение хряща. В слепом исследовании проведено сравнение диацерина с плацебо, теноксикамом и комбинации диацерина с теноксикамом. Оба препарата были эффективнее плацебо, действие наступало быстрее у теноксикама, у диацерина — через 6 нед. от начала лечения. Легкую диарею отметили 37 % больных, принимавших диацерин. В другом исследовании сравнивали эффективность диацерина и напроксена (375 мг 2 раза в день) у больных с ОА коленных и тазобедренных суставов в течение 2 мес. Эффективность диацерина была сравнима с напроксеном, но сохранялась через 30 дней после прекращения лечения, в отличие от напроксена. Неомыляющиеся соединения авокадо/сои (НСАС) экстрагируются из авокадо и сои в отношении 1:2. Исследования, проведенные in vitro, показали, что они способны ингибировать интерлейкины-1, индуцированную ИЛ-1 продукцию стромелизина, ИЛ-6, ИЛ-8, простагландина Е2 и коллагеназы, а также стимулировать синтез коллагена хондроцитами хряща. Двойные слепые плацебо-контролируемые исследования НСАС в течение 6 мес. лечения и последующих 2 мес. наблюдения больных с ОА коленных и тазобедренных суставов продемонстрировали превышение их эффективности над плацебо по действию на боль и снижению потребности в НПВС. Гиалуроновая кислота (ГиК) привлекает особое внимание как физиологическое терапевтическое средство. Ее изготавливают из петушиных гребешков и других источников. ГиК представляет собой полисахарид, состоящий из длинной цепи дисахаридов. Клиническое применение ГиК было обусловлено исследованиями синовиальной жидкости при ОА, показавшими значительное снижение концентрации ГиК, а также укорочение длины цепей. Однако данные по ее применению противоречивы, возможно, из-за использования ГиК разных молекулярных весов и полученных из различных источников. В настоящее время ГиК рекомендуется для больных, которые не отвечают на другие виды лечения или не переносят НПВС. При ОА коленных суставов применяется внутрисуставное введение гиалуроновой кислоты. Еженедельные инъекции в течение 3—5 нед. более эффективны, чем однократное внутрисуставное введение кортикостероидов. При безуспешности лечения вышеперечисленными методами возможно использование наркотических анальгетиков. В некоторых случаях ОА коленных суставов при противопоказаниях или отказе от хирургического вмешательства эффективен лаваж суставных поверхностей физиологическим раствором. Положительное воздействие этой процедуры, возможно, связано с удалением из полости сустава патологических фрагментов, продуктов распада и медиаторов воспаления. Трансплантация суставов дает наилучшие результаты. При ОА с поражением суставов нижних конечностей среднего и тяжелого течения трансплантация приводит к заметному улучшению качества жизни. С улучшением качества суставных протезов уменьшилась частота повторных вмешательств из-за появления «разболтанности» протезированного сустава. Эндопротезирование эффективно почти в 70 % случаев. Выживаемость искусственного сустава в течение 10 лет наблюдается у 90—95 % больных, что способствует улучшению качества жизни больных с тяжелым ОА суставов нижних конечностей. Таким образом, в последние 10 лет представления об ОА расширились. Изучение селективных ингибиторов циклооксигеназы-2 может способствовать появлению более безопасных НПВС и улучшению лечения ОА. Проводятся исследования нескольких новых препаратов — тетрациклина с измененной химической формулой и других ингибиторов металлопротеиназ, а также антагонистов интерлейкина-1, которые потенциально могут приводить к обратному развитию структурных и биохимических нарушений, присущих ОА. Кроме того, может быть эффективна трансплантация аутологичного хряща в ранней стадии заболевания и при очаговом характере поражения хряща. Возможно, эти достижения изменят прогноз и улучшат качество жизни больных ОА в нынешнем столетии. 2.3. ЗАБОЛЕВАНИЯ СТОПЫ 2.3.1. Вросший ноготь Вросший ноготь — одна из часто встречающихся в амбулаторной практике патологий, требующая хирургической помощи [3, 16, 26, 31]. Причиной врастания ногтевой пластины в край ногтевого валика, как правило, является ношение тесной обуви (I палец стопы) или непосредственная травма. После удаления ногтевой пластинки при росте нового ногтя также может произойти его врастание. Внедрение края ногтевой пластинки во внутренний боковой ногтевой валик приводит к воспалению, появляются боль, гнойные выделения, разрастание избыточных грануляций. Консервативное лечение заключается в ношении свободной обуви, содержании стоп в чистоте, ежедневном мытье их теплой водой. Допустимо прижигание грануляций ляписом, обрезание свободного края ногтя «по линейке». Однако если врастание ногтя продолжается, следует прибегнуть к оперативному лечению. Подготовка к операции заключается в гигиенической очистке кожи стопы, и особенно больного пальца. Несколько раз производят в домашних условиях теплые ванны для стопы с добавлением в воду перманганата калия. Кожу просушивают, протирают спиртом и накладывают на палец асептическую повязку. Операцию производят под проводниковой анестезией по Лукашевичу. Если врастает относительно небольшой участок ногтя в дистальном отделе, то выполняют продольную резекцию ногтевой пластинки. Задний ногтевой валик рассекают по линии будущей резекции ногтя. Латеральную часть валика отслаивают, обнажая корень ногтя. Остроконечными ножницами продольно разрезают ноготь, отделяя врастающую часть. Удаляемую часть пластинки захватывают зажимом и вывихивают. Иссекают пораженный ногтевой валик с грануляциями. Обычно резецируют 1/3 ногтевой пластинки. На рану заднего ногтевого валика и у дистального конца ногтя накладывают два-три шва. Повязка с синтомициновой эмульсией. При глубоком врастании ногтя производят более широкую операцию. Задний ногтевой валик рассекают двумя разрезами длиной 1 см по продолжению линии боковых краев ногтевой пластинки. Отделяют, отворачивают кожный лоскут с задним валиком. Зажимом вывихивают и удаляют пластинку. Продольно иссекают пораженный боковой валик с частью прилегающего матрикса (до надкостницы) и соответствующую часть ростковой зоны ногтя. Оставшиеся обрывки матрикса выскабливают острой ложкой. Край кожной раны после иссечения бокового околоногтевого валика мобилизуют и прикрывают участок удаленного матрикса. Накладывают несколько кожных швов (рис. 2.10), затем повязку с синтомициновой эмульсией. Швы снимают через 8-9 дней. 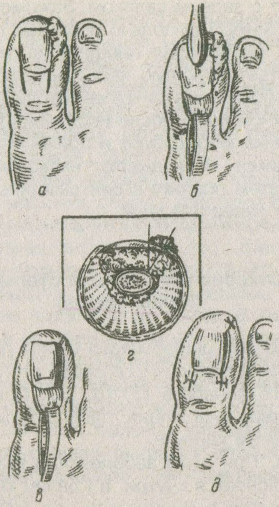 Рис. 2.10. Радикальная операция при вросшем ногте (из книги В. И. Маслова, 1988 г.). а — направление разрезов заднего ногтевого валика; б — удаление ногтевой пластинки; в — вид пальца после иссечения патологических грануляций и пораженной части матрикса; г — направление клиновидного иссечения матрикса; д — законченный вид операции, наложение отдельных швов. 2.3.2. Отклонение I пальца стопы кнаружи (Hallux valgus) Этиология. Эту деформацию стопы обычно связывают с уплощением поперечного свода стопы при ослаблении связочного аппарата [3, 16, 31]. Причины ослабления — возрастная инволюция, плоскостопие или ношение обуви на высоком каблуке. Патогенез. При этом заболевании головка I плюсневой кости отклоняется кнутри, а I палец кнаружи. Головка Г плюсневой кости выпячивается над внутренним контуром стопы в виде округлого бугра, мешающего в ношении обуви и причиняющего неудобства при ходьбе. Слизистая сумка над головкой плюсневой кости постоянно травмируется, воспаляется и причиняет боли, усиливающиеся при каждом шаге. В последующем на этом месте образуется экзостоз. Клиническая картина. Стопа расширена, поперечный свод отсутствует. Первый палец отклонен кнаружи, может находиться под или над вторым пальцем. В области головки I плюсневой кости болезненная припухлость или экзостоз. При рентгенологическом исследовании определяется веерообразное расхождение плюсневых костей, отклонение I пальца кнаружи. Вследствие внутренней ротации I плюсневой кости сесамовидные кости могут обнаруживаться в межпальцевом промежутке. Стадию заболевания можно оценить по углу отклонения большого пальца. I степень — угол отклонения 10°, характерна повышенная утомляемость стоп и поперечное плоскостопие; II степень —угол 15°, бурсит над головкой I плюсневой кости, формируется молоткообразная деформация 2-го пальца. III степень — большой палец отклонен на 30° градусов и больше, ротирован внутрь и располагается над или под 2-м пальцем, характерен бурсит над головкой I плюсневой кости, поперечное плоскостопие и молоткообразные пальцы [31]. В начальной стадии заболевания проводят консервативное лечение: ношение обуви с широким носком и низким каблуком, пользование ортопедическими стельками, восстанавливающими поперечный свод стопы. Во II стадии у больных в возрасте 20—40 лет показана резекция лишь выступающей части головки I плюсневой кости — удаление экзостоза по Шеде. В порядке подготовки к операции на протяжении недели делают гигиенические ванны для стопы, накануне операции после такой ванны смазывают кожу пальцев и дистальной части стопы раствором йода и накладывают асептическую повязку. Для хирургического лечения больных госпитализируют; при соответствующих условиях операцию можно выполнить и амбулаторно. Обезболивание — внутривенный наркоз или местная анестезия. Проводят овальный разрез длиной 5 см, окаймляющий головку I плюсневой кости на тыле стопы. Мобилизуют книзу кожный лоскут и иссекают слизистую сумку. Из капсулы плюснефалангового сустава выкраивают лоскут с основанием у проксимальной фаланги пальца и отворачивают его в дистальном направлении. Выступающую наружу часть головки I плюсневой кости продольно сбивают плоским долотом, острые костные края закругляют долотом или щипцами Люэра. Лоскут суставной капсулы укладывают на место и подшивают шелковыми швами к окружающим тканям с некоторым натяжением в ровном положении 1 пальца. Этот лоскут капсулы должен выполнять функцию боковой связки сустава, препятствуя рецидиву искривления пальца. В межпальцевой промежуток помещают и приклеивают клеолом плотный ватный валик для гиперкоррекции 1 пальца. Накладывают швы на кожную рану (рис. 2.11). Иммобилизацию производят гипсовой лонгетой по подошвенному краю стопы и пальца, фиксированной бинтами [16]. 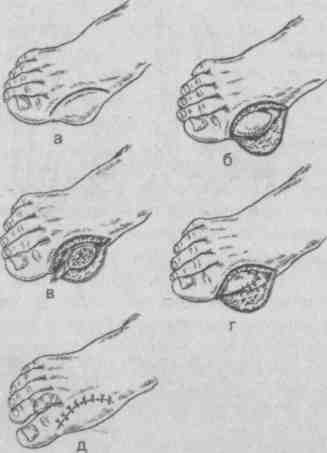 Рис. 2.11. Удаление экзостоза головки I плюсневой кости по Шеде (из книги В. И. Маслова, 1988 г.). а — разрез кожи; б — выкраивание дистального лоскута из суставной сумки; в — удаление экзостоза долотом; г — подшивание с натяжением лоскута суставной сумки; д — швы на кожу, валик в межпальцевой промежуток. Следует подчеркнуть, что операция Шеде при прогрессирующем артрозе, особенно у лиц пожилого возраста, не приводит к излечению. Более эффективна корригирующая остеотомия I плюсневой кости по Хохману. Проводят продольный разрез по внутреннему краю стопы на уровне проксимальной фаланги I пальца и I плюсневой кости. Удаляют слизистую сумку на уровне экзостоза, сухожилие отводящей мышцы I пальца отделяют от места ее прикрепления к проксимальной фаланге. У основания обходят распатором I плюсневую кость и высекают в ней долотом клиновидный участок, открытый в наружноподошвенную сторону. Удаление поперечного клина позволяет выровнять ось I плюсневой кости. Оба фрагмента этой кости фиксируют между собой проволокой или пластинкой для предотвращения вторичного смещения. Если экзостоз на плюсневой кости очень большой, то его сбивают долотом. Сухожилие отводящей мышцы I пальца укорачивают и с натяжением подшивают на прежнее место к основанию фаланги (рис. 2.12). Накладывают гипсовую повязку на стопу на 5-6 нед. При хорошей фиксации фрагментов плюсневой кости проволокой или пластинкой гипсовую повязку можно снять через 3 нед. Затем приступают к физиотерапевтическим процедурам, лечебной гимнастике. Исходы операции более благоприятные, чем после операции Шеде [16]. 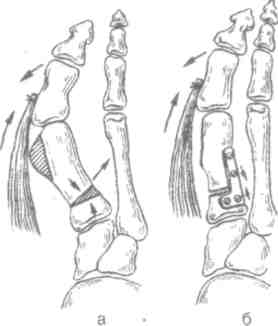 Рис. 2.12. Операция Хохмана при искривлении I пальца стопы (из книги В. И. Маслова, 1988 г.). а —поперечная клиновидная остеотомия 1 плюсневой кости, вдалбливание экзостоза и укорочение отводящей мышцы; б — положение костей стопы после выполненной операции. Если еще нет артроза и подвижность в суставе сохранена, у молодых пациентов может быть достаточно эффективной операция отсечения приводящей мышцы от проксимальной фаланги I пальца стопы по Мак-Брайду. Проводят продольный разрез на уровне проксимальной фаланги I пальца с подошвенной стороны. Проходят инструментом между головками I и II плюсневых костей и отделяют приводящую мышцу у места ее прикрепления к проксимальной фаланге I пальца. Эту мышцу укорачивают и фиксируют к головке I плюсневой кости с подошвенной стороны. Укорачивают и вновь подшивают на свое место отводящую мышцу I пальца (рис. 2.13). Накладывают гипсовую повязку на 3 нед. 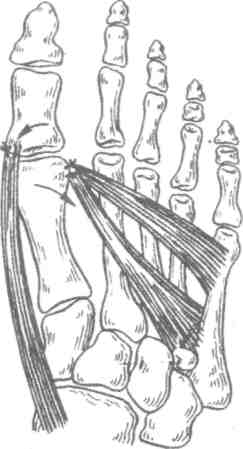 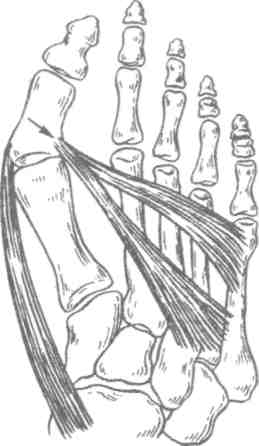 Рис. 2.13. Коррекция искривления I пальца стопы по Мак-Брайду (из книги В. И. Маслова, 1988 г.). слева — положение пальца перед отделением сухожилий отводящей и приводящей мышц; справа — восстановление нормального положения пальца после перемещения и подшивания укороченных мышц. У больных пожилого возраста при резко выраженном артрозе производят резекцию суставного конца проксимальной фаланги или головки I плюсневой кости. К таким вмешательствам относят операцию Вредена-Мейо — резекцию плюсневой кости. Капсулу сустава обнажают продольно дугообразным разрезом над выпячивающейся головкой плюсневой кости. Края кожной раны мобилизуют в обе стороны. Иссекают слизистую сумку, выкраивают лоскут из суставной капсулы и отворачивают его в дистальном направлении. Рассекают фиброзную перемычку между суставной капсулой и головкой плюсневой кости. С силой оттягивают I палец, увеличивая суставную щель, в которую вводят большую костную ложку Фолькмана, и с ее помощью вывихивают головку I плюсневой кости в рану. Пинцетом под кость подводят пилу Джигли и в поперечном направлении отпиливают всю головку плюсневой кости. Острые края опила закругляют щипцами Люэра. Образовавшийся после резекции головки избыток проксимального отдела суставной капсулы заворачивают на опил, и фиксируют одним-двумя кетгутовыми швами к надкостнице I плюсневой кости для интерпозиции во вновь формируемом суставе. Ранее выкроенным лоскутом суставной капсулы закрывают сустав, накладывают швы с некоторым натяжением. Производят ушивание кожной раны. В межпальцевой промежуток помещают плотный ватный валик и подклеивают его клеолом для создания гиперкоррекции I пальца. Металлическую пластинку (шпатель) или деревянную (фанерную) шину соответствующих размеров обкладывают ватой и помещают на внутреннюю боковую поверхность стопы и I пальца, не доходя до конца его на 1 см. Шину фиксируют на стопе циркулярным гипсовым бинтом, а к пальцу — узким гипсовым бинтом (рис. 2.14). Такая иммобилизация позволяет больному самостоятельно передвигаться в домашних условиях. Шину и швы снимают через 3 нед. На протяжении месяца после этого на ночь рекомендуется прибинтовывать мягким бинтом I палец к шине для удержания его в положении гиперкоррекции. 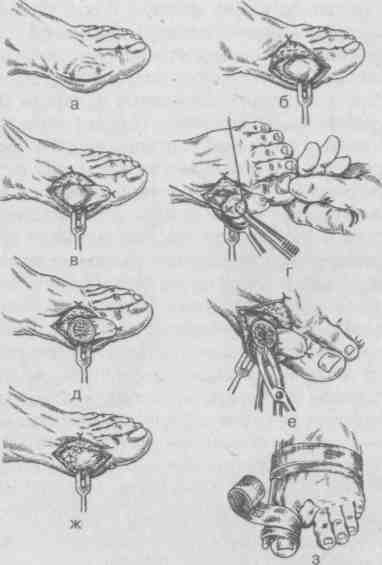 Рис. 2.14. Операция по Вредену-Мейо при выраженном вальгусном искривлении I пальца стопы (из книги В. И. Маслова, 1988 г.). а — разрез кожи; б — выкраивание дистального лоскута из суставной сумки; в — обнажение головки плюсневой кости; г — подведение костной ложки и пилы Джигли под головку плюсневой кости; д— головка I плюсневой кости спилена; е — обработка острых краев опила кости щипцами Люэра; ж — подшивание с натяжением дистального лоскута суставной сумки; з — иммобилизация I пальца шиной и узкими гипсовыми бинтами в состоянии гиперкоррекции. 2.3.3. Молоткообразный палец Как самостоятельное заболевание не встречается, обычно сочетается с Hallux valgus [3, 16, 26, 31]. Для этой деформации характерна сгибательная контрактура в проксимальном межфаланговом суставе II пальца стопы. Проксимальная фаланга находится в состоянии тыльного сгибания, средняя — подошвенного сгибания. При этом образуется острый угол между ними, приподнятый над уровнем остальных пальцев. Постоянная травматизация пальца в выступающей части приводит к формированию болезненной мозоли. Развивается подвывих плюсно-фаланговых суставов. Пользование обычной обувью становится затруднительным. Консервативное лечение только при невозможности операции — ношение обуви с мягким верхом и стелькой. Оперативное лечение — в амбулаторных условиях. Применяют местную проводниковую анестезию у основания пальца 1% раствором новокаина. Дугообразным разрезом длиной 3-4 см, окаймляющим сбоку проксимальный межфаланговый сустав II пальца, формируют и мобилизуют тыльный кожный лоскут. Сухожилие разгибателя пальца отводят в сторону, вскрывают сустав, вывихивают и с помощью кусачек Листона (или пилой Джигли) резецируют на протяжении 1 см суставной конец проксимальной фаланги (рис. 2.15). Если этого оказывается недостаточно для выправления пальца, то резецируют и суставной конец средней фаланги. Щипцами Люэра закругляют острые края опила костей. Накладывают швы на капсулу сустава с некоторым натяжением. Избыток капсулы иссекают. Сухожилие помещают на свое место [31]. 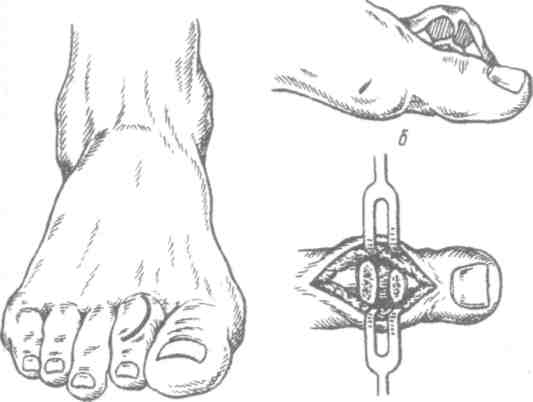 Рис. 2.15. Операция при молоткообразном пальце (из книги В. И. Маслова, 1988 г.). а — кожный разрез; б -— участки резецируемых суставных концов фаланг пальца (заштрихованы); в — вид межфалангового сустава после резекции. Применяют и поперечный доступ к суставу с предварительным иссечением мозоли вместе с участком окружающей кожи. Иммобилизацию подошвенной шиной стопы и пальца осуществляют в течение 10 суток. 2.3.4. Пяточная шпора Пяточная шпора представляет собой заостренный экзостоз (остеофит) на подошвенной поверхности пяточной кости [3, 20, 31]. Причина — плоскостопие или дистрофическое окостенение подошвенного апоневроза. Жалобы на жгучую боль по нижней поверхности пятки, особенно при ходьбе. Диагноз может быть подтвержден рентгенологически — видны костные выступы, периостит. Ношение стелек-супинаторов, подкладывание под пятку колец из поролона, спирт-новокаиновые блокады в окружности экзостоза, неспецифические противовоспалительные средства, противоболевая рентгенотерапия (75 Р через 3—4 дня, 4—5 раз) во многих случаях приводят к исчезновению симптомов заболевания [26]. При больших шпорах и неэффективности консервативного лечения производят операцию, обычно в условиях стационара. Обезболивание — местная инфильтративная или внутрикостная новокаиновая анестезия пункцией пяточной кости. Больного на операционном столе укладывают на живот. Полукружным разрезом, огибающим пятку на границе перехода подошвенной поверхности в обычную кожу заднего отдела стопы, формируют нижний кожный лоскут. Его мобилизуют, отворачивают, обнажая подошвенный апоневроз, который пересекают в поперечном направлении отступя 2 см от места его прикрепления. Пальцем определяют локализацию шпоры, освобождают ее от окружающих тканей и скусывают до основания щипцами Люэра. Поверхность кости сглаживают теми же щипцами. Подошвенный апоневроз сшивают П-образными шелковыми швами. Подшивают на свое место кожный лоскут (рис. 2.16). Производят иммобилизацию задней гипсовой лонгетой от кончиков пальцев до верхней трети голени на 1,5 недели. 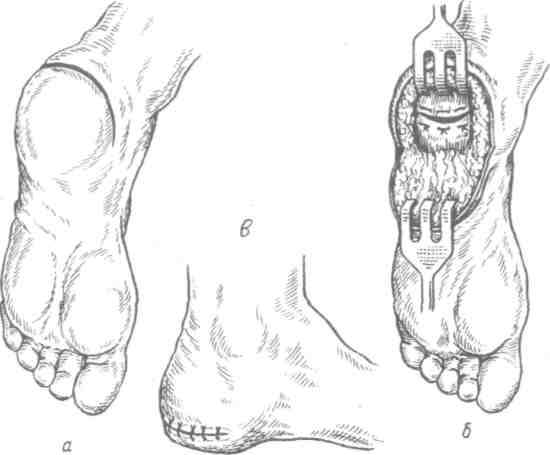 Рис. 2.16. Операция по поводу пяточной шпоры (из книги В. И. Маслова, 1988 г.): а — кожный разрез; б — ушивание рассеченного подошвенного апоневроза после скусывания пяточной шпоры; в — швы на кожную рану. 2.3.5. Мозоли На выступающих участках пальцев стопы вследствие постоянного давления и травматизации обувью образуются участки омозолелости — напластование и уплотнение ороговевающего эпидермиса [16, 20]. Давление на мозоль вызывает боль, возникают неудобства и затруднения при ходьбе. Способствует развитию мозолей деформация пальцев. Типичная локализация мозолей — на тыльной поверхности межфаланговых суставов. Консервативное лечение заключается в изоляции мозоли от травмирующего воздействия. Для этого приклеивают клеолом или фиксируют лейкопластырем специальные мозольные кольца (накладки), отверстие которых располагают над мозолью. Применяют также кератолитические мази (содержащие салициловую кислоту) с соблюдением предосторожности, не допуская попадания мази на здоровую кожу. Вырезают и наклеивают друг на друга несколько слоев лейкопластыря, в 2-3 раза превышающих по размерам мозоль. По центру полосок пластыря вырезают отверстие, соответствующее диаметру мозоли. Полоски приклеивают к коже, оставляя свободной по центру только мозоль. На нее накладывают кератолитическую мазь (мозольный пластырь) и приклеивают сверху сплошной полоской лейкопластыря. Через 3 дня повязку снимают, удаляют размягченные поверхностные слои мозоли и снова накладывают на следующие 3 дня такую же повязку. Повторяют повязки до полного удаления мозоли [16]. Если омозолелость распространилась на все слои кожи до подкожной жировой клетчатки, то консервативное лечение оказывается недостаточным, и в этих случаях применяют удаление мозоли оперативным путем. Проводят анестезию пальца по Лукашевичу. Окаймляющим разрезом иссекают мозоль с окружающей кожей. После этого ушить рану обычным способом не всегда удается. Целесообразно применять пластические методы закрытия дефекта кожи, которые изображены на рис. 2.17. 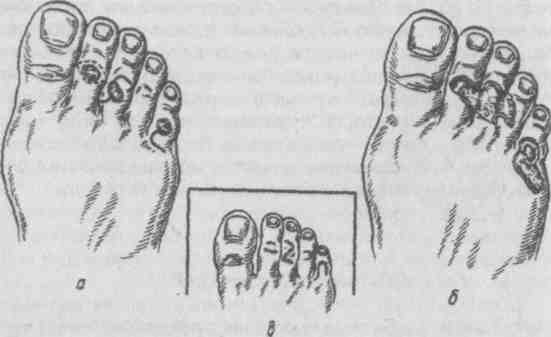 Рис. 2.17. Пластические операции при омозолелости пальцев стопы (из книги В. И. Маслова, 1988 г.). а — варианты кожных разрезов; б — формирование кожных лоскутов после иссечения пораженных участков; в — пластическое закрытие дефектов кожи. СПИСОК ЛИТЕРАТУРЫ
|
