ОНХимияПлакидкин. Теоретические основы химии
 Скачать 25.3 Mb. Скачать 25.3 Mb.
|
Химические свойства.1. Окислительные свойства неметаллов- взаимодействие с металлами: 2Na + S = Na2S - взаимодействие с водородом (образуются летучие водородные соединения): H2 + Cl2 = 2HCl - любой неметалл выступает в роли окислителя в реакциях с теми неметалами, которые имеют более низкое значение электроотрицательности: 2P + 3Cl2 = 2PCl3 - взаимодействие со сложными веществами: CH4 + 2O2 = CO2 + 2H2O 2. Восстановительные свойства- взаимодействие с кислородом (исключение – фтор): 4P + 5O2 = P4O10 - взаимодействие со сложными веществами-окислителями: S + 6HNO3 = H2SO4 + 6NO2 + 2H2O. При взаимодействии с неметаллами концентрированная серная кислота восстанавливается до SO2. 3. Реакция диспропорционированияОна характерна для активных неметаллов. Протекает в щелочной среде: 3I2 + 6NaOH = 5NaI + NaIO3 + 3H2O. 1.3. Химическая связь и строение вещества Учение о химической связи относится к важнейшим проблемам современной химии. Знание природы взаимодействия атомов в веществе позволяет понять причины многообразия химических соединений, строение и механизм их образования. Химическая связь возникает при взаимодействии атомов, обусловливающем образование химически устойчивой системы, при этом происходит понижение энергии системы. Возьмем простейший пример – образование молекулы водорода из атомов. E 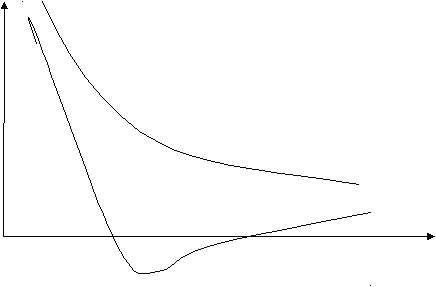 кривая 1 r0 r (расстояние между атомами) кривая 2 По мере сближения атомов, их электроны начинают притягиваться не только ядром своего атома, но и ядром другого атома. Атомные орбитали начинают перекрываться, и появляется вероятность одновременного появления обоих электронов в области перекрывания. Здесь вступает в действие принцип Паули: если спины электронов параллельны, то они стремятся разойтись, между ядрами возникает дополнительное отталкивание и химическая связь не образуется (кривая 1). Если же спины электронов двух атомов антипараллельны, то принцип Паули не препятствует их совместному пребыванию в межъядерной зоне в области притяжения. Кривая 2 описывает понижение энергии и химическая связь образуется. Система из двух атомов водорода имеет минимальную энергию при некотором расстоянии между атомами r0. При дальнейшем сближении атомов энергия системы снова возрастает за счет увеличения сил отталкивания между ядрами. Таким образом, химическая связь – это вид межатомных взаимодействий, характеризуемый определенной энергией, обуславливающий существование двух и многоатомных молекул. 1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи. Ионная, металлическая и водородная связь. Различают три основных типа химической связи: ковалентную, ионную и металлическую, хотя эта классификация является условной. Химическая связь между атомами, осуществляемая обобществленными электронами, называется ковалентной. Ковалентная связь по своей природе представляет универсальный тип химической связи. Промежуточный тип связи, когда электроны несколько смещены от одного атома к другому, называют полярной ковалентной связью. В неполярных молекулах центры тяжести положительных и отрицательных зарядов совпадают. Неполярная ковалентная связь возникает в димерных молекулах (N2, Cl2 и т.д.).  Для объяснения ковалентной химической связи используется метод валентной связи (метод ВС), в котором предполагается: а). При образовании молекулы электронная структура, индивидуальность каждого атома сохраняется. б). Химическая связь образуется в результате обмена электронами с образованием общих электронных пар, принадлежащих обоим атомам. в). Сама связь – область повышенной электронной плотности – локализована между каждой парой атомов в месте перекрывания атомных орбиталей. В методе ВС предполагается три механизма образования ковалентной связи: обменный, донорно-акцепторный и дативный. Обменный механизм, когда для образования химической связи каждый из двух связываемых атомов выделяет для обобществленной пары по одному неспаренному электрону. Не следует понимать пару электронов в виде каких-то материализованных точечных зарядов, расположенных в центре между атомами. Чтобы произошел обмен неспаренными электронами необходимо проникновение одной атомной орбитали в другую, т.е. их перекрывание. Схематически это выражается диаграммой ВС, например, для образования молекулы водорода (Н2) из атомов. 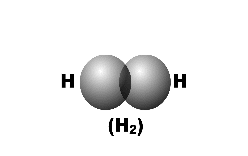 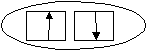 Электроны в атоме водорода находятся на s-подуровне, атомная орбиталь имеет форму сферы. Две сферы перекрываются, электронная плотность больше между атомами. Образуется химическая связь. Рассмотрим образование молекулы СО по методу ВС. О 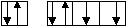 2s22p4 2s22p4C  2s22p2 2s22p2У кислорода и углерода имеется по два неспаренных электрона, следовательно, связь С=О двойная. Один электрон, находящийся на атомной орбитали называется неспаренным, а два на атомной орбитали – спаренными. Однако, экспериментальные данные указывают, что физические свойства СО близки к N2, у молекулы которого тройная связь.
Отсюда можно сделать вывод, что в молекуле СО тоже должна быть тройная связь. Для объяснения был предложен донорно-акцепторный механизм образования ковалентной связи, т.е. в предпосылках метода ВС было добавлено, что образование общей электронной пары может происходить, как по обменному, так и по донорно-акцепторному механизмам. По донорно-акцепторному механизму атом, имеющий пару спаренных электронов на атомной орбитали донор (кислород), при взаимодействии с другим атомом, имеющим вакантную (свободную) орбиталь – акцептор (углерод), отдает свою электронную пару в общее пользование. Согласно методу ВС ковалентная связь по донорно-акцепторному механизму возникает при перекрывании вакантной орбитали акцептора с заполненными орбиталями донора. Таким образом, в молекуле СО, кроме двух связей по обменному механизму, образуется еще одна по донорно-акцепторному механизму и связь в СО – тройная. Ионная связь Ионная связь осуществляется в результате образования и электростатического взаимодействия противоположно заряженных ионов. Она является предельным случаем полярной ковалентной связи, т.к. при соединении атомов с малой электроотрицательностью (щелочные и щелочно-земельные металлы) и высокой (фтор, кислород, азот) полярность молекулы возрастает настолько, что электронная плотность сильно смещена к атому неметалла и возникают катионы металла и анионы неметалла. Чисто ионная связь не существует, т.к. электронная плотность в молекуле делокализована. Кроме того, полярность молекулы уменьшается в результате поляризации. Даже соединение с максимальной разницей в электроотрицательности атомов CsF обладает 90% степенью ионности. Ионная связь ненаправлена и ненасыщенна. Так как электрическое поле иона имеет сферическую симметрию, то в отличие от ковалентной связи ионная связь не обладает направленностью. Взаимодействие двух противоположно заряженных ионов не приводит к полной взаимной компенсации их полей, они сохраняют способность притягивать и другие ионы, поэтому ионная связь не обладает насыщаемостью. Каждый ион в молекуле с ионной связью окружен ионами противоположного знака, число которых определяется размерами и силой отталкивания одноименно заряженных ионов. Соединения с ионной связью представляют собой кристаллические вещества. Ионный кристалл можно рассматривать как гигантскую молекулу, состоящую из очень большого числа ионов, в них нет отдельных молекул. Эти вещества при растворении в полярных растворителях распадаются на ионы, а в неполярных не растворяются. Ионные молекулы можно обнаружить только в парах ионных соединений (требуется высокая температура), при этом в парах присутствуют и различные ассоциаты. Например, в парах хлорида натрия присутствуют: NaCl, (NaCl)2, (NaCl)3 и ионы (Na2Cl)+, (NaCl2)- и т.д. Энергию кристаллической решетки обычно определяют экспериментально. Степень ионности рассчитывается по формулам: где: ω – степень окисления; эксп. – экспериментальный дипольный момент; l – расстояние между ионами; qэфф. и qфор. – практические и теоретические заряды на ионах. Металлическая связь Металлы отличаются от всех остальных элементов высокой пластичностью, электро- и теплопроводностью. Эти свойства, а также и многие другие – ковкость, металлический блеск и т.п. обусловлены особым видом связи между атомами металла -- металлической связью. Необходимо отметить, что свойства, присущие металлам, проявляются только в конденсированном состоянии. Например, серебро в газообразном состоянии не обладает физическими свойствами металлов. У всех металлов дефицит (мало) валентных электронов, поэтому при образовании связи они все становятся общими, принадлежащими всему кристаллу металла. Другой особенностью кристаллической структуры металлов являются высокие координационные числа (8-12), свидетельствующие о большой плотности упаковки в кристаллических ячейках. Для объяснения высокой электропроводности металлов издавна полагали, что внутри металлов имеются «почти свободно движущиеся электроны», которые переносят электричество. Наиболее простая модель строения металлов предполагала, что кристаллическая решетка металлов состоит из положительных ионов, окруженных свободными электронами, движение электронов происходит хаотически, подобно молекулам газа. Однако такая модель, качественно объясняя многие свойства металлов, при количественной проверке оказывается недостаточной. Так атомная теплоемкость металла, рассчитанная в соответствии с представлением о свободных электронах, должна составлять 9/2R. Экспериментальные значения (правило Дюлонга и Пти) равны примерно 6/2R. Дальнейшая разработка теории металлического состояния привела к созданию зонной теории металлов, которая основывается на представлениях квантовой механики. Характерным механическим свойством металлов является пластичность, обусловленная особенностями внутреннего строения их кристаллов. Под пластичностью понимают способность тел под действием внешних сил подвергаться деформации, которая остается и после прекращения внешнего воздействия. Это свойство металлов позволяет придавать им различную форму при ковке, прокатывать металл в листы или вытягивать в проволоку. Пластичность металлов обусловлена тем, что при внешнем воздействии слои ионов, образующих кристаллическую решетку, сдвигаются относительно друг друга без разрыва. Это происходит в результате того, что переместившиеся электроны благодаря свободному перераспределению продолжают осуществлять связь межу ионными слоями. При механическом воздействии на твердое вещество с атомной решеткой смещаются отдельные ее слои и сцепление между ними нарушается из-за разрыва ковалентных связей. Все отличительные общие физические свойства металлов объясняются современной теорией металлического состояния вещества и обусловлены двумя особенностями: особой кристаллической решеткой металла и особым видом связи. Водородная связь Промежуточный характер межу межмолекулярным взаимодействием и ковалентной связью имеет водородная связь. Если водород соединен с сильно электроотрицательным элементом (F, O, N) он может образовывать еще одну дополнительную связь – водородную. Хотя энергия водородной связи мала (8-40 кДж/моль), эту связь следует считать разновидностью ковалентной связи, т.к. она обладает свойствами направленности и насыщаемости. Механизм образования водородной связи сводится в электростатическому и донорно-акцепторным взаимодействиям (донор электронной пары – атом электроотрицательного элемента; акцептор – протон (Н+). Рассмотрим возникновение водородной связи в молекуле фтороводорода. В ней электронная пара смещена к атому фтора, т.е. атом водорода поляризован положительно, а фтор – отрицательно. Благодаря тому, что фтор сильно электроотрицателен, электронная пара практически полностью смещена к нему и ион водорода приобретает пустую, вакантную орбиталь, которая с неподеленной парой фтора образует донорно-акцепторную связь. Водородную связь принято обозначать точками. Обращаю внимание, что водородная связь это связь между молекулами, а не атомами в молекуле. Благодаря водородным связям фтороводородная кислота, в отличие от соляной, является слабой кислотой и образует соли типа KHF2. Водородная связь играет большую роль в процессах растворения, т.к. растворимость зависит и от способности вещества образовывать водородные связи с растворителем (водой). Водородная связь в молекуле воды 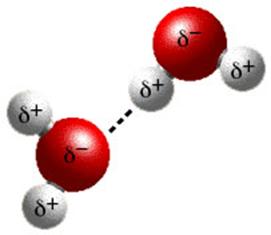 Пример. Серная кислота и фтороводород растворяется в воде неограниченно, а хлороводород обладает ограниченной растворимостью, что не позволяет получать соляную кислоту с концентрацией выше 37%. Объяснить это различие. Решение. Серная кислота содержит связь О–Н, фтороводород Н–F , которые способны образовывать водородные связи с водой, которая тоже имеет связь О–Н, и растворение происходит практически неограниченно. Виды химической связи 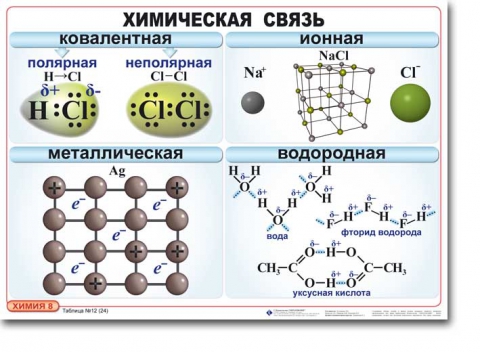 К основным характеристикам химической связи, дающим информацию о структуре молекулы и ее прочности, относятся валентный угол, длина, полярность и энергия связи. Длиной связи называют расстояние между центрами атомов, образующих данную связь (межъядерное расстояние). Ее определяют экспериментально при помощи различных физико-химических методов. Длина связи обусловлена размером реагирующих атомов и степенью перекрывания их электронных облаков, которая зависит от типа химической связи. Надо обратить внимание, что длина связи всегда меньше суммы радиусов элементов, т.к. происходит перекрывание атомных орбиталей, а не их касание. Длина связи от этана к ацетилену уменьшается, т.к. увеличивается кратность (порядок) связи от одинарной к тройной. Чем больше кратность связи, тем меньше длина связи.  В ряду галогеноводородов длина связи Н Г имеет следующие значения (в пм, 1 пм = 10-12 м):
 Другой характеристикой химической связи, отражающей геометрическое строение, является валентный угол.  Он зависит от природы атомов и характера химической связи. Количество энергии, выделяющейся при образовании химической связи, называется энергией связи. Эта величина является характеристикой прочности связи. Ее выражают в кДж/моль образующегося вещества. Полярные молекулы являются диполями, т.е. системами, состоящими из двух равных по величине, но противоположных по знаку зарядов (q+ и q ), находящихся на расстоянии l (длина диполя) друг от друга. Полярность молекулы оценивается значением электрического момента диполя = |
