ОНХимияПлакидкин. Теоретические основы химии
 Скачать 25.3 Mb. Скачать 25.3 Mb.
|
|
Расплавы ионных соединений тоже являются сильными электролитами. Высокая температура расплавов способствует их диссоциации на ионы. Для веществ с ковалентно-полярными связями сначала происходит поляризация связи под действием диполей воды; связь превращается в ионную и происходит диссоциация на гидратированные ионы. Доказано, что все ионы находятся в растворе в гидратированном состоянии, что препятствует их обратное соединение – ассоциацию. Правильнее написать диссоциацию так: NaCl + (n+m)H2O Na+nH2O + Cl-mH2O, Однако, в связи с тем, что неопределенный состав гидратов для решения практических задач не имеет значения, схемы диссоциации записываются без участия воды. 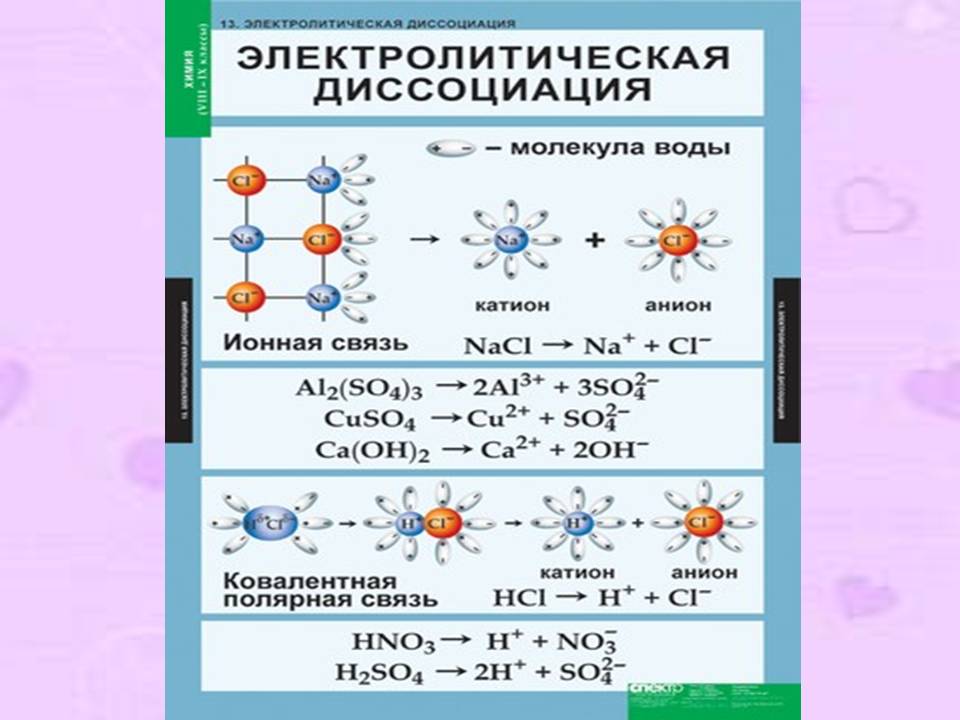 Существует классификация электролитов по величине степени электролитической диссоциации, которую ввел Аррениус. Электролиты, для которых в децимолярном (С=0,1 моль/л) растворе при 25оС α>0,3, называются сильными. Эта классификация является условной, т.к. степень диссоциации зависит от концентрации раствора, применяемого растворителя. Более удобным показателем силы электролита является константа диссоциации, которая не зависит от концентрации. Сильные электролиты К сильным электролитам относятся почти все растворимые соли, в том числе и органических кислот; основания щелочных (LiOH, NaOH, KOH, RbOH, CsOH) и щелочно-земельных (Ca(OH)2, Sr(OH)2, Ba(OH)2) металлов и некоторые кислоты, имеющие достаточно большие константы диссоциации. Приведем наиболее используемые кислоты – сильные электролиты: HCl, HBr, HI, HNO3, H2SO4, HClO3, HClO4, HMnO4, HCNS и некоторые другие, которые редко используются в данном курсе химии. Сильные электролиты диссоциируют полностью (необратимо). K2SO4 Слабые электролиты К слабым электролитам относятся все основания и кислоты, не включенные в вышеприведенный список, а также органические кислоты (СН3СООН, НСООН, и др.); некоторые растворимые соли (HgCl2, Fe(SCN)3, Hg(CN)2. Неэлектролитами являются органические соединения за исключением органических кислот, которые являются слабыми электролитами. Пример. Электрический ток проводит 1)спиртовой раствор иода; 2) расплав парафина; 3)расплав ацетата натрия; 4) водный раствор глюкозы Решение. Спирт, парафин и глюкоза – органические вещества и они являются неэлектролитами. Йод в спирте тоже не диссоциирует на ионы, поэтому спиртовый раствор йода не проводит электрический ток. Ацетат натрия является солью, поэтому в растворе или в расплаве она диссоциирует на катион и анион и проводит электрический ток. 1.4.6. Реакции ионного обмена. Для того чтобы между веществами прошла реакция, необходимо разорвать или ослабить старые связи в молекулах, а потом образуются новые. Особенностью реакций в растворах является то, что при помещении в полярный растворитель многие вещества подвергаются диссоциации, т.е. старые связи уже разорваны, и реакции обмена между ионами протекают с большой скоростью. Энергия активации таких процессов близка к нулю. Такие реакции идут до конца (необратимые) в тех случаях, когда в результате реакции образуется более устойчивое соединение. Обычно, выделяют четыре случая, когда реакции в растворе проходят до конца. Диссоциации на ионы подвергаются только сильные электролиты. Различают молекулярное уравнение, где все соединения находятся в виде молекул; молекулярно-ионное – в таком состоянии соединения находятся в растворе и краткое ионное уравнение, которое отражает саму суть, происходящую в ионообменной реакции. Na2S + 2HCl = 2NaCl + H2S – молекулярное уравнение; 2Na+ + S2- + 2H+ + 2Cl- = 2Na+ + 2Cl- + H2S – полное молекулярно-ионное; S2- + 2H+ = H2S – краткое ионное уравнение. 1. Образование осадка. BaCl2+Na2SO4 Ba Поскольку BaSO4 выпадает в осадок, который не участвует в обратной реакции, то равновесие сильно смещено вправо. При взаимодействии нитрата свинца с йодидом калия образуются кристаллы нерастворимого йодида свинца, но для получения такого опыта нужно соблюсти определенные условия  При взаимодействии сульфата меди(II) с гидроксидом калия образуется осадок нерастворимого гидроксида меди(II).  2. Выделение газа. Na2CO3+H2SO4 CO Разложение пероксида водорода, особенно в присутствии катализатора бурно протекает до конца с выделением кислорода. Этот опыт будет более эффектным, если катализатор смешать с моющим средством, а потом добавить пероксид водорода.   Этот опыт получил название «зубная паста для слона». 3. Образование слабого электролита. 2КСN + H2SO4 2CN + 2H+ 4. Образование комплексного иона. ZnCl2+4NH3 Zn2+ + 4NH3 Пример. Какая из приведенных реакций не относится к реакциям ионного обмена? 1) Ba(NO3)2 + Na2SO4 = BaSO4 + 2NaNO3 2) KOH + HCl = KCl + H2O 3) 2KMnO4 = K2MnO4 + MnO2 + O2 4) Li2SO3 + 2HNO3 = 2LiNO3 + H2O + SO2 И Разложение перманганата калия при нагревании (для начального разогрева КMnO4 немного полили спиртом)   1 2   3 4 1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная. Гидролиз – это взаимодействие веществ с водой, в результате которого изменяется среда раствора. Катионы и анионы слабых электролитов способны взаимодействовать с водой с образованием устойчивых малодиссоциируемых соединений или ионов, в результате чего меняется среда раствора. Формулы воды в уравнениях гидролиза обычно записывают в виде Н ОН. При реакции с водой катионы слабых оснований отнимают от воды гидроксил ион, и в растворе образуется избыток Н+. Среда раствора становится кислотной. Анионы слабых кислот притягивают из воды Н+, и реакция среды становится щелочной. В неорганической химии чаще всего приходится иметь дело с гидролизом солей, т.е. с обменным взаимодействием ионов соли с молекулами воды в процессе их растворения. Различают 4 варианта гидролиза. 1. Соль образована сильным основанием и сильной кислотой. Такая соль гидролизу практически не подвергается. При этом равновесие диссоциации воды в присутствии ионов соли почти не нарушается, поэтому рН=7, среда нейтральная. Na+ + H2O 2. Если соль образована катионом сильного основания и анионом слабой кислоты, то происходит гидролиз по аниону. Na2CO3 + HOH Так как в растворе накапливаются ионы ОН , то среда – щелочная, рН>7. 3. Если соль образована катионом слабого основания и анионом сильной кислоты, то гидролиз идет по катиону. Cu2+ + HOH СuCl2 + HOH Так как в растворе накапливаются ионы Н+, то среда кислая, рН<7. 4. Соль, образованная катионом слабого основания и анионом слабой кислоты, подвергается гидролизу и по катиону и по аниону. CH3COONH4 + HOH CH3COO + Растворы таких солей имеют или слабокислую, или слабощелочную среду, т.е. величина рН близка к 7. Реакция среды зависит от соотношения констант диссоциации кислоты и основания. Гидролиз солей, образованных очень слабыми кислотой и основанием, является практически необратимым. Это, в основном, сульфиды и карбонаты алюминия, хрома, железа. Al2S3 + 3HOH При определении среды раствора солей необходимо учитывать, что среда раствора определяется сильным компонентом. Если соль образована кислотой, являющейся сильным электролитом, то среда раствора кислая. Если основание сильный электролит, то – щелочная.
Пример. Щелочную среду имеет раствор 1) Pb(NO3)2; 2) Na2CO3; 3) NaCl; 4) NaNO3 1)Pb(NO3)2 нитрат свинца(II). Соль образована слабым основанием и сильной кислотой, значит среда раствора кислая. 2) Na2CO3 карбонат натрия. Соль образована сильным основанием и слабой кислотой, значит среда раствора щелочная. 3) NaCl; 4) NaNO3 Соли образованы сильным основанием NaOH и сильными кислотами HCl и HNO3 . Среда раствора нейтральная. Правильный ответ 2) Na2CO3 В растворы солей опустили индикаторную бумажку. В растворах NaCl и NaNO3 она не изменила цвет, значит среда раствора нейтральная. В растворе Pb(NO3)2 окрасилась в красный цвет, среда раствора кислая. В растворе Na2СO3 окрасилась в синий цвет, среда раствора щелочная. 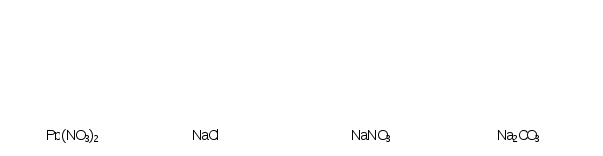 1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее. Любая окислительно-восстановительная реакция состоит из процессов окисления и восстановления. Окисление – это отдача электронов элементом, т. е. повышение его степени окисления. Восстановителем называется вещество, в состав которого входит элемент, повышающий степень окисления. К типичным восстановителям относятся простые вещества, имеющие малую электроотрицательность (металлы, водород и др.), катионы и анионы, атомы которых находятся в низких или низших степеней окисления. Низшая степень окисления для неметаллов равна номеру группы минус 8. Восстановление – принятие электронов элементом или понижение его степени окисления. Окислителем называется вещество, в состав которого входит элемент, понижающий степень окисления. Типичными окислителями являются простые вещества, атомы которых имеют высокую электроотрицательность (галогены, кислород), катионы и анионы, атомы которых имеют высокую или высшую степень окисления. Высшая степень окисления атома равна номеру группы, в которой он находится. Многие вещества, в зависимости от партнера и условий проведения реакции могут быть как восстановителями, так и окислителями. В этом случае говорят об окислительно-восстановительной двойственности. Уравнения окислительно-восстановительных реакций представляет иногда сложную задачу, поэтому для облегчения уравнивания предложено несколько методов. Наиболее часто используются метод полуреакций, электронного баланса и по изменению степени окисления. Рассмотрим правила определения степеней окисления в соединениях. 1. Степень окисления элемента в простых соединениях (состоят из одного типа химических элементов: Н2, Р4, Fe) равна нулю. 2. Водород в большинстве соединений имеет степень окисления +1, но в соединениях с металлами (гидридах: NaH, CaH2) она равна –1. 3. Кислород имеет степень окисления –2, за исключением пероксидов (Н2О2 и др.), где степень окисления равна –1. 4. Фтор во всех соединениях имеет степень окисления –1. 5. Металлы в соединениях имеют положительную степень окисления. Кроме того: первая группа, главная подгруппа (щелочные металлы) +1; вторая группа вся, кроме ртути +2; алюминий +3. 6. Алгебраическая сумма степеней окисления в нейтральной молекуле равна нулю, а в сложном ионе – заряду иона. Степень окисления указывается над символом атома со знаком плюс или минус впереди. |
