ОНХимияПлакидкин. Теоретические основы химии
 Скачать 25.3 Mb. Скачать 25.3 Mb.
|
|
Zn2+ + 2Cl- + 2Ag+ + 2NO3- = 2AgCl + Zn2+ + 2NO3-. Видно, что для первых трех реакций, чтобы прошла реакция необходимо превратить цинк в ион. На это надо затратить определенную энергию, поэтому скорость этих реакций будет меньше, чем в реакции №4, где эту работу: образование ионов хлора и серебра сделал полярный растворитель – вода. Реакции, проходящие в растворах без изменения степеней окисления, называются ионообменными и они протекают практически мгновенно. Если мы рассматриваем скорости 1-3 реакций, то наибольшая среди них будет реакция №2, так как концентрация соляной кислоты больше. Основным законом химической кинетики является открытый в 1864-1867 г.г. Гульдбергом и Вааге закон действующих масс для скорости химической реакции (ЗДМ). Скорость элементарной (простой) реакции пропорциональна произведению концентрации реагирующих веществ в степенях, равных стехиометрическим коэффициентам в уравнении реакции.  Для условно простой реакции аА +bВ = продукты математическая запись ЗДМ будет иметь вид (обращаю Ваше внимание, что концентрации веществ, входящие в это уравнение неравновесные). Чем дальше от состояния равновесия, тем скорость больше, а в состоянии равновесия скорость реакции равна нулю. Равновесные концентрации обозначаются в квадратных скобках, поэтому запись этого закона в таком виде V=k.[A]a.[B]b не имеет смысла, так как V=0 в состоянии равновесия. 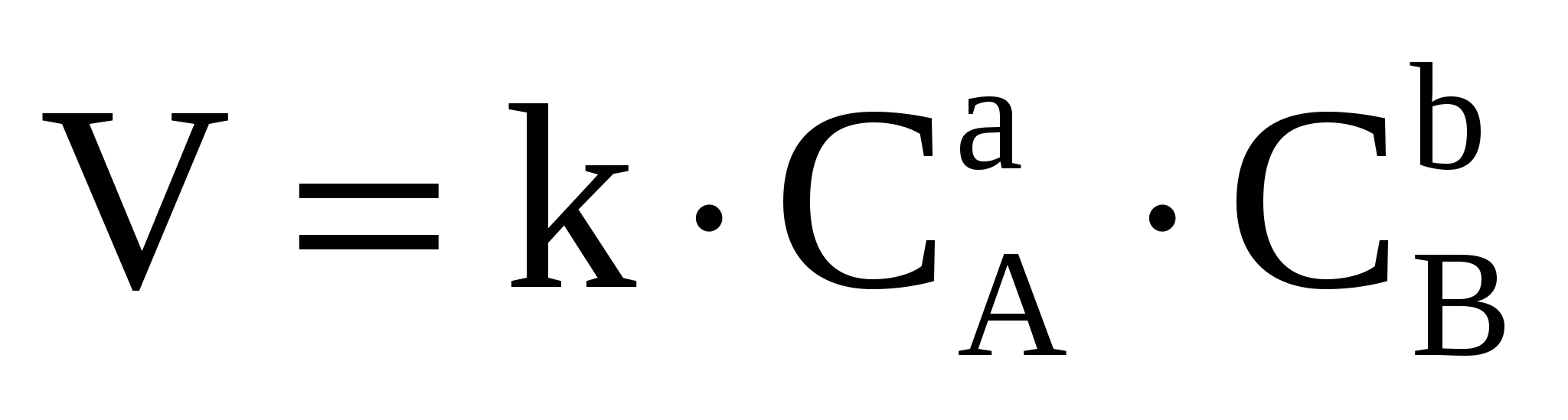 . .ЗДМ справедлив только для наиболее простых по своему механизму взаимодействий, протекающих в газах или разбавленных растворах, поэтому все химические реакции делятся на простые (элементарные) и сложные. Простые реакции идут в одну стадию без образования промежуточных соединений. Они характеризуются молекулярностью реакции. Она определяется числом молекул, одновременным взаимодействием которых осуществляется акт химического взаимодействия. В зависимости от этого простые реакции бывают: мономолекулярные – I2 бимолекулярные – Н2 + I2 = 2HI; тримолекулярные – 2NO + H2 = N2O + H2O; Мы ограничились рассмотрением только гомогенных простых реакций, но большинство реакций сложные и гетерогенные, которые протекают на границе раздела фаз. Математическое выражение для закона действующих масс в этом случае получило название кинетического уравнения. Интересно рассмотреть задачу, подобные которой встречаются в тестах ЕГЭ. Пример. От чего зависит скорость химической реакции между медью и азотной кислотой? Гетерогенными называются реакции, протекающие в среде, разделенной на отдельные части физическими границами раздела, на которых и происходит химическое взаимодействие. Для гетерогенной реакции ее скорость зависит от величины поверхности раздела между взаимодействующими фазами. Если в реакции участвует твердое тело, то его концентрация не входит в кинетическое уравнение, т.к. она практически не меняется. Роль твердого тела отражается введением его поверхности, на которой протекает данная реакция. Кинетическое уравнение для нашей реакции: Cu + HNO3 = продукты выглядит так.  Согласно нашему кинетическому уравнению скорость реакции зависит только от концентрации азотной кислоты, но не зависит от объема колбы, в которой проходит реакция; от объема кислоты и практически не зависит от массы меди, так как поверхность раздела при этом изменяется незначительно. Больший эффект увеличения скорости будет, если применять мелко раздробленную медь, но основным фактором все же остается изменение концентрации кислоты.  Зависимость скорости реакции от температуры Скорость подавляющего большинства химических реакций при повышении температуры возрастает, причем она очень чувствительна к изменению температуры. Зависимость скорости реакции от температуры старались установить многие ученые. Так в 1884 г. голландский ученый Якоб Вант Гофф, изучив примерно 50 различных реакций, пришел к выводу, что при повышении температуры на каждые 10 градусов скорость гомогенной реакции увеличивается в 2-4 раза. (Правило Вант-Гоффа). Однако, это чисто эмпирически выведенное правило Вант-Гоффа справедливо не для всех реакций, но оно удобно для примерной оценки изменения скорости химической реакции от температуры, если температурный коэффициент определен. Химическое взаимодействие между двумя частицами происходит при их столкновении, которое необходимо для разрыва старых и образования новых связей. Однако если бы каждое столкновение частиц приводило к их взаимодействию, то все реакции протекали бы мгновенно. На самом деле не каждое столкновение приводит к взаимодействию, а только такое, при котором энергия сталкивающихся частиц достаточна для возбуждения их связей. Энергия, необходимая для приведения одного моль реагирующих молекул в реакционноспособное состояние, называется энергией активации. Еа (кДж/моль) То есть скорость химической реакции носит пороговый характер. Столкновение частиц с Е>Еа приводит к реакции. Энергия активации реакции зависит от природы частиц и пути (механизма) реакции. Энергия активации, наряду с порядком реакции, очень важная кинетическая характеристика химической реакции. В дальнейшем на основе данных молекулярно-кинетической теории с учетом энергии активации Аррениусом было выведено уравнение, связывающее скорость химической реакции с температурой. Рассмотрение этого материала Вам предстоит уже в ВУЗе. 1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов. В зависимости от вероятности протекания реакций они подразделяются на: обратимые и необратимые. Например, реакция горения этанола практически необратимы, т.е. нельзя подобрать внешние условия, чтобы провести обратную реакцию: 2СО2 + 3Н2О = С2Н5ОН + 3О2. Однако существует много реакций, вероятность протекания которых имеет небольшое значение. Тогда, изменяя условия процесса, можно провести процесс как в прямом, так и в обратном направлениях. Например, реакция Н2(г) + I2(г) 2HI(г); обратима. В процессе реакции концентрации исходных веществ уменьшаются, а концентрации продуктов увеличиваются. Когда концентрация продуктов станет значительной, начинается обратный процесс. В результате устанавливается химическое равновесие, когда концентрации продуктов и исходных веществ остаются практически постоянными. Они называются равновесными и обозначаются в квадратных скобках, например [HI]. Химическое равновесие – равновесие динамическое. Закон действующих масс для химического равновесия При постоянстве давления и температуры отношение концентраций продуктов реакции и исходных веществ – число постоянное, и не зависит от конкретных значений концентраций. Для реакции аА + вВ = сС + dD математическим выражением закона действующих масс для химического равновесия является равенство. 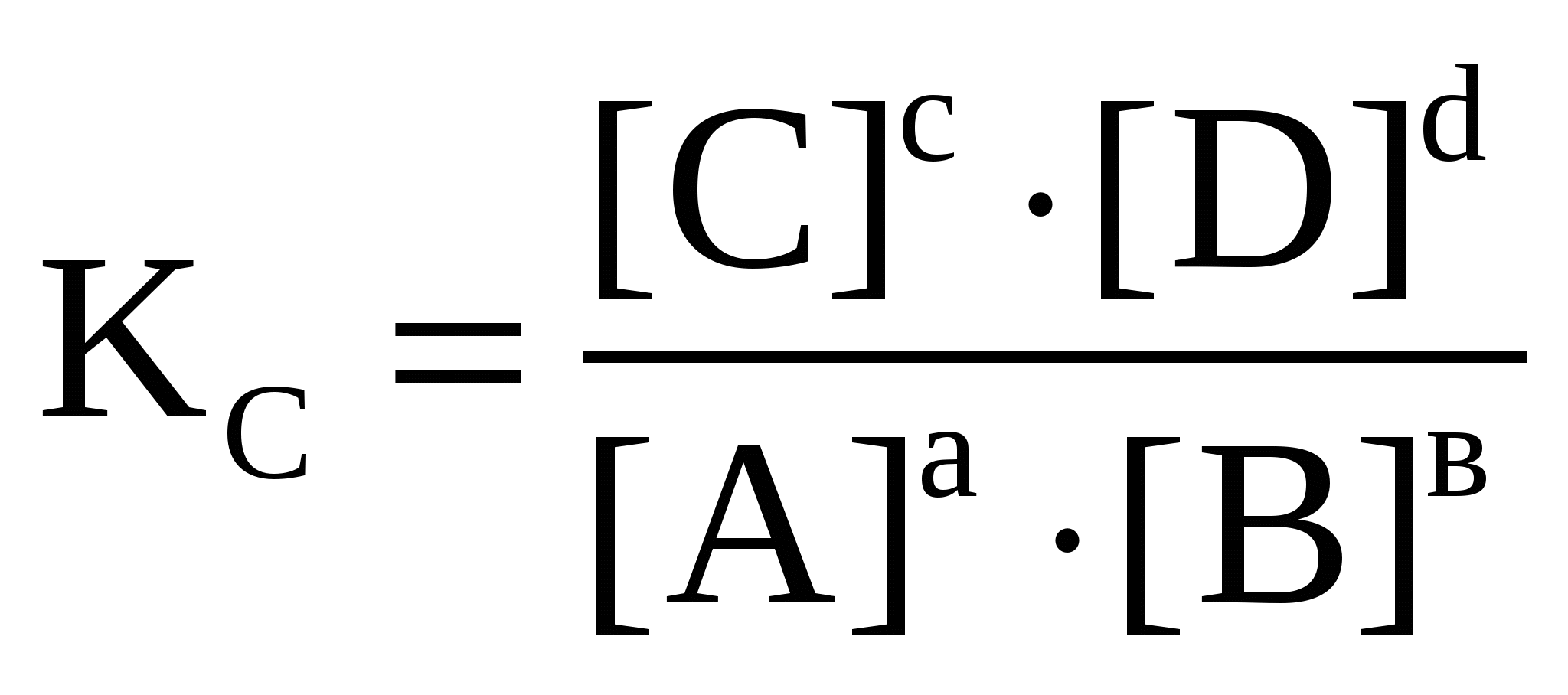 Константа равновесия определяет глубину протекания процесса в момент достижения равновесия. Чем больше Кс, тем полнее произошло взаимодействие между реагентами. Большинство химических реакций является гетерогенными, опыт показывает, что конденсированные фазы (жидкие и твердые) не оказывают влияние на константу равновесия. Изменение их массы, связанное с расходом или образованием веществ в исследуемой реакции не влечет за собой изменение состава и не нарушает равновесия, поэтому эти вещества не входят в константу равновесия. Принцип подвижного химического равновесия (Ле-Шателье). Многие производственные процессы являются обратимыми. На константу равновесия не влияет изменение концентрации реагентов и продуктов реакции. Однако если непрерывно выводить образующиеся вещества из реакционной смеси (удаление выделяющихся газов, образующихся осадков малорастворимых веществ), то система все время будет находиться в неравновесном состоянии, в ней будет происходить образование все новых и новых количеств продуктов. Выход продуктов реакции можно повысить и путем изменения температуры, давления или концентрации исходных веществ.  а) Влияние температуры. Повышение температуры вызывает смещение равновесия в том направлении, в котором обратимая химическая реакция идет с поглощением тепла (т.е., чтобы уменьшить внешнее воздействие). N2(г) + 3Н2(г) Это экзотермическая реакция проходит с выделением тепла. При Р=20 мПа и Т=300С выход NH3 равен 64% Т=600С 8% Повышение температуры смещает равновесие в сторону образования азота и водорода (в сторону эндотермической реакции).  На некоторых металлургических предприятиях при повышении температуры окружающего воздуха из труб появляется бурый газ. Это так называемый «лисий хвост». Это явление связано со смещением реакции 2NO2 D N2O4 + Q. NO2 – бурого цвета, а N2O4 – бесцветный. При повышении температуры равновесие смещается влево (т.к. реакция экзотермическая +Q), и из трубы идет бурый газ. Если температура понижается, то равновесие смещается вправо и газ N2O4 бесцветный. В трех колбах находится газ NO2 бурого цвета  К одной колбе подставили горячую воду, повысили температуру. Равновесие сместилось влево, бурый цвет усилился. В колбе, которая охладилась, газ обесцветился. Равновесие сместилось вправо. 2NO2 D N2O4 + Q  б) Влияние давления (только для процессов, происходящих в газовой фазе). Согласно принципу Ле-Шателье повышение давления смещает равновесие в направлении реакции, которая связана с уменьшением давления. Для процесса синтеза аммиака при постоянной температуре Т=300С и Р=20 мПа выход NH3 составляет 64% Р=100 мПа 92%, т.к. в результате прохождения прямой реакции уменьшается объем системы (было 1моль азота+3 моль водорода = 4 моль газов, а стало 2 моль аммиака), а, следовательно, уменьшается и давление. Увеличение давления в этом случае смещает равновесие в сторону меньшего числа моль газообразных веществ.  Чем меньше изменение объема системы в обратимой реакции, тем меньше влияние давления на сдвиг равновесия. Для реакции Н2(г) + I2(г) 2HI(г) изменение объема системы в процессе реакции равно нулю, поэтому ни увеличение, ни уменьшение давления не смещает это равновесие. Влияние инертного газа (не участвующего в реакции). При введении в равновесную систему, находящуюся при постоянном внешнем давлении, инертного газа все парциальные давления уменьшаются и действие его равнозначно уменьшению давления. в) Влияние концентрации. Введение в равновесную систему дополнительных количеств какого-либо компонента вызывает смещение равновесия в том направлении, при котором концентрация введенного компонента будет уменьшаться. Увеличением концентрации одного из исходных веществ пользуются для увеличения выхода продукта: SO2 + O2 СН3ОН + СН3СООН Увеличение концентрации исходных веществ смещает равновесие в сторону продуктов и наоборот увеличение концентрации продуктов смещает равновесие в сторону исходных веществ. Удаление (связывание) продуктов смещает равновесие в сторону продуктов, чем пользуются для увеличения выхода ценных продуктов реакции.  г) Влияние катализатора. Катализатор ускоряет как прямую, так и обратную реакции в равной степени, поэтому он не влияет на смещение равновесия, а только ускоряет его достижение. По определению катализатор не является ни реагентом, ни продуктом реакции. На основе принципа Ле-Шателье можно подобрать условия проведения процесса, обеспечивающие максимальный выход продуктов реакции. Пример. При каких внешних условиях следует проводить обратимую реакцию 3Fe(к) + 4Н2О(г) = Fe3О4(к) + 4Н2(г) +49,9 кДж, чтобы увеличить выход водорода? Решение. Давление не будет влиять на эту реакции, т.к. в правой части (4 моль водорода) и в левой (4 моль газообразной воды) число моль газообразных веществ одинаково. Так как реакция экзотермическая (с выделением теплоты), то для смещения равновесия вправо (образование водорода) необходимо снизить температуру. Однако уменьшение температуры существенно уменьшит скорость реакции, что тоже невыгодно для рентабельности процесса. Другой путь – изменение концентраций. Можно увеличить концентрацию воды или снизить концентрацию водорода, удаляя его из зоны реакции. Кристаллические вещества не входят в константу равновесия, они обычно берутся (Fe) в достаточном количестве, и изменение их массы не сказывается на состоянии равновесия. Вывод: наиболее эффективным средством повышения выхода водорода является его удаление из реакционной зоны и увеличение концентрации воды. 1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Электролитами называют вещества, которые в растворах проводят электрический ток. К электролитам относятся кислоты, основания и растворимые соли. При растворении в воде они распадаются на ионы движение которых обеспечивает электропроводность растворов этих веществ. Этим вопросом много занимался Аррениус. Он пришел к выводу, что диссоциация молекул растворенных электролитов на ионы происходит не под действием тока, как считали до него, а уже в процессе растворения, независимо от того пропускают через раствор электрический ток или нет.  Для количественной характеристики соотношения диссоциированных и недиссоциированных молекул электролита пользуются степенью электролитической диссоциации .  Основные положения теории электролитической диссоциации были разработана Гунде Сван Аррениусом (1887) и сводятся к следующему. 1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы – частицы с положительным (катионы) и отрицательным (анионы) зарядом. Ионы могут быть простыми (Na+, S2- и т.д.), сложными (NH4+, SO42- и т.д.) или комплексными ([Fe(CN)6]4-, [Cu(NH3)4]2+ и т.д.). «Ион» в переводе с греческого означает «странствующий»: в растворе ионы беспорядочно передвигаются в различных направлениях. 2. Под действием электрического тока движение ионов становится направленным: катионы движутся к катоду, а анионы к аноду. По этому признаку все соединения делятся на электролиты и неэлектролиты. 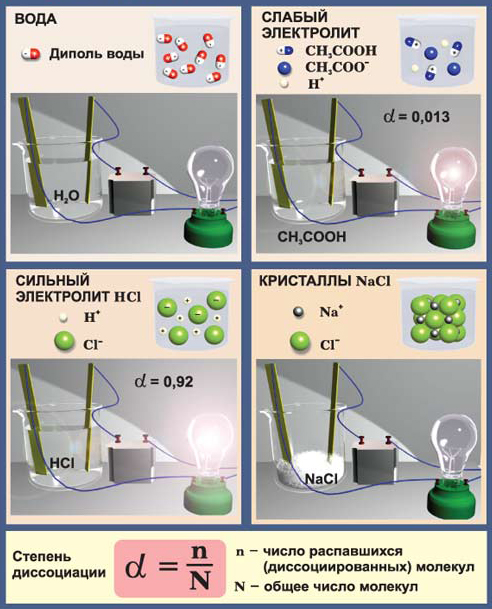 Чистая вода очень слабый электролит – лампочка не горит; Уксусная кислота слабый электролит – лампочка горит слабо; соляная кислота (HCl) сильный электролит – лампочка горит ярко; кристаллический NaCl не содержит ионы – лампочка не горит. Ионы у хлорида натрия появляются только в растворе или в расплаве. 3. Диссоциация – обратимый процесс, поэтому в уравнениях ставится знак обратимости. NaCl Na+ + Cl-; H2SO4 2H+ + SO42- Легче всего диссоциируют вещества с ионной связью, состоящие из ионов. Полярные молекулы воды (диполи) притягиваются к поверхностным ионам вещества; происходит ослабление химической связи между ионами, которое зависит от диэлектрической проницаемости растворителя (у воды оно очень велико 81). Достаточно теплового движения молекул, чтобы вещество распалось на гидратированные ионы. |
